Principios básicos en el manejo de heridas: abordaje inicial, tratamientos tópicos y uso de apósitos (parte I)
Resumen breve
En la actualidad, las heridas debidas a traumatismos, infección o dehiscencia del lecho quirúrgico constituyen uno de los principales motivos de consulta en medicina veterinaria, por lo que el conocimiento y la correcta aplicación de los principios básicos de manejo resulta clave tanto para generar como para mantener un ambiente propicio para la curación de estas.Esta serie de artículos tiene como finalidad establecer las bases que rigen el manejo y el tratamiento de estas lesiones, así como…Índice de contenidos
Introducción
Aunque la curación de heridas se basa en una secuencia compleja de eventos fisiológicos y bioquímicos que requieren del equilibrio entre ciertos procesos biológicos y celulares, el correcto control de los factores intrínsecos y extrínsecos a éstas, presentará influencia no solo en la calidad, sino en la velocidad de cicatrización de este tipo de lesiones.
En un periodo en el que la preocupación sobre el desarrollo de resistencias a los antibióticos está aumentando, el uso de una técnica aséptica, el manejo gentil de los tejidos y la correcta utilización de preparaciones tópicas y/o medicación sistémica resulta fundamental al tener un impacto positivo sobre el proceso de cicatrización, si bien el tratamiento ha de ser individualizado y sistemático, adaptándose siempre al tipo de herida y al estado del paciente.
Evaluación inicial de la herida
Por norma general y previamente al examen de la herida, se deberá de realizar una valoración exhaustiva del animal, centrándose en aspectos como la vía aérea, la ventilación y la circulación, sobre los que en muchas ocasiones se requerirá de una intervención inmediata, especialmente cuando se trata de animales politraumatizados en los que la evaluación clínica preliminar a la actuación intensiva sobre el área afectada puede resultar esencial.
Del mismo modo, se han de tener en cuenta aquellos procesos, tratamientos médicos o enfermedades concomitantes que pudieran presentar un impacto directo sobre la cicatrización, así como determinar aquellos factores que podrían estimular la curación de heridas en las que exista un compromiso metabólico (p.ej, hipotermia, caquexia) o heridas crónicas (tabla 1).
| Tabla 1. Principales factores que contribuyen al retraso en la cicatrización de la herida. |
| Factores inherentes al paciente | Obesidad Animales geriátricos Hiperadrenocorticismo Enfermedad hepática Diabetes mellitus FIV Uremia Emanciación/caquexia |
| Factores relacionados con la herida | Antisépticos Cuerpos extraños Infección Hipotermia Exudado severo Anomalías en la vascularización Estrés mecánico |
| Factores extrínsecos y terapia farmacológica | Corticoides Quimioterapia Radioterapia |
En esta primera fase se ha de prevenir tanto el deterioro de las heridas como el desarrollo de nuevas lesiones en los tejidos anexos hasta que sea posible la actuación clínica, por lo que éstas se cubrirán mediante un vendaje estéril con o sin estabilización rígida para prevenir la desecación y limitar la contaminación y el potencial desarrollo de una infección nosocomial, siendo de utilidad los apósitos adhesivos en ciertos casos.
Una vez sea posible, se procederá al examen minucioso de la herida, poniendo énfasis en su etiología, grado de contaminación y daño tisular de visu1,2, ya que permitirán tanto planificar las opciones terapéuticas como establecer el pronóstico de la lesión (tabla 2).
| Tabla 2. Aspectos relevantes a tener en cuenta durante el examen inicial de la herida. |
|
Durante la exploración de la herida resultará necesario descartar la presencia de cuerpos extraños que puedan generar tanto una respuesta inflamatoria exacerbada, como la formación de abscesos, con el problema añadido de su potencial migración a estratos más profundos, que podría conducir no solo al desarrollo de dolor crónico sino a problemas locomotores relacionados con su retención3-6.
El examen tanto de grandes heridas como de aquellas que requieran una exploración agresiva se llevará a cabo bajo sedación o anestesia general, especialmente cuando se pretenda determinar si existe comunicación con cavidades corporales como el tórax o el abdomen, o en aquellas ocasiones en las que se requiera de una exploración minuciosa ante la posible contaminación -no solo proveniente de la microflora bacteriana o la suciedad, si no de las propias manos del clínico veterinario, por lo que resulta primordial preservar las condiciones de asepsia y limpieza7.
En aquellas situaciones en las que se aprecie un daño vascular leve o moderado se deberá valorar la patencia de la circulación colateral en los días subsiguientes, mientras que la presencia de lesiones vasculares a nivel arterial habitualmente precisará de una intervención inmediata basada en técnicas de hemostasia o técnicas de sutura vascular8. Además, puede resultar necesaria una actuación quirúrgica de mayor o menor magnitud en casos de sangrado en sábana, especialmente ante lesiones de grandes dimensiones9.
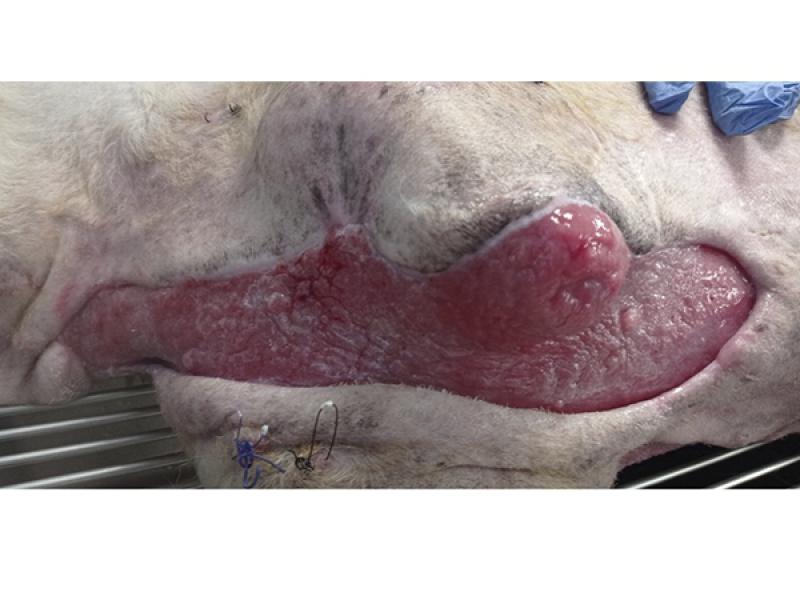
De igual manera, en aquellas circunstancias en las que existan daños evidentes en los ligamentos, tendones o nervios se habrá de tener en cuenta tanto el posible deterioro como la contracción virtual de la herida10-12, valorando la realización de técnicas quirúrgicas que permitan restaurar la funcionalidad siempre y cuando la integridad de los tejidos y la severidad de las lesiones lo permita (foto 1).
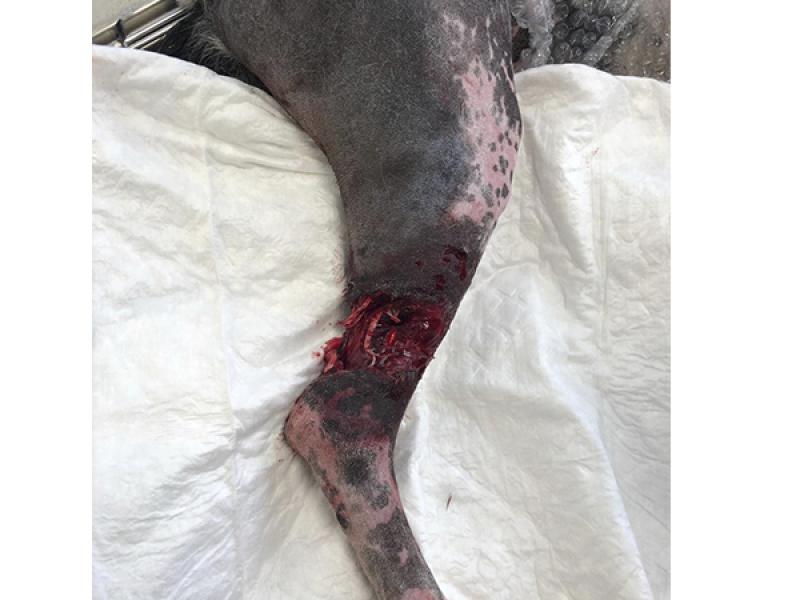
En la actualidad, las técnicas de diagnóstico complementario como la ecografía han cobrado una importancia capital a la hora de valorar el compromiso vascular y establecer un pronóstico más preciso, mientras que la realización de radiografías puede aportar datos fundamentales sobre todo en situaciones en las que se aprecien heridas penetrantes en el tórax o en el abdomen, o bien ante procesos que afecten a las extremidades.
Además, la realización de un examen neurológico completo en casos en los que estén afectados los miembros torácicos o pelvianos resultará fundamental a la hora de descartar posibles daños a nivel neurovascular que pudieran hacer variar el pronóstico no solo de la herida, sino del animal.
Cabe destacar que aquellas heridas profundas con gran cantidad de tejido necrótico estarán más predispuestas al desarrollo de infecciones13,14, mientras que las heridas superficiales se consideran limpias y generalmente permitirán la actuación mediante el cierre quirúrgico por primera intención.
No obstante, en cada caso se habrá de valorar la causa de la lesión, el grado de compromiso tisular, así como el tiempo transcurrido desde el desarrollo de la herida, la potencial contaminación ambiental, los cuidados que ha instaurado el propietario o bien el tratamiento que ha establecido el veterinario remisor3,15, siempre teniendo en cuenta la clasificación de las heridas basada en el grado y duración de la contaminación, ya que la excesiva carga bacteriana junto con otros factores como la presencia de material extraño y de tejido necrótico, los seromas o hematomas, el daño iatrogénico o la isquemia pueden tener efectos perjudiciales de diversa índole sobre la cicatrización de la herida (Tabla 3)(figura 2).
| Tabla 3. Clasificación de las heridas por el grado y duración de la contaminación. Tomado de Henderson RA. Wound management. En Henderson RA. Small animal wound management 2nd edition. Baltimore: Williams et Wilkins 1997. Pp 14-56 |
| Clasificación | Grado de contaminación | Duración de la contaminación | Consideraciones adicionales |
| Limpia | Mínimo | 0-6 horas | Heridas quirúrgicas sin invasión de órganos o sistemas |
| Limpia-contaminada (clase I) | Bajo | 0-6 horas | Heridas quirúrgicas con contaminación de órganos o sistemas |
| Contaminada (clase II o III) | Significativo | 6-12 horas (clase II) | Heridas traumáticas con detritus, inflamadas o contaminadas |
| Sucia o infectada | Elevado | Mayor de 12 horas | Heridas infectadas con implicación de órganos y sistemas o heridas crónicas |
De igual forma, el retraso en el abordaje terapéutico de la herida podría traducirse en la colonización bacteriana y el desarrollo de una infección16, aunque también dependerá de factores como la virulencia y los mecanismos defensivos del hospedador12,17 por lo que la pronta intervención sobre la lesión se considera crucial, ya que se clasifican como heridas contaminadas aquellas en las que ha transcurrido un intervalo de más de seis horas hasta su tratamiento a menos que se hayan tomado las medidas oportunas para protegerlas18.
Durante la exploración de la herida resulta fundamental rasurar el pelo del área colindante con la finalidad de reducir el riesgo de contaminación y facilitar tanto su inspección como la posterior limpieza de la zona19-21. En el curso de este proceso, la herida se cubrirá con un lubricante acuoso, un hidrocoloide o gasas impregnadas en suero salino fisiológico que se retirarán en el momento del lavado19,20.
Además, la cuchilla ha de estar en buen estado, limpia y afilada, evitando lesionar los bordes de la herida durante este proceso, situación por la que puede ser necesario el uso de una tijera impregnada en gel estéril1, sobre todo en ubicaciones delicadas en las que los extremos de la lesión estén lábiles o presenten una consistencia friable.
Sea del tipo que sea la intervención que se realice sobre la herida, se llevará a efecto siempre en condiciones asépticas, por lo que se aconseja limpiar la piel sana anexa a la herida mediante un antiséptico diluido22, evitando el contacto de la solución con la lesión ante su citotoxicidad, para posteriormente secarla con gasas estériles.
Lavado de la herida
El objetivo de esta fase es reducir la carga bacteriana, la presencia de material extraño y el exudado, así como eliminar aquel tejido no viable que se desprenda con facilidad23-25
Por norma general, la solución de lavado deberá de ser inocua -careciendo de citotoxicidad y no generando reacciones de hipersensibilidad-, además de estar ampliamente disponible y resultar económica en la medida de lo posible.
En la actualidad, se opta por la utilización de soluciones isotónicas con una presión osmótica similar a la presente en las células. Aunque los lavados con agua pueden ser de ayuda cuando no se disponga de otro recurso o en lesiones muy extensas, su uso resulta controvertido ante la potencial destrucción celular causada por su naturaleza hipotónica 26.
Un estudio realizado a finales de los años 90 determinó que el agua corriente generaba un deterioro en los fibroblastos durante el contacto con las heridas en periodos de lavado de entre 30 segundos y 10 minutos, mientras que el suero salino fisiológico (SSF) causaba daños pasados los 10 minutos. Otros como el Ringer Lactato (RL) no provocaban daños en las poblaciones celulares objeto de estudio, por lo que desde entonces se considera como la solución de lavado estándar tanto en medicina humana como en medicina veterinaria26
No obstante, investigaciones actuales no han mostrado diferencias en la tasa de infección o de curación en lo que respecta a los lavados con agua o el suero salino fisiológico27,28, mientras que en modelos animales se ha determinado que el agua produce una disminución de la carga bacteriana similar a la que se producía al irrigar con SSF, incluso en casos de fracturas abiertas29.
En cualquier caso, se prefiere evitar el uso de antisépticos durante esta etapa ya que presentan efectos directos sobre los queratinocitos y los fibroblastos. No obstante, resulta loable reseñar que mientras que la povidona iodada y el agua oxigenada reducen la proliferación y la migración de fibroblastos, la clorhexidina a bajas concentraciones y la sulfadiazina argéntica parecen promover la epitelización en el lecho de la herida30-31.
Otro hecho a tener en cuenta es que la suplementación de la solución de lavado con antibióticos se considera aberrante, errática e ineficaz, dada la dificultad para conseguir concentraciones terapéuticas a nivel local, pudiendo además generar reacciones de hipersensibilidad al paciente y favorecer el desarrollo de resistencias32.
En aquello que respecta a la tensión con la que se irriga la herida, se ha estipulado que presiones de 8 a 12 psi (pounds per square inch o libras por pulgada cuadrada) permiten vencer la fuerza de adhesión de las bacterias33, mientras que presiones inferiores a 5 psi no permiten eliminar correctamente la contaminación bacteriana y aquellas por encima de 15 psi podrían conllevar a un deterioro de la lesión, causando incluso la separación de fascias34 , así como el paso de bacterias y contaminantes a estratos profundos de la lesión35.
Habitualmente se puede recurrir a un suero conectado a un set intravenoso con una aguja hipodérmica y una presión de 300-400 mmHg, lo que permite una irrigación consistente de unos 8 psi, acorde a las recomendaciones anteriormente descritas36,37
De manera alternativa, se puede utilizar una jeringuilla de 20 ml con un catéter de 18G para alcanzar una presión de 8-10 psi38, a la que se puede incorporar un sistema de suero conectado a una bolsa de fluidos de
entre 500 ml y 1 litro.
Se ha determinado que cuanto mayor sea el volumen de lavado, menor riesgo de infección tal y como determina el axioma médico “ante la infección, dilución”, siendo especialmente relevante cuanto mayor grado de contaminación y extensión de la herida.
A pesar de que varios estudios en medicina humana determinaron un volumen de 50-100 ml por centímetro cuadrado de herida39,40, estas cantidades no son extrapolables a la medicina de pequeños animales donde los requerimientos parecen mayores especialmente ante situaciones como la contaminación ambiental o del manto y a los factores intrínsecos al paciente, por lo que el autor recomienda utilizar un volumen de 500-1000 ml de Ringer lactato en heridas de pequeño a moderado tamaño.
En el momento de la evaluación de la herida, se determinará la fase de curación de la misma (de hemostasia e inflamación, desbridamiento, proliferación y reparación y maduración), dado que las heridas presentan diferentes criterios de tratamiento en función de la fase de cicatrización, lo que además permitirá elegir adecuadamente tanto el tratamiento tópico, como el tipo de apósitos o vendajes.
Desbridamiento
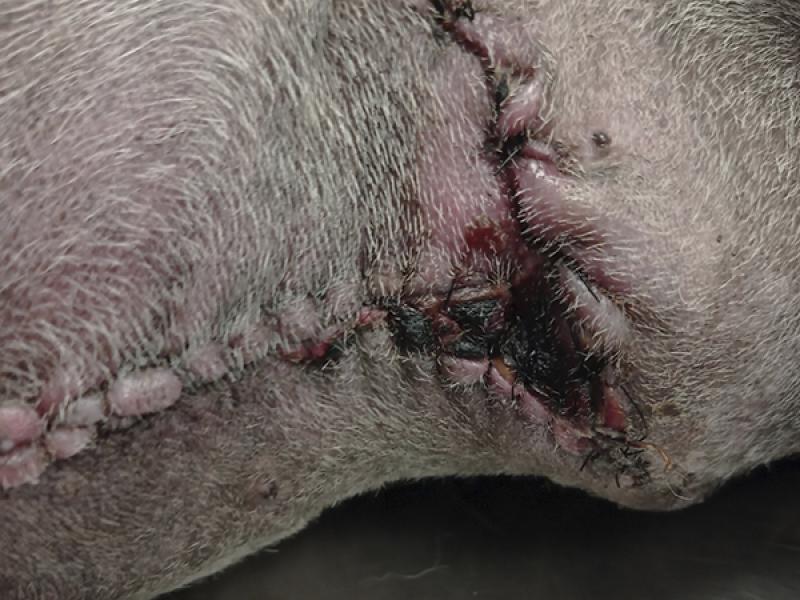
Este proceso consiste en la eliminación de tejido contaminado, necrótico, no viable y retirada de material extraño en el lecho de la herida, con la finalidad de generar condiciones que permitan su correcta evolución, ya que el tejido necrótico puede prolongar la fase inflamatoria de la herida, generar condiciones que favorezcan la infección y por tanto ir en detrimento de la curación, demorando la reepitelización y la fase de contracción de la herida14,21,41,42 (foto 3 y 4).
El desbridamiento puede clasificarse como selectivo o no selectivo. Mientras que el desbridamiento selectivo se realiza mediante el uso de geles, apósitos, enzimas exógenas o endógenas para eliminar el tejido no viable, el desbridamiento no selectivo implica la retirada de material necrótico, pero también de tejido sano que puede clasificarse como inviable de manera errónea, si bien se considera que este tipo de desbridamiento es más agresivo y resulta más rápido a la hora de retirar el tejido no viable, fomentando la formación de tejido de granulación y permitiendo plantear el cierre quirúrgico temprano (tablas 4 y 5).
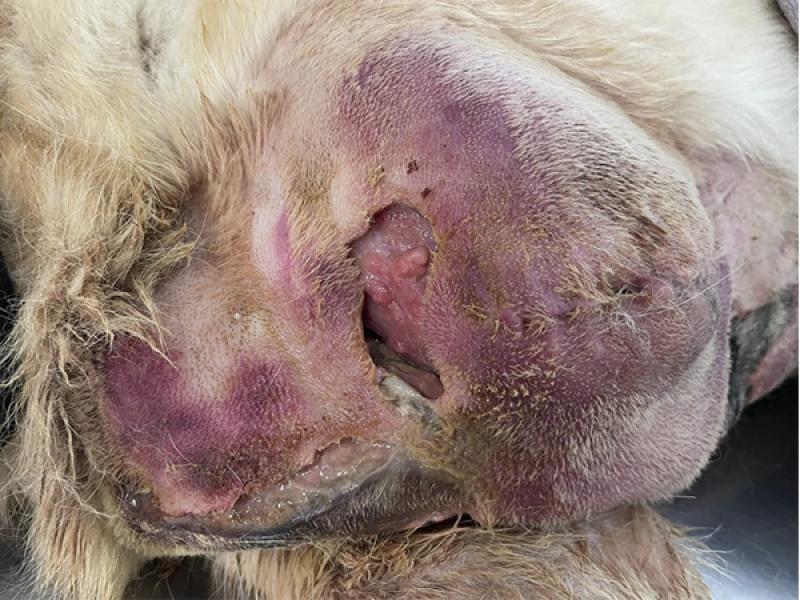
| Tabla 4. Clasificación general de los diferentes tipos de desbridamiento. |
| Método de desbridamiento | Ejemplo |
| Mecánico o hidrodinámico | Lavado Vendaje wet to dry Exéresis quirúrgica |
| Bioquirúrgico o bioterapéutico | Larvas |
| Enzimático | Tripsina Colagenasa Fibrolisina Estreptoquinasa |
| Autolítico | Azúcar Miel Hidrogel Hidrocoloides Alginatos |
| Tabla 5. Métodos de desbridamiento selectivo. |
| Método de desbridamiento selectivo | Ventajas | Desventajas | Indicaciones |
| Autolítico |
|
|
|
| Bioquirúrgico |
|
|
|
| Enzimático |
|
|
|
La evaluación de la cantidad de tejido no viable se llevará a cabo en las 24 horas posteriores a la inspección de la herida, aunque en ciertas ocasiones el tejido necrótico puede no delimitarse hasta los 7 días posteriores al desarrollo de la lesión, por lo que en estos casos se preferirá realizar un desbridamiento suave para valorar la viabilidad tisular en días posteriores, razón por la cual es fundamental añadir antibióticos sistémicos, así como una pauta de analgesia multimodal, siempre en función de la etiología, el grado y la extensión de la herida y especialmente en aquellos animales con enfermedades concomitantes -p.ej, diabetes- o en los que exista un compromiso en el tejido conectivo -fascia-, muscular o signos de infección local o sistémica.
Asimismo, cabe destacar que el desbridamiento adecuado y la descontaminación de la herida permitirán una rápida progresión a la fase de proliferación y reparación, por lo que en algunas situaciones puede resultar interesante mantener un ambiente húmedo que además favorezca el desbridado autolítico y conserve un exudado rico en mediadores inflamatorios sobre el lecho de la herida.
Desbridamiento quirúrgico y vendaje wet to dry
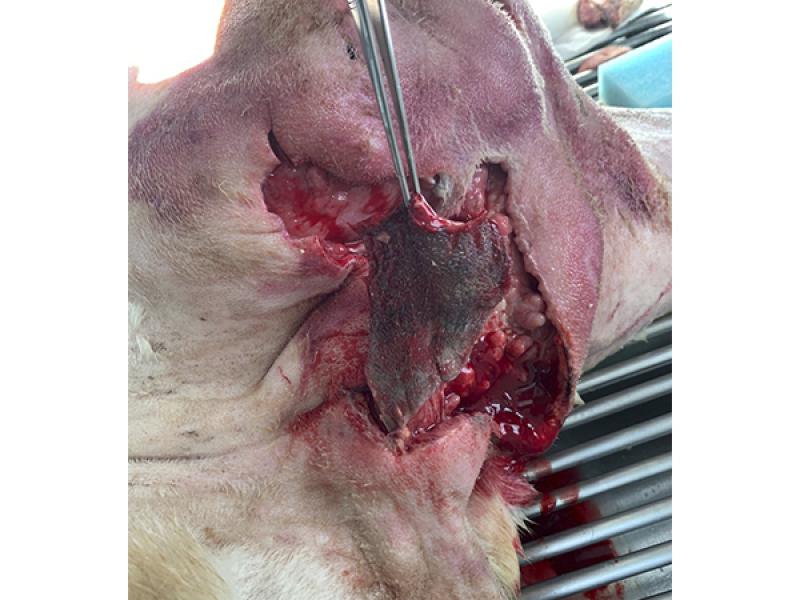
El desbridado quirúrgico que se considera como el método de elección en aquellos casos en los que se requiera la resección de grandes cantidades de tejido desvitalizado, consiste en la exéresis del tejido necrótico bajo anestesia general y en condiciones asépticas. Durante este proceso se evitará dañar los bordes de la herida, preservando el aporte vascular y haciendo énfasis en la inspección quirúrgica de los tejidos anexos, los planos profundos y de la temperatura de la zona (foto 5).
El uso del sangrado activo como criterio para marcar los límites de escisión quirúrgica puede resultar erróneo y controvertido en estos casos, ya que la presencia de hematomas, las contusiones o la pigmentación podrían conllevar a una resección excesiva o errática, mientras que las anomalías en la coagulación, la vasoconstricción local o sistémica, la hipotensión intraquirúrgica o la hipotermia podrían inducir al cirujano veterinario a error ante la interpretación estricta de esta regla.
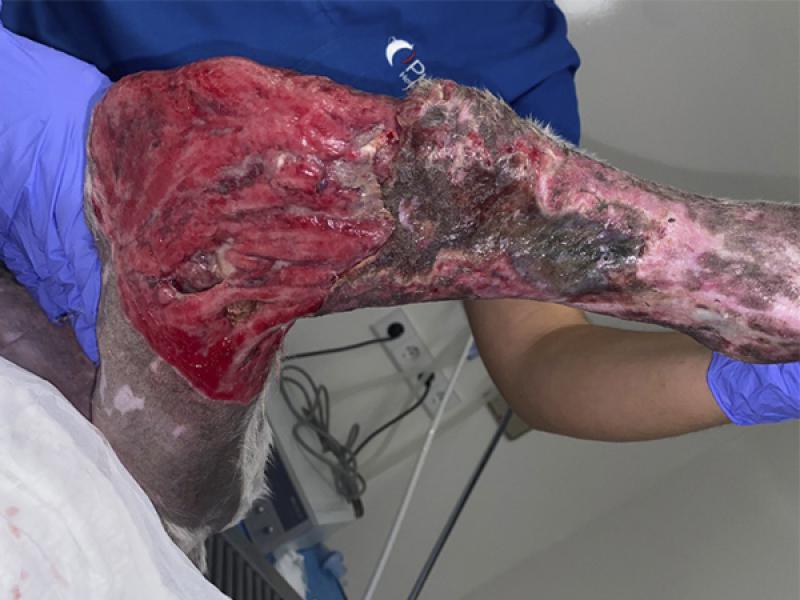
Mientras que en aquellas zonas en las que sea viable el cierre primario, se realizará una escisión en bloque del tejido afectado hasta los bordes sanos de la herida y una sutura aposicional por planos de manera convencional, en otras localizaciones -p.ej, heridas en la parte distal de las extremidades-, se preferirá llevar a cabo una resección gradual o por capas del tejido desvitalizado, así como una evaluación sistemática y seriada de la viabilidad tisular, requiriendo en ciertas ocasiones del uso de gasas o apósitos que permitan realizar un desbridamiento mecánico o bien que fomenten las condiciones óptimas para la curación de la herida, sobre todo en aquellos casos en los que se valore el cierre de la herida por segunda intención tras el desbridado quirúrgico (foto 6a y 6b)
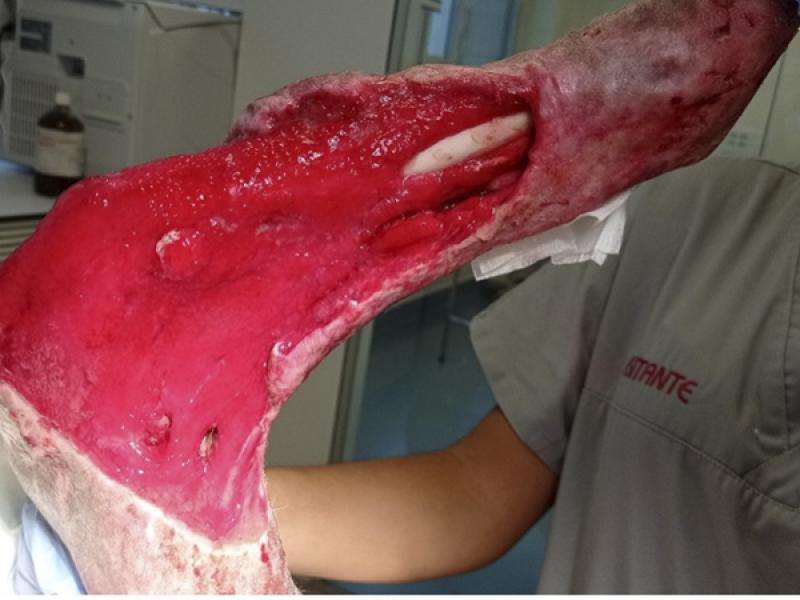
El vendaje wet to dry, es un método de desbridamiento no selectivo que ha sido ampliamente empleado durante décadas en la especie humana y que ha adquirido una alta relevancia en medicina veterinaria. Se trata de un vendaje que se adhiere directamente sobre la superficie de la herida y que permite eliminar tejido no viable y material extraño del lecho tisular atrapado en la capa primaria ante el arrastre mecánico que se produce durante la retirada de mismo- (foto 7).
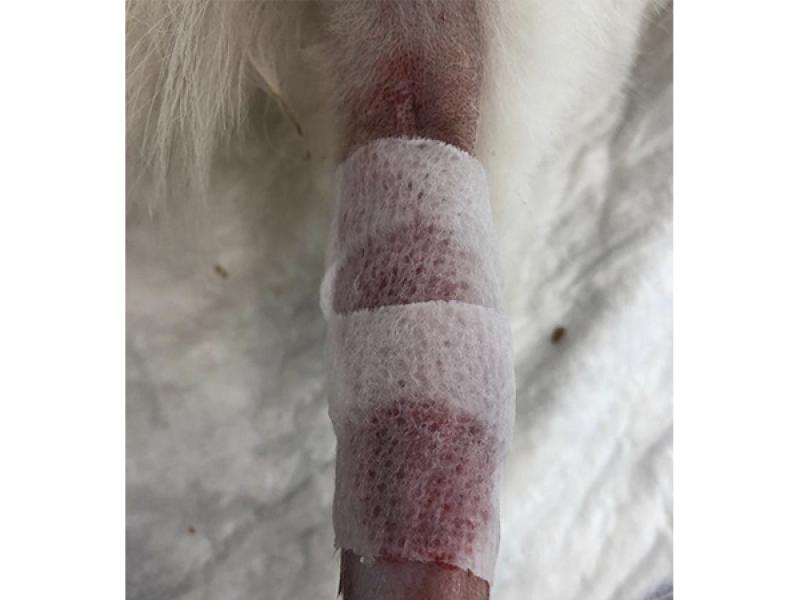
Este vendaje es apropiado para el desbridamiento mecánico en la fase inflamatoria de la herida. Por tanto, se ha de evaluar la lesión durante cada cambio, ya que en ciertas ocasiones y como consecuencia de su retirada se producirá el desprendimiento de cierta cantidad de tejido viable o incluso tejido de granulación, lo cual puede ser una desventaja en caso de lesiones profundas con exposición de tendones o huesos, ya que junto a la deshidratación presente podría demorar su cicatrización44, por lo que resulta recomendable sustituir este tipo de vendaje por métodos de desbridamiento autolítico como apósitos de hidrogel, alginato, hidrocoloides o espumas una vez presente el tejido de granulación 43,44.
Cabe reseñar que esta técnica precisa de poco material y por lo tanto resulta económico, ya que únicamente requiere de gasas estériles impregnadas en una solución -p.ej, suero salino o ácido hipocloroso-, que se ponen en contacto con el lecho de la herida y que posteriormente se protegen con una capa secundaria y una capa terciaria que completan el vendaje (tabla 6).
| Tabla 6. Ventajas y desventajas del vendaje wet to dry. |
| Ventajas | Desventajas |
|
|
Además, su humedad inicial permite reducir la viscosidad del exudado, quedando adherida la capa primaria a la herida, teniendo la capa secundaria una función absorbente, por lo que precisa de cambios regulares, ya que la patencia del vendaje puede hacer que éste se macere, aumentando el riesgo de infección y produciendo un retraso en la cicatrización.
De manera habitual, se recomienda realizar estos cambios entre 1 y 3 veces al día, ya que de otro modo, se podría producir un descenso de la temperatura local, con la consecuente vasoconstricción y la disminución tanto de la perfusión tisular como de la capacidad del oxígeno para eliminar las bacterias.
En la actualidad, este tipo de vendaje ha sido desplazado por apósitos avanzados que resultan más cómodos para el paciente y que permiten mantener la humedad, el intercambio de aire y favorecer el metabolismo de la herida, fomentando el desbridado autolítico selectivo45, habiéndose demostrado la superioridad de estos últimos sobre todo en casos de heridas crónicas45,46.
Desbridamiento enzimatico
Este tipo de desbridamiento, se realiza mediante fármacos que contienen tripsina, colagenasas, fibrolisina o estreptoquinasa que se aplican a la superficie de la herida con un vendaje no adherente y que ha de cambiarse cada 12-24 horas, lapso de tiempo en el que actuará sobre el tejido necrótico y el biofilm bacteriano permitiendo un mejor acceso de otros productos tópicos tanto a tejidos comprometidos como infectados.
El desbridamiento enzimático se puede llevar a cabo en combinación con la resección quirúrgica en aquellos casos en los que se requiere que este proceso sea progresivo ante la presencia de tejido de viabilidad dudosa o si hay evidencias de un alto compromiso tisular en zonas como las extremidades, en las que se ha de preservar la mayor parte de tejido para mantener la funcionalidad o bien para planear una cirugía reconstructiva a corto o medio plazo.
No obstante, el desbridamiento enzimático puede ser lento y demorar la cicatrización, dada la inhibición de los productos celulares necesarios para la reparación de la herida por parte de la colagenasa o la fibrolisina, pudiendo además macerarse la herida por el contacto íntimo y persistente de estos agentes con los bordes de la herida.
Desbridamiento autolitico
El desbridamiento autolítico se basa en el mantenimiento de un ambiente húmedo en la superficie de la herida mediante el uso de vendajes y apósitos hidrofílicos que permitan a las células implicadas en el proceso de cicatrización la fagocitosis y destrucción de las bacterias, el desprendimiento del tejido necrótico y la reparación del tejido dañado, manteniendo el tejido sano en buenas condiciones.
Además, los apósitos permiten la gestión del exudado -que contiene citoquinas, factores de crecimiento y enzimas-, permitiendo conservar la humedad y estimulando a su vez la tanto angiogénesis como la formación de tejido de granulación.
En todo caso, se deberá preparar el lecho de la herida para crear las condiciones óptimas ya que la presencia de tejido necrótico o materia orgánica podría inhibir este tipo de desbridamiento, por lo que en ocasiones se requiere de una actuación quirúrgica preliminar, así como del lavado de la herida previamente a la colocación de un nuevo apósito tanto para eliminar la contaminación como el exceso de exudado, que podrían retrasar la cicatrización47.
Del mismo modo, el ambiente húmedo disminuirá el dolor y la sensación de prurito, mientras que el mantenimiento de una temperatura similar a la corporal favorecerá las reacciones enzimáticas, producirá el incremento del flujo sanguíneo y mejorará a consecuencia de ello la función de las células implicadas en este proceso.
Citología y cultivo
Mientras que las heridas levemente contaminadas, sin detritus o material necrótico pueden precisar únicamente de productos tópicos49. En pacientes con enfermedades concomitantes o inmunocomprometidos puede ser necesario instaurar tratamiento antibiótico.
La toma de cultivo se habrá de valorar en situaciones en las que se sospeche de contaminación o infección, siendo útil el envío de muestras de tejido -ya que los hisopos en ocasiones no permiten aislar aquellas bacterias que afectan a los planos profundos- instaurando una pauta de antibioterapia inmediata que se cambiará una vez recibido el resultado de éste, siempre que se considere necesario48,49.
Conclusión
Existe una gran cantidad de procedimientos que se pueden llevar a cabos solos o en combinación en el tratamiento de heridas con la finalidad de obtener un buen pronóstico para nuestros pacientes.
Esta serie de artículos describe el uso de técnicas de rasurado, el lavado y el uso de soluciones limpiadoras, así como el desbridamiento, la toma de cultivo y la correcta utilización de vendajes a fín de permitir un correcto manejo de este tipo de lesiones, contibuyendo su abordaje integral no solo a la calidad de cicatrización de la herida, si no a la mejora en los tiempos de curación de las mismas.
Bibliografía
- Swaim SF, Henderson RA. Wound management. En: Swaim SF, Henderson RA, editors. Small animal wound management. 2nd edition. Baltimore (MD): Williams & Wilkins; 1997. p. 13–51
- White RAS. The aetiology and classification of wounds and skin deficits. En: Fowler D, Williams JM, editors. Manual of canine and feline wound management and reconstruction. Cheltenham (UK): BSAVA; 1999. p. 5–12.
- Moreira ME, Markovchick VJ. Wound management. Emergency Medicine Clinics of North America 2007;25(3):873–899.
- American College of Emergency Physicians. Clinical policy for the initial approach to patients presenting with penetrating extremity trauma. Annals of Emergency Medicine 1994;23(5):1147–56.
- Lee CK, Hansen SL. Management of acute wounds. Surgical Clinics of North America 2009; 89(3):659–676.
- DeBoard RH, Rondeau DF, Kang CS. Principles of basic wound evaluation and management in the emergency department. Emergency Medicine Clinics of North America 2007;25(1):23–39.
- Shahar R, Shamir M, Johnston DE. A technique for management of bite wounds of the thoracic wall in small dogs. Veterinary Surgery 1997;26:45–50.
- Kerstetter KK, Sackman JE. Principles of vascular surgery. En: Bojrab MJ, editor. Current techniques in small animal surgery. 4th edition. Baltimore (MD): Williams & Wilkins; 1998. p. 643–50.
- Leaper DJ, Harding KG. The ABC of wound healing. Traumatic and surgical wounds. BMJ 2006;332(7540):532–535.
- Weigelt JA. Risk of wound infections in trauma patients. American Journal of Surgery 1985;150(6): 782–784.
- Bowler PG, Duerden BI, Armstrong DG. Wound microbiology and associated approaches to wound management. Clinical Microbiology Reviews 2001;14(2):244–69.
- Berk WA, Osbourne DD, Taylor DD. Evaluation of the ‘Golden Period’ for wound repair: 204 cases from a third world emergency department. Annals of Emergency Medicine 1988;17(5):496–500
- Cardany CR, Rodeheaver G, Thacker J, et al. The crush injury: a high risk wound. Journal of the American College of Emergency Physicians 1976;5(12):965–970
- White RAS, Lane JG. Pharyngeal stick penetration injuries in the dog. Journal of Small Animal Practice 1988;29(1):13–35.
- Edlich RF, Rodeheaver GT, Morgan RF. Principles of emergency wound management. Annals of Emergency Medicine 1988;17(12):1284–302.ç
- obson MC, Duke WF, Krizek TJ. Rapid bacterial screening in the treatment of civilian wounds. Journal of Surgical Research 1973;14(5):426–430.
- Krizek TJ, Robson MC. Evolution of quantitative bacteriology in wound management. American Journal of Surgery 1975;130(5):579–584.ç
- ercival NJ. Classification of wounds and their management. Surgery 2002;20(5): 114–117.
- Aldridge P, O’Dwyer L. Practical emergency and critical care veterinary nursing. Chichester (United Kingdom): John Wiley & Sons; 2013.
- Alexander JW, Fischer JE, Boyajian M. The influence of hair-removal methods on wound infections. Archives of Surgery 1983;118(3):347–352.
- Cockbill SME, Turner TD. Management of veterinary wounds. Veterinary Record 1995; 136(14):362–365ç
- wales N, Cogan T. Failure to achieve asepsis following surgical skin preparation is influenced by bacterial resistance to chlorhexidine, but not skin preparation technique. Veterinary Nursing Journal, 2017;32(8), 224.
- Strohal R, Apelqvist J, Dissemond J. EWMA document: debridement. Journal of Wound Care 2013;22(Suppl 1):S1–52.
- Hamer ML, Robson MC, Krizek TJ. Quantitative bacterial analysis of comparative wound irrigations. Annals of Surgery 1975;181(6):819–822.ç
- hetty R, Paul MK, Barreto E, et al. Syringe-based wound irrigating device. Indian Journal of Plastic Surgery 2012;45(3):590–591.
- Buffa EA, Lubbe AM, Verstraete FJ. The effects of wound lavage solutions on canine fibroblasts: an in vitro study. Veterinary Surgery 1997;26:460–466.
- Griffiths RD, Fernandez RS, Ussia CA. Is tap water a safe alternative to normal saline for wound irrigation in the community setting? Journal of Wound Care. 2001;10(10):407-411
- Hall S. A review of the effect of tap water versus normal saline on infection rates in acute traumatic wounds. Journal of Wound Care. 2007;16(1):38-41.
- Svoboda SJ, Owens BD, Gooden HA, Melvin ML, Baer DG, Wenke JC. Irrigation with potable water versus normal saline in a contaminated musculoskeletal wound model. Journal of Trauma. 2008;64(5):1357-1359.
- Thomas GW, Rael LT, Bar-Or R, Shimonkevitz R, Mains CW, Slone DS, Craun ML, Bar-Or D. Mechanisms of delayed wound healing by commonly used antiseptics. Journal of Trauma. 2009;66(1):82-92
- Morton LM, Phillips TJ. Wound healing update. Seminars in Cutaneous Medicine and Surgery. 2012;31, 33–37.
- Crowley DJ, Kanakaris NK, Giannoudis PV. Irrigation of the wounds in open fractures. Journal of Bone and Joint Surgery . 2007;89(5):580-5.
- Stevenson TR, Thacker JG, Rodeheaver. Cleansing the traumatic wound by high pressure syringe irrigation. Journal of the American College of Emergency Physicians 1976;5(1):17–21.
- Stashak TS. Management practices that influence wound infection and healing. En: Stashak TS, Theoret C, editors. Equine wound management. 2nd edition. Ames (IA): Wiley-Blackwell; 2008. p. 85–106
- Wheeler CB, Rodeheaver GT, Thacker JG, et al. Side-effects of high pressure irrigation. Surgery Gynecology and Obstetrics 1976;143(5):775–8.
- Gall TT, Monnet E. Evaluation of fluid pressures of common wound-flushing techniques. American Journal of Veterinary Research. 2010;71(11):1384-6.
- Dulecki M, Pieper B. Irrigating simple acute traumatic wounds: a review of the current literature. Journal of Emergency Nursing. 2005;31(2):156-60.
- Singer AJ, Hollander JE, Subramanian S, Malhotra AK, Villez PA. Pressure dynamics of various irrigation techniques commonly used in the emergency department. Ann Emerg Med. 1994 Jul;24(1):36-40.
- Chisholm CD, Cordell WH, Rogers K, Woods JR. Comparison of a new pressurized saline canister versus syringe irrigation for laceration cleansing in the emergency department. Annals of Emergency Medicine 1992;21(11):1364–13677
- Lammers RL, Hudson DL, Seaman ME. Prediction of traumatic wound infection with a neural network-derived decision model. American Journal of Emergency Medicine 2003; 21(1):1–7
- Brown A. The role of debridement in the healing process. Nursing Times 2013; 109(40):16–9.
- Haury B, Rodeheaver G, Vensko J. Debridement: an essential component of traumatic wound care. American Journal of Surgery 1978;135(2):238–42
- Mayet N, Choonara YE, Kumar P. A comprehensive review of advanced biopolymeric wound healing systems. Journal of Pharmaceutical Sciences 2014;103:2211–2230.
- Tanaka A, Nagate T, Matsuda H. Acceleration of wound healing by gelatin film dressings with epidermal growth factor. Journal of Veterinary Medicine and Science 2005;67:909–13.
- Heyer K, Augustin M, Protz K. Effectiveness of advanced versus conventional wound dressings on healing of chronic wounds: systematic review and meta-analysis. Dermatology 2013;226:172–84
- Boateng JS, Matthews KH, Stevens HN. Wound healing dressings and drug delivery systems: a review. Journal of Pharmacological Sciences 2008;97:2892–923.
- Hedlund C. Surgery of the integumentary system. En: Fossum TW, editor. Small animal surgery. 3rd edition. St Louis (MO): Mosby Elsevier; 2007. p. 159–259
- Hosgood G. Wound repair and specific tissue response to injury. En: Slatter D. Textbook of Small Animal Surgery. 3 ed. v. 1. Saunders, 2003, p.91-111.
- Johnson MB, Pang B, Gardner DJ, Niknam-Benia S, Soundarajan V, Bramos A, Perrault DP, Banks K, Lee GK, Baker RY, Kim GH, Lee S, Chai Y, Chen M, Li W, Kwong L, Hong YK, Wong AK. Topical Fibronectin Improves Wound Healing of Irradiated Skin. Scientific Reports. 2017 20;7(1):3876.
 by Multimédica
by Multimédica