Shock traumático y cirugía de control de daño, un delicado equilibrio
Resumen breve
El shock traumático suele ser el resultado de traumatismo no penetrante y penetrante accidental, puede observarse en el periodo posoperatorio de cirugías de tejidos blandos extensas u ortopédicas, como así también, en ingresos a cirugía de pacientes sin compensación hemodinámica acorde.Índice de contenidos
Introducción
El shock traumático suele ser el resultado de traumatismo no penetrante y penetrante accidental, puede observarse en el periodo posoperatorio de cirugías de tejidos blandos extensas u ortopédicas, como así también, en ingresos a cirugía de pacientes sin compensación hemodinámica acorde.
La cirugía puede verse como un traumatismo controlado, que permite conocer el tiempo y el tipo de evento que ha desencadenado el shock. La disfunción cardiovascular, en las fases iniciales, se origina de alteraciones del volumen normal de sangre que ocurre como consecuencia de hemorragia o pérdidas de fluidos evaporativas, no reemplazadas en procedimientos quirúrgicos extensos. El dolor no controlado puede precipitar el flujo simpático sustancial, produciendo, la distribución del volumen circulatorio efectivo en detrimento del lecho esplácnico. La liberación de catecolaminas puede ocasionar daño a nivel microcirculatorio (daño de glicocálix endotelial).
Los pacientes con dolor severo pueden tener signos de shock sin presentar hemorragias importantes, debido a que las fibras nerviosas que transmiten el dolor tienen relación con el centro vasomotor. El manejo del dolor en estos pacientes es una de las piedras angulares.
En algunos pacientes, las lesiones tisulares y la isquemia pueden desencadenar un Síndrome Inflamatorio de Respuesta Sistémica (SIRS). Típicamente, la respuesta inflamatoria requiere varias horas para manifestarse por completo, y esta manifestación, en una lesión traumática, puede no ser aparente hasta mucho después de que la resucitación inicial con fluidos y manejo del dolor hayan restablecido una actividad cardiovascular normal. Por ello, una monitorización adecuada y agresiva del paciente en busca de signos de SIRS permitirá una intervención temprana.
Relación entre cirugía (un traumatismo controlado) y el SIRS
El trauma grave, al igual que el trauma quirúrgico controlado, no solo determina en la “respuesta de fase aguda” la aparición de un estado de estrés metabólico con mediadores neuroendocrinos, sino también, una respuesta microendocrina encargada de modular la respuesta inflamatoria.
Este proceso desencadena una compleja y múltiple cascada de eventos generales y multifocales. Dependiendo de la severidad del trauma controlado, en el acto quirúrgico, puede iniciarse un SIRS; o si la intensidad del trauma es mayor, un síndrome de disfunción orgánica múltiple (SDOM). El desarrollo de los eventos fisiopatológicos, aún durante el primer día postrauma, así como la presencia de algunos mediadores específicos, pueden servir como predictores del curso y supervivencia del paciente.
Los eventos que se desarrollan durante el shock traumático y en menor medida en el acto quirúrgico, o trauma controlado, son los siguientes:
- Daño tisular relacionado con el secuestro de polimorfonucleares (PMN): en la primera hora del shock traumático puede comenzar el secuestro de PMN. Este puede ser explicado por el síndrome de bajo flujo o por la activación del endotelio y de los propios PMN, produciendo su adherencia y agregación. La leucoestasis pulmonar en arteriolas, vénulas y capilares alveolares, es un hecho morfológico habitual en la fase temprana del shock. Los PMN entregan los primeros mediadores luego del trauma, incluyendo radicales de oxígeno, mieloperoxidasa, ácido hipocloroso y proteasas.
- Activación del complemento: en el trauma y quemaduras, el sistema del complemento se activa a través de la vía alterna. Dicha activación juega un papel importante, tanto para la fase temprana del SIRS, como en la fase tardía, produciendo mediadores inflamatorios, que incluyen a las anafilotoxinas C3a, C4a y C5a. Los leucocitos y el sistema del complemento, serían los gatilladores, en la fase temprana del trauma severo.
- Importancia del intestino: este puede afectarse tempranamente en la etapa del shock traumático. El fenómeno de reperfusión por disminución del VCE en forma selectiva al lecho esplácnico y la activación del sistema linfático, asociado al intestino (GALT) (con la consiguiente liberación de citoquinas) convierten al sistema digestivo como órgano diana del shock traumático.
- Activación de la coagulación y sistema fibrinolítico: el sistema de la coagulación puede activarse tanto durante la etapa temprana del shock traumático, como en su fase final hiperdinámica. Durante el shock, se activa el sistema de la coagulación por sus vías intrínseca y extrínseca, tendiendo el paciente con shock traumático a un estado de procoagulación.
- Daño microcirculatorio y glicocálix endotelial: en situación de trauma sin compensación, la liberación de catecolaminas en forma sostenida y exacerbada produce daño de la microcirculación a nivel de glicocálix endotelial (teoría SHINE 2017).
Detección del shock traumático y/o hemorrágico en la UCI y la cirugía control de año
El paciente en shock traumático que debe ingresar a cirugía, requiere ser estabilizado previamente, al igual que al salir del procedimiento quirúrgico. Muchas veces, el acto quirúrgico solo repara daños mayores, (cirugía de control de daños) por lo que el tiempo quirúrgico debe ser lo más corto posible. El paciente con reingreso a UCI poscirugía de control de daños, requiere monitoreo permanente e intenso. En aquellos pacientes que no se realiza una terapia y monitoreo eficiente, la posibilidad de ingreso a shock traumático, SIRS, sepsis, shock séptico o SDOM es altamente probable, disminuyendo su sobrevida.
A comienzos de 1990, surge el concepto del control de daño (damage control), que hace referencia a una estrategia quirúrgica que sacrifica la reparación definitiva de las lesiones, a cambio de realizar un tratamiento provisional de las mismas (limitándose a lesiones sangrantes o concomitantes). Este procedimiento se realiza para evitar que el prolongado acto quirúrgico, que podría significar un tratamiento definitivo, condicione la muerte en un paciente en situación precaria.
Para Matox un paciente no compensado en un quirófano “es el medio fisiológicamente más desfavorable para el traumatizado grave”, y puede tener consecuencias funestas, debido a que la pérdida de calor por disipación, la hemorragia inicial y la coagulopatía, se aceleran en forma desmedida.
La aproximación a una cirugía de control de daño, se fundamenta en el tratamiento quirúrgico incompleto de las lesiones, para minimizar la secuencia de hipotermia, hemorragia y coagulopatía. Luego de ello, es necesario derivar al paciente a la UCI para su correcta estabilización y luego el reingreso a cirugía para la reparación definitiva de las lesiones. Los pacientes susceptibles para esta aproximación terapéutica son aquellos con graves lesiones hepáticas, esplénicas y de grandes vasos, entre otras.
La laparatomía abreviada como cirugía de control de daños, exige el adecuado control de las lesiones activamente sangrantes o que produzca contaminación de la cavidad abdominal. La mayoría de las lesiones vasculares venosas pueden ser ligadas, o realizar empaquetamientos de los lechos sangrantes. Se debe limitar las contaminaciones, que son desencadenantes potenciales de shock séptico y SDOM (Figura 1), a través de resecciones rápidas o el uso de suturas mecánicas (bajando el tiempo quirúrgico). Si se debe realizar esplenectomías o nefrectomías, pueden dejarse pinzas vasculares, que en un segundo tiempo quirúrgico se retirarán. La posibilidad de dejar una bolsa de Bogotá para disminuir los efectos del síndrome compartimental abdominal es una opción válida.
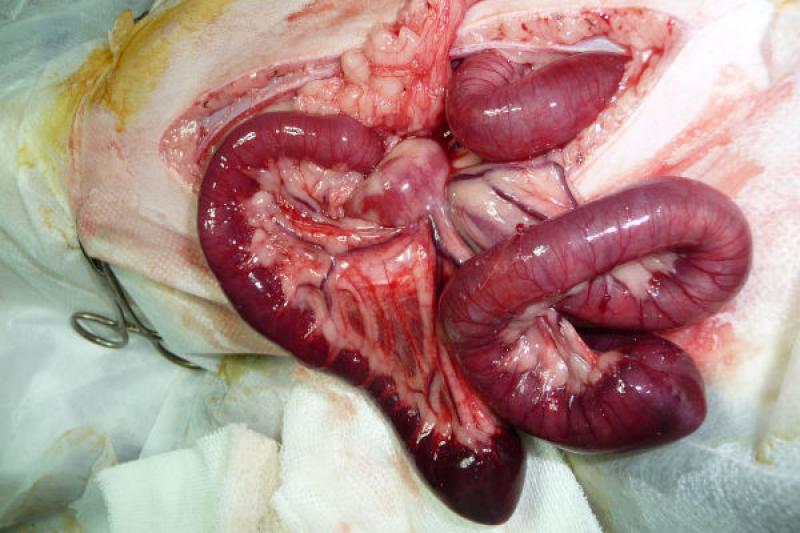
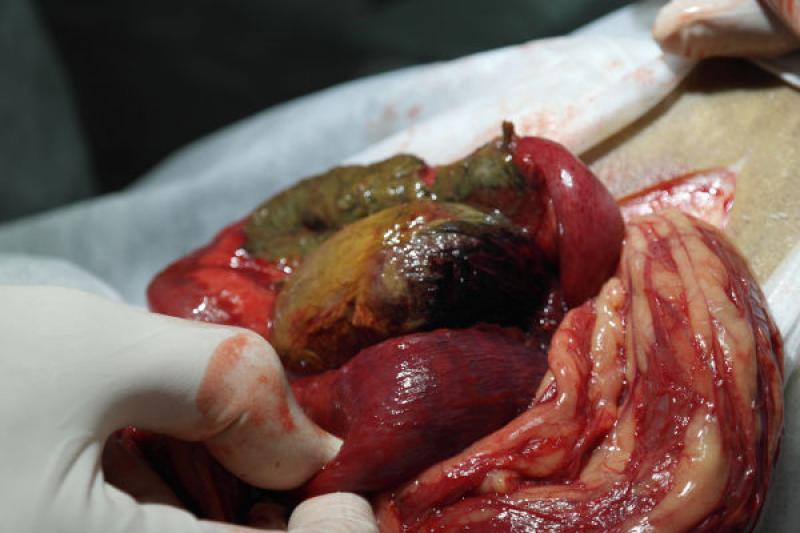
La técnica de cirugía de control de daños, pionera en el concepto, y la más realizada, es el empaquetamiento hepático. Pringle fue el primero en describir dicha maniobra para las lesiones hepáticas. Esta técnica constituyó la piedra angular de las lesiones hepáticas desde principios del siglo XX hasta la segunda guerra mundial, posteriormente, dejó de realizarse por vinculársela de forma errónea, con sepsis de origen abdominal. A partir de 1981, Feliciano comienza nuevamente a realizarla con buenos resultados. El empaquetamiento hepático debe ser considerado un instrumento útil, con indicaciones precisas, para hemorragias que no son coercibles con otras medidas y aquellas lesiones hepáticas en las que se considera el sangrado hepático, como secundario a la evidencia de acidosis, hipotermia y coagulopatía (tríada de la muerte).
El origen del síndrome compartimental abdominal (SCA) por cirugía de control de daño es multifactorial. El trauma abdominal desencadena la inflamación, y el aporte de fluidos, si en forma liberal, aumenta el edema intestinal, con elevación de la presión intraabdominal. Si se suma un cierre quirúrgico permanente, el SCA es inevitable, con resultados funestos para el paciente.
Las medidas terapéuticas propuestas para el tratamiento del shock traumático se dirigen, fundamentalmente, a la normalización de las constantes vitales; sin embargo, existen diferentes estudios que demuestran que, estos parámetros, carecen de sensibilidad suficiente para valorar la eficacia de la reanimación y para predecir el resultado final. El signo más precoz de shock es la taquicardia, que aparece con pérdidas de volemia a partir del 15 %, pero es un signo inespecífico, ya que la ansiedad y el dolor también pueden ser los causantes. La tensión arterial (TA) sistólica, se mantiene inicialmente normal gracias a una respuesta vasoconstrictora compensadora muy potente.
La TA comienza a disminuir cuando las pérdidas de la volemia superan el 25-30 %. Es importante recordar que el bazo en los caninos, juega un rol fundamental en el retraso de la aparición de los signos de shock y que, en el felino, no posee esta característica. Por ello, el paso de hipotensión a colapso cardiovascular puede ser muy rápido o más lento, de acuerdo a la especie que se examina.
La disminución de la presión arterial de oxígeno (PaO2), de la concentración de hemoglobina y del volumen minuto cardiaco, provocarán una disminución de la saturación venosa de oxígeno (SvO2), al disminuir los aportes de oxígeno. El estrés, el dolor y la hipertermia también disminuyen la SvO2 al incrementar en exceso el consumo de oxígeno. Cuando los mecanismos de compensación han sido superados y la SvO2 sigue disminuida, aparecen la hipoxia tisular global y la acidosis láctica. Hasta un 50 % de los pacientes que están siendo reanimados de un shock, pueden tener sus constantes vitales normalizadas y, sin embargo, mantener una hipoxia tisular global “oculta”, que, si no es detectada y tratada con medidas adicionales, conllevará a un peor pronóstico.
La SvcO2 es más accesible que la SvO2, que precisa la inserción de un catéter en la arteria pulmonar y mantiene una buena correlación con ella.
Se ha demostrado que el cociente entre frecuencia cardíaca y presión sistólica, refleja el índice de shock. En caninos tiene como límite superior entre 0.9 a 1 con un grado de sensibilidad muy aceptable, sobre todo en shock hemorrágico. Es decir que, en perros con índice de shock cercanos o > 0.9 a 1 deberían instaurarse medidas terapéuticas urgentes para normalizar dicho parámetro (< 0.9/1).
El exceso de bases (EB) también es un indicador de shock y un predictor fiable de la gravedad de la lesión traumática y de la mortalidad. Un EB < -5 se ha relacionado con una mortalidad del 37 % en pacientes pediátricos humanos. En este mismo estudio, el EB demostró ser más sensible para detectar el shock que las constantes vitales al ingreso, ya que no se detectaron diferencias significativas en la TA ni en la frecuencia cardiaca de los niños acidóticos, con respecto a los que no lo estaban. La presencia, al ingreso, de un EB < -8 debe hacer sospechar la existencia de lesiones potencialmente mortales y de un shock descompensado. La incapacidad para corregir el déficit de bases durante las primeras 24 horas, conlleva a una elevada mortalidad.
La determinación de ácido láctico en sangre arterial o venosa ha demostrado ser más precoz y más predictivo que el EB. Las cifras de ácido láctico superiores a 2 mmol/L o 18 mg/dl indican la presencia de shock. La determinación de ácido láctico, en la actualidad, es de fácil acceso para la medicina veterinaria, con un costo beneficio excelente. Las mediciones seriadas en estos pacientes, nos permite en primera instancia, monitorear si es efectiva la resucitación hemodinámica; por otro lado, es un predictor efectivo de índice de mortandad.
Terapia shock traumático
Fluidos
En el shock traumático, la reanimación agresiva con cristaloides (30 ml/kg pacientes > 5 kg; 10 ml/kg pacientes < 5 kg) debe tenerse siempre en cuenta, salvo que el paciente que ingresa a la UCI se encuentre con una hemorragia activa grave. En estos casos, el retraso en la consecución de los objetivos terapéuticos estándar, puede ser beneficioso, si los pacientes van a ser intervenidos quirúrgicamente de forma precoz.
La denominada “hipotensión permisiva”, que consiste en mantener una TA por debajo de los niveles normales (70 mmHg de presión sistólica) sin comprometer excesivamente la perfusión orgánica, reduce el ritmo de sangrado, el resangrado y la hemodilución; mejorando la supervivencia.
La maniobra contrapresiva es otra opción para tratar el sangrado abdominal, este abordaje terapéutico debe tener en cuenta el monitoreo permanente de la presión arterial. Los objetivos básicos de la reanimación, en el shock traumático, se dirigen al cumplimiento de los siguientes parámetros:
- TA sistólica 95 mmHg
- TA media 65 mmHg
- Diuresis > 1 ml/kg/hora
- Lactato
- Índice de shock < 0.9/1
- EB +- 2 meq L
- Normotermia
La reposición de líquidos intravenosos (cristaloides), se iniciará con un bolo de 30 ml/kg en caninos y, 10-15 ml/kg en felinos. En esta especie debe realizarse una previa corrección de la hipotermia, con solución electrolítica balanceada con plasma o Ringer lactato, durante 10 a 15 minutos y luego monitorear los parámetros.
El suero salino hipertónico posee una probada capacidad para aumentar la TA y disminuir la presión intracraneal con la infusión de volúmenes bajos. La solución fisiológica al 7.5 % sigue siendo un recurso valedero y económico para restablecer la TA. Está contraindicado el uso de solución hipertónica de ClNa, en los estados previos de hipernatremia (“golpe de calor” o deshidratación hiperosmolar).
Los coloides restablecerán antes la hemodinámica del paciente, sin embargo, no se usan inicialmente. Los estudios que comparan cristaloides y coloides, no encuentran ninguna ventaja en cuanto a la supervivencia, al menos en las publicaciones disponibles. Por otro lado, la posibilidad de nefrotoxicidad en medicina humana y veterinaria, sigue siendo prevalente.
En algunos estudios epidemiológicos, la transfusión de sangre en el shock hemorrágico traumático, ha resultado ser un predictor independiente de fallo multiorgánico. La sangre almacenada en banco, más de 15 días, provoca leucotoxicidad y obstrucción de los capilares, por disminución de la deformabilidad de la membrana de los hematíes almacenados y la presencia de interleukinas y leucotrienos en las bolsas de transfusión. Sin embargo, en nuestro medio, las hemoglobinas libres de estroma no están aún al alcance, por lo que sigue siendo una opción segura, la transfusión con sangre fresca, previo cross match.
Apoyo vasomotor e inotrópico
En el caso de evidenciarse refractariedad a la administración de cristaloides y habiéndose monitoreado en forma intensiva el manejo del dolor, la posibilidad de la interacción del shock traumático con la aparición de un SIRS agudo, sepsis o shock séptico es frecuente. En este caso, es menester realizar un apoyo vasomotor/inotrópico.
La refractariedad a la terapia, implica la no corrección de variables hemodinámicas esperadas (hipotensión continua con aumento de la frecuencia cardíaca, oligoanuria, aumento de los niveles de lactato en sangre). Los fármacos inotrópicos, requieren un volumen intravascular apropiado para ser eficaces, y no lo son en estados de hipovolemia no corregida. Son ejemplos de inotrópicos que pueden emplearse en pacientes con una evidencia continuada de mal gasto, a pesar de una expansión de volumen adecuada, la dobutamina, la dosis beta de dopamina y dosis bajas de noradrenalina por poseer un efecto beta 1 leve.
La dobutamina es un agente simpaticomimético sintético, que ejerce efectos sobre los adrenoreceptores beta 1 del miocardio, para incrementar la fuerza de la contracción. También ejerce efectos débiles sobre los receptores beta 2, localizados en los vasos sanguíneos, para producir una leve vasodilatación. La combinación de una leve vasodilatación arterial y el incremento de la fuerza de la contracción miocárdica, resulta en un incremento del gasto cardíaco sin un incremento dramático de la presión arterial. La dosis recomendada es 2-5 ug/kg/min. Dosis mayores pueden llevar a mal distribución de flujo.
La dopamina es un precursor de la norepinefrina y ejerce efecto dosis dependiente. La dosis baja de 1-5 ug/kg/min estimula los receptores dopaminérgicos en las arterias renales (aunque hoy su efecto renal es desestimado), coronarias, cerebrales e intestinales. La dosis de 5-8 ug/kg/min produce efectos beta 1 y leve beta 2; y en dosis de 8-12 ug/kg/min el efecto es netamente alfa. El efecto alfa va en desmedro de la circulación y resucitación hemodinámica esplácnica.
La noradrenalina es un agonista de los receptores alfa y se asocia con vasoconstricción arteriolar y venosa. También exhibe una mínima actividad agonista sobre los receptores beta 1. La experiencia clínica sugiere que puede aumentar la presión arterial media, sin deteriorar el gasto cardíaco ni las funciones orgánicas. El trabajo ventricular izquierdo aumenta y la presión de oclusión de la arteria pulmonar no cambia o lo hace levemente. En general, la noradrenalina es más potente que la dopamina para revertir la hipotensión en el shock traumático y séptico.
En estudios en animales, las altas dosis administradas por vía arterial, inducen isquemia renal, sin embargo, en el shock traumático y séptico, mejora la perfusión renal, aunque se debe recordar que una mejora en la diuresis no implica aclaramiento de la creatinemia. En lo relativo a la resucitación del lecho esplácnico, los resultados de la terapia con noradrenalina son dosis dependiente, es decir, a mayor dosis, aumenta la isquemia del lecho vascular esplácnico. Se recomienda comenzar con dosis bajas y titular respuesta 0.1; 0.2 hasta 1 ug/kg/min. Cuanto más alta es la dosis, mayor es el porcentaje de mortandad a mediano y largo plazo.
Coagulopatía traumática
El paciente politraumatizado con una hemorragia profusa, entrará en un círculo vicioso, caracterizado por hemodilución, consumo de factores de la coagulación, fibrinólisis, hipotermia, acidosis, politransfusión, mayor hemodilución y finalmente SDOM y muerte.
El paciente que presenta la tríada hipotermia, acidosis y coagulopatía, presenta una mortalidad muy elevada a pesar de la cirugía, por ello, es muy importante minimizar la transfusión de hemoderivados en lo posible, mediante un control quirúrgico muy precoz de la hemorragia. Cuando la coagulopatía se ha establecido, el recalentamiento y la reposición de factores de la coagulación son esenciales.
Es evidente que en el shock traumático la posibilidad de aparición de la coagulopatía traumática está siempre presente. Por ello, para contrarrestar el estado fibrinolítico, se ensayó un fármaco con capacidad antifibrinolítica. El ácido tranexámico (TXA = ácido trans-4-aminometilciclohexano-1-carboxílico) es un análogo sintético de la lisina. Este aminoácido está presente en la malla de fibrina y es el cebador de la fibrinólisis. Mientras más residuos de lisina exponga la molécula de fibrina, más débil es ese coágulo.
La evidencia muestra una correlación directa entre la profundidad de la hipotensión y el aumento de la fibrinólisis. En este punto, la administración de ácido tranexámico, inhibe la descomposición enzimática de coágulos de fibrina, evitando su unión con el plasminógeno. Al no producirse este enlace, no se forma plasmina. La plasmina es funcionalmente la antítesis de la trombina, la primera rompe los coágulos y la última los forma.
El estudio CRASH-2 (clinical randomisation of antifibrinolytic therapy in significant hemorrhage) evaluó la administración de TXA en pacientes traumatizados y es, hasta la fecha, el estudio que más pacientes incluyó, con una N= 20211. En él se concluyó categóricamente, que los pacientes que reciben TXA dentro de las 3 horas de ocurrido el trauma, reducen drásticamente la mortalidad por hemorragias. Cuando no se dispone de pruebas viscoelásticas, como tromoboelastografía (TEG) o tromoboelastometría (ROTEM) para demostrar fibrinólisis acelerada, se sugiere su aplicación sin estos estudios. La dosis de ácido tranexámico es de 10-20 mg/kg EV lento, seguido de una infusión a ritmo constante de 10- 20 mg/kg/h durante 8 horas, mejorando su eficacia, cuando más temprano se administre.
Conclusiones
- Es necesario la comunicación fluida e integral entre las áreas de UCI y cirugía para determinar el momento óptimo de ingreso del paciente a quirófano.
- El planteo de la cirugía de control de daño debe ser informada y aceptada por el propietario del paciente, ya que debe comprender que dicha terapia es sólo el inicio de terapéuticas de urgencia, para intentar salvar la vida.
- El intento por resolver todas las lesiones producto del politrauma, en un tiempo extenso, solo disminuye la posibilidad de sobrevida del paciente.
- Una mala estabilización hemodinámica previa a la cirugía de control de daño, solo empeora el cuadro.
- Es necesario el trabajo mancomunado y responsable entre las áreas de cirugía y UCI para obtener buenos resultados.
Bibliografía
- Aller MA, Arias JI, Alonso.Poza A, Arias J (2010). A Review of metabolic staging in severly injured patients. Scandinavian Journal of Trauma, Resucitation and Emergency Medicine, 18: 27.
- Anderson M W, MSN, ACNP-BC, CCRN, Watson G A, MD, FACS. Traumatic Shock: The Fifth Shock. Journal of trauma nursing. Volume 20, Number 1, January–March 2013.
- Bateman S. Hypercoagulable states. In Small Animal Critical Care Medicine. Silverstein DC and Hopper K (eds), Saunders Elsivier, pp:502-506.
- Fragio Arnold C. (2018) Manual de Fluidoterapia en Pequeños Animales. Multimédica Ediciones Veterinarias. Sant Cugat del Vallés. Barcelona - España.
- Johansson P, Stensballe J, Ostrowski S, Shock induced endotheliopathy (SHINE) in acute critical illness a unifying pathophysiologic mechanism. Critical Care. 21:25 (2017)
- Keel T,Trentz O. (2005) Pathophysiology of polytrauma. Injury, Int. J. Care Injured
- Mouly, J, Donati, P. (2020) Manejo Integral del Shock en Perros y Gatos. Multimédica Ediciones Veterinarias. Sant Cugat del Vallés. Barcelona - España
- Mouly J. (2018) Emergencias y Cuidados críticos en Pequeños Animales. Magnago F Cap 22. Coagulopatía Aguda del Shock y el Trauma (Acost). Multimédica Ediciones Veterinarias. Sant Cugat del Vallés. Barcelona – España.
- Mouly J. Controversias en el apoyo vasopresor e inotrópico en el paciente con shock séptico. Clinurgevet. Revista Clínica de Urgencias Veterinarias. Multimédica Ediciones Veterinarias (9) mayo 2018. PP 16 : 21.
- Quesada Suescun, Rabanal Llevot J. (2008) Actualización en el manejo del trauma grave. J M Rabanal Llevot. Capítulo 9 Avances en el manejo inicial del shock traumático hipovolémico. Pag 109. Editorial Ergon Madrid España.
 by Multimédica
by Multimédica