Tratamiento de carcinoma de células escamosas mediante maxilectomía rostral oblícua y prótesis de titanio
Resumen breve
Las neoplasias de cavidad oral suponen un 6% de los tumores caninos.El Carcinoma de células escamosas (CCE) supone el 17-35% de los tumores orales en perros, el segundo más frecuente en esta localización después del Melanoma. Se presenta habitualmente en animales de edad avanzada (10 años de media), no parece haber predisposición de raza ni de sexo.Su localización más frecuente dentro de la cavidad orofaríngea es la mandíbula rostral, tienen aspecto de coliflor y frecuentemente aparecen…Índice de contenidos

Introducción
Las neoplasias de cavidad oral suponen un 6% de los tumores caninos.
El Carcinoma de células escamosas (CCE) supone el 17-35% de los tumores orales en perros, el segundo más frecuente en esta localización después del Melanoma. Se presenta habitualmente en animales de edad avanzada (10 años de media), no parece haber predisposición de raza ni de sexo.
Su localización más frecuente dentro de la cavidad orofaríngea es la mandíbula rostral, tienen aspecto de coliflor y frecuentemente aparecen ulcerados.
Los signos clínicos dependen de la localización, puede aparecer apatía, hiporexia/anorexia, sialorrea, halitosis y disfagia.
Los CCE son localmente agresivos, con baja frecuencia de metástasis y alta capacidad de recidiva. Los de localización rostral tienen mejor pronóstico que los situados en porciones caudales (base de la lengua, tonsilas, faringe), en caso de la aparición de metástasis esta suele ser a linfonodos regionales y pulmón.
Cuando está presente, el hueso subyacente suele estar invadido y necesita ser resecado en bloque con el tumor (maxilectomía, mandibulectomía).
Caso clínico
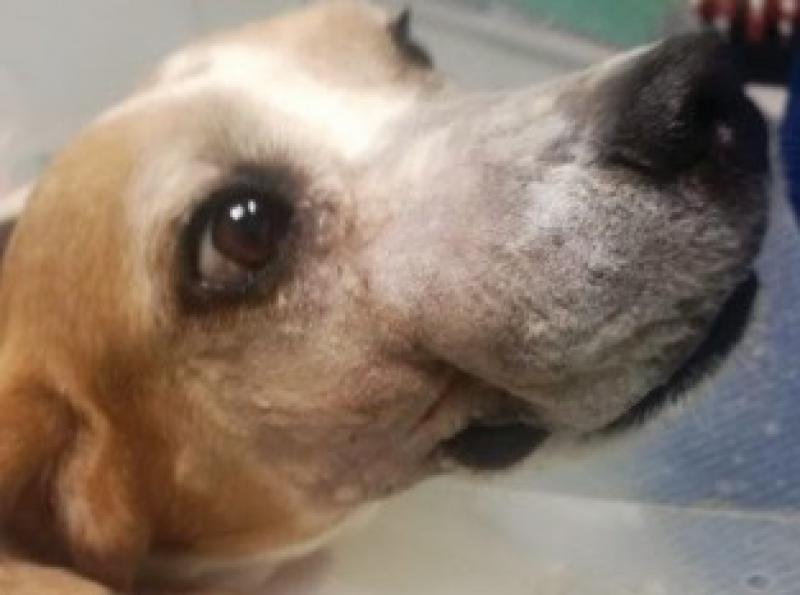
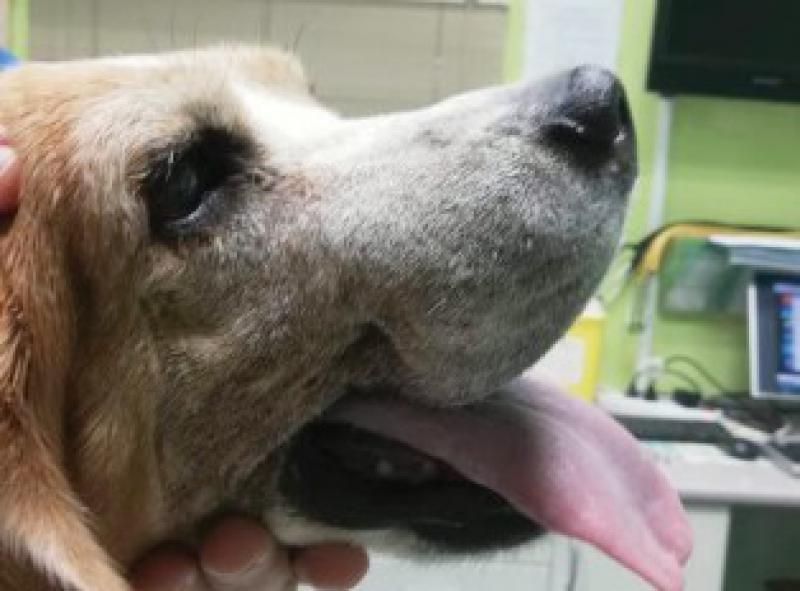
Se atiende en consulta una perra de raza Beagle, hembra esterilizada de 7 años de edad.
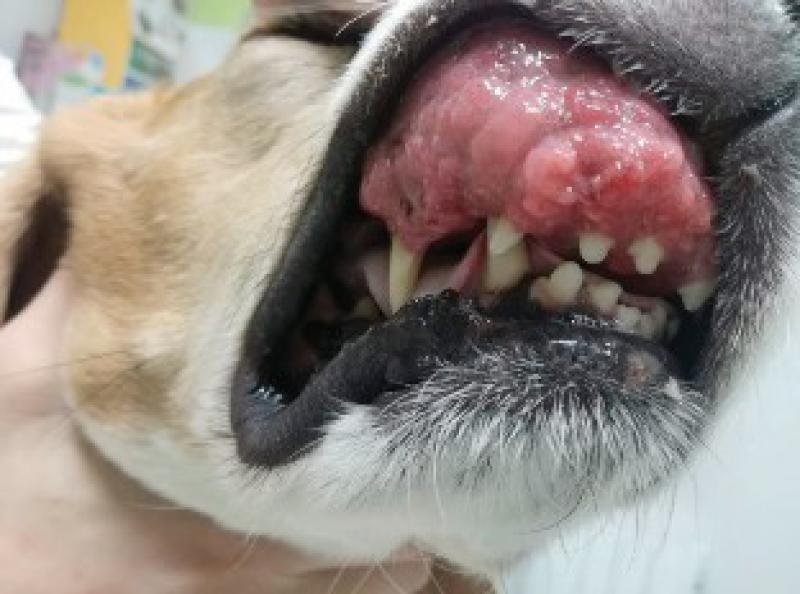
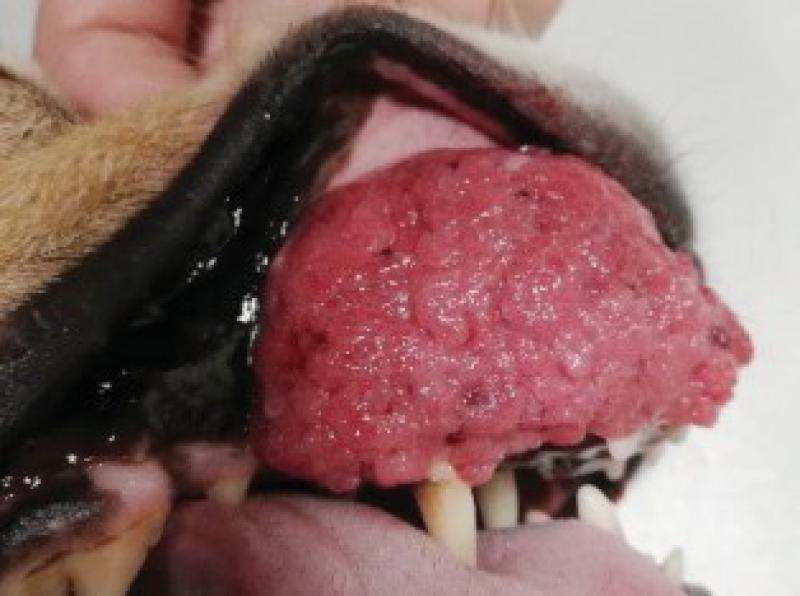
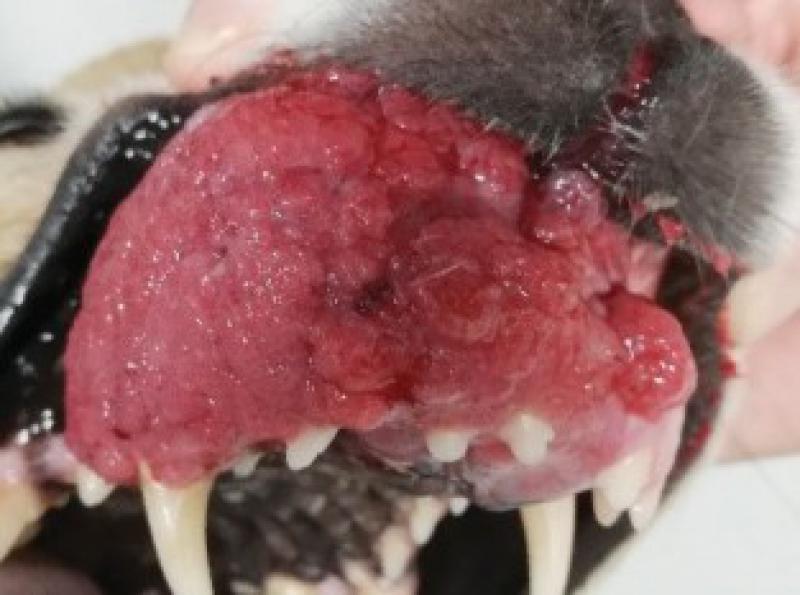
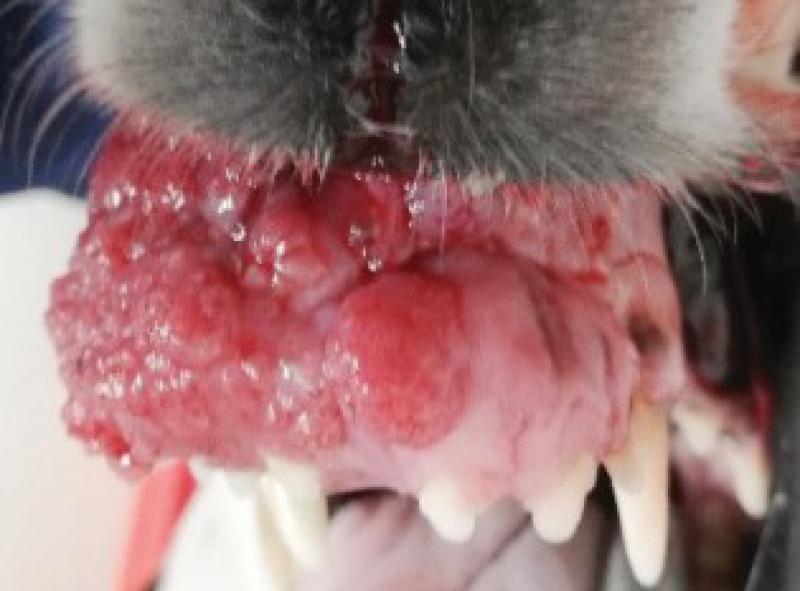
Presenta crecimiento exuberante en la región rostral de la maxila de aproximadamente 5 x 4 cm, ha sido intervenido en dos ocasiones en otro centro sin realizarse biopsia y con sendas recidivas. La masa desplaza el canino superior derecho, así como todos los incisivos superiores.
La perra come y bebe con normalidad, tiene un buen estado de ánimo(Figuras1 y 2).

Los diferenciales deben incluir los tumores orales posibles en la especie canina:
- Melanomas.
- Carcinoma de células escamosas.
- Fibrosarcomas.
- Épulis.
- Tumores odontogénicos.
Técnicas diagnósticas
Citología
Las punciones y aspirados con aguja fina pueden ser de utilidad para aproximar el diagnóstico en estas masas, aunque no siempre se obtienen muestras representativas ya que normalmente hay material inflamatorio y/o infecciones secundarias y además en los tumores orales suele haber una marcada anaplasia.
El diagnóstico definitivo lo obtendremos mediante un estudio histopatológico, se recomienda la realización de biopsias quirúrgicas profundas que incluyan si es posible el hueso subyacente.
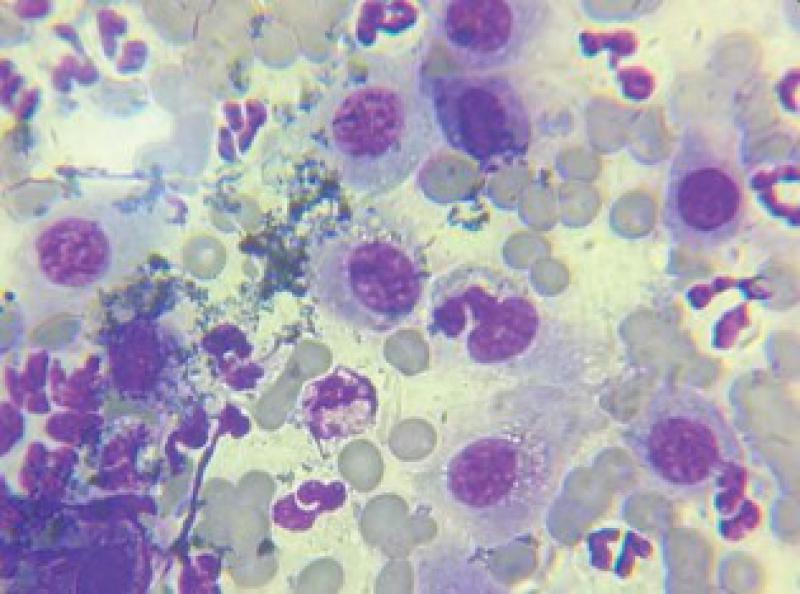
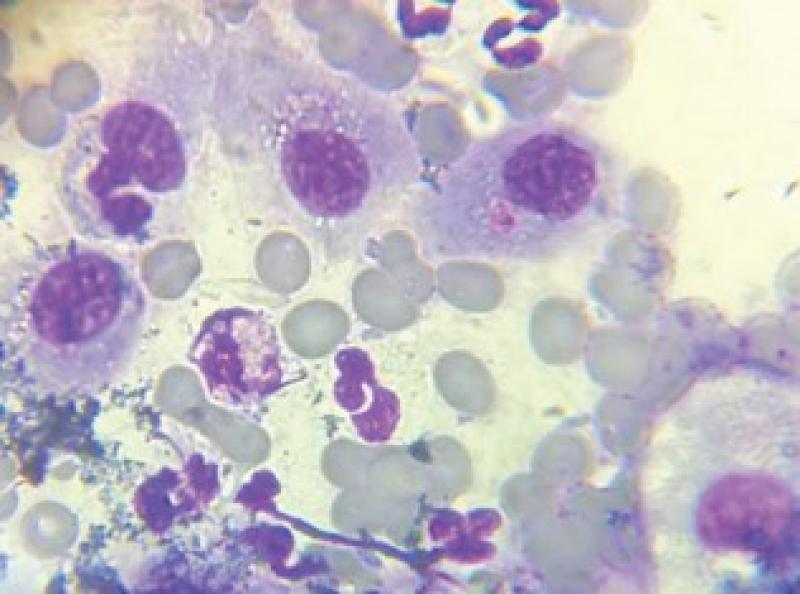
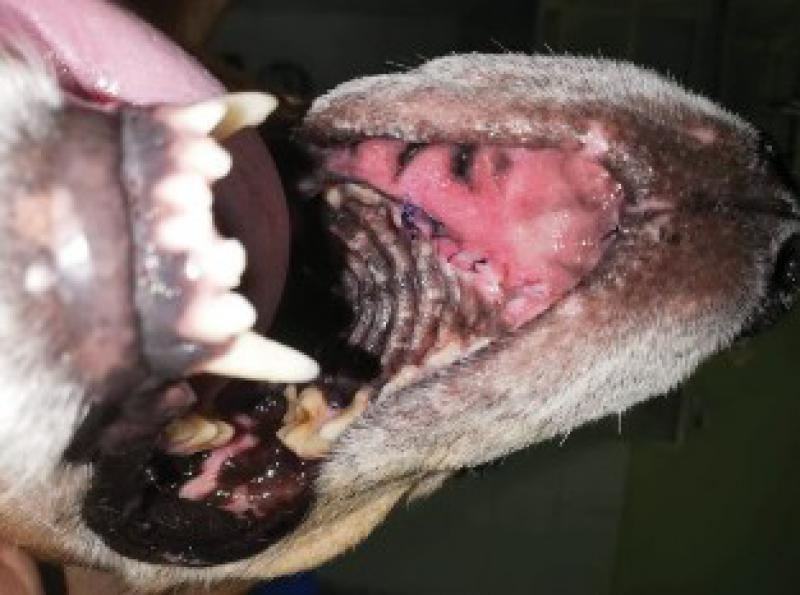
En primera instancia se realiza Punción con Aguja Fina (PAF) de la masa, la citología resulta sugestiva de Carcinoma de células escamosas vs Melanoma amelanocítico (Figuras 3 y 4).
Se realizó analítica sanguínea completa con tiempos de coagulación sin encontrarse alteraciones significativas.
Pruebas de imagen
Se realizan radiografías de tórax en las que no se encuentra ninguna imagen compatible con metástasis pulmonares.
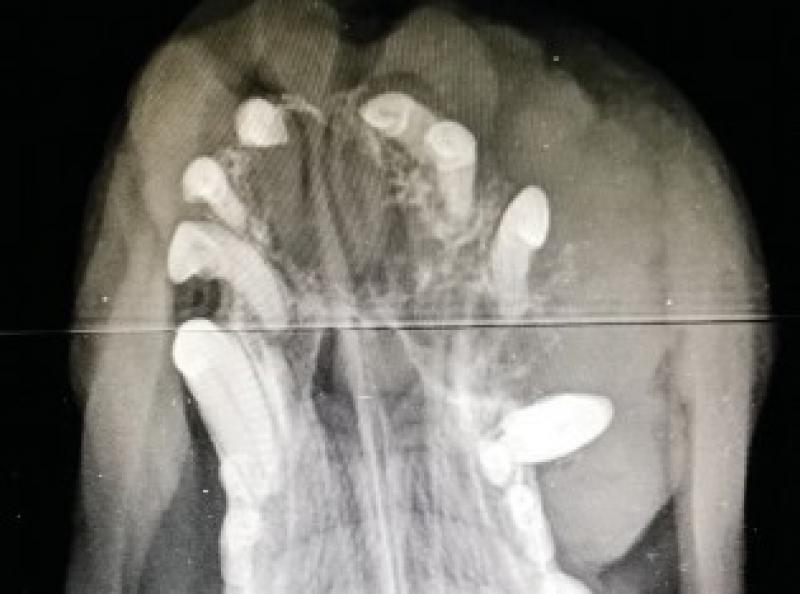
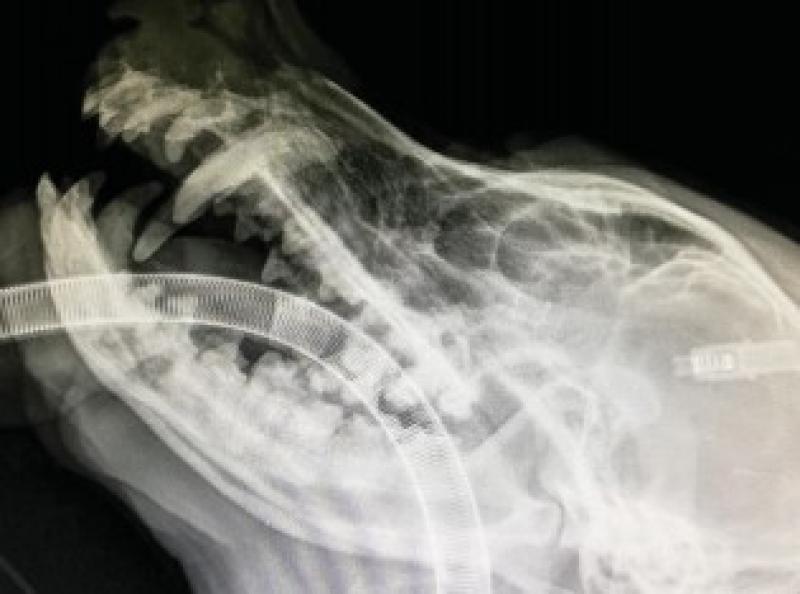
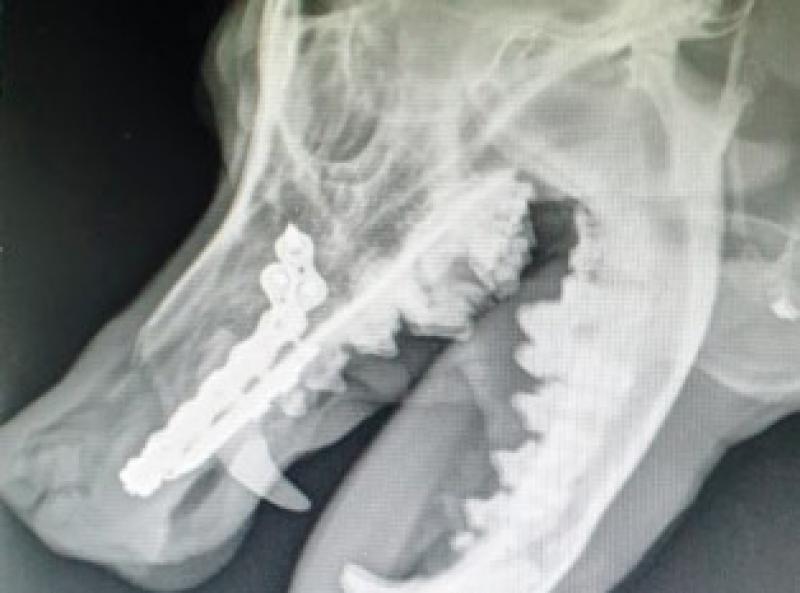
Se realizan radiografías ortogonales del maxilar en las que se evidencia osteólisis del hueso maxilar e incisivo, desplazamiento muy evidente del canino superior derecho y de los incisivos superiores (Figuras 5 y 6).
Dada la extensión y el tipo de tumor se decide la realización de una tomografía computerizada (TC) que permita valorar correctamente los márgenes del tumor, la afectación de tejidos adyacentes, así como la evaluación de ganglios mandibulares, retrofaríngeos y otros ganglios linfáticos cervicales.
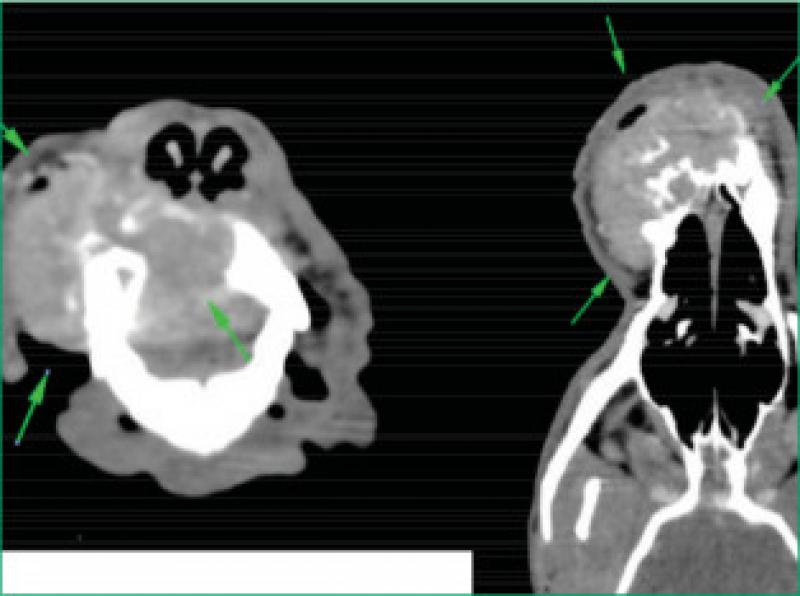
La TC evidencia una masa en maxilar derecho de 5,4 cm de longitud x 4 cm de anchura x 3,4 cm de altura asociada a lisis del hueso maxilar y ambos huesos incisivos consistente con neoplasia oral (Figura 7).
Aprovechando la anestesia de la TC se toma biopsia incisional y se remite para estudio histopatológico el cual indica la presencia de un ameloblastoma acantomatoso.
Estadificación
- Tamaño >4 cm el diámetro mayor.
- No afectación de linfonodos regionales.
- No metástasis a distancia.
- Invasión ósea.
- T3bN0M0 estadío clínico IIIb.
Tratamiento
El tratamiento de elección es la cirugía agresiva mediante maxilectomía.
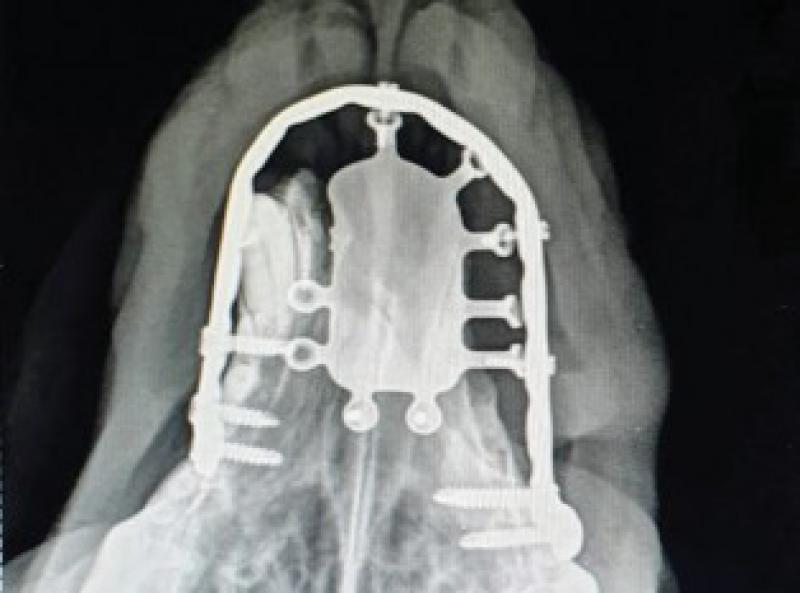
De acuerdo con los propietarios se decide la resolución quirúrgica mediante una maxilectomía rostral oblicua. Dado que el resultado estético es muy importante para ellos se plantea la sustitución del hueso retirado por una prótesis a medida de titanio que dé soporte a los tejidos blandos de la trufa y labios y otra que sustituya la parte de paladar duro que se incluirá en la ostectomía y además sirva de base para el colgajo de mucosa del carrillo que utilizaremos para cerrar el defecto.
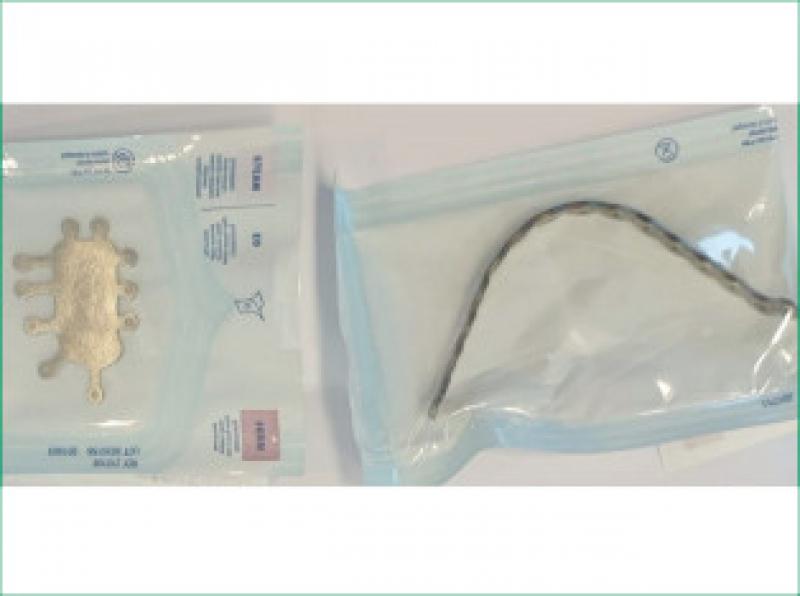
Se encarga la fabricación del implante a BETA Implante(Figuras 8 a11).
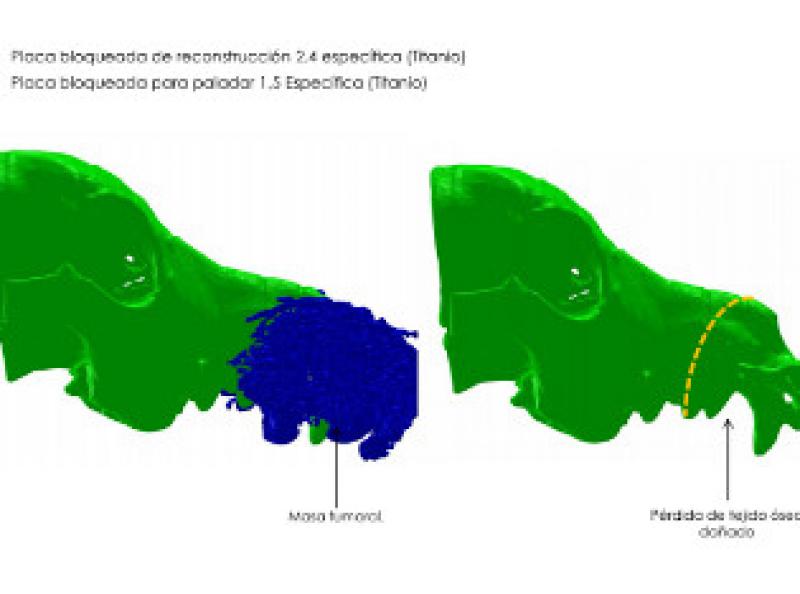
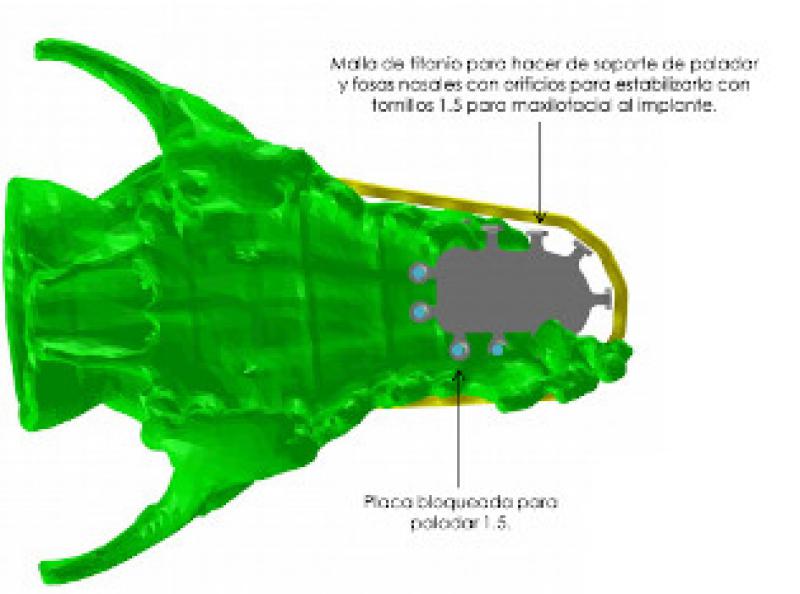
Se planifica la cirugía según los resultados obtenidos de la TC incluyendo en la ostectomía 1,5 cm de margen con respecto a la imagen obtenida en la TC. Se incluyen, por tanto, los dos primeros premolares y canino superiores derechos, así como todos los incisivos.
En la preparación anestésica se realiza bloqueo loco-regional de las ramificaciones del nervio maxilar a nivel del agujero infraorbitario derecho e izquierdo.
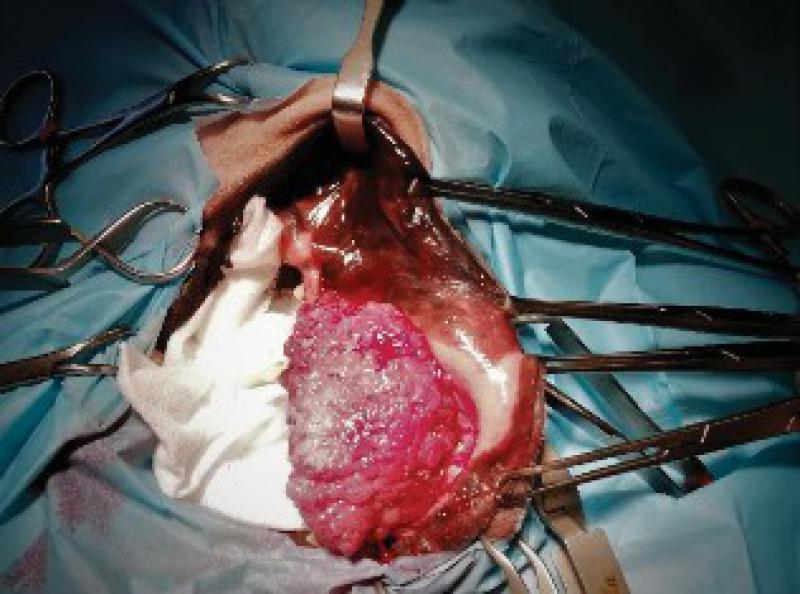
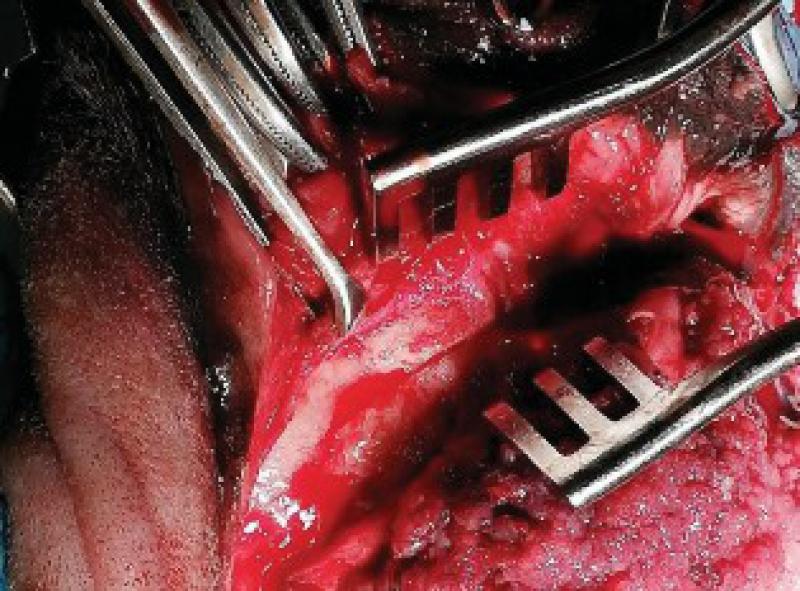
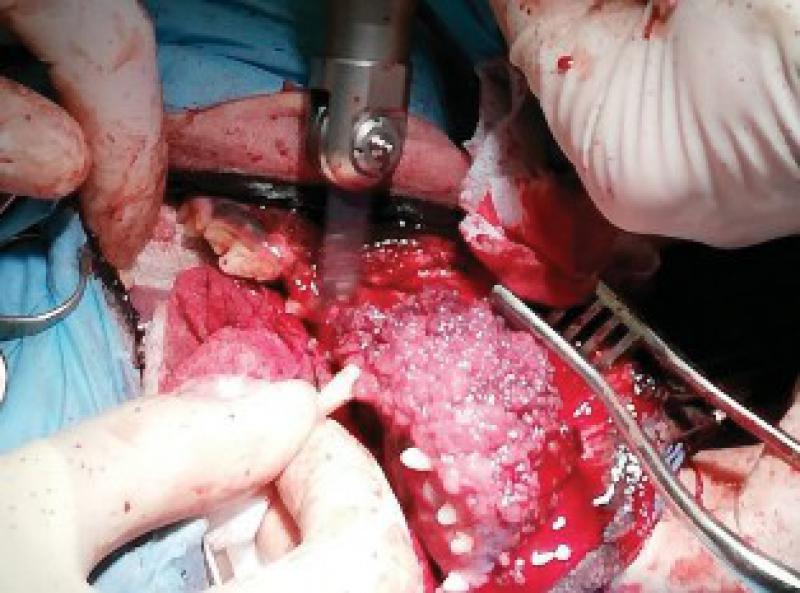
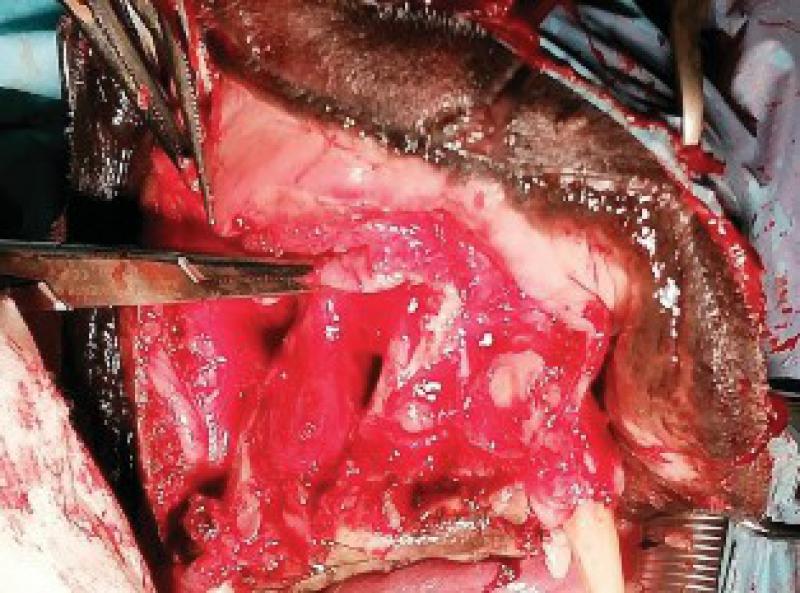
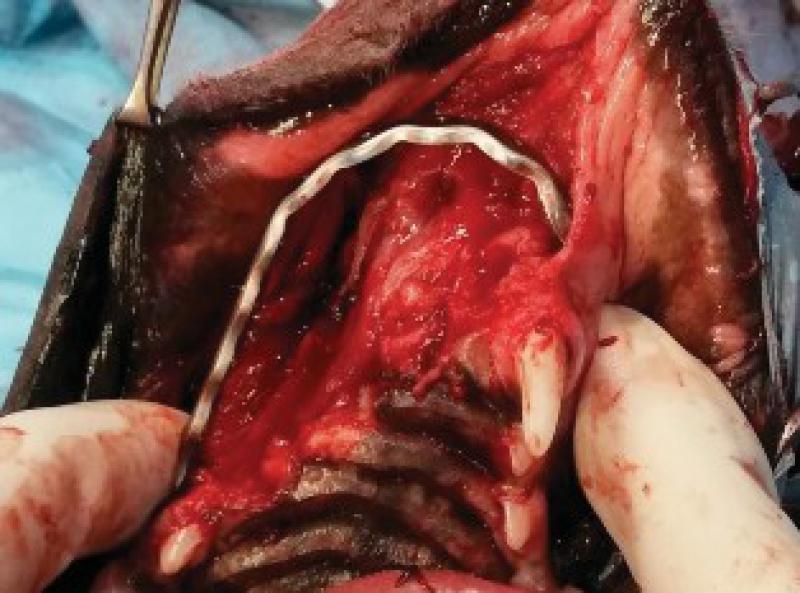
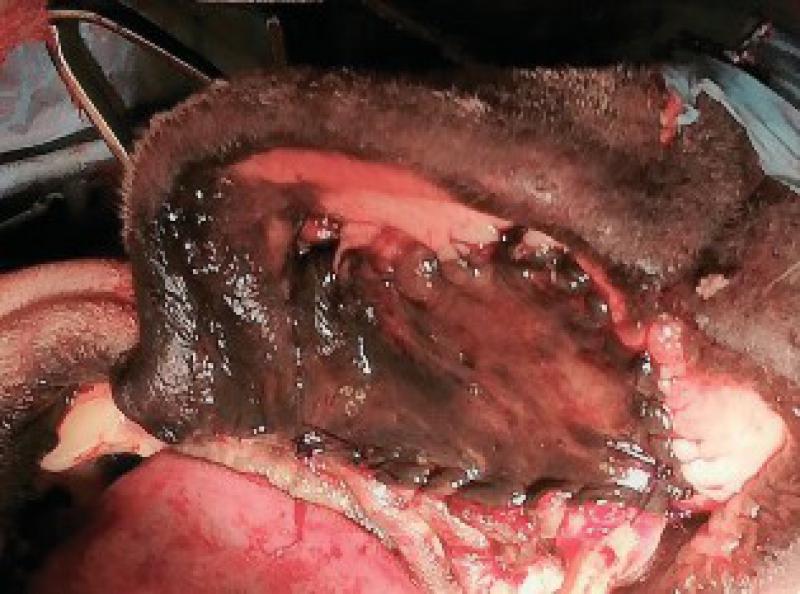
Retiramos los tejidos blandos dorsalmente, comenzando la incisión a nivel de la encía y elevando las estructuras nerviosas y vasculares que llegan a la zona de la trufa y labios con el fin de preservarlos. Una vez elevados los tejidos blandos se realiza el marcaje de la línea de ostectomía en los dos huesos maxilares. Igualmente se incide al paladar, ligando las dos arterias palatinas y, tras separar la mucosa del paladar se marca también la línea de la ostectomía. A continuación, realizamos la ostectomía y se retira el bloque hasta la parte ventral de los cornetes nasales.
Para el control del sangrado se utiliza electrocirugía, compresión y ligaduras.
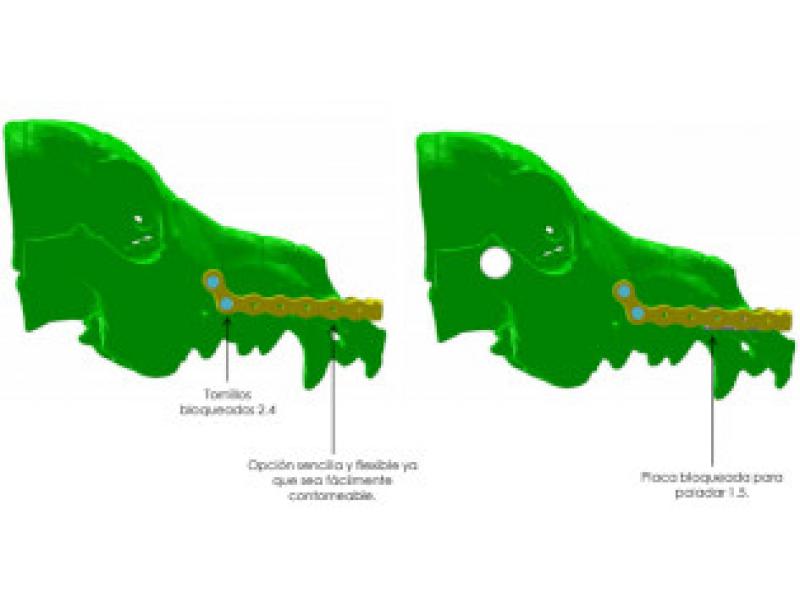
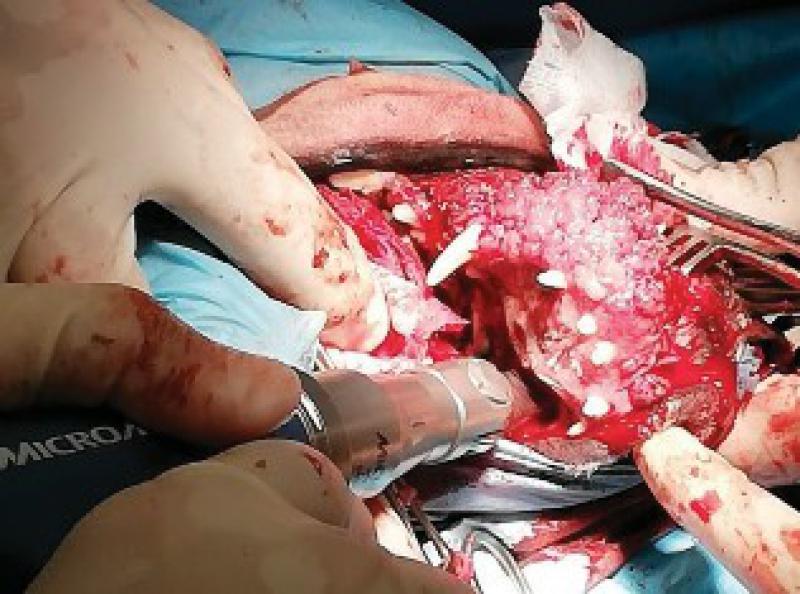
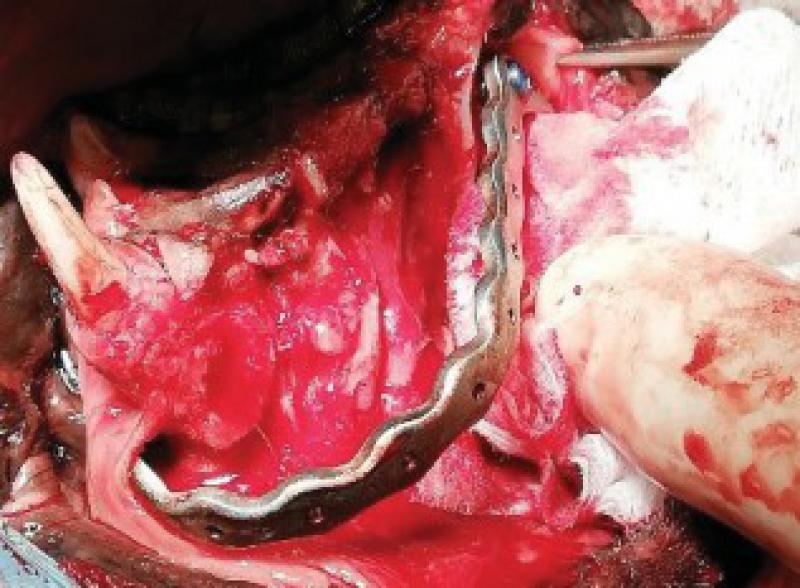
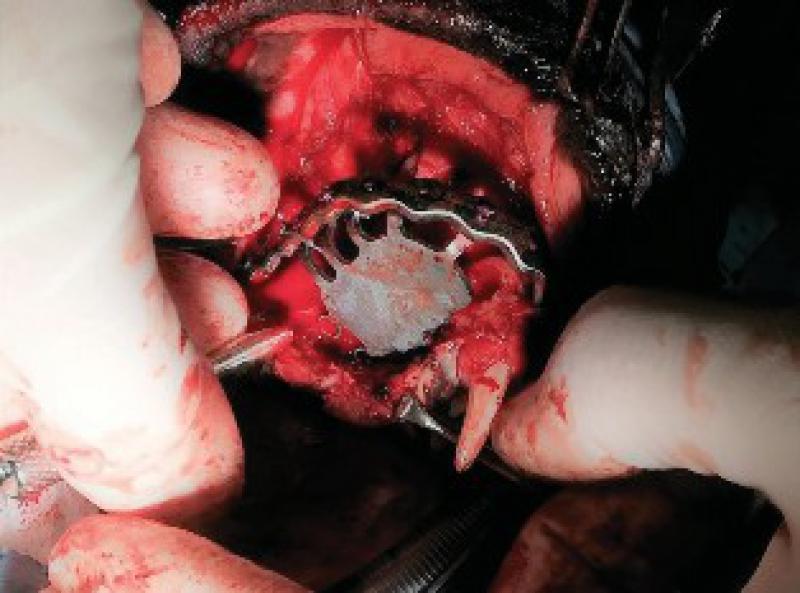
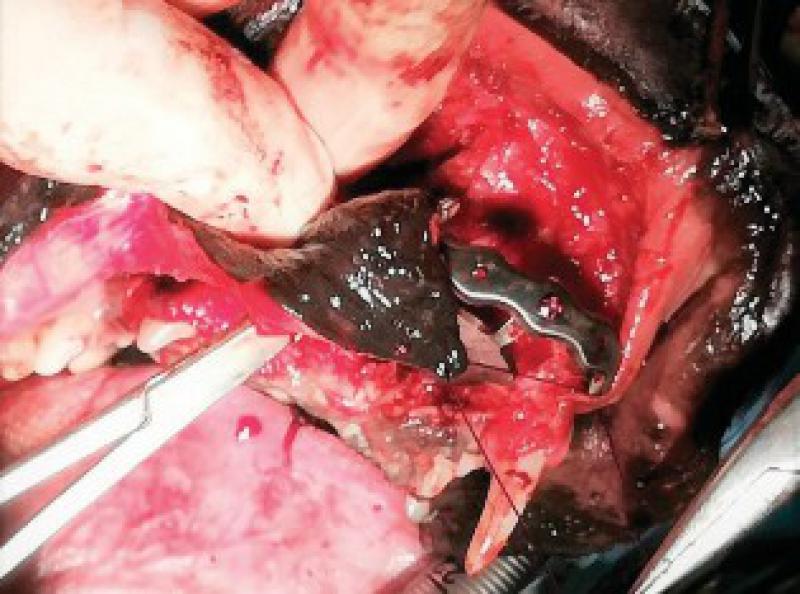
Una vez realizada la ostectomía se moldea la placa de titanio según la anatomía del animal, se coloca mediante tornillos de titanio de 2,4mm que la unen al hueso maxilar de ambos lados. Posteriormente se recolocan los tejidos blandos en su localización original. En el defecto del paladar se coloca la plancha de titanio y se atornilla a la placa ya colocada con tornillos de 1,5 mm, a continuación, se cubre la plancha de titanio con un colgajo de mucosa del carrillo en el lado derecho (Figuras 12 a 34).
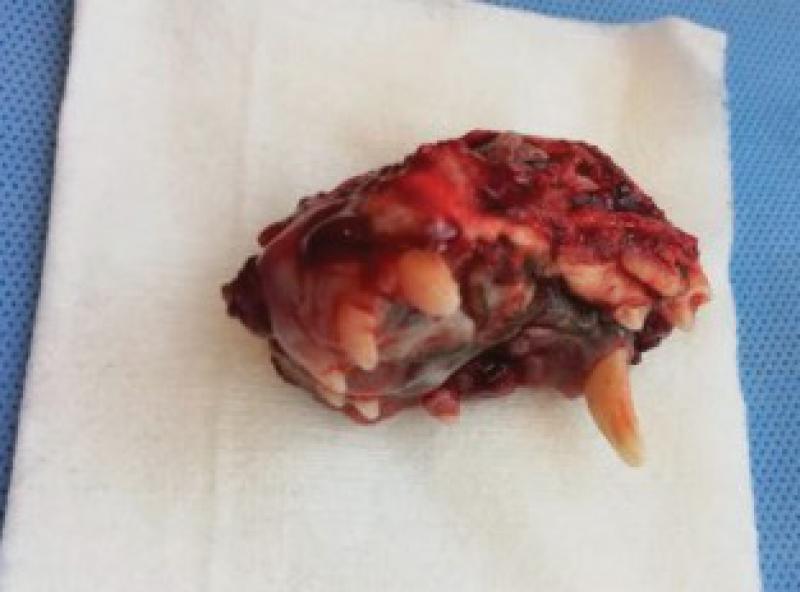
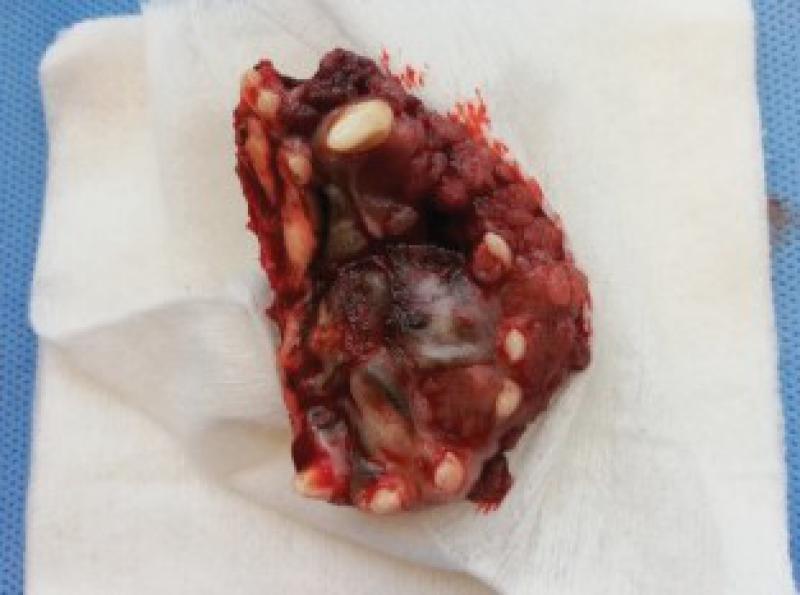
El bloque se remite a anatomía patológica para diagnóstico y valoración de márgenes.
Se diagnostica un carcinoma de células escamosas subtipo verrucoso con resección completa, pero con márgenes próximos a las células neoplásicas.


Tratamientos alternativos/adyuvantes para el CCE
- La radioterapia adyuvante puede considerarse en los casos en los que la escisión quirúrgica no pueda lograr márgenes suficientes o como tratamiento paliativo cuando la cirugía no es una opción. Como terapia única ha demostrado menor eficacia.
- Quimioterapia sistémica: Mitoxantrona, carboplatino, doxorrubicina, se indica en tumores con alto potencial metastásico, la quimiosensibidad de estos tumores en general es baja
- Inhibidores de la Cox-2.
- Inhibidores de la Tirosin kinasa : Toceranib . En un estudio el en cual se incluyeron 85 perros con diferentes tumores sólidos se concluyó que el 74% tuvieron mejoría clínica evidente después del tratamiento con Toceranib, se incluyeron 7 perros con CCE (3 nasales y 4 orales) de estos sólo uno tuvo remisión completa (12.5%), aunque se desconoce el tiempo que se mantuvo la remisión y cinco tuvieron respuesta parcial (62.5 %) con una media de duración de tratamiento de 5 meses.
- El tratamiento con toceranib combinado con un inhibidor de la Cox-2 podría ser un tratamiento de elección en CCE orales (no tonsilares) en estadío I cuándo la cirugía no es una opción factible.
En nuestro caso el tratamiento elegido como terapia adyuvante post cirugía es Toceranib a 2,7 mg/kg/48h combinado con cimicoxib (inhibidor de la Cox-2).
Pronóstico
El tamaño del tumor es el factor pronóstico más claro en perros con tumores orales tratados con cirugía en términos de supervivencia y recurrencia.
Los tumores rostrales están asociados a un mejor pronóstico debido a que, normalmente, tienen un diagnóstico más temprano y su escisión completa es más probable.
Si se puede lograr una escisión completa el pronóstico también es mejor.
La tasa de recurrencia es de alrededor del 15% en casos de resección completa y del 65% cuando tenemos márgenes incompletos.
Discusión
Dado que el tratamiento de elección para este tipo de neoplasias es la cirugía agresiva que habitualmente va asociada a una deformación estética importante en el paciente, la técnica quirúrgica elegida en este paciente puede ser una opción muy interesante frente a la maxilectomía radical en la que no conservamos los tejidos blandos de la trufa y labios ya que se consigue un resultado estético muy bueno y esto resulta muy importante para algunos propietarios que no aceptan el cambio estético de sus animales.
La técnica es relativamente sencilla y el coste de los implantes es aceptable.
Debido a la elevada incidencia de recidivas de los CCE y el escaso margen conseguido en la cirugía se opta por la quimioterapia adyuvante anteriormente descrita.
Bibliografía
- Del Castillo Magán, N., Ruano Barneda,R. Manual de Oncología para veterinarios clínicos . 2017 Madrid, España: Servet
- Martínez de Merlo, E.M., Pérez Alenza,D., Arconada Muñox,L., Arenas Bemejo, C. (2011) Manual práctico de oncología en pequeños animales 2011. .Madrid, España. Axón comunicación
- Ruano Barneda,R. ( 2013). Oncología práctica para el clínico de pequeños animales.. (2013 ) Multimédica ediciones veterinarias
- Findji,L., Referrals,F. Cirugía de Tumores oral. AVEPA, Barcelona 2015
- Adell,D., Gay,C. Tratamiento médico de un carcinoma de células escamosas oral maxilar. (2019) Barcelona . Portal Veterinaria
- Preliminary evidence for biologic activity of toceranib phosphate in solid tumours. Original article of veterinaty & comparative Oncology. 2011 . Blackwell Publishing Ltd)
- Finding and treatment oral melanoma, squamous cell carcinoma and fibrosarcoma in dog.Veterinary medicine. Laura D. Garret, DVM,DACVIM , Virginia J. Coylle DVM (2009)
- Jobson, JM., Lascelles BD., Manual de oncología en pequeños animales . 3ª edición BSAVA (2014)
- Lascelles BD, Henderson RA, Seguin B, Bilateral rostral maxillectomyand nasal planectomy for large rostral maxillofacial neoplasms in six dogs and one cat . (2004) J Am Anim Hosp Assoc 40: 137
 by Multimédica
by Multimédica