Barrera cutánea y su relación con la dermatitis atópica
Resumen breve
La barrera cutánea constituye el límite entre el medio externo y el medio interno. Está formada por las diferentes capas de la epidermis, siendo al más importante el estrato córneo. De hecho, la función más importante de la epidermis y su sentido de ser es la formación de un estrato córneo saludable y funcional que evite el ingreso de sustancias externas al cuerpo. Debajo de este estrato córneo descansa el estrato granuloso que constituye el representante más externo del sistema inmune…Índice de contenidos
Conceptos generales
La barrera cutánea constituye el límite entre el medio externo y el medio interno. Está formada por las diferentes capas de la epidermis, siendo al más importante el estrato córneo. De hecho, la función más importante de la epidermis y su sentido de ser es la formación de un estrato córneo saludable y funcional que evite el ingreso de sustancias externas al cuerpo. Debajo de este estrato córneo descansa el estrato granuloso que constituye el representante más externo del sistema inmune innato y tiene capacidad de respuesta intrínseca ante potenciales invasores y sustancias extrañas. Entre las células de la última capa del estrato granuloso se hallan las digitaciones de las células de Langerhans que forman parte también del sistema inmune innato, actuando no solo como presentadoras de antígenos sino también como los actores más importantes en el diálogo entre el organismo y su microbiota superficial. Creciente evidencia muestra la fina y amigable relación entre estas células y la microbiota normal1.
La dermatitis atópica es una enfermedad alérgica inflamatoria y pruriginosa en la cual se evidencia no solo una respuesta inmune anómala frente a alérgenos ambientales sino también una falla en el funcionamiento de la barrera cutánea. Tanto la falla en la barrera como la respuesta inmune anómala constituyen los ejes sobre los que se desarrolla la dermatitis atópica2.
Sobre la última capa de células del estrato granuloso descansa el estrato córneo, y justo en el medio se forma un ambiente muy particular, con una compleja interacción de factores que intervienen en el proceso de cornificación. En este lugar se comienzan a formar las lamelas, se fortifican los desmosomas, se forma el recubrimiento córneo interno de los corneocitos, se liberan péptidos antimicrobianos y enzimas (proteasas e inhibidores de proteasas) que intervienen no solo en la maduración normal del estrato córneo sino también en su normal descamación3. Este trabajo estudiará la anatomía y fisiología de la epidermis y del proceso de cornificación, marcando las alteraciones que se observan en pacientes caninos y humanos afectados de dermatitis atópica. Sin embargo, para comprender estos aspectos debemos repasar primero las características conformaciones de uno de los lípidos más importantes de estrato córneo: las ceramidas.
Ceramidas
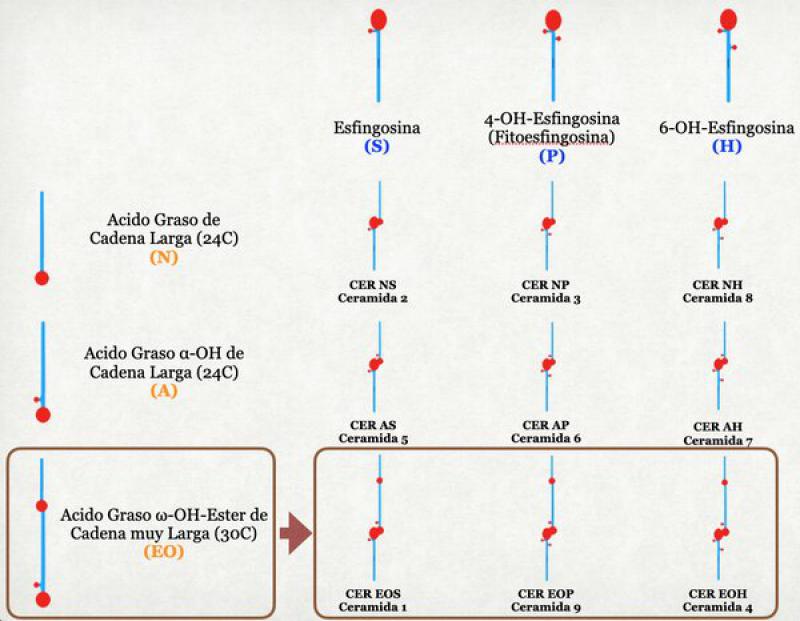
Se trata de moléculas de mediano tamaño que de forma muy conceptual están constituidas por 2 colas y una cabeza. La cabeza, hidrofílica (polar), se localiza normalmente inmersa entre otras moléculas hidrofílicas. Las 2 colas, hidrofóbicas, se mezclan entre otras sustancias hidrofóbicas (apolares), de forma análoga a los fosfolípidos de las membranas plasmáticas. Una de las 2 colas de la ceramida es aportada por un polialcohol derivado del esfingol, que puede ser la esfingosina, la fitoesfingosina o la esfinganina. La otra cola es aportada por un ácido graso de cadena muy larga (28, 30 o más átomos de carbono).
Esta segunda cola es mucho más larga que la primera. Una forma especial de ceramidas la constituyen las ωacilceramidas, en las cuales la cola más larga está esterificada a un ácido linoleico, extendiendo aún más su longitud. Esta cola extremadamente larga es necesaria para que pueda atravesar todo el espesor de la membrana plasmática y unirse a proteínas intracelulares en el proceso de cornificación4-6.
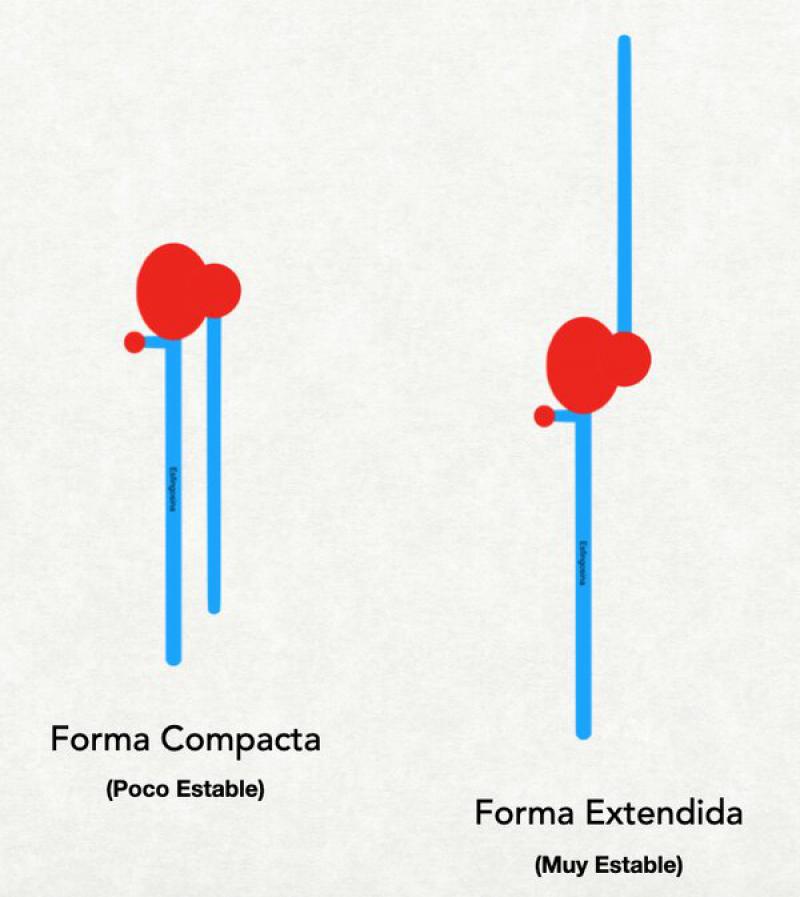
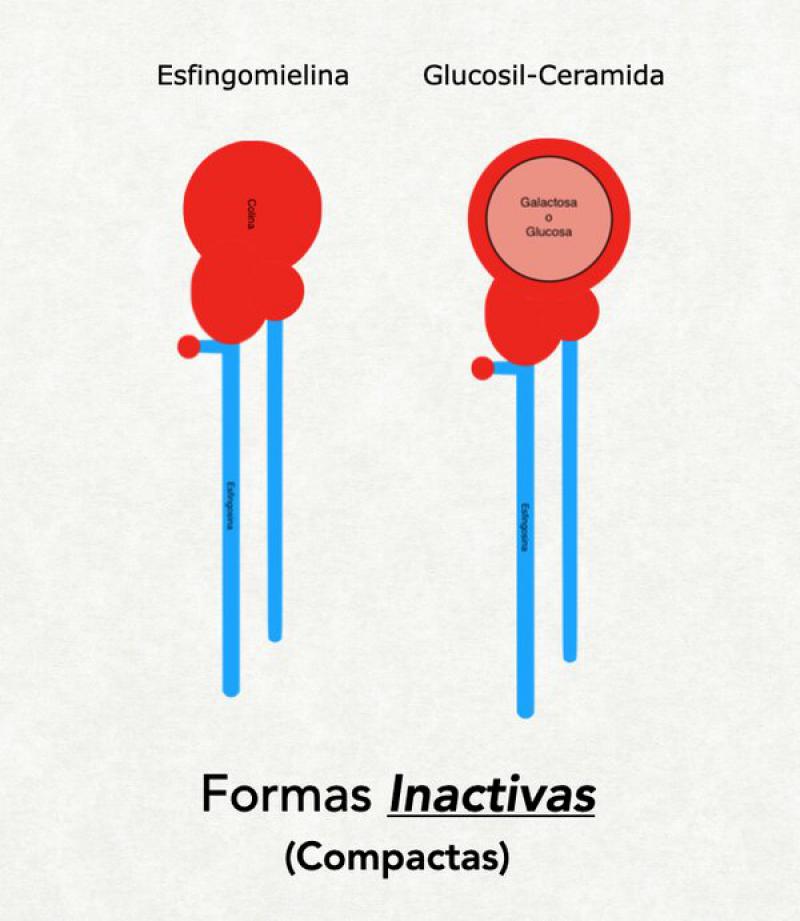
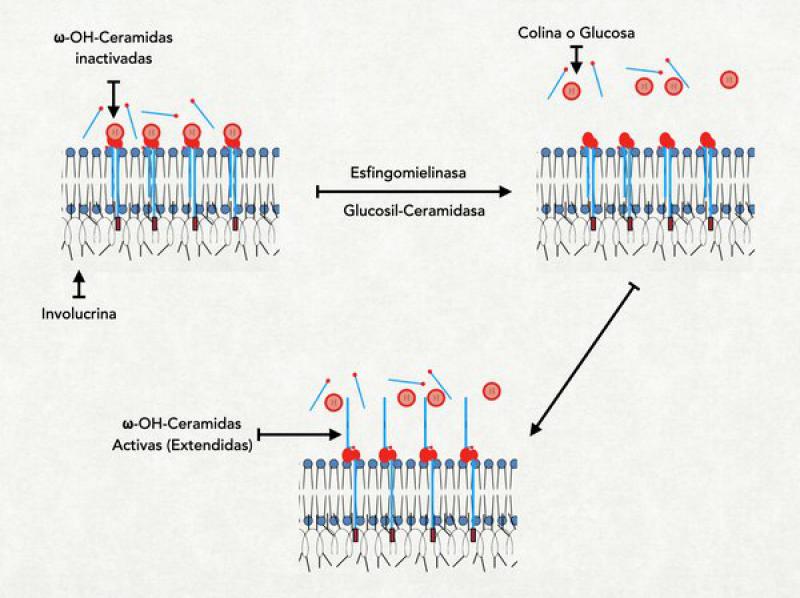
Todas las ceramidas tienen 2 conformaciones diferentes: extendida (con las 2 colas apuntando en direcciones opuestas) o compacta (con las 2 colas apuntando hacia el mismo lado). La forma extendida es la fisiológicamente activa y es la necesaria para formar una barrera funcional. La forma compacta es poco estable. Sin embargo, en la síntesis de ceramidas, el organismo produce dentro de los cuerpos lamelares ceramidas en conformación “compacta” llamadas "precursores de ceramidas”. Esta conformación se mantiene gracias al agregado de una molécula de glucosa, de galactosa o de colina. El agregado de estas moléculas a la “cabeza” de la ceramida obliga a las 2 colas a dirigirse hacia el mismo lado. Al ser activadas las ceramidas, esta molécula de glucosa, galactosa o colina es eliminada y las 2 colas de la ceramida se disponen entonces de forma extendida7.
Microanatomía del estrato córneo y granuloso
Corneocitos
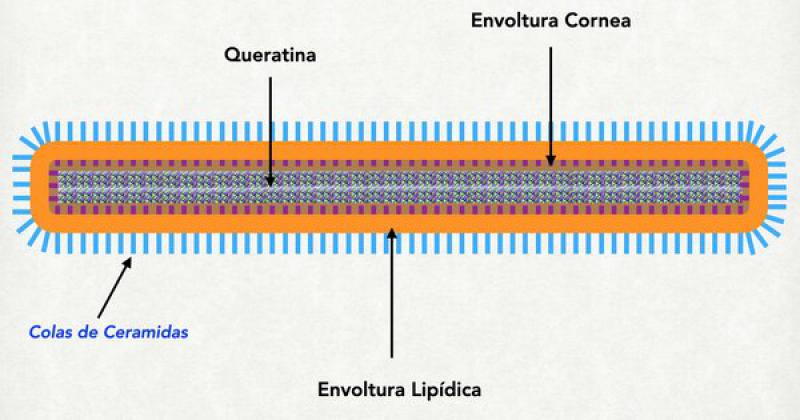
Los corneocitos son células achatadas y planas. Miden de 1 a 2 μm de ancho y unos 20 μm de diámetro. Al descamarse en la superficie de la piel se enrollan y aparecen en la citología como espículas o conos. Cada corneocito esta originalmente formado por 2 capas principales: el recubrimiento lípidido (localizado en el exacto lugar donde se hallaba la membrana plasmática del queratinocito que le dio origen) y el recubrimiento córneo interno, localizado por dentro del anterior y firmemente unido al mismo. Por dentro del recubrimiento córneo interno se halla el entramado de queratina. Estudiemos cada una de estas partes.
Recubrimiento lipídico
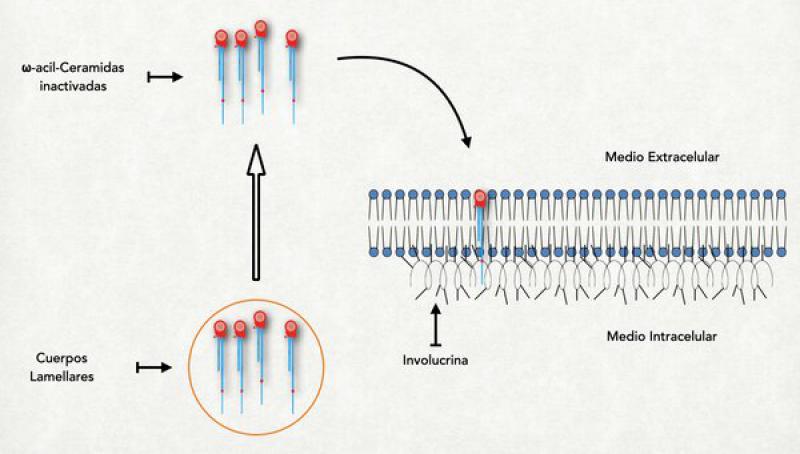
Esta formado por una forma especial de ceramidas de cadena muy larga denominada HidroxiAcilceramida. Esta ceramida se sintetiza como inactiva dentro del los cuerpos lamelares, en forma de ωacilceramida (esterificada con un ácido graso normalmente ácido linoléico) y bloqueada por glucosa o colina. Se localiza donde estaba la membrana plasmática del queratinocito granuloso que le dio origen. La cola más larga se dirige hacia adentro y se una firmemente a las proteínas del recubrimiento córneo interno (concretamente a restos glutamina de la involucrina) y la cola más pequeña (la que corresponde al derivado del esfingol) se dirige hacia afuera del corneocito entremezclándose con las lamelas8,9.
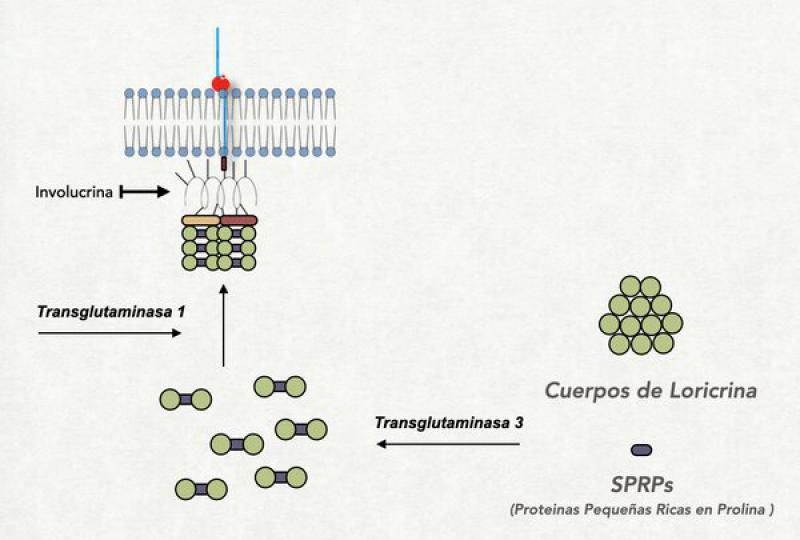
Recubrimiento córneo interno
Se trata de una espacie de “reboque” de proteínas que se localizan en la parte de adentro de la membrana plasmática (que luego desaparece) y se une por un lado a la cola más larga de la ceramida del recurbimiento lipídico, y hacia adentro se une firmemente a la queratina. Este recubrimiento proteico esta formado por una serie de importantes proteínas entre las que se hallan la involucrina (que hace de nexo entre el recubrimiento lipídico y el resto de las proteínas del recubrimiento córneo), la emboplaquina y periplaquina (que están también unidas a la involucrina y a la queratina) y la loricrina (que es la proteína más abundante en esta parte del corneocito) entre otros9,10,18.
Queratina
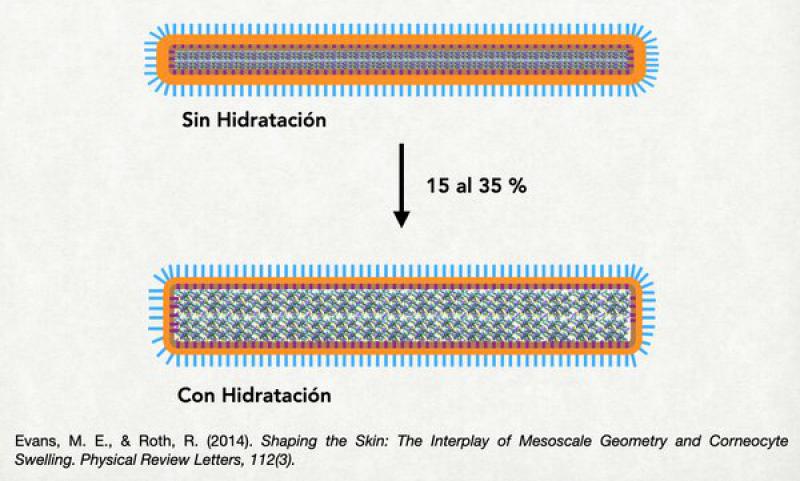
Es quizás la proteína más importante de la epidermis, más adelante en este trabajo hablaremos en detalle de ella. Sin embargo, en este punto es bueno mencionar que se halla unida firmemente al recubrimiento córneo interno y completa todo el espacio interno de los corneocitos. Mezclada con la queratina se halla la filagrina (una de cuyas funciones es aglomerar o unir filamentos de queratina) o sus productos de degradación: aminoácidos libres y ácido urocánico (que cumplen importantes funciones a la hora del control de la hidratación de ese corneocito y del control del pH de la superficie cutánea). Si bien la queratina es una proteína organizada en filamentos, el entrelazamiento de esos filamentos da origen a estructuras funcionales cúbicas, lo cual permite que se expanda o se contraiga. Esta expansión o contracción de la queratina puede incrementar el volumen de los corneocitos en un 25-35 %. Esta dada por el ingreso de agua dentro del corneocito atraída por las fuerzas osmóticas originadas en los productos de degradación de la filagrina11,12.
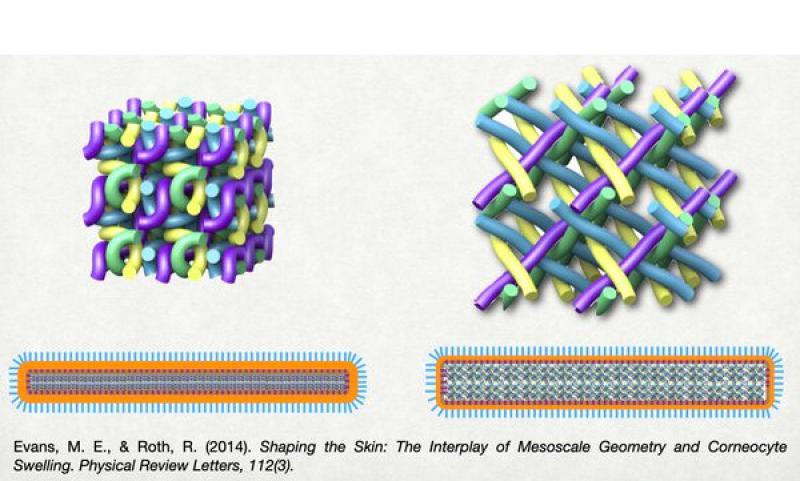
Organización de los corneocitos
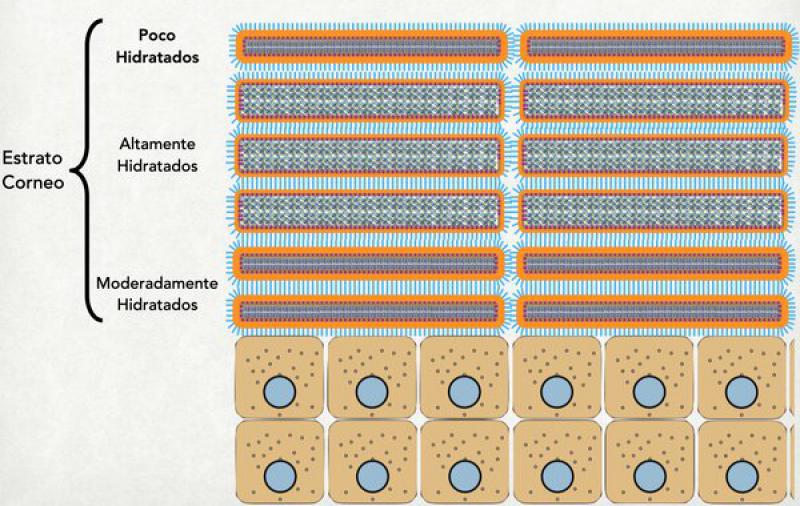
Si se observa el estrato córneo como un todo, se distinguen 2 partes diferentes: el estrato córneo compacto (apoyado sobre el estrato granuloso) y el estrato córneo laxo, más superficial y en donde se están despegando los corneocitos unos de otros para luego ser descamados al medio ambiente. Dentro del estrato córneo compacto, vamos a distinguir 3 partes diferentes: la porción más interna, conformada por corneocitos moderadamente hidratados; la intermedia, conformada por corneocitos altamente hidratados; y la más externa, constituida por corneocitos que se están deshidratando y que en breve se van a descamar. De estas 3 porciones la más importante es la intermedia ya que al haber una máxima hidratación de los corneocitos éstos son capaces de “sellar” todos los espacios entre ellos mismos y hacer que la barrera sea más efectiva12-15.
Nota para dermatitis atópica
Los pacientes humanos y caninos afectados de dermatitis atópica presentan menor cantidad de filagrina en su piel. Esto genera en el estrato córneo que no exista una adecuada cantidad de aminoácidos libres y productos de degradación de la filigrina dentro del corneocito. Por tanto, la atracción osmótica de agua es menor y la hidratación de estos corneocitos es menor. Los corneocitos menos hidratados no pueden sellar bien todos los espacios entre ellos y generan una barrera más permeable a sustancias externas. Al mismo tiempo, al haber menor cantidad de aminoácidos libres y ácido urocánico (ambos provenientes de la filagrina) el pH de la superficie del estrato córneo se comienza a tornar más alcalino respecto a individuos que no tienen dermatitis atópica. Este desbalance de pH superficial genera también alteraciones en la microbiota superficial que pueden repercutir en empeoramiento en el cuadro de dermatitis atópica16,17.
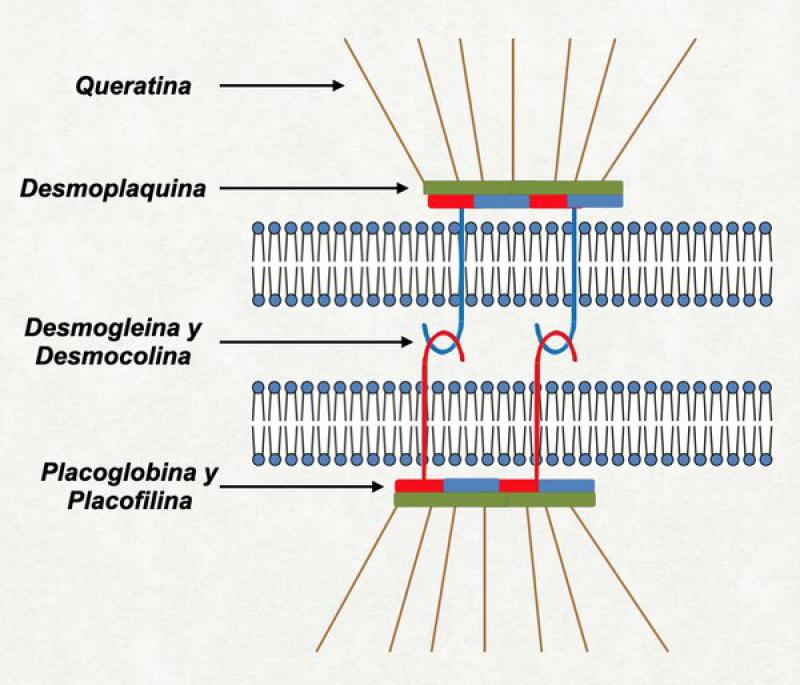
Uniones entre los corneocitos
Los corneocitos se hallan unidos entre si por los llamados “corneodesmosomas”. Éstos derivan de los desmosomas existentes en los queratinocitos granulosos. Sin embargo, son fortificados por una proteína llamada “corneodesmosina”. Esta corneodemosina se localiza dentro de los cuerpos lamelares y es secretada al medio extracelular en la interfase entre el estrato granuloso y córneo. La función principal de la corneodesmosina es dificultar la hidrólisis prematura del desmosoma por las proteasas del estrato córneo (Kalicreina 5 y Kalicreina 7). Los corneodesmosomas se hallan más concentrados en los laterales del corneocito (ya que en los bordes están compactadas las paredes laterales del queratinocito que le dió origen) y se hallan más dispersos en las caras superiores e inferiores del corneocito. Estos corneodesmosomas de la parte superior e inferior (que lo unen con el corneocito de arriba y de abajo) son los primeros en ser atacados por las proteasas responsables de la descamación (las Kalikreinas) y cuando se degradan dan al estrato córneo ese aspecto típico de “red de basquet” (basket weave shape)19.
Las lamelas lipídicas
La estructura lamelar de los lípidos del estrato córneo constituye uno de los pilares fundamentales para asegurar su impermeabilidad. Las lamelas se forman mediante la interacción de 3 lípidos diferentes: ceramidas de cadena larga, ácidos grasos libres (principalmente ácido linoleico) y colesterol.
De forma espontánea estos lípidos se organizan formando “capas” idénticas, atrayéndose las áreas hidrofóbicas de cada molécula con las hidrofóbicas y las hidrofílicas con las hidrofílicas. Para que la organización sea perfecta se requieren cantidades equimoleculares de colesterol, ceramidas y ácidos grasos.
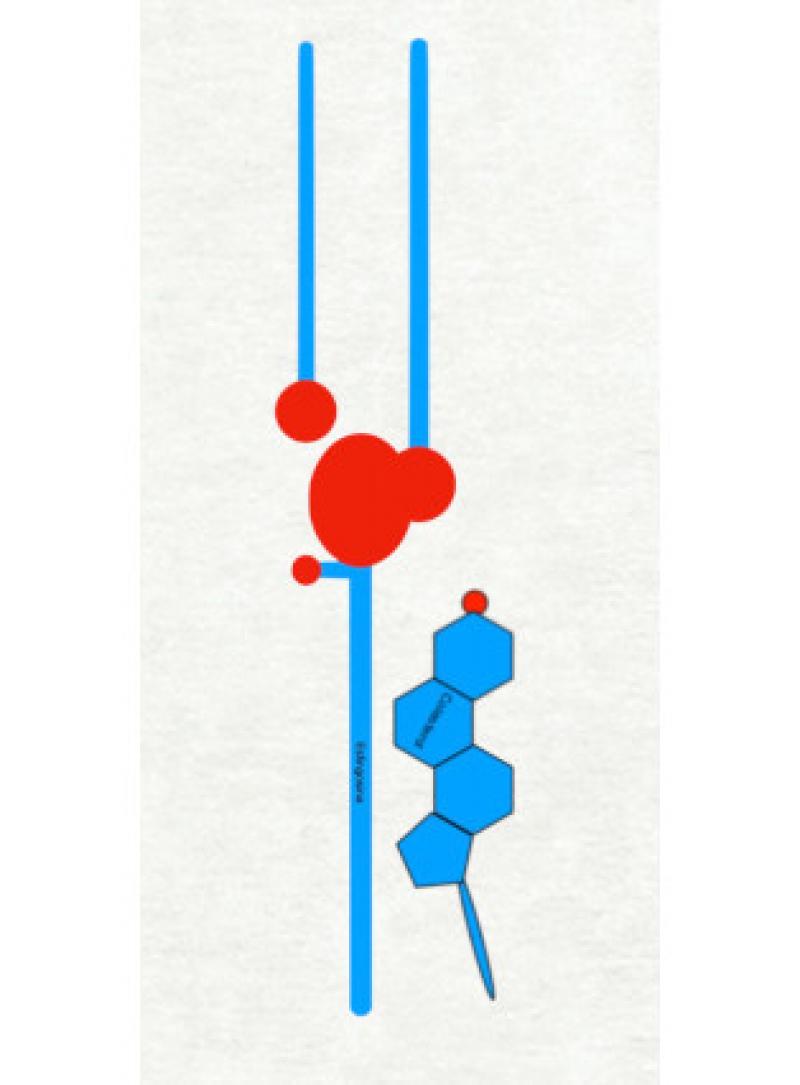

Entre un corneocito y otro pueden existir 5 a 10 lamelas. La primera y la última capa de las lamelas que separan dos corneocitos se entrelazan con las colas externas de las ceramidas que conforman el recubrimiento lipídico del corneocito. Todas las moléculas hidrofílicas van a estar acumuladas en las áreas hidrofílicas de las lamelas7. En el interior de estas lamelas se forman “ríos” de agua, que son canales por donde puede circular agua. Esta circulación de agua tiende a ser limitada y escasa, ya que a este nivel la mayor parte del agua es atraída hacia adentro de los corneocitos.
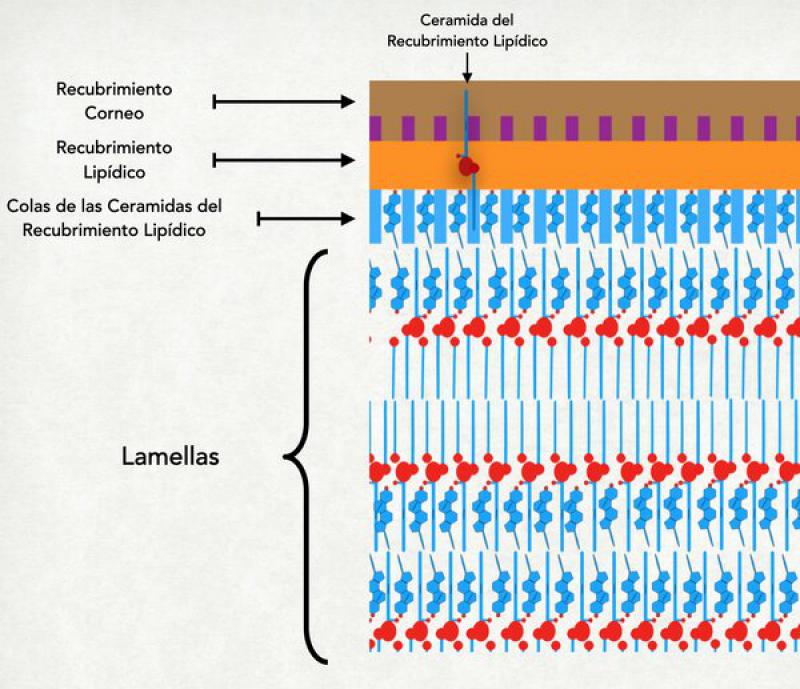
Los constituyentes de las lamelas se sintetizan dentro de los cuerpos lamelares (que se originan en el aparato de Golgi) y son transportados por la red trans Golgi hasta las cercanías de la membrana apical de la célula granulosa. En el proceso de achatamiento de la célula granulosa (denominado colapso controlado del citoesqueleto) para transformarse en un corneocito, estos cuerpos lamelares son compactados contra la membrana celular y obligados a unirse a la misma, liberando así su contenido al medio extracelular (a la interfase entre estrato granuloso y córneo)20. Dentro de los cuerpos lamelares las moléculas que luego van a formar las lamelas se hallan en forma de precursores: glucosil ceramidas o esfingomielina (para activarse y extender sus colas deben perder la glucosa o la colina que las mantiene en forma compacta) y sulfato de colesterol (que debe perder su grupo sulfato para formar parte de las lamelas). Así inactivos son expulsados al medio extraceluar y son activados fuera de la célula por enzimas que también se hallan en los cuerpos lamelares (pero en diferentes localizaciones para evitar una prematura activación)21.
En la medida que el estrato córneo va madurando y acercándose a las porciones más externas, las lamelas comienzan a ser degradadas. La ceramida, por acción de ceramidasas originadas mayormente en la microbiota, se divide en sus dos constituyentes principales: esfingosina y un ácido graso libre. La esfingosina tiene un efecto antimicrobiano, mientras que el ácido graso libre, junto con los demás ácidos grasos libres de las lamelas, contribuye al control del pH de la superficie cutánea22,23.


Nota para dermatitis atópica
Los pacientes humanos y caninos afectados de dermatitis atópica tienen menor cantidad de lamelas lipídicas en el estrato córneo. En parte esto se debe a una anormal liberación de los cuerpos lamelares. Sin embargo, se ha demostrado en humanos una alteración en la síntesis de ceramidas en los cuerpos lamelares y una disminución en la actividad de las enzimas activadoras de las ceramidas (la glucosilceramidasa y la esfingomielinasa). Esto trae como consecuencia que muchas moléculas de ceramida no se activen correctamente y queden como glucosilceramidas o esfingomielina, con sus patas dirigidas hacia el mismo lado e imposibilitadas de formar lamelas. Por esto la cantidad de esfingomielina y glucosil ceramida es mayor en el estrato córneo de humanos con dermatitis atópica y la cantidad de ceramida es menor. Todo esto repercute de manera directa en la función de barrera del estrato córneo ya que la ausencia de una adecuada cantidad de lamelas hace un estrato córneo más permeable. Al mismo tiempo la menor cantidad de ceramidas trae como consecuencia una menor cantidad de esfingosina en la superficie del estrato córneo con la consecuente pérdida de la actividad antibacteriana superficial, lo cual promueve más desequilibrios en la microbiota. También la menor cantidad de ceramidas lleva a una menor cantidad de ácidos grasos libres provenientes de su degradación, con el consecuente incremento del pH superficial de la piel de estos pacientes. Existe también una enzima denominada esfingomielina-glucosilceramida-deacilasa (EM-GC-deacilasa) que se halla en elevada concentración en humanos con dermatitis atópica, y tiene la capacidad de degradar a los precursores de ceramidas (esfingomielina o glucosilceramida) en moléculas inservibles (quitándoles el ácido graso). No está claro el origen de esta enzima pero su actividad complica aún más el perfil lipídico de individuos afectados de dermatitis atópica24,25,26,30.
El proceso de cornificación
La cornificación es un proceso análogo al de la muerte celular programada. De hecho, se trata de una muerte celular muy especial. En ella intervienen enzimas y señales celulares muy organizadas que llevan a la degradación del núcleo, la reorganización de la queratina, la formación del recubrimiento córneo, colapso del citoesqueleto, degradación de organelas y membrana celular, etc.
En realidad el proceso de cornificación inicia a nivel de las células basales. En el estrato basal se manifiestan dos caminos evolutivos diferentes: proliferación y diferenciación. En la proliferación la célula basal queda adherida a la membrana basal y mantiene las características de una célula basal. En la diferenciación la célula basal se separa de la membrana basal y comienza a transitar un camino que la llevará a transformarse en un corneocito. Este camino de diferenciación se inicia a través de múltiples señales, entre las que destacan el incremento paulatino de los niveles citoplasmáticos de calcio. Esto desencadena múltiples señales que llevan al inicio de la síntesis de todas las proteínas que van a jugar un rol en la transformación.
Una de las primeras proteínas sintetizadas es la involucrina, que una vez formada es trasladada a las inmediaciones de le membrana celular. También comienza un cambio en el tipo de queratina y en el tipo de caderinas de los desmosomas. La profilagrina se comienza a producir en el estrato granuloso. Los eventos más drásticos y significativos en el proceso de cornificación ocurren en la última capa del estrato granuloso y si bien son múltiples, complejos, ocurren de forma simultánea, para poder explicarlos más claramente debemos considerarlos individualmente.
Formación del recubrimiento córneo interno
Vamos a dividir este proceso de manera esquemática en varios pasos.
- Unión de la ωacilceramidas: A nivel del estrato granuloso la involucrina, que es la primera proteína del recubrimiento córneo, ya se halla en las proximidades de la membrana plasmática. Es una proteína pequeña con estructura de alfa-hélice y muchos restos de ácido glutámico saliéndole por todos lados. En este momento también ya se ha comenzado a liberar el contenido de los primeros cuerpos lamelares al medio extracelular y la primera de las ceramidas, la ωacilceramidas ya se halla en las cercanías de la membrana celular pero del lado externo. Recordemos que este tipo de ceramida tiene una cola muy larga, extendida aún más por el agregado de un ácido linoleico. Esta pata extremadamente larga se solubiliza dentro de la membrana plasmática atravesándola completamente y llegando a tocar a la involucrina que se halla del lado interno. En este momento se activa una importante enzima denominada transglutaminasa-1 (TG-1) localizada en el interior de la membrana plasmática. Se asume que el mismo incremento del calcio intracitoplasmático es el responsable de su activación. La TG-1 cataliza la unión entre los restos de ácido glutámico de la involucrina con la cola más larga de la ceramida. En este proceso, el ácido linoleico que estaba elongando la ceramida se pierde y queda unida fuertemente a la involucrina. Una vez que se produjo esta unión, la ceramida es atacada por la glucosilceramidasa o por la esfingomielinasa, que hidroliza la glucosa o la colina que estaban unidas a la ceramida. Al perderse esta molécula la ceramida puede extender su cola más pequeña y orientarla hacia la parte externa de la célula, dejándola lista para interaccionar con las lamelas6,27,28.
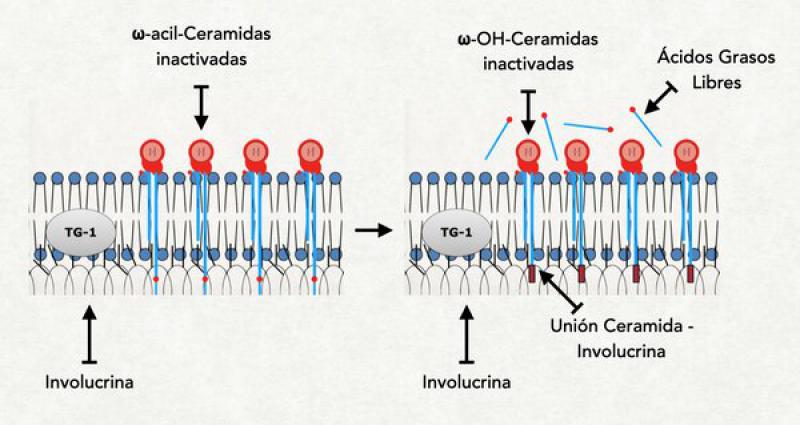
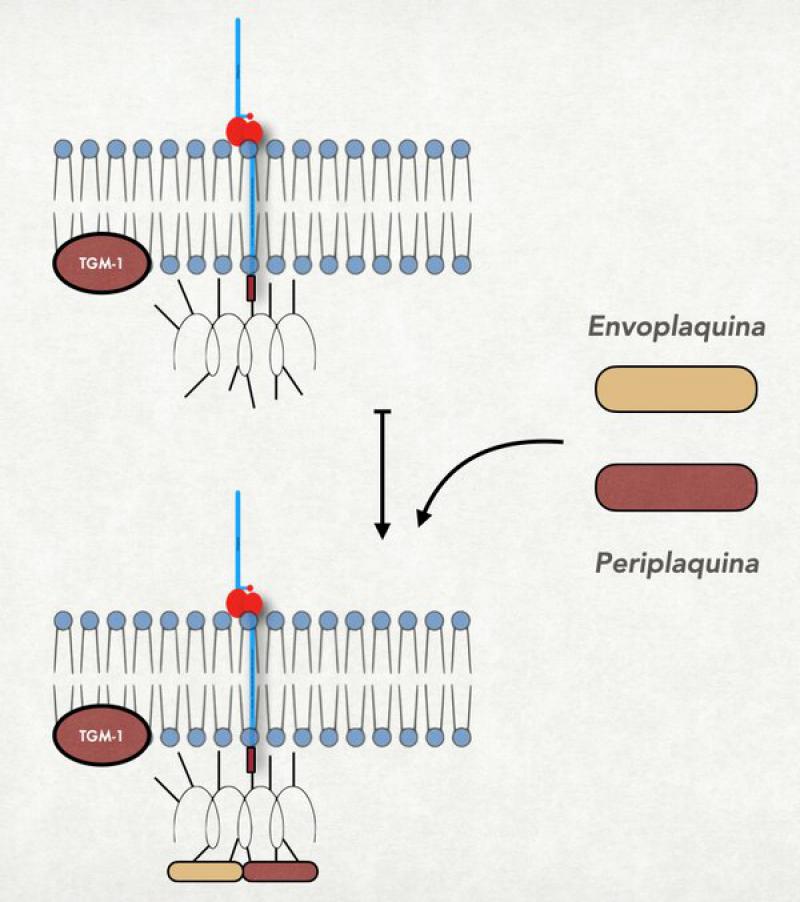
- Unión de la periplaquina y la envopaquina a la involucrina: La periplaquina y envoplaquina son proteínas de la familia de las plaquinas que cumplen la función no solo de formar parte del recubrimiento córneo sino también de ligar a la queratina con el mismo, y se hallan unidas a la queratina. Por acción de la misma TG-1, las dos plaquinas (que tienen también restos de ácido glutámico) se unen a la involucrina (los restos de ácido glutámico de ambas proteínas actúan de puentes entre las mismas). De esta forma, los filamentos de queratina adheridos a las plaquinas son traccionados hacia la membrana plasmática9.
Nota para dermatitis atópica
El TNF-α es capaz de disminuir la producción de loricrina en pacientes humanos con dermatitis atópica32. También IL-4, IL-13 (ambas citoquinas TH2), IL-22, IL-17A son capaces de inhibir la expresión de loricrina e involucrina en humanos, trayendo aparejado mayor daño en la barrera cutánea29,31.
Colapso controlado del citoesqueleto
Este es el momento en el que la célula granulosa se achata y se transforma en una célula plana. El citoesqueleto de la célula está formado fundamentalmente por la queratina, principal proteína del estrato córneo. Para comprender este proceso repasaremos la estructura básica de la queratina, su relación con los desmosomas y el papel de una importante proteína: la filigrina.
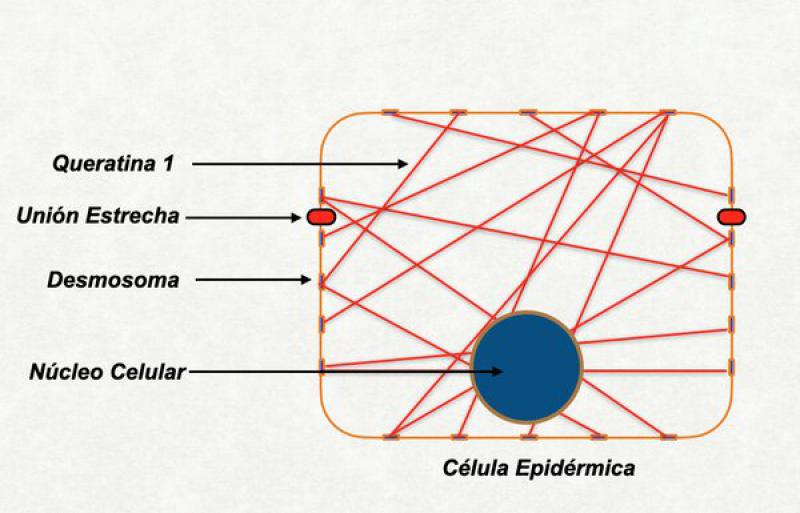
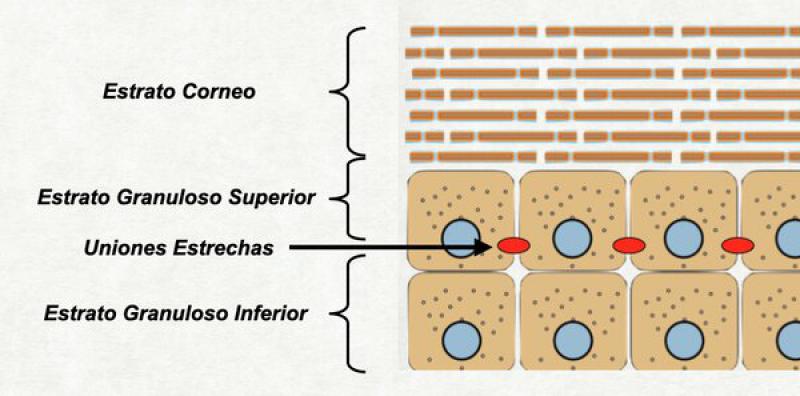
Nota para dermatitis atópica
Algunos individuos humanos y caninos con dermatitis atópica tienen alterada la función de las proteínas de las uniones estrechas. Esto genera que la barrera líquido-líquido no funcione correctamente bien y los líquidos del medio externo y del medio interno se hallen parcialmente mezclados. Si a esto le sumamos un anormal estrato córneo, parte importante de este líquido se pierde por evaporación al medio ambiente y la piel en toda su extensión tiende a estar sumamente deshidratada24,35,36.
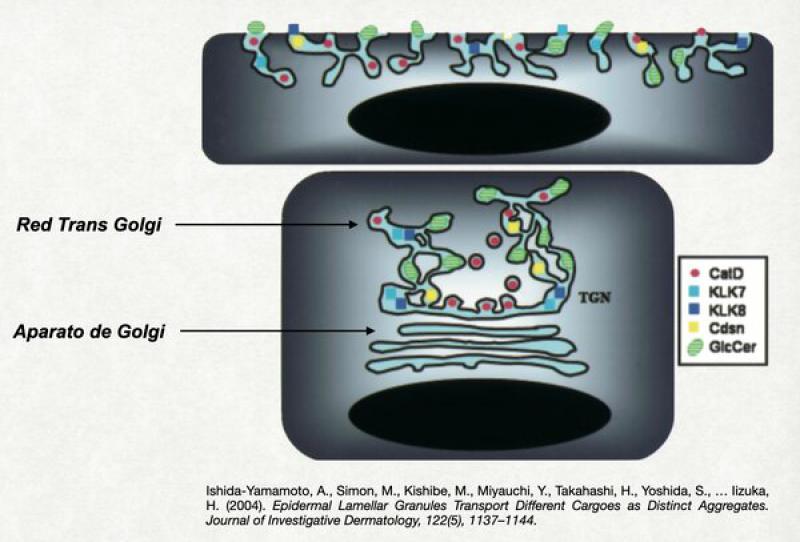
Liberacion de cuerpos lamelares
Son estructuras membranosas originadas en el aparato de Golgi. En su interior se hallan los componentes necesarios para la correcta formación de estructuras lamelares entre los corneocitos: glucosilceramidas y esfingomielina (ambos precursores de ceramidas), ácidos grasos libres, sulfato de colesterol, enzimas activadoras de lípidos (glucosil-ceramidasa, esfingomielinasa, colesterol sulfatasa, fosfolipasas). También dentro de los cuerpos lamelares se hallan las proteasas responsables de la degradación de los desmosomas durante la normal descamación (Kalikreina 5 y Kalikreina 7) junto con un inhibidor de proteasas, el LEKTI (Lympho-epithelial Kazal-type-related inhibitor). En los cuerpos lamelares también se halla la corneodesmosina y múltiples pépticos antimicrobianos. Todo este contenido va a ser volcado a la interfase entre el estrato granuloso y el estrato córneo.
Recordemos que el aparato de Golgi se relaciona fluidamente con el retículo endoplásmico, lo cual permite que los cuerpos lamelares contengan tal variedad de moléculas. No está claro el mecanismo exacto por el cual el contenido de los cuerpos lamelares es liberado, aunque se presume que durante el colapso celular el aparato de Golgi y toda la red trans-Golgi es forzada hacia la membrana apical del queratinocito y esto obliga a la fusión de la membrana celular con la de la red trans-Golgi y los cuerpos lamelares, con la consecuente liberación de su contenido en el espacio extracelular apical. También se presume que en la red trans-Golgi existen mecanismos de transporte distintos para las diferentes sustancias que van a ser expulsadas. Es decir, no viajan juntas las enzimas activadoras de las proteasas y las proteasas, ni las enzimas activadoras de lípidos con los lípidos. Estos son expulsados de forma independiente e interaccionan en el medio extracelular (exactamente en el espacio entre el estrato granuloso y córneo)20,21.
Nota para dermatitis atópica
Los pacientes humanos y caninos con dermatitis atópica tienen afectada la cantidad de filagrina en su piel. Por un lado la mutación en el gen de filagrina (que en humanos genera una enfermedad denominada ictiosis vulgar) se considera un factor predisponente para la presentación de dermatitis atópica y genera cuadros clínicos más agresivos. En caninos se ha demostrado esta mutación aunque en muy pocos individuos y no se sabe aún su real implicancia clínica. Sin embargo, la cantidad de filagrina se ve afectada por los procesos inflamatorios. Tanto en humanos como en caninos con dermatitis atópica la inflamación disminuye la cantidad efectiva de filagrina en la piel, por una menor producción o por una mayor velocidad de degradación. Sea una u otra, le disminución en la actividad de filagrina es un hecho y repercute enormemente en la funcionalidad de la barrera.
Por un lado, el colapso del citoesqueleto con el consecuente achatamiento de la célula no se realiza correctamente y los corneocitos quedan deformes. Esto también afecta la liberación de los cuerpos lamelares que, al no ser completamente compactados por el achatamiento celular, muchos permanecen dentro de la célula. Por tanto, en el medio extracelular habrá menor cantidad de lípidos (ceramidas, ácidos grasos, colesterol) y menor formación de lamelas. También se liberan menor cantidad de péptidos antimicrobianos, lo cual se suma a su vez a una menor producción (característica de los pacientes con dermatitis atópica) y repercute negativamente en el control de la microbiota de estos pacientes. Por otro lado, recordemos que la filagrina en los corneocitos es luego degradada en pequeños aminoácidos que son los responsables de la hidratación del corneocito, lo cual por supuesto se ve también afectado40-42.
Degradación de la membrana celular
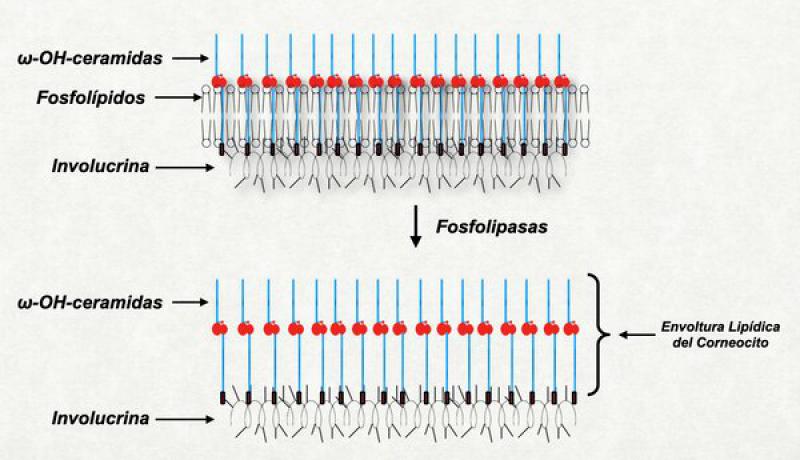
Este proceso consiste en la hidrólisis de los fosfolípidos de la membrana plasmática. Esta acción es llevada a cabo por fosfolipasas provenientes de los cuerpos lamelares. Los productos resultantes de tal hidrólisis son entre otras moléculas, ácidos grasos. Éstos se incorporan a las lamelas y al llegar a la superficie del estrato córneo, colaboran en determinar el pH superficial. La hidrólisis de la membrana celular deja a las ωohceramidas como el único límite exterior del corneocito.
Descamación del estrado córneo y rol del gradiente de pH
En condiciones naturales las últimas capas del estrato córneo se descaman en el medio ambiente. Para que esto ocurra deben degradarse los corneodesmosomas que las mantenían unidas. Las enzimas responsables de esta degradación se denominan kalikreinas. Estas proteasas liberadas desde los cuerpos lamelares mantienen actividad tanto en pH más alcalino (de la interfase estrato granuloso-estrato córneo) como a pH más ácido (como el existente en la superficie del estrato córneo). Sin embargo, la degradación de los corneodesmosomas debe realizarse en la superficie del estrato córneo y no en la profundidad. Para evitar que estas proteasas ataquen a los corneodesmosomas de la profundidad del estrato córneo la piel cuenta con dos mecanismos: el primero consiste en la protección de los desmosomas con corneodesmosina (proveniente de los cuerpos lamelares) y el segundo es la presencia de un inhibidor de kalikreinas denominado LEKTI ( Lympho-epithelial Kazal-type-related inhibitor).
El LEKTI tiene actividad a pH más alcalino pero pierde actividad en el pH más ácido de la superficie del estrato córneo. Por tanto, se configura así un sistema de gradiente de pH como maquinaria activadora de las kalikreinas, que funciona de la siguiente manera: en la profundidad del estrato córneo, con un pH más alcalino que en la superficie, las kalikreinas se hallan inhibidas por el LEKTI. En la medida que el estrato córneo va avanzando hacia la superficie de la piel, el pH va disminuyendo producto de la liberación de elementos de degradación de la filagrina (aminoácidos libres, ácido urocánico) y producto de la degradación de las ceramidas de las lamelas (por ceramidasas naturales de la microbiota). A un pH más ácido el LEKTI pierde actividad, lo cual conlleva a que las kalikreinas dejen de estar inhibidas y comiencen a atacar a los corneodesmosomas, primero a los de las partes superiores e inferiores del corneocito (que ahora van a quedar unidos solo por los bordes y darán al estrato córneo superficial ese aspecto característico de Red de básquet) y luego a los desmosomas localizados en los bordes laterales (que están más concentrados y parcialmente protegidos unos contra otros). Finalmente, los corneocitos se desprenden, se enrollan y caen al ambiente13,43,44.
Nota para dermatitis atópica
Los individuos afectados de dermatitis atópica, tanto humanos como caninos, presentan un pH en la superficie del estrato córneo más alcalino respecto de individuos normales. Si bien en perros normales ya es más alcalino que en humanos normales (el perro es uno de los mamíferos que presenta uno de los pH más alcalinos en su superficie cutánea), se torna aún más alcalino cuando hay presencia de dermatitis atópica. Esto se debe a la menor cantidad de ceramidas (por tanto menor cantidad de ácidos grasos superficiales) y a la menor cantidad de productos de degradación de la filagrina (aminoácidos libres y ácido urocánico). Esto genera un desbalance en el fino equilibro de activación de kalikreinas, alterando la normal descamación del estrato córneo. Al menos en humanos esto lleva a un incremento en la actividad LEKTI, una anormal descamación y la consecuente hiperqueratosis vista en estos pacientes. También se ha demostrado en humanos una anormal producción de kalikreina 7 que intensifica aún más este efecto43,44.
Consecuencias de las alteraciones de la barrera cutánea
Una barrera cutánea poco funcional trae como consecuencia el contacto masivo de elementos ambientales (antígenos, bacterias, hongos, proteasas, etc.) con la superficie del estrato granuloso. A este nivel en condiciones normales llega una mínima cantidad de sustancias. Sin embargo, el contacto masivo de elementos medioambientales tanto con las células granulosas como con las extensiones de las células de Langerhans (o de las células dendríticas) lleva a su activación con la secreción de múltiples sustancias mayormente proinflamatorias. Las células granulosas al activarse mediante sus receptores PAR2 o TLR comienzan a secretar sustancias como IL-1, IL-6, TNF-α, TARC (CCL17), GM-CSF y las llamadas citoquinas de daño epidérmico: IL-25, IL-33 y TSLP. Estas adquieren un rol clave en la activación de las células linfoideas innatas tipo 2 (ILC-2) en la dermis las cuales comienzan a producir grandes cantidades de interleucinas TH2 (IL-4, IL-5, IL-13).
La activación y migración de las células de Langerhans primero y las células dendríticas luego, a los ganglios linfáticos conlleva a formación y recirculación de linfocitos TH2 hacia la piel afectada y luego a la producción de más mediadores inflamatorios. Al perpetuarse en el tiempo, la inflamación se incrementa, la barrera cutánea se daña aún más (a más inflamación menos producción de filagrina) y el cuadro cutáneo comandado por linfocitos Th2 va complicándose por la generación temprana de linfocitos TH-22 (y producción de IL-22 que tiene un marcado efecto en el engrosamiento epidérmico) y más tarde con la llegada de linfocitos TH-1 (con la producción de mediadores de la inflamación crónica) y una inhibición de los perfiles TH-17. Simultáneamente los mastocitos cargados en sus membranas con altas cantidades de IgE comienzan a desgranularse y liberar diversas sustancias que complican aún más el cuadro. El prurito se origina como consecuencia de la interacción de sustancias pruritogénicas variadas (IL-31, TSLP, periostina) en las terminales nerviosas. No es tema de este trabajo analizar los complejos mecanismos intervinientes en la inflamación de la dermatitis atópica, pero mucho de la misma se produce a raíz de una barrera cutánea poco funcional17,46,47.
Bibliografía
- Byrd, A., Belkaid, Y. & Segre, J. The human skin microbiome. Nat Rev Microbiol 16, 143–155 (2018)
- Marsella, R. Advances in our understanding of canine atopic dermatitis. Vet Dermatol.(2021),
- Peter M. Elias,Stratum Corneum Defensive Functions: An Integrated View,Journal of Investigative Dermatology,Volume 125, Issue 2,2005,Pages 183-200,
- Walter M. Holleran, Yutaka Takagi, Yoshikazu Uchida,Epidermal sphingolipids: Metabolism, function, and roles in skin disorders,FEBS Letters,Volume 580, Issue 23,2006,Pages 5456-5466,
- Nilika Bhattacharya, William J. Sato, Avalon Kelly, Gitali Ganguli-Indra, Arup K. Indra,Epidermal Lipids: Key Mediators of Atopic Dermatitis Pathogenesis,Trends in Molecular Medicine,Volume 25, Issue 6,2019,Pages 551-562,
- Yoshikazu Uchida, Walter M. Holleran,Omega-O-acylceramide, a lipid essential for mammalian survival,Journal of Dermatological Science,Volume 51, Issue 2,2008,Pages 77-87,
- Ichiro Iwai, HongMei Han, Lianne den Hollander, Stina Svensson, Lars-Göran Öfverstedt, Jamshed Anwar, Jonathan Brewer, Maria Bloksgaard, Aurelie Laloeuf, Daniel Nosek, Sergej Masich, Luis A. Bagatolli, Ulf Skoglund, Lars Norlén,The Human Skin Barrier Is Organized as Stacked Bilayers of Fully Extended Ceramides with Cholesterol Molecules Associated with the CeramideSphingoid Moiety,Journal of Investigative Dermatology,Volume 132, Issue 9,2012,Pages 2215-2225,
- ELIAS, Peter M., et al. Formation and functions of the corneocyte lipid envelope (CLE). Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2014, vol. 1841, no 3, p. 314-318.
- KALININ, Andrey; MAREKOV, Lyuben N.; STEINERT, Peter M. Assembly of the epidermal cornified cell envelope. Journal of cell science, 2001, vol. 114, no 17, p. 3069-3070.
- MATSUI, Takeshi; AMAGAI, Masayuki. Dissecting the formation, structure and barrier function of the stratum corneum. International immunology, 2015, vol. 27, no 6, p. 269-280.
- EVANS, Myfanwy E.; ROTH, Roland. Shaping the skin: the interplay of mesoscale geometry and corneocyte swelling. Physical review letters, 2014, vol. 112, no 3, p. 038102.
- NORLEN, L. Stratum corneum keratin structure, function and formation–a comprehensive review. International journal of cosmetic science, 2006, vol. 28, no 6, p. 397-425.
- RAWLINGS, A. V. Molecular basis for stratum corneum maturation and moisturization. British Journal of Dermatology, 2014, vol. 171, p. 19-28.
- CHOE, ChunSik, et al. Keratin-water-NMF interaction as a three layer model in the human stratum corneum using in vivo confocal Raman microscopy. Scientific reports, 2017, vol. 7, no 1, p. 1-13.
- RICHTER, T., et al. Dead but highly dynamic–the stratum corneum is divided into three hydration zones. Skin pharmacology and physiology, 2004, vol. 17, no 5, p. 246-257.
- Egawa G, Kabashima K. Barrier dysfunction in the skin allergy. Allergol Int. 2018 Jan;67(1):3-11.
- Elias PM, Schmuth M. Abnormal skin barrier in the etiopathogenesis of atopic dermatitis. Curr Opin Allergy Clin Immunol. 2009 Oct;9(5):437-46.
- CANDI, Eleonora; SCHMIDT, Rainer; MELINO, Gerry. The cornified envelope: a model of cell death in the skin. Nature reviews Molecular cell biology, 2005, vol. 6, no 4, p. 328-340.
- ISHIDA-YAMAMOTO, Akemi; IGAWA, Satomi. The biology and regulation of corneodesmosomes. Cell and tissue research, 2015, vol. 360, no 3, p. 477-482.
- ISHIDA-YAMAMOTO, Akemi, et al. Epidermal lamellar granules transport different cargoes as distinct aggregates. Journal of investigative dermatology, 2004, vol. 122, no 5, p. 1137-1144.
- ELIAS, Peter M.; WAKEFIELD, Joan S. Mechanisms of abnormal lamellar body secretion and the dysfunctional skin barrier in patients with atopic dermatitis. Journal of allergy and clinical immunology, 2014, vol. 134, no 4, p. 781-791. e1.
- RIPPKE, Frank, et al. Stratum corneum pH in atopic dermatitis. American journal of clinical dermatology, 2004, vol. 5, no 4, p. 217-223.
- COBIELLA, Danielle, et al. Pilot study using five methods to evaluate skin barrier function in healthy dogs and in dogs with atopic dermatitis. Veterinary dermatology, 2019, vol. 30, no 2, p. 121-e34.
- ELIAS, Peter M.; HATANO, Yutaka; WILLIAMS, Mary L. Basis for the barrier abnormality in atopic dermatitis: outside-inside-outside pathogenic mechanisms. Journal of Allergy and Clinical Immunology, 2008, vol. 121, no 6, p. 1337-1343.
- HIGUCHI, Kazuhiko, et al. The skin of atopic dermatitis patients contains a novel enzyme, glucosylceramide sphingomyelin deacylase, which cleaves the N-acyl linkage of sphingomyelin and glucosylceramide. Biochemical Journal, 2000, vol. 350, no 3, p. 747-756.
- ARIKAWA, Junko, et al. Decreased levels of sphingosine, a natural antimicrobial agent, may be associated with vulnerability of the stratum corneum from patients with atopic dermatitis to colonization by Staphylococcus aureus. Journal of Investigative Dermatology, 2002, vol. 119, no 2, p. 433-439.
- THEERAWATANASIRIKUL, Sirin, et al. Histologic morphology and involucrin, filaggrin, and keratin expression in normal canine skin from dogs of different breeds and coat types. Journal of veterinary science, 2012, vol. 13, no 2, p. 163.
- NEMES, Z. Involucrin cross-linking by transglutaminase 1. J Biol Chem, 1999, vol. 274, p. 11021.
- KIM, Byung Eui, et al. Loricrin and involucrin expression is down-regulated by Th2 cytokines through STAT-6. Clinical immunology, 2008, vol. 126, no 3, p. 332-337.
- IMOKAWA, Genji. A possible mechanism underlying the ceramide deficiency in atopic dermatitis: expression of a deacylase enzyme that cleaves the N-acyl linkage of sphingomyelin and glucosylceramide. Journal of dermatological science, 2009, vol. 55, no 1, p. 1-9.
- FURUE, Masutaka. Regulation of filaggrin, loricrin, and involucrin by IL-4, IL-13, IL-17A, IL-22, AHR, and NRF2: pathogenic implications in atopic dermatitis. International journal of molecular sciences, 2020, vol. 21, no 15, p. 5382.
- KIM, Byung Eui, et al. TNF-α downregulates filaggrin and loricrin through c-Jun N-terminal kinase: role for TNF-α antagonists to improve skin barrier. Journal of Investigative Dermatology, 2011, vol. 131, no 6, p. 1272-1279.
- UITTO, Jouni; RICHARD, Gabriele; MCGRATH, John A. Diseases of epidermal keratins and their linker proteins. Experimental cell research, 2007, vol. 313, no 10, p. 1995-2009.
- HOLTHÖFER, Bastian, et al. Structure and function of desmosomes. International review of cytology, 2007, vol. 264, p. 65-163.
- BRANDNER, J. M., et al. Epidermal tight junctions in health and disease. Tissue barriers, 2015, vol. 3, no 1-2, p. e974451.
- KIM, Ha‐Jung, et al. A comparative study of epidermal tight junction proteins in a dog model of atopic dermatitis. Veterinary dermatology, 2016, vol. 27, no 1, p. 40-e11.
- IGAWA, Satomi, et al. Tight junctions in the stratum corneum explain spatial differences in corneodesmosome degradation. Experimental dermatology, 2011, vol. 20, no 1, p. 53-57.
- HARDING, C. R.; AHO, S.; BOSKO, C. A. Filaggrin–revisited. International journal of cosmetic science, 2013, vol. 35, no 5, p. 412-423.
- KANDA, Satoko, et al. Characterization of canine filaggrin: gene structure and protein expression in dog skin. Veterinary dermatology, 2013, vol. 24, no 1, p. 25-e7.
- MARSELLA, Rosanna. Does filaggrin expression correlate with severity of clinical signs in dogs with atopic dermatitis?. Veterinary dermatology, 2013, vol. 24, no 2, p. 266-e59.
- THYSSEN, Jacob P.; KEZIC, Sanja. Causes of epidermal filaggrin reduction and their role in the pathogenesis of atopic dermatitis. Journal of Allergy and Clinical Immunology, 2014, vol. 134, no 4, p. 792-799.
- FANTON, Natalia, et al. Increased filaggrin‐metabolizing enzyme activity in atopic skin: a pilot study using a canine model of atopic dermatitis. Veterinary dermatology, 2017, vol. 28, no 5, p. 479-e111.
- FISCHER, Jan; MEYER-HOFFERT, Ulf. Regulation of kallikrein-related peptidases in the skin–from physiology to diseases to therapeutic options. Thrombosis and haemostasis, 2013, vol. 110, no 09, p. 442-449.
- JANG, Hyosun, et al. Skin pH is the master switch of kallikrein 5-mediated skin barrier destruction in a murine atopic dermatitis model. Journal of Investigative Dermatology, 2016, vol. 136, no 1, p. 127-135.
- RIGOPOULOS, Dimitrios; TILIGADA, Ekaterini. Stratum corneum lipids and water-holding capacity. En Dermatoanthropology of Ethnic Skin and Hair. Springer, Cham, 2017. p. 63-73.
- MARSELLA, Rosanna; DE BENEDETTO, Anna. Atopic dermatitis in animals and people: an update and comparative review. Veterinary sciences, 2017, vol. 4, no 3, p. 37.
- OLIVRY, Thierry, et al. Early activation of Th2/Th22 inflammatory and pruritogenic pathways in acute canine atopic dermatitis skin lesions. Journal of Investigative Dermatology, 2016, vol. 136, no 10, p. 1961-1969.
 by Multimédica
by Multimédica