Calcinosis cutis: caso clínico
Resumen breve
La calcinosis cutis (CC) es una lesión poco común, en la cual se depositan sales minerales en la epidermis, dermis o subcutis. En el caso aquí expuesto se catalogó como un proceso iatrogénico debido a la administración crónica de glucocorticoides sistémicos por presentar la paciente una enfermedad inflamatoria intestinal, que respondía a este tratamiento antiinflamatorio.Índice de contenidos
Resumen
La calcinosis cutis (CC) es una lesión poco común, en la cual se depositan sales minerales en la epidermis, dermis o subcutis.
Este proceso se considera secundario, o asociado a otras condiciones, siendo la causa más frecuente el hiperadrenocortisolismo por administración de glucocorticoides sistémicos de manera continuada.
En el caso aquí expuesto se catalogó como un proceso iatrogénico debido a la administración crónica de glucocorticoides sistémicos por presentar la paciente una enfermedad inflamatoria intestinal, que respondía a este tratamiento antiinflamatorio.
El diagnóstico, manejo terapéutico, así como su prevención son de gran importancia en esta patología cutánea y es el objetivo de este trabajo.
Introducción
La calcinosis cutis (CC) es una lesión infrecuente1 (1.7-8 % como lesión temprana)2, en la cual las sales minerales insolubles e inorgánicas se depositan en la dermis, subcutis o, raramente, la epidermis1.
Con mayor frecuencia, la precipitación mineral involucra al colágeno y las fibras de la dermis3. Este proceso se considera secundario, o asociado a otras condiciones, pudiendo clasificarse en cuatro categorías separadas: metastásico, iatrogénico, distrófico e idiopático1,4-8.
Otras condiciones asociadas a estas lesiones, que causan inflamación en la piel, como quistes foliculares, granulomas por cuerpo extraño, pioderma interdigital, demodicosis o pilomatrixomas, también se relacionan con calcificación distrófica y osificación1-9.
La distribución de las lesiones cutáneas no parece ser un indicador de una causa subyacente particular de CC, pero el dorso parece ser la zona donde aparecen las lesiones en todos los perros con hiperadrenocorticismo endógeno y es la región corporal más típicamente afectada con calcinosis cutis, mientras que las lesiones inguinales y de la cabeza, las segundas zonas más comunes1-4.
Está descrito que el hipercortisolismo iatrogénico con CC se puede desarrollar después de tan solo 7 semanas de terapia con corticosteroides o hasta 3 años de terapia con dexametasona en días alternos8. El tratamiento, en el caso de la calcinosis cutis iatrogénica, básicamente, es retirar los glucocorticoides y/o tratar en el caso de existir una enfermedad de Cushing, así como aplicar en formato tópico, DMSO (dimetil sulfóxido) al 90 %, que es un solvente orgánico higroscópico simple5-7.
Los puntos claves se centran en un buen diagnóstico de la enfermedad de base, si la hay, así como una buena monitorización del paciente y los signos clínicos, ya que la calcinosis cutis es, en la mayoría de los casos, un signo de aumento del cortisol sanguíneo, por lo que es de esperar en aquellos animales alérgicos con tratamiento crónico con glucocorticoides para el prurito.
Calcinosis cutis
La calcinosis cutis es poco común en perros, pero suele asociarse con la administración prolongada de glucocorticoides o hiperadrenocorticismo, por lo que, en el ámbito de la dermatología, no sería una lesión tan infrecuente.
Se clasifica principalmente como calcificación distrófica, que ocurre en presencia de concentraciones normales de calcio y fosfato en el suero, y se localiza en áreas de daño tisular. Otras formas incluyen la calcificación metastásica, iatrogénica e idiopática1,4-8.
La calcificación metastásica se produce porque las sales de calcio se precipitan dentro de los tejidos normales, como consecuencia de un desequilibrio sistémico subyacente de calcio o fósforo5. Esto se observa con mayor frecuencia en perros con deterioro de la función renal (displasia renal o alteraciones del tracto urinario)9,10, pero también se ha descrito en casos de blastomicosis sistémica11,paecilomicosis12,13 y leptospirosis14,15.
La blastomicosis y la paecilomicosis pueden conducir a la calcinosis cutis a través de mecanismos inflamatorios y de daño tisular16. Estas infecciones fúngicas provocan una respuesta inflamatoria crónica en el cuerpo, lo cual puede alterar el metabolismo del calcio y del fósforo. Esto puede resultar en la deposición anormal de sales de calcio en los tejidos blandos, incluida la piel, llevando a la calcinosis cutis. La inflamación crónica y el daño tisular también pueden estimular la producción de factores que promueven la mineralización, contribuyendo a la formación de depósitos de calcio.
También se ha descrito este tipo de lesiones en animales con alteraciones del calcio y el fósforo, por una enfermedad o tumor en las glándulas paratiroides o el tratamiento para esta patología, que secundariamente altera el equilibrio de estos iones17.
La CC iatrogénica se produce como consecuencia de la absorción percutánea o la inyección de productos que contienen calcio en la piel18,19, que provocan una calcificación distrófica, desarrollándose una lesión tisular local. Esto se observa con mayor frecuencia en perros con hiperadrenocortisolismo iatrogénico o endógeno, pero también se ha descrito en asociación con enfermedades sistémicas, incluyendo la leptospirosis14,15.
La CC idiopática tiene un aspecto histológico similar al CC inducido por glucocorticoides, sin embargo, se presenta en perros menores de 1 año sin antecedentes de exceso de glucocorticoides y se resuelve espontáneamente en un año3,6. Esta debe diferenciarse de la calcinosis circunscrita, que también ocurre comúnmente en perros jóvenes, pero no se resuelve espontáneamente.
La calcinosis circunscrita ocurre con mayor frecuencia en puntos de presión o áreas de trauma, especialmente en perros jóvenes en crecimiento con un metabolismo aumentado del calcio y el fósforo3,7.
Está descrito que el hipercortisolismo iatrogénico con CC se puede desarrollar después de tan solo 7 semanas de terapia con corticosteroides, o hasta 3 años de terapia con dexametasona en días alternos8.
En cuando a la epidemiología, curiosamente, los perros y las chinchillas son las únicas especies conocidas de animales que desarrollan CC en respuesta al hiperadrenocortisolismo20.
En un estudio específico, las razas más afectadas incluyeron al Labrador retrievers, Rottweiler, Bóxer y Staffordshire terrier. La mayoría de los perros tenían una fuente exógena o endógena de corticosteroides. Se descubrió que la mineralización se encontraba en toda la dermis y los cristales de apatita fueron identificados como la fuente de mineralización21.
En los casos de calcinosis cutis asociados con el tratamiento con glucocorticoides, las lesiones suelen regresar después de la interrupción del tratamiento, aunque esto puede tardar meses. La eliminación quirúrgica de las lesiones primarias de osteoma cutis puede ser curativa sin recurrencia. Sin embargo, si no se aborda la causa subyacente, pueden desarrollarse lesiones adicionales17,18.
La distribución de las lesiones cutáneas no parece ser un indicador de una causa subyacente particular de CC, pero el dorso parece ser la zona donde aparecen las lesiones en todos los perros con hiperadrenocorticismo endógeno y es la región corporal más típicamente afectada por calcinosis cutis, mientras que las lesiones inguinales y de la cabeza, las segundas zonas más comunes1-5,21.
El tratamiento básicamente es retirar los glucocorticoides y/o tratar en el caso de existir una enfermedad de Cushing, así como aplicar en formato tópico, DMSO (dimetil sulfóxido) al 90 %, que es un solvente orgánico higroscópico simple. En el caso de utilizar este fármaco vía tópica, se debe monitorizar el calcio19 durante su aplicación, ya que este calcio suele ser reabsorbido por el organismo y, si es excesiva la cantidad, podría aumentar el calcio circulante en sangre, produciendo una hipercalcemia y, en pacientes con alteraciones renales primarias o secundarias al hipercortisolismo, leptospirosis o incluso leishmaniosis, se debe evitar su uso.
Se han descrito tratamientos a base de minociclina22,23.Se administró por vía oral en varios casos de calcinosis cutis distrófica en base a los resultados y beneficios observados en medicina humana, con buenos resultados o respuestas parciales.
Los puntos claves se centran en un buen diagnóstico de la enfermedad de base, si la hay, así como una buena monitorización del paciente y los signos clínicos, ya que la calcinosis cutis es, en la mayoría de los casos, un signo de aumento del cortisol sanguíneo, por lo que es de esperar en aquellos animales alérgicos con tratamiento crónico con glucocorticoides para el prurito.
Caso clínico
Se presentó en consulta una paciente de especie canina, hembra, de raza Pastor alemán, de 5 años, esterilizada, dónde su tutor consultó por unas lesiones que presentaba el animal desde hacía un mes y medio.
Estaba diagnosticada hacía casi dos años de enfermedad inflamatoria intestinal con tratamiento de prednisona a dosis de 1 mg/kg cada 24 horas junto con omeprazol, inicialmente, para luego pasar a una dosis de mantenimiento de 10 mg diarios. Se le administraron dosis únicas de glucocorticoides inyectables, además de la terapia oral en las crisis digestivas que sufría puntualmente.
Las lesiones comenzaron como un enrojecimiento y, luego, evolucionaron a placas en los laterales del tronco y de la zona pélvica, según relató el tutor. El animal a veces sufría de colitis con hemotoquecia, que a veces respondía a la administración de vitamina K, junto con los glucocorticoides.
El tutor refirió, además, que la perra presentaba polidipsia y poliuria. El animal presentaba prurito en la zona de las lesiones, lo cual producía que se rascara y mordiera. Llamaba la atención la gran pérdida de pelo que sufría en las zonas afectadas y circundantes.
El control de pulgas se realizaba con collar a base de imidacloprid y flumetrina (Seresto® collar, Elanco, Madrid) y para Dirofilaria con moxidectina inyectable de liberación prolongada (Guardian®, Elanco, Madrid). Nunca estuvo en zonas endémicas de Leishmania y en casa no convivía con más animales. Los tutores no presentaban lesiones ni referían haberlas tenido en el transcurso de toda la historia clínica de las lesiones dermatológicas que presentó el animal.
La perra comía pienso comercial de gama alta, y se le aplicaban baños semanales en la peluquería con un champú para perros no específico para problemas dermatológicos. Estaba correctamente vacunada de todas las enfermedades infecciosas caninas.
En la inspección física general el animal no presentaba abdomen en forma de péndulo, ni pérdida de masa muscular o signos de atrofia dérmica. Las constantes físicas estaban dentro de la normalidad.
La exploración dermatológica destacó por las lesiones en las zonas laterales del tórax y pelvis bilaterales, de tipo papular formando placas lineales alopécicas, rosadas y elevadas (Figura 1- 3). Al tacto eran duras y ásperas, firmes y no parecían ser dolorosas para el animal.
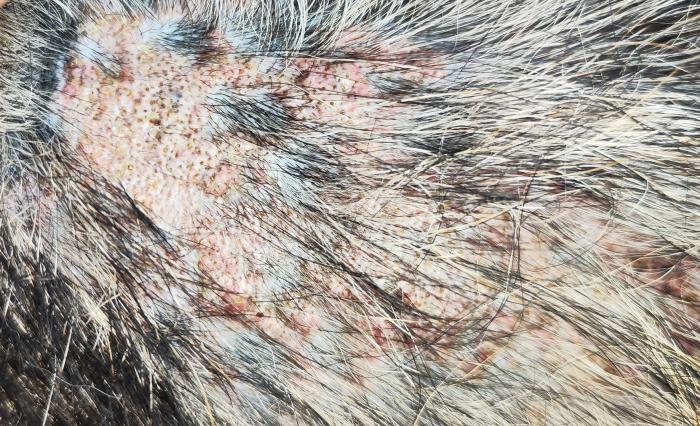
Figura 1. Lesión alopécica con eritema acompañado de costras amarillas y comedones.
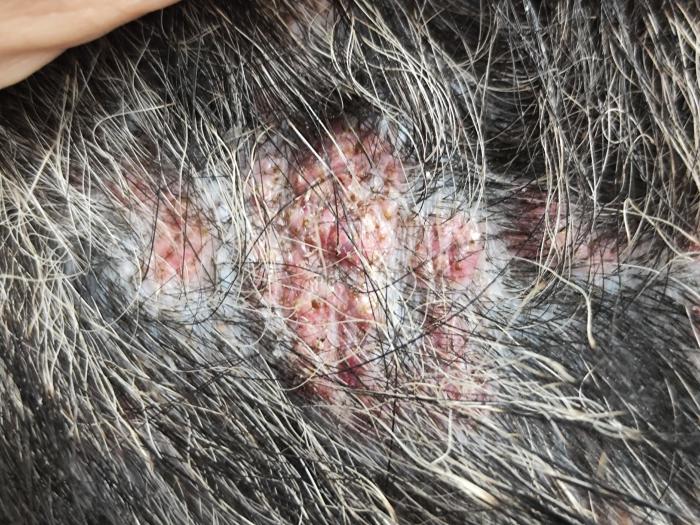
Figura 2. Imagen de lesión alopécica con placas eritematosas, comedones y costra amarillas.
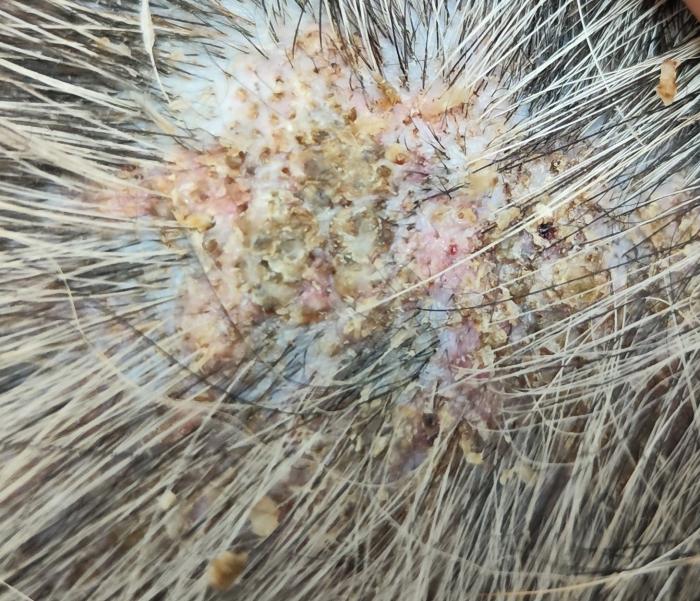
Figura 3. Fotografía de lesión macroscópica con alopecia, pápulo-costras amarillas gruesas con comedones.
En la exploración con dermatoscopio se pudieron observar comedones y restos de queratina perifolicular, así como descamación microscópica en la superficie de la piel (Figura 4 y 5). En algunas zonas se observaron los capilares sanguíneos ingurgitados, posiblemente por la atrofia cutánea localizada (Figura 6).
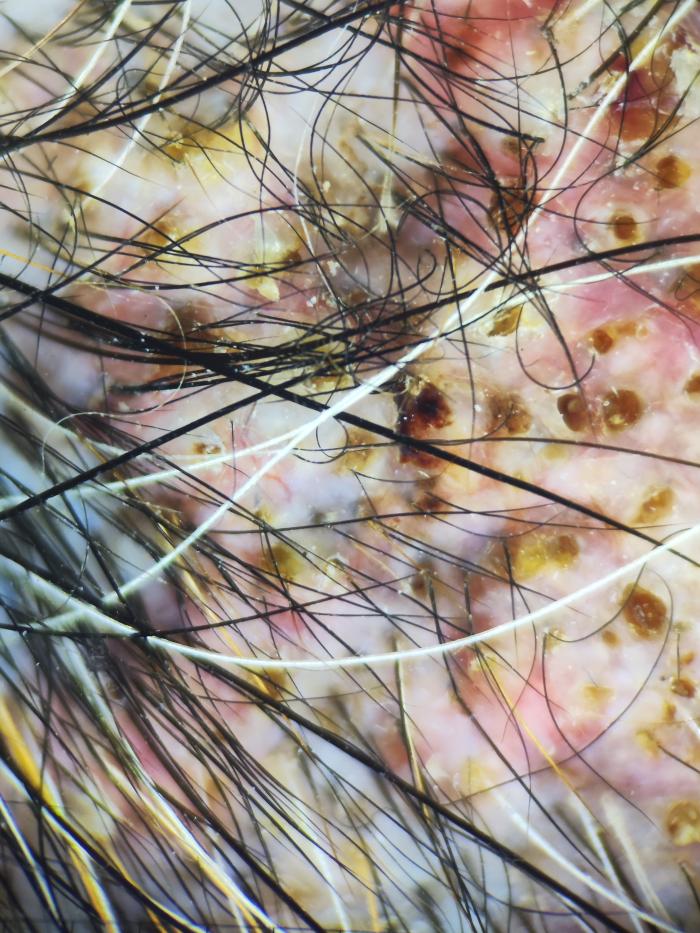
Figura 4. Imagen microscópica (dermatoscopio) donde se observan con mayor detalle los folículos ocupados por restos de queratina oxidada (comedones) así como eritema.
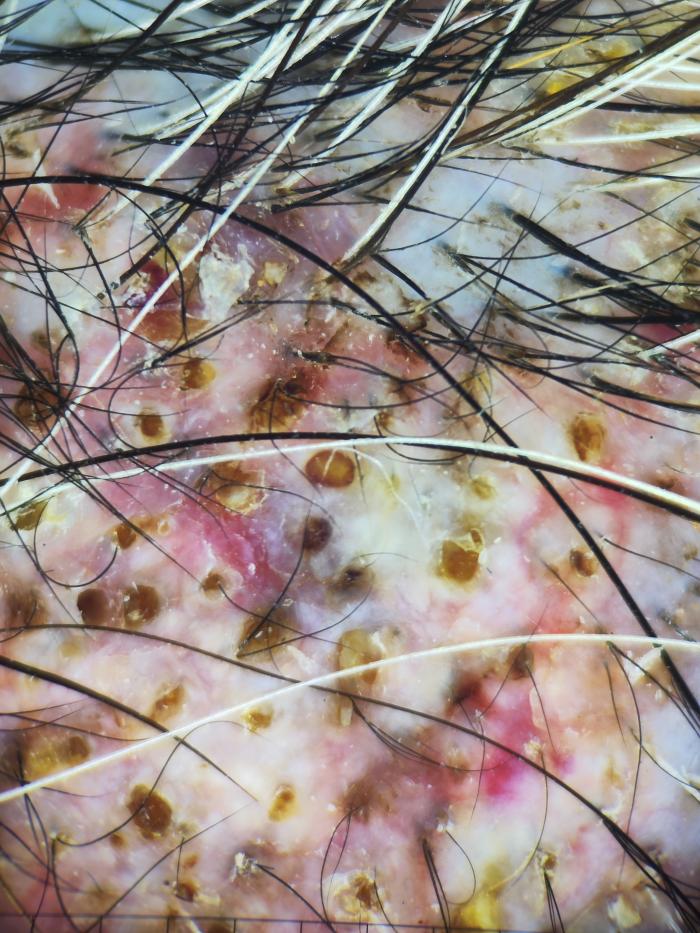
Figura 5. Imagen dermatoscópica donde se pueden observar, además de comedones ocupando el espacio folicular, costras así como ingurgitación de capilares dérmicos.

Figura 6. Fotografía dermatoscópica donde se observan microhemorragias alrededor de los folículos con presencia de los comedones anteriormente citados.
El patrón clínico se definió como pápulo-nodular formando placas asociado a alopecia y los diagnósticos diferenciales propuestos fueron la calcinosis cutis secundaria a hiperadrenocortisolismo (enfermedad de Cushing), nódulos inflamatorios (bacterianos, fúngicos o estériles) y neoplasias.
En base a la exploración física y los posibles diagnósticos diferenciales se propusieron las siguientes pruebas laboratoriales:
- Citología mediante punción con aguja fina (PAF): para la valoración de lesiones de tipo neoplásicas, principalmente, así como las lesiones de tipo inflamatorio o presencia de cristales.
- Análisis de sangre general y urianálisis: debido a los signos clínicos generales que presentó la paciente, es recomendable realizar un chequeo de los principales parámetros renales y hepáticos por la sospecha de enfermedad de Cushing.
- Análisis hormonal: mediante la estimulación con dexametasona a dosis baja para medir la concentración de cortisol pre y posadministración de esta, por la sospecha de hiperadrenocortisolismo.
- Ecografía: por la posibilidad de enfermedad de Cushing, para complementar el diagnóstico junto con la concentración de cortisol y la analítica general, valorando el tamaño y la morfología de las glándulas adrenales.
- Biopsia: para diagnosticar neoplasias, así como para la confirmación de lesiones de calcinosis cutis.
En este caso el tutor accedió a realizar la citología, la analítica de sangre y la biopsia, el resto de las pruebas se pospusieron en espera de respuesta con la retirada de los glucocorticoides de manera gradual.
En el estudio citológico de las lesiones, se observaron células multinucleadas compatibles con células fagocíticas, cristales, así como abundantes restos de queratina y queratinocitos (Figura 7 y 8).
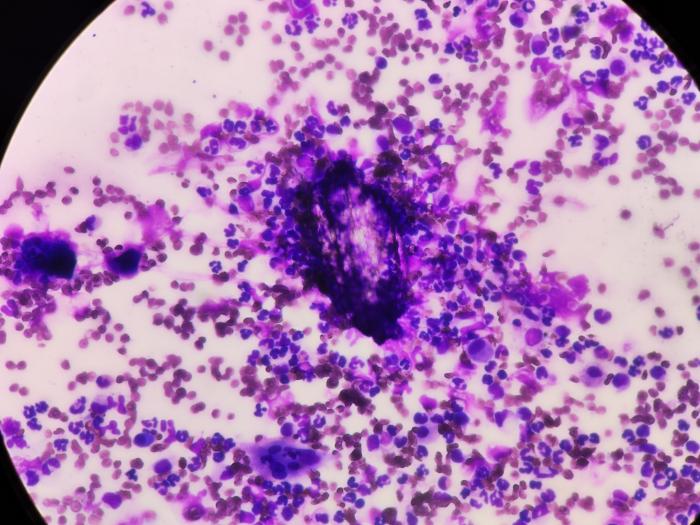
Figura 7. Imagen de la citología mediante PAF donde se observa un patrón piogranulomatoso (neutrófilos y macrófagos), así como un cristal en el centro de la imagen.
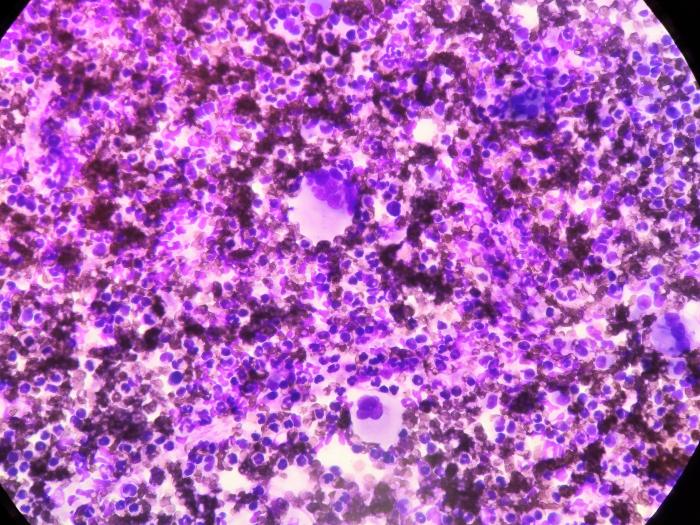
Figura 8. Patrón piogranulomatoso con presencia de células gigantes multinucleadas en el centro y periferia de la imagen.
Se observó gran cantidad de neutrófilos degenerados, algunos fagocitando bacterias cocoides y cantidad moderada de bacterias cocoides extracelulares y macrófagos espumosos (activados).
La analítica de sangre mostró un aumento moderado de la fosfatasa alcalina, BUN y urea, linfopenia y eosinopenia leve. No se observaron alteraciones en los demás parámetros renales o hepáticos.
Los resultados del estudio histopatológico confirmaron el diagnóstico de la lesión dermatológica, describiéndose la piel circundante a las lesiones elevadas como una epidermis fina con queratosis laminar, atrofia dérmica, dilatación y queratosis infunfibular y, atrofia y telogenización de las raíces foliculares, así como engrosamiento de la vaina conectiva perifolicular. Se observó una disminución del volumen de las glándulas sebáceas (Figura 9).
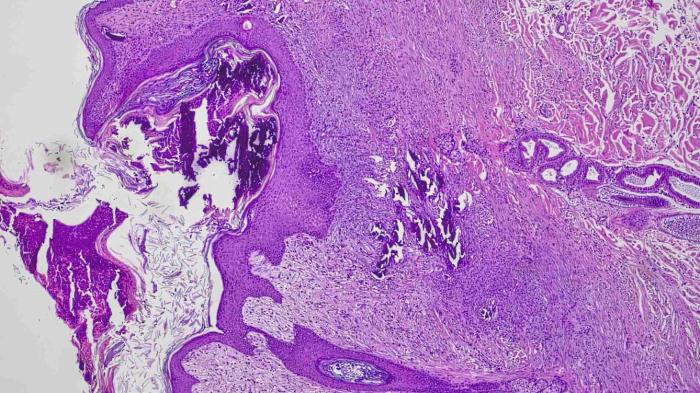
Figura 9. Imagen del corte histológico de las lesiones donde se observa el depósito de sales (restos violetas oscuros en la zona apical de la imagen y zona de la dermis) con infiltrado celular en la zona de la dermis.
En las zonas papulares-placas se observó hiperplasia de la epidermis con fibrosis de la dermis con focos de mineralización, rodeadas de infiltrado inflamatorio (similar al efecto de un cuerpo extraño) con macrófagos y células gigantes multinucleadas (Figura 10).
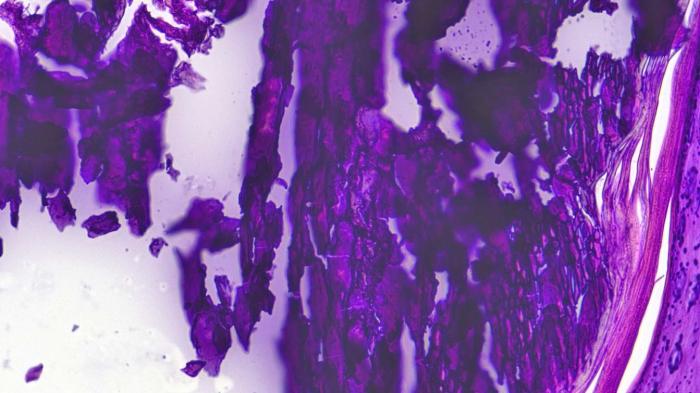
Figura 10. Detalle de las sales cálcicas en el corte histológico de una de las muestras enviadas.
El diagnóstico fue de calcinosis cutis posiblemente secundario a la administración crónica de glucocorticoides, sin confirmación de un Cushing iatrogénico.
El tratamiento utilizado se centró básicamente en DMSO (dimetil sulfóxido) al 90 % en gel, dos veces al día, para las lesiones, advirtiendo al tutor que las lesiones suelen tener un origen hormonal por exceso de cortisol sanguíneo, posiblemente secundario al tratamiento que estaba recibiendo de manera crónica con glucocorticoides sistémicos, por lo que también se debía ir reduciendo la dosis de manera progresiva y lenta para evitar efectos secundarios. Se propuso reducir un 25 % la dosis cada 7 días.
Para mejorar los signos clínicos de prurito se introdujo como tratamiento a base de oclacitinib oral (Apoquel®16 mg, Zoetis, Madrid) así como baños con champú a base de clorhexidina al 3 % y Ophytrium (Douxo Pyo® champú, Ceva, Barcelona) recomendando hacer baños cada 72 horas. Se decidió utilizar este tipo de composición para los baños terapéuticos, por la presencia de bacterias en la citología y así controlar las posibles infecciones cutáneas.
Se insistió en realizar controles analíticos, la ecografía y medir el cortisol antes y después de la administración de ACTH, para poder descartar también la posibilidad de un hiperadrenocortisolismo de base.
Durante el seguimiento, el animal fue mejorando, con desaparición progresiva de los signos clínicos, como la polidipsia, poliuria y prurito, la caída del pelo y las lesiones de calcinosis cutis comenzaron a desaparecer.
En la última revisión realizada a las 8 semanas, se suspendió el tratamiento tópico con DMSO y el oclacitinib oral, y se mantuvo un baño en semana con el mismo champú. Al animal se le instauró un tratamiento para la enfermedad inflamatoria intestinal a base de mesalazina (Claversal®, Glaxosmithkline, Madrid), omeprazol, DHA y probióticos orales, y así, evitar el uso de corticoides.
En esta última visita, la paciente no presentaba lesiones (Figuras 11 y 12), ni prurito ni caída del pelo acusada, tampoco polidipsia y poliuria, así como una analítica casi normalizada, con un leve aumento de la fosfatasa alcalina. Se le dio el alta con una cita de control analítico para monitorizar la normalización del parámetro hepático y una exploración física general.
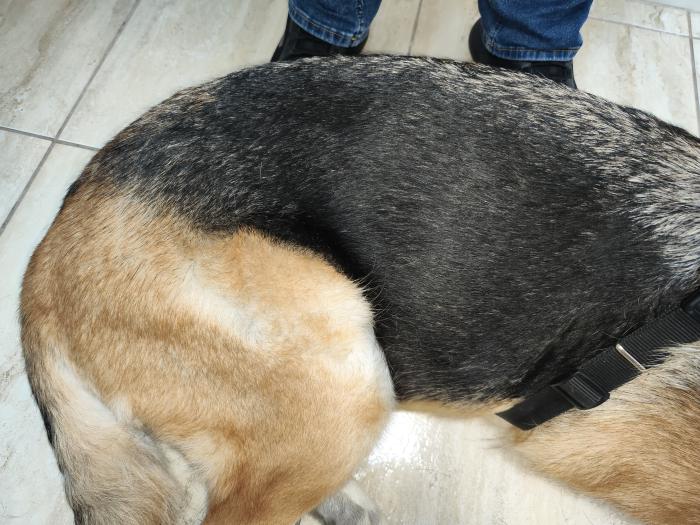
Figura 11. Fotografía de la paciente en su lateral derecho a las 8 semanas, sin presencia de lesiones.

Figura 12. Fotografía de la paciente en su lateral izquierdo a las 8 semanas, sin presencia de lesiones.
Discusión
La presencia de calcinosis cutis en esta paciente se asumió que fue un proceso iatrogénico debido a la administración crónica de glucocorticoides sistémicos por la enfermedad inflamatoria intestinal que padecía previamente a la aparición de las lesiones cutáneas.
No se incluyó en los posibles agentes etiológicos las enfermedades infecciosas como puede ser la leptospirosis, ya que el animal estaba correctamente vacunado, y en el caso de la blastomicosis y la paecilomicosis, no se observaron estructura fúngicas compatibles en la histopatología ni tampoco se observó aumento en el recuento de neutrófilos, que hubiera sido lo esperable en procesos infecciosos; en cambio, presentó alteraciones en el hemograma compatibles con el efecto del cortisol, como son la linfopenia y la eosinopenia (respuesta leucemoide o patrón de estrés leucocitario). Se descartó también una posible demodicosis, granulomas de cuerpos extraños o los pilomatrixomas, que son tumores benignos que se desarrollan en el folículo piloso.
Tampoco había recibido inyecciones de calcio o de fármacos que aumentaran los niveles de este ión a nivel sanguíneo, como para producir una calcinosis iatrogénica de tipo distrófica.
En este caso, los resultados de la bioquímica sanguínea de la paciente no eran sugestivos de una enfermedad renal, ya que la creatinina estaba en rango, así como el calcio y el fósforo.
En esta paciente, al realizarse la histopatología, se pudieron descartar las condiciones inflamatorias que podrían producir calcificación, ni la edad de la paciente ni la localización de las lesiones, que no se presentaron en zonas de presión o trauma, pudieron relacionarse con una calcinosis circunscrita.
La distribución de las lesiones cutáneas no parece ser un indicador de una causa subyacente particular de CC; en este caso, las lesiones estaban todas localizadas en los laterales del tronco a la altura de la zona pélvica y torácica, tanto las ingles, como la cabeza estaban libres de lesiones, por lo que se cumplía la distribución típica del tronco, como primera localización habitual.
La calcinosis se puede desarrollar después de tan solo siete semanas de tratamiento con corticosteroides, o hasta 3 años de terapia con dexametasona en días alternos8, que en este caso superó la administración mínima para que se produjeran los depósitos de calcio en la piel, siento el tiempo de terapia mayor de un año.
En cuanto a las pruebas diagnósticas o herramientas que nos pueden orientar en el diagnóstico en consulta, es de gran ayuda la citología mediante punción con aguja fina, ya que podemos observar los cristales de sal, así como la celularidad que acompaña a estas lesiones. Algunas de las claves son la presencia de células multinucleadas de naturaleza fagocítica, que cumplen la función de destruir estos cristales, y que éstas producen un efecto de cuerpo extraño en la piel. Podemos ver, además, un patrón inflamatorio asociado, con neutrófilos y macrófagos activados con vacuolas en su interior (denominados espumosos).
En esta ocasión, el uso del dermatoscopio, el cual no se considera una herramienta esencial para el diagnóstico, sí puede ser útil como herramienta de apoyo para la observación a nivel microscópico. Nos puede ayudar a observar la presencia de moldes foliculares, restos de queratina, existencia o no de pelo en los folículos o incluso para poder apreciar a nivel vascular si existe algún tipo de ingurgitación o equimosis en los vasos capilares de la piel afectada.
En cuanto al tratamiento de estas lesiones, se basa principalmente en retirar progresivamente los glucocorticoides sistémicos y tratar la enfermedad de base en el caso de existir un síndrome de Cushing.
En cuanto a las lesiones cutáneas, el fármaco más usado es el DMSO (dimetil sulfóxido) al 90 % (pudiendo estar menos concentrado), que es un solvente orgánico higroscópico simple. Este penetra en la piel rápidamente, unos 5 minutos, y puede aumentar el calor o el picor de la zona a tratar, porque causa la liberación de histamina y produce un efecto exotérmico con el agua. Normalmente se prepara como una fórmula magistral en la farmacia y se suele solicitar en formato de gel, para facilitar su aplicación y absorción.
Se ha descrito también la efectividad del tratamiento con minociclina22,23 en la calcinosis cutis distrófica. La minociclina es un antibiótico del grupo de las tetraciclinas y, basándose en la efectividad observada en medicina humana, se ha utilizado en varios casos de perros con calcinosis cutis, que tuvieron una buena respuesta al fármaco y desaparición de las lesiones en mayor o menor medida.
La minociclina inhibe las MMP que son un grupo de enzimas que pueden descomponer las proteínas, como el colágeno, que se encuentran normalmente en los espacios entre las células de los tejidos (es decir, proteínas de la matriz extracelular) y dependen del zinc. La minociclina y compuestos relacionados inhiben varias colagenasas y gelatinasas, que tienen funciones importantes en la inflamación. Se cree que la inhibición de las MMP reduce la inflamación, el daño del colágeno en la calcinosis cutis y, secundariamente, efecto quelante del calcio. Este efecto de la minociclina está relacionado con las lesiones que se producen por el depósito de sales cálcicas en la piel, dónde se daña el colágeno, y por la presencia de cristales, que produce una inflamación y una respuesta celular localizada para intentar eliminar este material inorgánico; es por ello podemos entender su efectividad en esta entidad clínica.
En esta paciente en concreto, se pautó el tratamiento de mesalazina, que pertenece al grupo de fármacos llamados antiinflamatorios intestinales y actúa frente a la inflamación producida por la enfermedad inflamatoria del intestino (utilizado para la colitis ulcerosa y la enfermedad de Crohn en humanos), debido a que no se recomendaba volver a utilizar glucocorticoides sistémicos.
Se ha descrito también el uso de la luz fluorescente o fotobioestimulación (Phovia®, Vetoquinol, Madrid) para el tratamiento de las infecciones localizadas y asociadas a las lesiones de calcinosis cutis con buenos resultados.24
En conclusión, es importante hacer un buen diagnóstico de la enfermedad de base, si la hay, así como una buena monitorización del paciente y los signos clínicos, ya que la calcinosis cutis es, en la mayoría de los casos, un signo de aumento del cortisol sanguíneo, con frecuencia iatrogénico, por lo que es de esperar en aquellos animales alérgicos con tratamiento crónicos con glucocorticoides para el prurito, o pacientes con enfermedades que afecten a la función renal o al metabolismo del fósforo y el calcio.
Bibliografía
- Walsh J, Fairley J.: Cutaneous mineralization and ossification. In:Goldsmith L, Katz S, Gilchrest B et al., eds. Fitzpatrick’s Derma-tology in General Medicine. 5th edn. New York: McGraw-Hill,1999; 1829–1835.
- White, S. D., Ceragioli, K. L., Bullock, L. P., Mason, G. D., & Stewart, L. J. Cutaneous markers of canine hyperadrenocorticism. The Compendium on continuing education for the practicing veterinarian 1989; 456-470.
- Gross T, Ihrke P, Walder E et al.: Degenerative, dysplastic and depositional diseases of dermal connective tissue. In: Skin Diseases of the Dog and Cat. 2nd edn. Oxford: Blackwell Science Ltd, 2005; 373–380
- Touart D, Sau P. Cutaneous deposition diseases. Part II. J Am Acad Dermatol 1998; 39: 527–544
- Walsh J, Fairley J.: Calcifying disorders of the skin. J Am Acad Dermatol 1995; 33: 693–706.
- Doerr, K. A., et al.: Calcinosis cutis in dogs: histopathological and clinical analysis of 46 cases. Veterinary Dermatology 2013; 24(3): 355-e79.
- Scott D, Miller W, Griffin CE.: Neoplastic and non-neoplastic tumors. In: Muller and Kirk’s Small Animal Dermatology. 6thedn. Philadelphia: W.B. Saunders, 2001; 1398–1402.
- Cornelius L, Calvert C.: Four case studies in the use and misuse of corticosteroid therapy. Vet Med 1991; 86: 1186–1198
- Lee, E. M., Kim, A. Y., Lee, E. J., & Jeong, K. S. (2016). Pathomorphological features of calcinosis circumscripta in a dog. Laboratory Animal Research, 32, 74-77.
- Muller, A., Degorce‐Rubiales, F., Guaguère, E. (2011). Metastatic calcinosis (including calcinosis cutis) in a young dog with multiple urinary tract abnormalities. Veterinary Dermatology, 22(3), 279-283.
- Gortel K, McKiernan B, Johnson K et al.: Calcinosis cutis associated with systemic blastomycosis in three dogs. J Am Anim Hosp Assoc 1999; 35: 368–374.6.
- Holahan M, Loft K, Swenson C et al.: Generalized calcinosis cutis associated with disseminated paecilomycosis in a dog. Vet Dermatol 2008; 19: 368–372.
- Woolford, L., Parker, K., Lee, K., Westermann, T., Hicks, P., Mackie, Q., Kessell, A. (2019). Paecilomycosis in two Australian dogs. Australian Veterinary Practitioner, 49(1).
- Munday J, Bergen D, Roe W.: Generalized calcinosis cutis associated with probable leptospirosis in a dog. Vet Dermatol 2005;16: 401–406.
- Muller, C., Guaguère, É., Muller, A., Husson, J. C., Degorce-Rubiales, F. (2022). Localized cutaneous calcinosis associated with leptospirosis in a 4-month-old beagle puppy. The Canadian Veterinary Journal, 63(10), 1027.
- Thompson, G. R., et al. (2021). Global guideline for the diagnosis and management of the endemic mycoses: an initiative of the European Confederation of Medical Mycology in cooperation with the International Society for Human and Animal Mycology. The Lancet Infectious Diseases, 21(12), e364-e374.
- Schaer, M., Ginn, P. E., Fox, L. E., Leon, J., & Ramirez, F. M. (2001). Severe calcinosis cutis associated with treatment of hypoparathyroidism in a dog. Journal of the American Animal Hospital Association, 37(4), 364-369.
- Schick M, Schick R, Richardson J.: Calcinosis cutis secondary to percutaneous penetration of calcium chloride in dogs. J Am Vet Med Assoc 1987; 191: 207–211.8.
- Paradis M, Scott D.: Calcinosis cutis secondary to percutaneous penetration of calcium carbonate in a Dalmation. Can Vet J 1989; 30: 57–59.
- Tisljar M, Janic D, Grabarevic Z et al. Stress-induced Cushing’s syndrome in fur-chewing chinchillas. Acta Vet Hung 2002; 50:133–142.
- de Moraes, R. S., et al. (2021). Calcinosis cutis with large extension and uncommon location in a dog. Acta Scientiae Veterinariae, 49.
- Cho, D. H., Lee, W. H., & Park, S. J. (2017). Treatment of calcinosis cutis with minocycline in five dogs. Journal of veterinary clinics, 34(2), 119-122.
- Jang, H. J., Kang, M. H., Sur, J. H., & Park, H. M. (2013). Minocycline as a treatment of dog with calcinosiscutis. Korean Journal of Veterinary Research,53(4), 253-256.
- Apostolopoulos, N., Mayer, U. (2020). Use of fluorescent light energy for the management of bacterial skin infection associated with canine calcinosis cutis lesions. Veterinary Record Case Reports, 8(4), e001285.
 by Multimédica
by Multimédica