Trichophyton mentagrophytes. Caso clínico
Resumen breve
Se presentó en consulta una paciente de especie canina, hembra Mestiza de 5 años, esterilizada, por unas lesiones que presentaba el animal desde hacía 6 meses y que no respondían al tratamiento a base de glucocorticoides y antibióticos pautado de manera ininterrumpida.Índice de contenidos
Resumen
La dermatofitosis, en medicina veterinaria y humana, es una enfermedad infecciosa causada por agentes fúngicos que puede afectar a gran variedad de especies, incluidos los seres humanos, ya que presenta un alto potencial zoonótico.
Se considera una patología de distribución mundial con diferentes tasas de prevalencia e incidencia dependiendo del país y de la época del año.
Trichophyton mentagrophytes es un dermatofito el cual tiene como reservorio natural a los roedores, incluyendo los erizos. Esto hace que las razas o individuos con instinto cazador estén más predispuestos.
Es de vital importancia el diagnóstico mediante pruebas complementarias que apoyen las sospechas clínicas y sustenten la práctica basada en la evidencia científica para evitar contagios entre otros animales y los tutores, así como un tratamiento correcto y enfocado, además, en el control ambiental.
Introducción
Las dermatofitosis son infecciones micóticas superficiales causadas por un grupo de hongos queratinofílicos conocidos como dermatofitos. Estos hongos tienen la capacidad de invadir tejidos queratinizados como la piel, el pelo y las uñas, tanto en humanos como en animales.
Los dermatofitos se clasifican en tres géneros principales: Microsporum, Epidermophyton y Trichophyton, siendo este último de particular interés debido a su relevancia clínica y zoonótica.
Una de las características más preocupantes de las dermatofitosis es su potencial zoonótico, lo que representa un desafío importante para la salud pública y la medicina veterinaria, especialmente en contextos donde la interacción entre humanos y animales es estrecha, como en hogares con mascotas, clínicas veterinarias, granjas y zoológicos. La transmisión puede ocurrir a través del contacto directo con animales infectados, así como mediante el contacto con objetos contaminados como cepillos, camas y otros utensilios.
Dentro del género Trichophyton, Trichophyton mentagrophytes, es una especie significativa debido a su prevalencia y virulencia. Este hongo es un patógeno oportunista que afecta a una amplia variedad de hospedadores, incluyendo perros, gatos, roedores, caballos y, ocasionalmente, humanos. Las infecciones por T. mentagrophytes suelen manifestarse como lesiones cutáneas eritematosas, con descamación y prurito, que pueden complicarse por infecciones secundarias.
T. mentagrophytes presenta una gran diversidad genética y fenotípica, lo que contribuye a su adaptabilidad y resistencia en diferentes entornos. Su diagnóstico requiere la combinación de métodos clínicos, micológicos y moleculares, siendo esencial para implementar un tratamiento adecuado y eficaz. El manejo de las infecciones por dermatofitos implica tanto el tratamiento de los animales afectados como la desinfección del entorno para prevenir la reinfección y la transmisión zoonótica.
Trichophyton mentagrophytes
Trichophyton mentagrophytes es un hongo dermatofito de gran relevancia en la medicina veterinaria y humana debido a su capacidad para causar infecciones superficiales en la piel, el pelo y las uñas. Este patógeno oportunista se caracteriza por su diversidad morfológica y su capacidad de adaptación a diferentes hospederos y entornos1.
En términos de morfología, Trichophyton mentagrophytes presenta hifas septadas y ramificadas, de entre 2 y 7 septos. Su reproducción asexual se realiza mediante la producción de conidios, que se dividen en macroconidios y microconidios. Los macroconidios, que tienen forma de cigarro o fusiforme, poseen paredes delgadas y lisas (Figura 1).

Figura 1. Imagen de los macroconidios de T. mentagrophytes con aspecto de cigarro/puro, con segmentaciones (entre 2-7) con tinción de azul de metileno tras cultivo fúngico e incubación durante 12 días.
Por otro lado, los microconidios son abundantes y se agrupan en racimos o se disponen lateralmente a lo largo de las hifas. Las colonias de T. mentagrophytes en cultivo pueden ser planas y cerebriformes, con colores que varían del blanco al crema, aunque algunos aislamientos pueden presentar pigmentación amarillo-marrón2.
Este hongo también puede reproducirse sexualmente mediante la formación de ascosporas en estructuras conocidas como cleistotecios. Sin embargo, esta forma de reproducción es menos común y se observa raramente en condiciones de laboratorio3.
Trichophyton mentagrophytes tiene múltiples reservorios, incluyendo animales domésticos como perros y gatos, animales de granja y roedores. La transmisión de este hongo ocurre principalmente por contacto directo con animales infectados o con objetos contaminados como cepillos, camas y jaulas (fómites). Aunque es menos frecuente, también puede transmitirse entre humanos. Los factores de riesgo incluyen tener: un sistema inmunológico comprometido, ser niño o trabajar en estrecha proximidad con animales4.
En cuanto a su distribución, T. mentagrophytes tiene una presencia mundial, siendo más prevalente en regiones templadas y tropicales. Las infecciones pueden ocurrir en cualquier lugar donde haya contacto cercano con animales portadores del hongo, prefiriendo ambientes cálidos y húmedos, lo que favorece su crecimiento y diseminación. Se encuentra comúnmente en el suelo, en materiales queratinosos y en ambientes frecuentados por animales5.
En los animales, Trichophyton mentagrophytes afecta principalmente la piel, el pelo y las uñas. Las lesiones pueden ser localizadas o diseminadas, presentándose como áreas de alopecia, eritema y descamación. En humanos, las infecciones suelen manifestarse como tinea corporis o herpes circinado (infección del cuerpo), tinea capitis (infección del cuero cabelludo) y onicomicosis (infección de las uñas)6.
El tratamiento de las infecciones causadas por T. mentagrophytes puede ser tópico o sistémico. Los antimicóticos tópicos como clotrimazol, miconazol, terbinafina y ketoconazol son comúnmente efectivos en el tratamiento de infecciones localizadas y leves. En casos más severos o diseminados, se utilizan tratamientos sistémicos como la griseofulvina, terbinafina oral e itraconazol. La duración del tratamiento puede variar desde varias semanas hasta meses, dependiendo de la severidad y localización de la infección7.
Aunque T. mentagrophytes generalmente responde bien a los tratamientos antimicóticos, puede desarrollarse resistencia, especialmente si el tratamiento no se sigue adecuadamente o se interrumpe prematuramente. Por ello, es crucial mantener una buena higiene, desinfectar los objetos contaminados y tratar a las mascotas infectadas para prevenir la reinfección y la propagación zoonótica8.
Caso clínico
Se presentó en consulta una paciente de especie canina, hembra Mestiza de 5 años, esterilizada, por unas lesiones que presentaba el animal desde hacía 6 meses y que no respondían al tratamiento a base de glucocorticoides y antibióticos pautado de manera ininterrumpida.
Las lesiones habían sido diagnosticadas como parte de los signos clínicos de una dermatitis alérgica, aunque anteriormente nunca había presentado lesiones y comenzó de manera aguda. No se realizaron pruebas previamente.
Estaba siendo tratada desde hacía 6 meses con prednisona a dosis de 0.5 mg/kg/24 h junto con antibióticos de amplio espectro, que fueron variando. Se le administraron dosis únicas de glucocorticoides inyectables además de la terapia oral. Se le pautaron, también, baños terapéuticos con champú a base de clorhexidina y pomada a base de betametasona y gentamicina (Diprogenta® pomada, MSD, Madrid) aplicándola cada 12 horas de manera ininterrumpida, así como crema hidratante con lanolina (Nivea® crema, Unilever, Alemania).
Las lesiones comenzaron en forma de pápulas y eritema localizadas en el costado derecho y luego evolucionaron a lesiones alopécicas, con hiperpigmentación multifocal, así como placas en algunas zonas por coalescencia de las pápulas. La lesión fue aumentando de tamaño hasta alcanzar un diámetro de 10 x 15 cm, abarcando el abdomen lateral del mismo lado.
El animal refería algo de prurito y la tutora (en estado gestante) presentaba una lesión abdominal periumbilical que era pruriginosa, con bordes eritematosos y piel de aspecto atrófico centralmente (Figura 2).
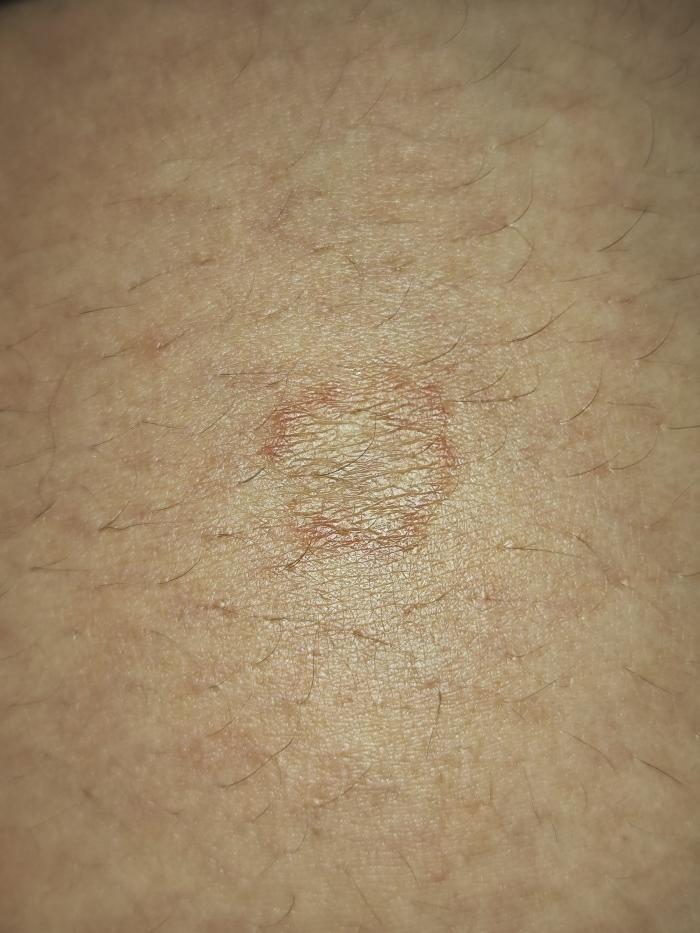
Figura 2. Lesión pruriginosa e inflamatoria abdominal en la piel de la tutora con aspecto circinado compatible con dermatofitosis producida por T. mentagrophytes.
Los tutores comentaban que el animal presentaba polidipsia, poliuria y polifagia desde que comenzó con el tratamiento con glucocorticoides.El animal vivía en una casa con jardín dónde había troncos secos, árboles y plantas, así como césped artificial, dónde solía frotarse. En la zona de jardín había acceso para pequeños animales silvestres, como gatos e incluso roedores, incluyendo erizos.
El control de pulgas se realizaba con pipeta mensual y estaba correctamente vacunada de todas las enfermedades infecciosas caninas. Nunca estuvo en zonas endémicas de Leishmania y en casa no convivía con más animales. La perra era alimentada con pienso comercial de gama alta que era bien tolerado.
En la inspección física general el animal no presentaba adenomegalias y los parámetros físicos estaban dentro de la normalidad.
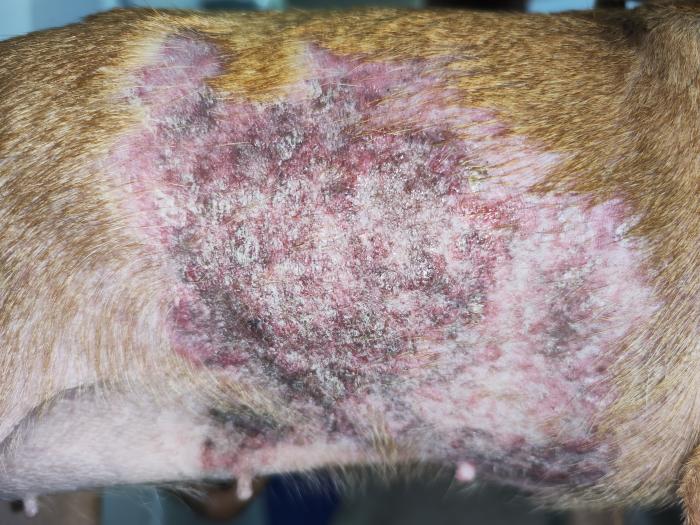
La exploración dermatológica destacó por la lesión alopécica de gran tamaño en el tronco lateral derecho que recorría hasta la zona abdominal lateral con hiperpigmentación, abundantes pápulas eritematosas, algunas coalescentes (placas), escamas y costras blancas de gran tamaño (Figura 3A-B). Al tacto eran ásperas, firmes y no parecían ser dolorosas para el animal. En el costado izquierdo tenía una lesión similar pero solo mostraba hipotricosis leve y algo de hiperpigmentación (Figura 3C), con un tamaño de 10 cm de alto por 15 cm de ancho (longitudinal).
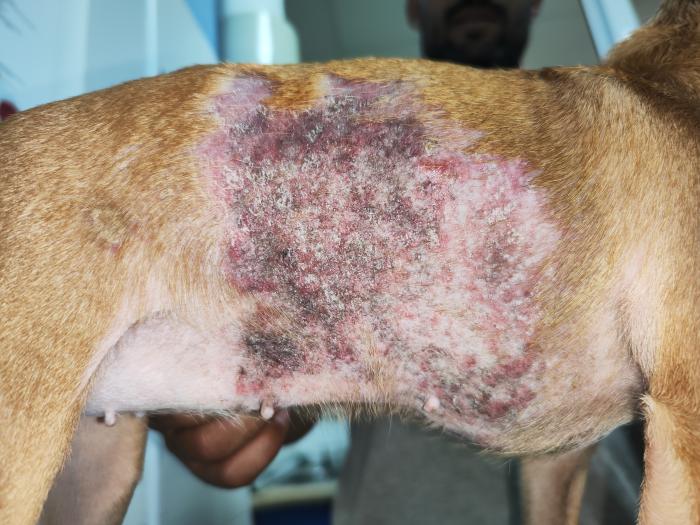
Figura 3. Fotografías de las lesiones troncales en (A-B) el lateral derecho y en (C) el lateral izquierdo, con alopecia, placas eritematosas, pápulas, hiperpigmentación y costras.
El patrón clínico se definió como papular formando placas asociado a alopecia e hiperpigmentación y los diagnósticos diferenciales propuestos fueron dermatofitosis, demodicosis, sarnas, reacción adversa a alimentos, dermatitis atópica canina, reacción de hipersensibilidad por contacto, enfermedades endocrinas y pioderma secundaria.
En base a la exploración física y los posibles diagnósticos diferenciales se propusieron las siguientes pruebas laboratoriales:
- Lámpara de Wood: por las altas sospechas de dermatofitosis, aunque solo la especie Microsporum canis presenta refringencia con la exposición a la luz UV.
- Tricografía (examen tricoscópico): para descartar artrosporas fúngicas, así como presencia de signos de autotraumatismo en el pelo o alteraciones en el crecimiento del pelo.
- Citología superficial (test del acetato): para descartar presencia de sobrecrecimientos de bacterias o levaduras (Malassezia pachidermatis) o piodermas bacterianas con presencia de neutrófilos fagocitando.
- Raspado superficial y profundo: para descartar posibles sarnas.
- Cultivo cutáneo: para confirmar o descartar piodermas o dermatofitosis.
- Perfil analítico y de orina: para detección de alteraciones sistémicas relacionadas con procesos endocrinos principalmente.
- Perfil hormonal: para descartar alteraciones en las hormonas tiroides y/o cortisol.
Se fueron realizando las pruebas en el orden establecido para ir del diagnóstico diferencial más probable al menos compatible, dejando siempre en último lugar las patologías que menos cumplían todos los criterios de signos clínicos.
La lámpara de Wood no ofreció ningún tipo de refringencia en ninguna de las lesiones expuestas a la luz UV. En cuanto al tricograma o tricografía se observaron pelos con figuras de tricorrexis y estructuras circulares/acinares compatibles con artrosporas fúngicas y alteraciones corticomedulares (Figura 4).
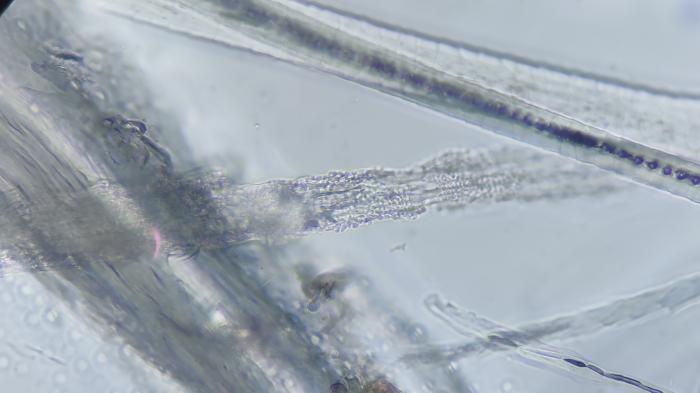
Figura 4. Imagen de tricografía, donde se observan varios pelos con estructuras circulares acinares invadiendo la médula y con rotura de la corteza del pelo, además de la pérdida de los raíles de tren de la melanina y aspecto tortuoso de estos.
En el estudio citológico de la superficie cutánea o test de acetatose observaron abundantes clústers de bacterias de aspecto bacilar, neutrófilos degenerados y abundantes estructuras alargadas segmentadas y de color basófilo compatible con hifas fúngicas (Figura 5).
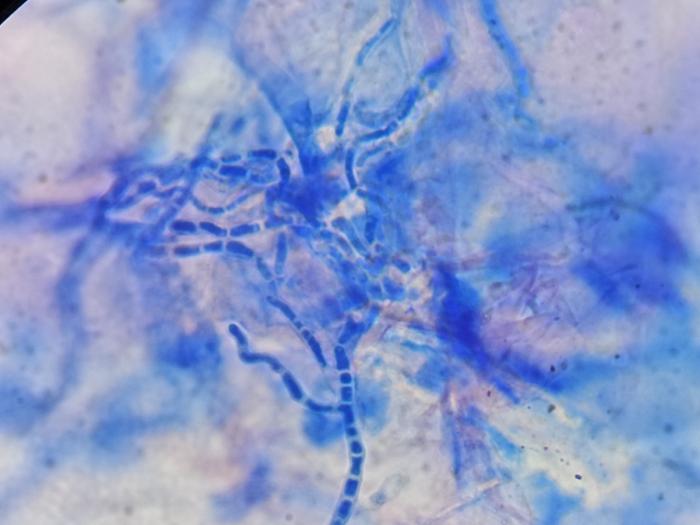
Figura 5. Fotografía del test mediante cinta de acetato (test de acetato) dónde se pueden observar hifas fúngicas con aspecto tabicado y en formando racimos. Tinción Diff Quick y azul de metileno.
En el raspado no se observaron ácaros y el perfil hormonal se realizó para evaluar alguna alteración secundaria a la administración crónica de glucocorticoides, siendo los resultados de cortisol basal y posACTH normales, así como el perfil tiroideo.
Se realizó cultivo fúngico con crecimiento del dermatofito Trichophyton mentagrophytes. En la analítica general de sangre y orina se observó elevación moderada de las globulinas, fosfatasa alcalina y ALT y leve hipercolesterolemia. En el hemograma se observó una leucopenia moderada por linfopenia, eosinopenia y monocitopenia.
En el tiempo de espera de los resultados del cultivo, se suspendió el tratamiento antibiótico y se pautó la bajada progresiva y controlada de los glucocorticoides orales (disminución del 25 % de la dosis cada 6 días), se comenzó con limpiezas con mousse a base de clorhexidina al 3 % y Ophytrium (Douxo® pyo mousse, CEVA, Barcelona), aplicación de pomada a base de ketoconazol (Fungarest® pomada, Stada, Barcelona) en las lesiones dos veces al día después de la limpieza y se pautaron baños diarios con champú a base de miconazol y clorhexidina al 2 % (Malaseb® champú, Dechra, Barcelona).
El diagnóstico final fue dermatofitosis por Trichophyton mentagrophytes.
Una vez se obtuvieron los resultados, confirmando las sospechas clínicas, se añadió al tratamiento inicial itraconazol oral (Itrafungol®jarabe, Virbac, Barcelona) a dosis de 5 mg/kg/24 h en semanas alternas durante 8 semanas. La terapia tópica con champú se mantuvo todos los días las 2 primeras semanas y luego se fueron disminuyendo a días alternos la tercera y cuarta semana, para pasar a un mantenimiento de un baño cada 72 horas desde la quinta a la octava semana. Se añadió además vía oral diario, tratamiento inmunoestimulante adaptógeno a base de fermentado de hifas de Hericium erinaceus, extracto de Cúrcuma y de Echinacea (Hifas®InmunoPet, Hifas Vet, Pontevedra) para mejorar la calidad y eficiencia de la microbiota intestinal y el sistema inmune, tras el largo periodo de glucocorticoides y antibióticos sistémicos.
Para el control ambiental de esporas se pautó cal sulfurada tópica (Cutania® lime sulphur, VetNova, Murcia) aplicándolo en la superficie del animal una vez en semana
Durante el seguimiento el animal fue mejorando, con desaparición rápida y progresiva de los signos clínicos, creciendo el pelo en todas las superficies afectadas, y en ningún momento presentó signos clínicos adversos al tratamiento (Figura 6).
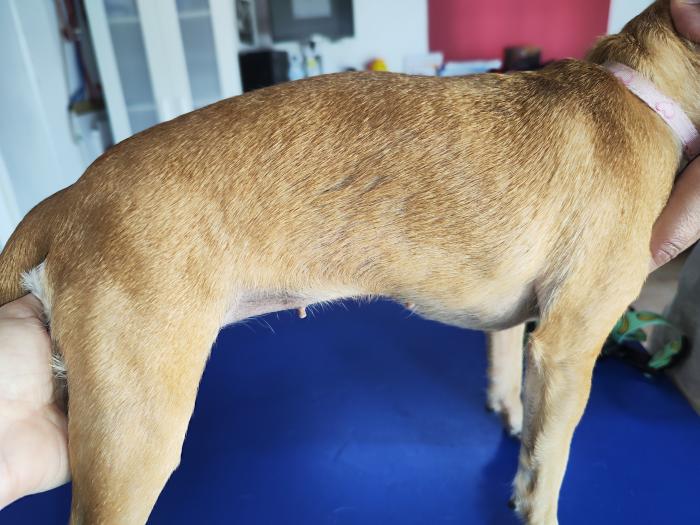
Figura 6. Imagen de la paciente tras 8 semanas de tratamiento antifúngico oral, champuterapia y suplementación inmunoestimulante.
Se repitió el cultivo fúngico a las 8 semanas antes de suspender el itraconazol oral, con resultado negativo. Se mantuvo solamente el tratamiento inmunoestimulante durante 4 meses más y un baño cada 10 días. En la analítica de control, los valores hepáticos y de inflamación se habían normalizado.
Se recomendó retirar los troncos secos del jardín, así como el césped artificial, ya que podría haber sido la fuente de contagio con el dermatofito. Se recomendó control de plagas con medios físicos (tapar agujeros o accesos desde el exterior). Hasta la fecha actual, la paciente no presenta ningún signo clínico dermatológico. La tutora, tras consulta con su matrona, fue tratada con tópicos y el bebé no tuvo ningún tipo de alteración derivada de la infección local ni el tratamiento pautado.
Discusión
La dermatofitosis es una enfermedad infecciosa importante y zoonótica, que afecta a perros de cualquier país y localización. Se suelen declarar o identificar en perros jóvenes de manera más frecuente1.
Los signos clínicos pueden incluir alopecia, eritema, pápulas, costras y escamas, y no suele ser una enfermedad pruriginosa. Las lesiones están bien definidas, con inflamación periférica y normalmente localizadas en la cara y extremidades. Estas pueden progresar y volverse generalizadas2.
El agente fúngico más común es variable y depende de la región el país donde se estudie su prevalencia. Aun así, en la mayoría de los países, las especies más comunes son Microsporum canis, M. gypseum yTrichophyton mentagrophytes3.
En la mayoría de los países, M. canis ha sido el agente etiológico más aislado, aunque existen países como la India, que presenta mayor prevalencia de T. mentagrophytes4, y es el segundo dermatofito más prevalente en países como Croacia, Reino Unido, Irán y Puerto Rico. En el sureste de EE. UU., Brasil e Italia, la especie T. mentagrophytes es el tercer agente causal más frecuente de dermatofitosis. En España el agente etiológico más aislado en veterinaria es Microsporum canis y en medicina humana Trichophyton rubrum 9-12.
Algunos organismos fúngicos se identifican como etapa sexual (teleomorfo) o etapa de forma asexual o conidial (anamorfo), si la etapa sexual no está identificada. La clasificación antigua englobaba a todos los organismos solo como T. mentagrophytes. Ahora se han organizado en el denominado complejo T. mentagrophytes. El complejo Trichophyton mentagrophytes está compuesto por el estadio teleomorfo, Arthroderma benhamiae, A. vanbreuseghemii y A. simii, o el estadio anamorfo, T. interdigitale, T. erinacei y T. quinckeanum13.
Con los métodos tradicionales de cultivo de hongos, comúnmente se obtiene un diagnóstico de complejo T. mentagrophytes. Si bien sería mejor identificar el organismo mediante identificación molecular, muchos estudios más antiguos (y algunos más nuevos) todavía se refieren a él como complejo T. mentagrophytes en lugar de identificarlo en una subclase. En el caso aquí expuesto no se identificó la subespecie.
Los tipos de pruebas moleculares necesarias para identificar estas subclases incluyen la PCR y la espectrometría de masas asociada a matriz (MALDI-ToF). Este tipo de pruebas moleculares se realizan más comúnmente en laboratorios de investigación o de diagnóstico especializados.
En un estudio de 202313, donde se analizaron 64 perros infectados por T. mentagrophytes de EE. UU., uno de los datos obtenidos fue la alta incidencia del grupo de perros englobados en las razas deportistas, siendo el primero el Labrador retriever, el cual se consideró más predispuesto por utilizarse para la cacería en este país. En un estudio similar en Italia, se observaron similares resultados, con un 67 % de perros del grupo deportista afectados por este dermatofito14.
Otro grupo de razas afectadas son los Terrier, ya que suelen cazar roedores, los cuales son reservorios naturales de T. mentagrophytes14. En un estudio en el Reino Unido se identificó el Jack Russell terrier, con un 58 % de prevalencia para la infección por T. mentagrophytes mientras que en las razas mixtas se situó en un 19.6 %9. En este estudio de Reino Unido9 también se observó estacionalidad en este tipo de infección, con un marcado aumento en otoño, sobre todo en el mes de octubre14,15.
En España no existen razas definidas más predispuestas, sin ser los Yorkshire terrier, que presentan mayor prevalencia en sí por sus características del pelaje, que mantiene más la humedad por su densidad y longitud19.
Otros estudios de EE. UU. sitúan los picos de infectividad en los meses de noviembre y diciembre16. Se cree que los aumentos de la incidencia coinciden con una mayor densidad en la población de roedores y su actividad17. En el caso aquí expuesto el contagio ocurrió en el mes de enero, lo cual coincide con el cálido invierno en Canarias y la raza, al ser Mestiza de tamaño pequeño-mediano, podría ser más similar a un Terrier.
El reservorio natural del complejo T. mentagrophytes son los roedores; debido a esto los perros suelen presentar las lesiones en la zona de la nariz (normalmente en forma de granuloma o querion dermatofítico), ya que olisquean el suelo y los objetos y acercan la cabeza a las zonas donde hay esporas fúngicas. Esto también explica mayor contagio en perros de deporte, sobre todo cazadores o los Terrier, cuyo instinto cazador de roedores y alimañas es mayor13.
En numerosos estudios se describen las zonas más afectadas, siendo el hocico, la cabeza y las orejas las localizaciones más típicas descritas, aunque algunos artículos hablan de una alta incidencia en las patas (Figura 7) 10,18.
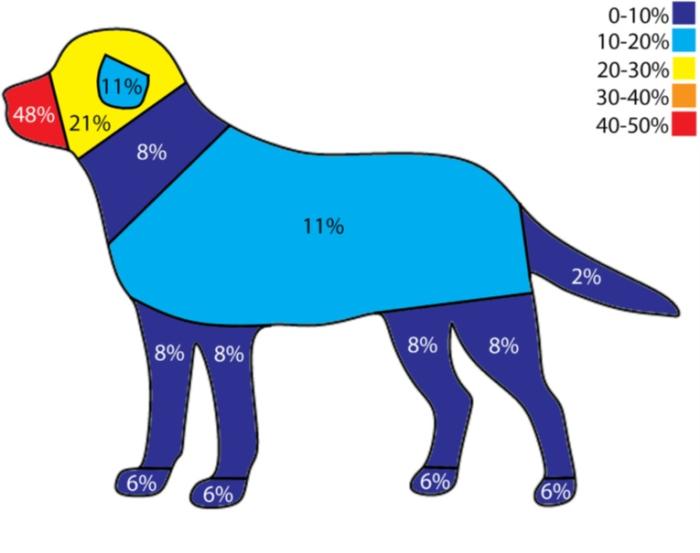
Figura 7. Mapa de distribución de T. mentagrophytes (Fuente: J. Pieper, Vet Derm, 2023).
En el caso aquí expuesto, la localización fue troncal, que según el estudio de 202313 habla de un 11 % de incidencia en esta región anatómica, pudiendo ser la conducta de la paciente de frotarse en el césped artificial que tenían en el jardín, la fuente de contagio. En este material, podrían haber quedado esporas fúngicas de roedores, como ratones, ratas o erizos, y luego entrar en contacto con la piel y el pelo del animal con microtraumatismos debido a la rigidez del material plástico (efecto exfoliativo).
En cuanto a los tratamientos utilizados, es frecuente el uso de la terapia tópica, sobre todo para evitar la contaminación del entorno. La literatura habla de la eficacia de gran variedad de ingredientes activos presentes en champús, utilizados para el tratamiento de la infección por el complejo T. mentagrophytes19.
También se han descrito en multitud de casos el uso de cremas y pomadas, junto con los champús, tanto en lesiones localizadas como multifocales19.
Con respecto a los tratamientos sistémicos en general itraconazol y ketoconazol presentan similar eficacia, mientras que se ha observado una reducción de la susceptibilidad al fluconazol11, 20-28. Se ha observado un aumento en el uso de terbinafina sistémica en el tratamiento de esta enfermedad y con ello se han descrito resistencias debido a mutaciones en la escualeno epoxidasa, que explicaría la baja tasa de resolución con terapias sistémicas a base de este fármaco22,29-31.
Es de vital importancia no administrar glucocorticoides en pacientes donde no estemos totalmente seguros, mediante pruebas diagnósticas fiables, de que no existe una infección por dermatofitos, puesto que los pacientes inmunodeprimidos por una iatrogenia (como en este caso), son muchísimo más susceptibles a una mayor diseminación cutánea o incluso profunda si hubiera una lesión de entrada.
Existen casos descritos de infecciones severas en pacientes con hiperadrenocortisolismo, donde las lesiones son mucho más extensas y graves, lo que pone de manifiesto la importancia de la inmunocompetencia del paciente32.
Existe una forma clínica descrita en el completo T. mentagrophytes en forma de granuloma, denominado granuloma dermatofítico. Las lesiones granulomatosas se caracterizan por nódulos firmes que se pueden ulcerar y drenar, y suelen localizarse en la zona de belfos, cigomáticos y barbilla (cara principalmente). También se han descrito algunos granulomas causados por Microsporum canis en varios gatos y perros, sobre todo en Yorkshire terrier como ya se comentó, que, junto con los gatos persas, presentan una predisposición a la dermatofitosis33-38.
En este caso, además del tricograma, la clave fue la citología con cinta de acetato con la que se pudieron visualizar las hifas fúngicas para justificar aún más el cultivo fúngico y bacteriano, por lo que las pruebas sencillas y baratas que se pueden realizar el día de la primera visita, son esenciales para no errar en el diagnóstico y aplicar terapias, como en este caso, que pudiesen empeorar el cuadro o permitir la diseminación de las esporas en los hogares de las mascotas, con la consecuente infección zoonótica del resto de habitantes.
Concretamente con este caso clínico, se puede intuir la gran repercusión de este tipo de enfermedades no controladas, como en el caso de la infección en una mujer embarazada (la tutora), pues no pueden recibir la mayoría de los tratamientos que existen en medicina y en casos de inmunodepresión podría tener consecuencias más peligrosas para la madre y el bebé.
En conclusión, partiendo de un diagnóstico fiable y basado en la evidencia científica, podremos identificar el foco de contagio, usar terapias no iatrogénicas y controlar en todo momento la diseminación de esporas en el ambiente y sobre todo, informar/educar a los tutores sobre hábitos de higiene dentro del domicilio con mascotas convivientes.
Bibliografía
- Weitzman I, Summerbell RC. The dermatophytes. Clin Microbiol Rev. 1995 Apr;8(2):240-59.
- Foster KW, De Hoog GS. Atlas of Clinical Fungi. 2nd ed. Utrecht: Centra Albureau Voor Schimmelcultures; 2000. p. 154-7.
- Larone DH. Medically Important Fungi: A Guide to Identification. 5th ed. Washington: ASM Press; 2011. p. 209-13.
- Ajello L, Padhye AA, Chandler FW, McGinnis MR. Medical Mycology. 2nd ed. Philadelphia: Lea & Febiger; 1987. p. 285-7.
- Rippon JW. Medical Mycology: The Pathogenic Fungi and the Pathogenic Actinomycetes. 3rd ed. Philadelphia: W.B. Saunders Company; 1988. p. 169-75.
- Kwon-Chung KJ, Bennett JE. Medical Mycology. Philadelphia: Lea & Febiger; 1992. p. 110-8.
- Elewski BE. Onychomycosis: Pathogenesis, Diagnosis, and Management. Clin Microbiol Rev. 1998 Apr;11(2):415-29.
- Gupta AK, Cooper EA. Update in antifungal therapy of dermatophytosis. Mycopathologia. 2008;166(5-6):353-67.
- Pinter LJ, Štritof Z. A retrospective study of Trichophyton mentagrophytes infection in dogs (1970-2002). Vet Arhiv. 2004;74:251-60.
- Wright AI. Ringworm in dogs and cats. J Small Anim Pract. 1989;30:242-9.
- Katiraee F, Kouchak Kosari Y, Soltani M, Shokri H, Minooieanhaghighi MH. Molecular identification and antifungal susceptibility patterns of dermatophytes isolated from companion animals with clinical symptoms of dermatophytosis. J Vet Res. 2021;65:175-82.
- Hernandez-Bures A, Pieper JB, Bidot WA, O'Dell M, Sander WE, Maddox CW. Survey of dermatophytes in stray dogs and cats with and without skin lesions in Puerto Rico and confirmed with MALDI-TOF MS. PLoS One. 2021;16
- Pieper JB, Bowden DG, Berger DJ, Noxon JO, Grable SL, Campbell K. Trichophyton mentagrophytes complex: A retrospective study of 64 dogs from the Central United States (1997–2020). Vet Dermatol. 2023;34(4):310-7.
- Mancianti F, Nardoni S, Cecchi S, Corazza M, Taccini F. Dermatophytes isolated from symptomatic dogs and cats in Tuscany, Italy during a 15-year-period. Mycopathologia. 2003;156:13-8.
- Lewis DT, Foil CS, Hosgood G. Epidemiology and clinical features of dermatophytosis in dogs and cats at Louisiana State University: 1981-1990. Vet Dermatol. 1991;2:53-8.
- Kaplan W, Ivens MS. Observations on the seasonal variations in incidence of ringworm in dogs and cats in the United States. Sabouraudia. 1962;1:91-102.
- Singleton GR, Krebs CJ. The secret world of wild mice. In: Fox JG, Davisson MT, Quimby FG, Barthold SW, Newcomer CE, Smith AL, editors. The mouse in biomedical research. 2nd ed. Amsterdam: Elsevier; 2007. p. 25-46.
- Georg LK, Roberts CS, Menges RW, Kaplan W. Trichophyton mentagrophytes infections in dogs and cats. J Am Vet Med Assoc. 1957;130:427-32.
- Moriello KA. In vitro efficacy of shampoos containing miconazole, ketoconazole, climbazole or accelerated hydrogen peroxide against Microsporum canis and Trichophyton species. J Feline Med Surg. 2017;19:370-4.
- Begum J, Kumar R. Prevalence of dermatophytosis in animals and antifungal susceptibility testing of isolated Trichophyton and Microsporum species. Trop Anim Health Prod. 2020;53:3.
- Gnat S, Łagowski D, Nowakiewicz A, Osińska M, Kopiński Ł. Population differentiation, antifungal susceptibility, and host range of Trichophyton mentagrophytes isolates causing recalcitrant infections in humans and animals. Eur J Clin Microbiol Infect Dis. 2020;39:2099-113.
- Łagowski D, Gnat S, Nowakiewicz A, Osińska M, Dyląg M. Intrinsic resistance to terbinafine among human and animal isolates of Trichophyton mentagrophytes related to amino acid substitution in the squalene epoxidase. Infection. 2020;48:889-97.
- Itoi S, Kano R, Hasegawa A, Kamata H. In vitro activities of antifungal agents against clinical isolates of dermatophytes from animals. J Vet Med Sci. 2012;74:1067-9.
- Siqueira ER, Ferreira JC, dos Santos PR, Sicchiroli Lavrador MA, Candido RC. Dermatophyte susceptibilities to antifungal azole agents tested in vitro by broth macro and microdilution methods. Rev Inst Med Trop Sao Paulo. 2008;50:1-5.
- Mota C, Miranda K, de Aquino LJ, Costa CR, Hasimoto e Souza LK, Passos XS, et al. Comparison of in vitro activity of five antifungal agents against dermatophytes, using the agar dilution and broth microdilution methods. Rev Soc Bras Med Trop. 2009;42:250-4.
- Fernandez-Torres B, Carrillo A, Martin E, Del Palacio A, Moore MK, Valverde A, et al. In vitro activities of 10 antifungal drugs against 508 dermatophyte strains. Antimicrob Agents Chemother. 2001;45:2524-8.
- Barros ME, Hamdan JS. Determination of susceptibility/resistance to antifungal drugs of Trichophyton mentagrophytes isolates by a macrodilution method. Can J Microbiol. 2005;51:983-7.
- Aneke CI, Rhimi W, Otranto D, Cafarchia C. Comparative evaluation of E-test and CLSI methods for Itraconazole, fluconazole and ketoconazole susceptibilities of Microsporum canis strains. Mycopathologia. 2020;185:495-502.
- Singh A, Masih A, Khurana A, Singh PK, Gupta M, Hagen F, et al. High terbinafine resistance in Trichophyton interdigitale isolates in Delhi, India harbouring mutations in the squalene epoxidase gene. Mycoses. 2018;61:477-84.
- Gnat S, Łagowski D, Nowakiewicz A, Dyląg M, Osińska M. Complementary effect of mechanism of multidrug resistance in Trichophyton mentagrophytes isolated from human dermatophytoses of animal origin. Mycoses. 2021;64:537-49.
- Kaufmann R, Blum SE, Elad D, Zur G. Comparison between point-of-care dermatophyte test medium and mycology laboratory culture for diagnosis of dermatophytosis in dogs and cats. Vet Dermatol. 2016;27:284-e68.
- Miró EM, Sánchez NP. Cutaneous Manifestations of Infectious Diseases. In: Atlas of Dermatology in Internal Medicine. New York: Springer; 2012.
- Medleau L. Recently described dermatoses. Vet Clin North Am Small Anim Pract. 1990;20(6):1623-32.
- Tuttle PA. Deep dermatophytosis in a cat. J Am Vet Med Assoc. 1983;183:1106-8.
- Medleau L, Rakich PM. Microsporum canis pseudomycetomas in a cat. J Am Anim Hosp Assoc. 1994;30:573-6.
- MacKay BM, Johnstone I, O’Boyle DA, et al. Severe dermatophyte infections in a dog and cat. Aust Vet Pract. 1997;27:86-90.
- Miller WH, Goldschmidt MH. Mycetomas in the cat caused by a dermatophyte: a case report. J Am Anim Hosp Assoc. 1986;22:255-60.
- Castellanos Londoño IC. Caracterización morfológica y sensibilidad antimicrobiana en dermatitis bacterianas y micóticas en el perro. Bogotá: Universidad de la Salle; 2011.
 by Multimédica
by Multimédica