Dermatitis pustular estéril asociada a leishmaniosis canina: presentación clínica y manejo terapéutico. Reporte de dos casos clínicos
Resumen breve
La dermatitis pustular estéril (DPE) asociada a leishmaniosis canina (LC) es una presentación muy poco habitual de esta enfermedad. En este trabajo se describe y discute, el diagnóstico y tratamiento en dos pacientes caninos, con una evolución favorable, pero con unas necesidades a nivel terapéutico distintas para llegar al control de los signos clínicos. Se resalta la importancia de la terapia inmunomoduladora para controlar la sintomatología cutánea refractaria a los tratamientos convencionales.Índice de contenidos
Introducción
La leishmaniosis es una enfermedad parasitaria que en Europa está causada por un protozoo parásito del género Leishmania (clase Kinetoplastea, familia Trypanosomatidae). El ciclo natural de la infección implica a un hospedador vertebrado (cánidos principalmente) y a un vector del género Phlebotomus (orden Diptera, familia Psychodidae, subfamilia Phlebotominae). La respuesta inmunitaria juega un papel muy importante en la aparición de las diferentes manifestaciones clínicas dermatológicas y/o sistémicas, siendo las lesiones cutáneas la manifestación más común (81-89 % de los perros enfermos). En la LC hay presentaciones más habituales o típicas como la dermatosis descamativa, dermatosis ulcerativa que afecta a las prominencias óseas y onicogriposis, y presentaciones menos habituales como la dermatitis del plano nasal, dermatitis nodular subcutánea o la dermatosis pustular1-2.
A finales de los años 80 se hizo el primer reporte de DPE asociada a LC3 y desde entonces se han descrito más casos, pero siempre con la dificultad de relacionar y comprobar esta presentación clínica a la LC. Más recientemente, se han realizado estudios retrospectivos describiendo las características clínico-patológicas de esta presentación en concreto4-5, intentando encontrar la asociación con evidencia científica entre ambas. Aunque no se conoce con exactitud la causa, se sospecha que la leishmaniosis podría ser un factor de riesgo para el desarrollo de una DPE1,4-5.
Caso clínico 1
Un American staffordshire terrier macho no castrado de 1.5 años y 30 kg de peso, se presentó a consulta dermatológica con un diagnóstico de leishmaniosis estadio II con signos clínicos dermatológicos persistentes y refractarios al tratamiento administrado hasta el momento.
El paciente había sido adoptado un año antes, desde entonces su hábitat fue de exterior en un jardín, sin ningún otro animal de compañía, vacunado regularmente, incluida la vacunación frente a leishmaniosis 6 meses antes de la consulta, desparasitado correctamente, externa e internamente. No se describieron lesiones que sugirieran zoonosis por parte de los tutores.
Dos meses antes de la consulta, se le diagnosticó leishmaniosis estadio II. En aquel momento, según la descripción de los tutores, el animal presentaba fiebre, letargia y, a nivel dermatológico, lesiones pruriginosas (6-7 pVAS), papulopustulares, eritematosas, descamativas generalizadas, afectando incluso a las almohadillas plantares, ocasionándole cojera. Los análisis previos realizados incluyeron: una serología cuantitativa para leishmaniosis positiva (IFI 1/320), serología cualitativa para ehrlichiosis, borreliosis, dirofilariosis y anaplasmosis con resultados negativos, un hemograma con anemia normocítica normocrómica leve, hematocrito del 33.5 % (ref: 35-56 %), leucocitosis leve-moderada neutrofílica, con 25000 leucocitos/µl (ref: 6100-17300 leucocitos/µl) y sin alteraciones en los parámetros bioquímicos.
Los fármacos administrados a posteriori de la aparición de los signos clínicos fueron: antibióticos por sospecha de enfermedad vectorial y foliculitis bacteriana (doxiciclina 5 mg/kg cada 24 h, 20 días y amoxicilina clavulámico 20 mg/kg cada 12 h, durante 15 días hasta el momento de la consulta) y antiinflamatorios (meloxicam 1 mg/kg cada 24 h como antitérmico, inicialmente durante unos 5 días y, posteriormente, prednisona 0.5 mg/kg cada 24 h como antiprurítico 1 semana. Paralelamente se administró al paciente el tratamiento específico de leishmaniosis, antimoniato de meglumina 100 mg/kg cada 24 h durante 30 días (cesado un mes antes de la consulta) y alopurinol 10 mg/kg cada 12 h, que se seguía administrando. La respuesta a estos tratamientos fue parcial, mejorando en cierto grado el estado general y las alteraciones en el hemograma y proteinograma, pero en cuanto a las lesiones dermatológicas, persistió el prurito, las lesiones pustulocostrosas, que únicamente mejoraron parcialmente con la administración de los glucocorticoides. Tópicamente, se estaban aplicando baños periódicamente con un champú a base de clorhexidina.
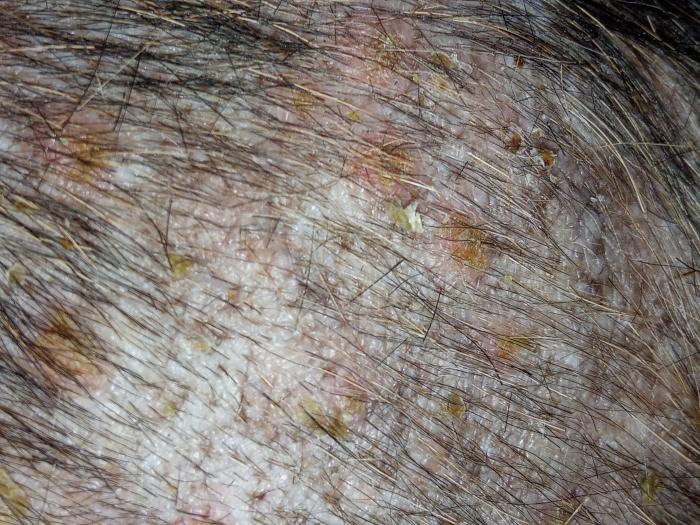
El día de la consulta dermatológica, en el examen físico solo se detectó linfadenopatía generalizada moderada y un cierto edema en las extremidades posteriores, que no le ocasionaba molestias. En el examen dermatológico, se apreció descamación leve generalizada y lesiones papulopustulares intactas muy discretas y collaretes epidérmicos (Figura 1).
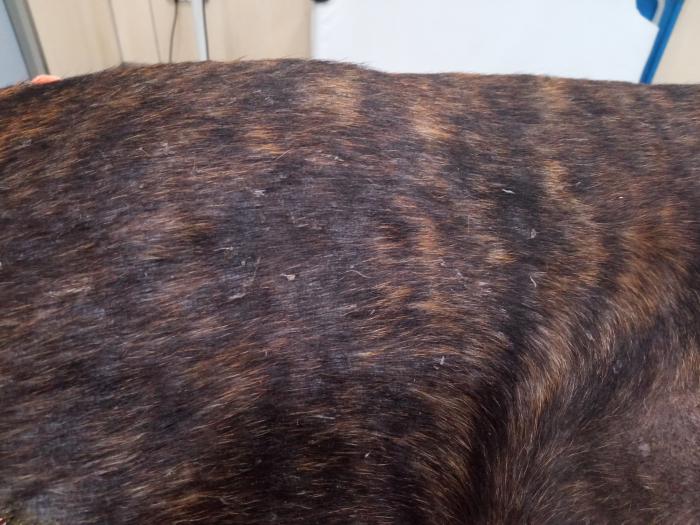
Figura 1.
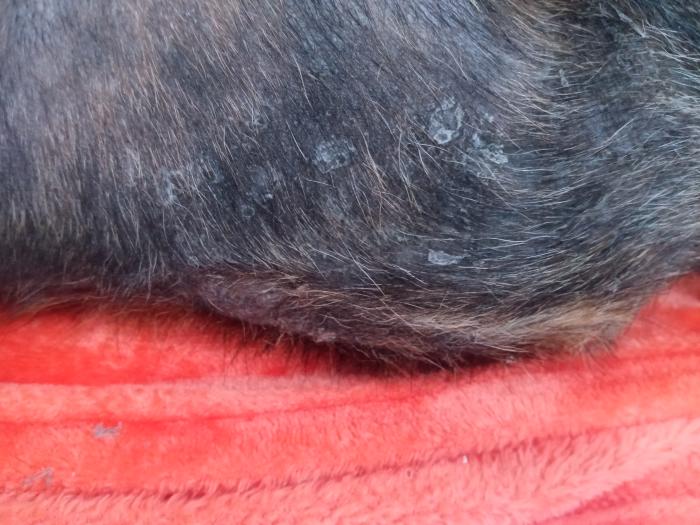
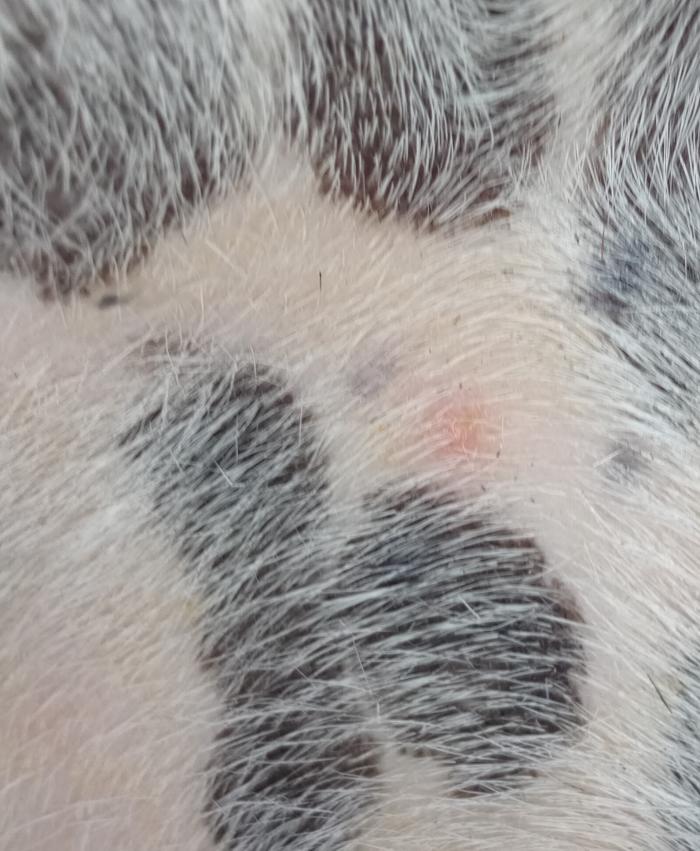
El prurito fue evidente durante la consulta tal y como habían descrito por los tutores. Un examen más en detalle con el dermatoscopio evidenció eritema, descamación, collaretes-costras y lesiones papulopustulares intactas no tan evidentes a simple vista (Figura 2).
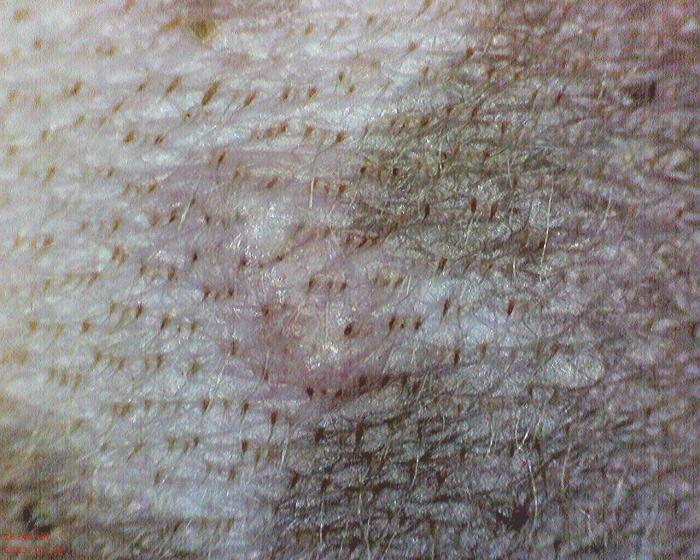
Figura 2.
En el diagnóstico diferencial se planteó la posibilidad de una foliculitis bacteriana, demodicosis, dermatofitosis, leishmaniosis pustular, otras causas de dermatitis pustulosas como el pénfigo foliáceo, pustulosis neutrofílicas o eosinofílicas estériles, así como una reacción medicamentosa, aunque poco probable, ya que todos los fármacos fueron administrados con posterioridad a la aparición de los signos clínicos.
Como pruebas diagnósticas complementarias, se realizaron raspados que resultaron negativos, en la tricografía no se observaron alteraciones en la estructura del pelo y se expusieron las lesiones a la lámpara de Wood sin observarse fluorescencia. Se realizó una analítica completa (hemograma, bioquímica, proteinograma, serología ELISA frente a leishmaniosis y urianálisis completo con UPC) sin alteraciones a destacar, incluso la serología frente a leishmaniosis fue negativa en este momento (IFI 1/20).
En la citología de las lesiones, se pudo observar la presencia de abundantes PMNN, algún macrófago con algún amastigote de Leishmania presente en su interior (Figura 3), así como algún queratinocito acantolítico y alguna bacteria cocoide extracelular.
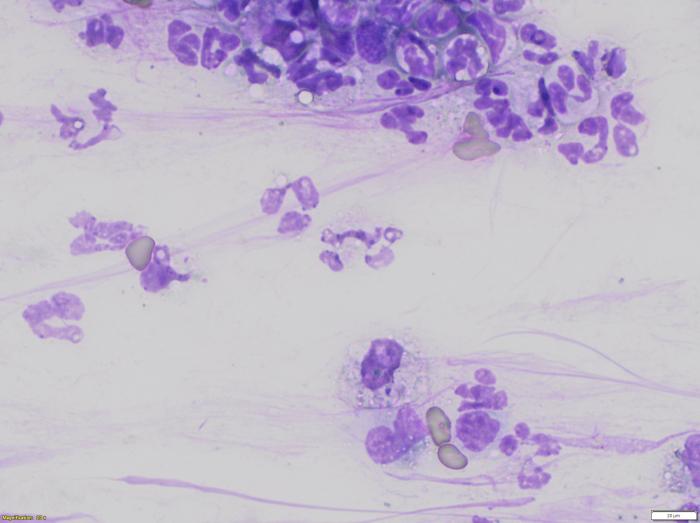
Figura 3.
Se llevó a cabo una biopsia bajo sedación medetomidina/vatinoxano 1 mg/m2 (Zenalpha® 0.5 mg/ml + 10 mg/ml, Dechra, Países bajos), con punch de 8 mm de las lesiones intactas presentes. El diagnóstico histopatológico fue de una dermatitis hiperplásica, plasmática, neutrofílica, linfocítica y mastocítica perivascular e insterticial con formación de pústulas subcorneales, pero en pequeñas áreas foliculitis y furunculosis (Figura 4).
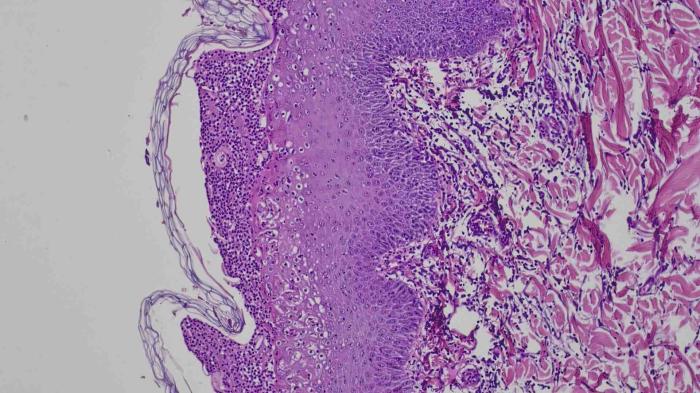
Figura 4.
Estos cambios podrían corresponderse con una manifestación de leishmaniosis, ya diagnosticada en este paciente, que a su vez podría haber favorecido una infección bacteriana superficial y profunda. En las muestras examinadas no se observaron amastigotes de Leishmania, pero sí algunos queratinocitos acantolíticos en las pústulas en un número reducido, lo que hace que el diagnóstico de pénfigo foliáceo resulte menos probable. La tinción PAS de la muestra resultó negativa, así como el cultivo realizado del que no se obtuvo crecimiento alguno. La foliculitis y la furunculosis se atribuyeron al autotraumatismo debido al prurito.
Después de descartar el origen infeccioso de las lesiones, el diagnóstico clinicopatológico de este paciente fue de le DPE asociada a LC o, lo que podríamos, llamar leishmaniosis pustular.
El tratamiento se basó en la continuación en la administración de alopurinol 10 mg/kg cada 12 h (Zyloric® 300 mg comprimidos, Faes Farma España). Se añadió domperidona 1 mg/kg cada 24 h durante 30 días (Leishguard solución oral®, Ecuphar Veterinaria, España), prednisolona 1.2 mg/kg cada 24 h (Prednicortone® 20 mg comprimidos, Dechra, Países bajos). En una semana hubo regresión total de las lesiones y el animal se mostraba aparentemente normal. Se revisó al paciente cada 10 días aproximadamente, disminuyendo la dosis y frecuencia de manera progresiva de los glucocorticoides, evaluando siempre la no recidiva de las lesiones en cada fase de modificación de la medicación. A los dos meses el paciente estaba controlado a dosis de prednisolona a dosis de 0.3 mg/kg cada 48 h, sin recidivas de los signos dermatológicos ni sistémicos. Al cuarto mes, se pudo cesar el tratamiento con prednisolona, manteniéndose la administración de alopurinol durante 6 meses y la domperidona a ciclos de cada 4 meses. Siete meses después, el paciente se mantiene asintomático con controles periódicos regulares.
Caso clínico 2
Cruce de Yorkshire terrier macho castrado de unos 12 años aproximadamente y 5.5 Kg de peso.
Rescatado de una protectora por una cuidadora del mismo centro, con un historial previo de leishmaniosis estadio II con lesiones dermatológicas pruriginosas (pVAS 5-6/10) graves, que describían como heridas costrosas de manera generalizada, descamación y mal estado general. Los análisis realizados para el diagnóstico revelaron anemia normocítica-normocrómica moderada con un hematocrito del 27.9 % (ref: 35-56 %), leucocitosis neutrofílica con 19.000 leucocitos/µl (ref: 6100-17300 leucocitos/µl), hiperproteinemia de 96 g/l (ref: 40-85 g/l) y gammapatía policlonal con hipergammaglobulinemia del 40.35 % (ref: 5-12 %).
Se trató al paciente con antimoniato de meglumina vía subcutánea, alopurinol, amoxicilina-clavulámico y prednisona vía oral en distintas ocasiones con dosis, periodos y frecuencias variables, así como con baños con ketoconazol y clorhexidina de manera periódica, y pomada con sulfadiazina argéntica. La respuesta fue parcial según la tutora.
Desde la adopción, 6 meses previos a la consulta, solo se administraba el alopurinol y se bañaba al paciente regularmente con champús a base de clorhexidina. La tutora no observó resolución de la sintomatología dermatológica persistiendo las lesiones costrosas y descamación, pero sí mejoró su estado general desde entonces, en que el paciente estuvo en un piso con otro perro sin lesiones y se le empezó a alimentar con pienso de gama alta y comida casera. No se le administró ningún tratamiento profiláctico (vacunas o antiparasitarios).
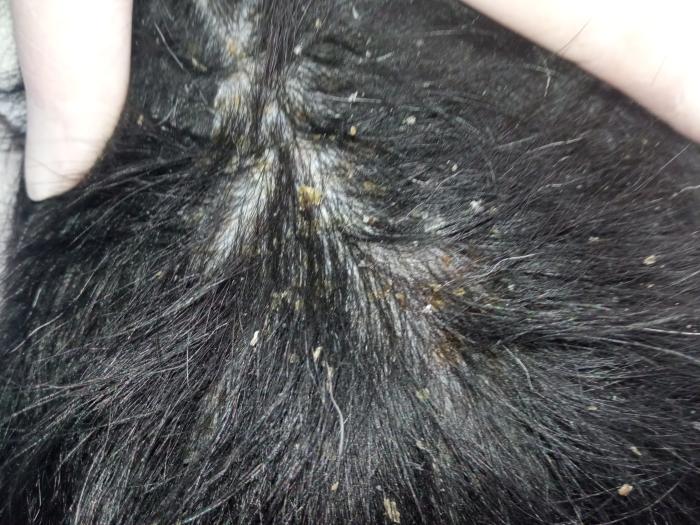
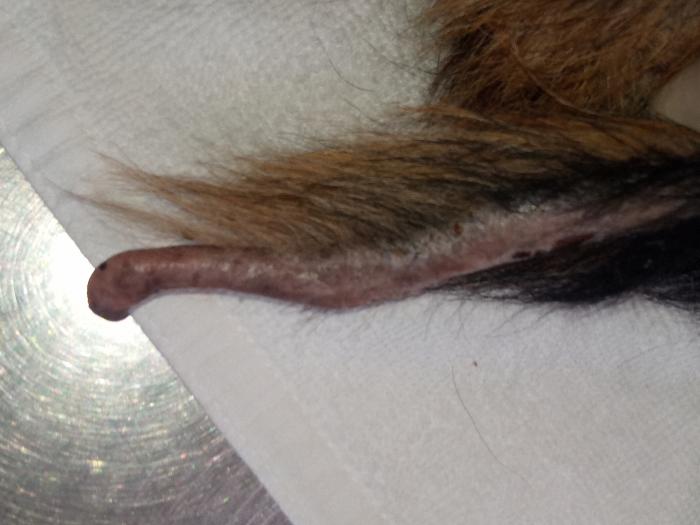
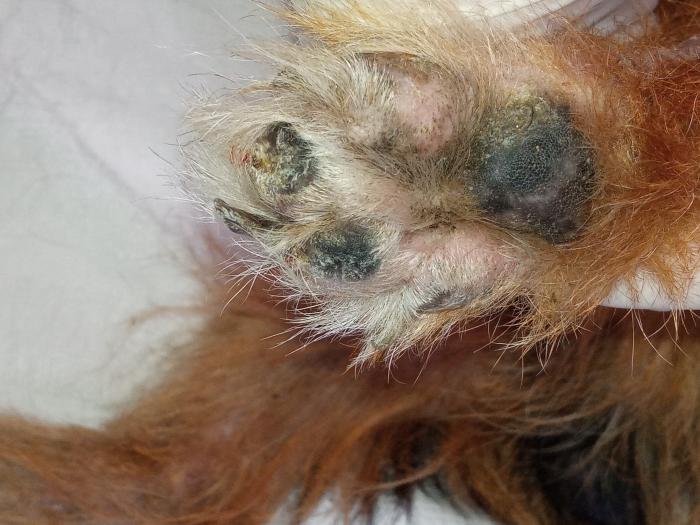
En la exploración física, se observó linfadenomegalia generalizada y una condición corporal 3/5. En la exploración dermatológica, se pudieron observar lesiones cicatriciales en cola y orejas atribuidas a lesiones, probablemente vasculares, anteriores, lesiones papulopustulosas intactas, collaretes y costras generalizadas, hiperqueratosis plantar y onicodistrofia (Figura 5).
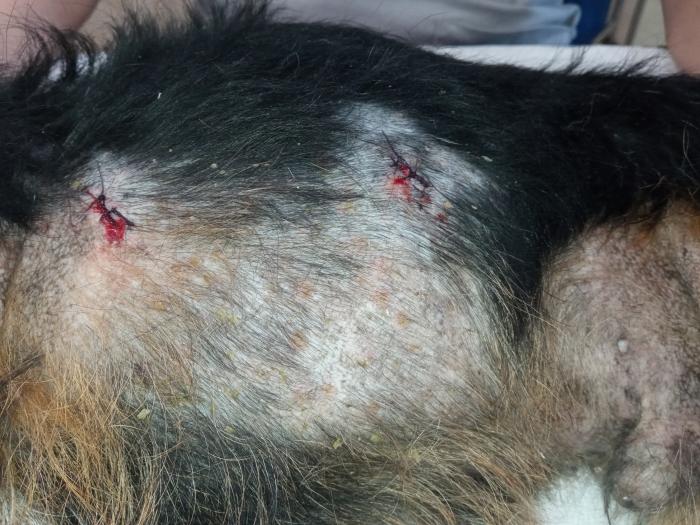
Figura 5.
En el diagnóstico diferencial se contempló la posibilidad de una foliculitis bacteriana, demodicosis, dermatofitosis, vasculitis, reacción farmacológica, leishmaniosis pustular asociada a otras manifestaciones clínicas de esta, pénfigo foliáceo y otras causas de dermatitis pustulosas neutrofílicas o eosinofílicas estériles.
Se realizó una analítica completa que incluyó un hemograma y bioquímica completos, un proteinograma, serología cualitativa frente a leishmaniosis, serología cuantitativa frente a Anaplasma phagocytophilum, Anaplasma platys, Borrelia burgdorferi, Ehrlichia canis y Ehrlichia ewingii, un urianálisis completo con UPC, con alteraciones solo en la serología positiva frente a leishmaniosis (IFI 1/320), y una gammapatía policlonal (proteínas de 79 g/l y gammaglobulinas de 15.78 g/l). Como pruebas diagnósticas dermatológicas, se llevaron a cabo raspados, tricografía y exposición a la lámpara de Wood sin observar alteraciones; se realizó una citología de una pústula intacta en la que se observaron abundantes neutrófilos, con presencia de algunos queratinocitos acantolíticos (Figura 6) y un cultivo de una de las pústulas sin crecimiento bacteriano ni fúngico.
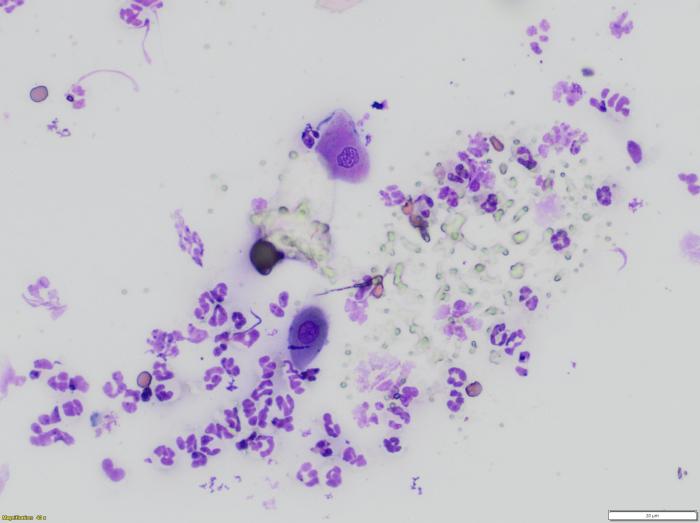
Figura 6.
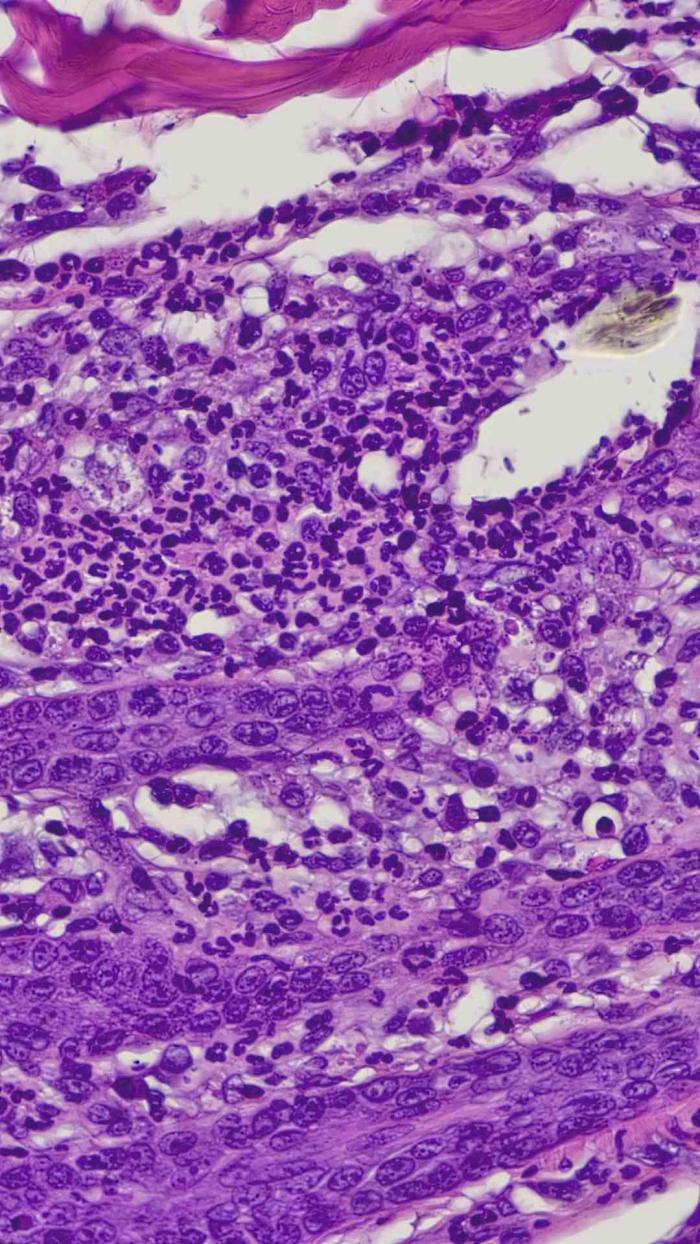
Se recogió muestra para un examen histopatológico bajo sedación del paciente con medetomidina/vatinoxano 1 mg/m2 (Zenalpha®0,5 mg/ml + 10 mg/ml, Dechra, Países Bajos) y utilizando un punch de 8 mm. El diagnóstico histopatológico fue de una dermatosis pustular, con pústulas y costras neutrofílicas y eosinofílicas extensas con acantolisis focal leve. Dermatitis perivascular y periadnexal subaguda, moderada con amastigotes de Leishmania intralesionales dentro de los macrófagos localizados en la dermis (Figura 7), por lo tanto, el cuadro clínico era compatible con una forma pustular estéril o que no responde a antibióticos de una leishmaniosis pustular.
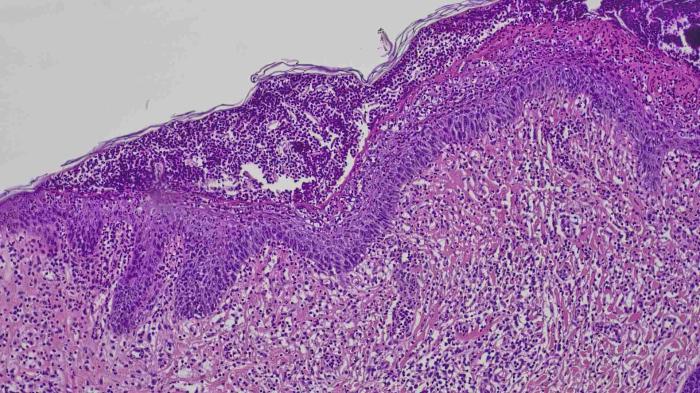
Figura 7.
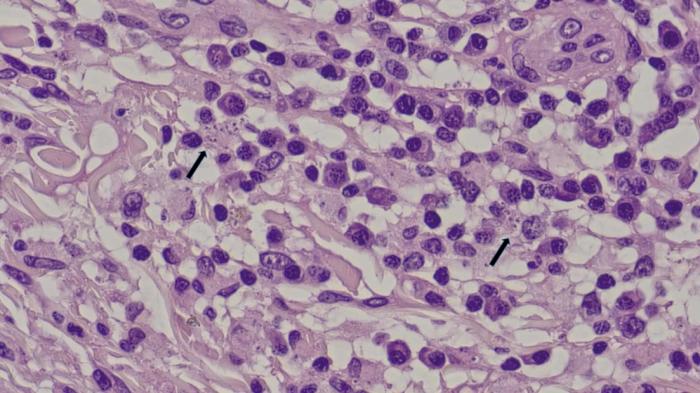
No se observaron signos histológicos que sugirieran una reacción medicamentosa, pero la posibilidad no puede excluirse desde el punto de vista histológico y requería de una correlación con la clínica.
El diagnóstico fue de leishmaniosis asociada a dermatitis pustular estéril.
El tratamiento inicial se basó en la administración de alopurinol 10 mg/kg cada 12 h (Zyloric®100 mg comprimidos, Faes Farma, España). Antimoniato de meglumina vía subcutánea 100 mg/kg cada 24 h durante 30 días (Antishmania®300 mg/ml solución inyectable, Fatro Iberia, España). Para el control del prurito, se bañó al paciente periódicamente con un champú calmante cada 48 h (Douxo Calm®, Ceva, España). A las tres semanas de tratamiento, se observaron mejoras en el estado general, pero persistían las lesiones papulopustulares, collaretes, costras y prurito, por lo que se inició tratamiento con prednisolona 1.5 mg /kg cada 24 h (Prednicortone®5 mg comprimidos, Dechra, Países bajos), a los que el paciente respondió rápidamente en cuanto a las lesiones dermatológicas, pero le ocasionaba importantes efectos adversos, principalmente poliuria, polidipsia y heces blandas (score fecal 5/7). Se optó a las tres semanas por disminuir la dosis a 1 mg/kg cada 24 h de prednisolona y asociar a la terapia inmunomoduladora la ciclosporina A (Cyclavance solución oral®, Virbac, España) a dosis de 5 mg cada 24 h vía oral. Esta terapia fue bien tolerada por el paciente, lo que permitió al cabo de un mes disminuir la dosis de prednisolona a 0.5 mg cada 48 h. En este caso, no fue posible reducir o eliminar tratamientos, ya que esto resultaba en la reaparición de los signos dermatológicos, manteniéndose estables los parámetros analíticos.
Discusión
Este trabajo describe dos perros con un diagnóstico de LC estadio II simultáneamente a una DPE, en ambos casos, las lesiones cutáneas fueron refractarias al tratamiento convencional con alopurinol y antimoniato de meglumina como tratamiento específico de la leishmaniosis, además de no obtenerse respuesta a los antibióticos administrados ante la sospecha de pioderma bacteriana. En este trabajo, se lleva a cabo una revisión sobre la asociación de estas dos entidades clínicas, mostrando el desafío que puede suponer el diagnóstico y manejo de estos pacientes.
La leishmaniosis canina es una enfermedad infecciosa zoonótica causada por Leishmania infantum común en áreas endémicas y con una patogenia compleja. El resultado de la infección y, por tanto, de la clínica y evolución de la enfermedad dependerá de factores propios del huésped (antecedentes genéticos, respuesta inmunitaria celular y humoral, entorno de citocinas, enfermedades concurrentes) y de la virulencia del parásito6-8.
Las lesiones cutáneas son los signos clínicos más frecuentes en la LC y son muy pleomórficas desde el punto de vista clínico e histopatológico1-5. Las presentaciones clínicas más habituales son la dermatitis exfoliativa, ulcerativa, nodular y papular entre otros, pero también se ha descrito una forma pustulosa, que es poco común1-5. La relación causal entre DPE y LC no está clara, pero podría considerarse a la LC como un factor de riesgo para el desarrollo de esta presentación clínica1,4-5. Hay estudios retrospectivos recientes que describen las características clinicopatológicas de los perros con infección por LC y dermatitis pustulosa4, así como otros que demuestran esta asociación, al menos en áreas endémicas para leishmaniosis5.
Los signos clínicos dermatológicos observados en estos pacientes serán papulopústulas con un halo eritematoso descrito según algunos reportes, collaretes epidérmicos y costras, con posible configuración anular o cíclica, distribuidas de manera simétrica y con presencia de prurito de intensidad variable1,4-5. En los pacientes descritos, las lesiones fueron muy discretas en el primer caso y, en el segundo caso, las lesiones eran más similares a lo que se describe en la bibliografía; el prurito en ambos era moderado-alto. En zonas endémicas para leishmaniosis, se debe considerar esta enfermedad como parte del diagnóstico diferencial de la dermatitis pustular1,4-5. Así mismo, se deberán descartar otras patologías que cursen con este signo clínico como la pioderma superficial, dermatofitosis, demodicosis u otras dermatitis pustulosas inmunomediadas como pénfigo foliáceo, dermatitis neutrofílicas o eosinofílicas estériles y reacciones medicamentosas1. Ayudará, en este sentido, hacer un protocolo diagnóstico exhaustivo, demostrando la esterilidad de las lesiones y descartando las demás alteraciones del diferencial.
El diagnóstico de la leishmaniosis canina se basa en utilizar varias herramientas que deben interpretarse en el contexto de las características clínicas, es decir, una combinación de hallazgos clínicos, pruebas serológicas y confirmación parasitológica9-13. Las pruebas serológicas (cuantitativa y cualitativa) para Leishmania spp, pueden confirmar la infección, aunque no siempre se correlacionan con la gravedad de la enfermedad ni con los signos clínicos que pueda presentar el paciente. Normalmente, los niveles altos de anticuerpos confirman la enfermedad, pero se debe tener en cuenta que, sin embargo, los niveles de anticuerpos negativos-bajos no descartan la LC, ni los resultados débilmente positivos siempre se correlacionan con la gravedad de la enfermedad clínica9-13. Por lo tanto, la detección del parásito en los tejidos afectados es la forma ideal de llegar a un diagnóstico definitivo de leishmaniosis, normalmente mediante la visualización directa de amastigotes de Leishmania sp en citología o histopatología, considerándose suficiente para demostrar la causalidad en los casos típicos9-13. En los casos atípicos, esto puede no resultar tan fácil y, a veces, requiere de un estudio más exhaustivo como ocurre en los casos en que la LC se presenta clínicamente asociada a una DPE, para, así, llegar a un diagnóstico definitivo correcto4-5.
La citología de las lesiones cutáneas es una prueba objetiva y puede revelar la presencia de amastigotes de Leishmania sp, pero su sensibilidad puede ser variable y, a veces, depende de la destreza del veterinario clínico. La histopatología de las biopsias cutáneas proporciona información adicional muy importante en estos casos e informa sobre los cambios inflamatorios y la presencia de amastigotes en los tejidos afectados. En los casos en los que el examen citológico o histológico no permite la visualización de amastigotes, se necesitan pruebas específicas para detectar al parásito o demostrar la presencia de su ADN. Así, se puede llevar a cabo una tinción de inmunohistoquímica (IHQ) específica de Leishmania sp o métodos moleculares (PCR)4,5,13-15, estas últimas con una alta sensibilidad, incluso en muestras citológicas o de raspado cutáneo14.
En los casos descritos, el diagnóstico de la leishmaniosis estadio II fue realizado en primer lugar mediante los hallazgos clinicopatológicos de la analítica sanguínea, serología y uroanálisis, relacionando la dermatitis pustulosa con una pioderma secundaria, posiblemente asociada a la inmunosupresión del paciente8. En los dos pacientes, la comprobación de la presencia de la infección por Leishmania sp se demostró sin muchas complicaciones. En el primer caso, la citología fue diagnóstica, demostrando la presencia de amastigotes en la muestra; no se observaron bacterias intracelulares en la muestra recolectada, pero incluso así, se decidió realizar un cultivo de una pústula intacta para descartar un posible origen bacteriano o fúngico. La tinción PAS, con un resultado negativo, permitió descartar con más seguridad un origen fúngico. En el segundo caso se diagnosticó por biopsia; los amastigotes se visualizaron en la dermis sin necesidad de tinciones de IHQ o realizar una PCR. Un punto importante que mencionar es la presencia de algunas células acantolíticas en las muestras citológicas de ambos pacientes. Se conoce, recientemente, que en la DPE asociada a leishmaniosis, se pueden observar dichas células4-5. Se sabe que los queratinocitos acantolíticos también pueden presentarse en infecciones bacterianas, fúngicas y en enfermedades inmunomediadas como en el pénfigo foliáceo16. En este último, el número de estas células será mucho mayor que en las demás entidades patológicas5,16-17, por lo tanto, un número reducido presente en las muestras examinadas en los dos casos reportados, tanto citológicas como histológicas, hacían que el diagnóstico de pénfigo foliáceo fuera menos probable. Así mismo, habiendo descartado el origen infeccioso de las lesiones, la posibilidad de una DPE asociada a leishmaniosis cobraba mucho sentido en ambos casos.
La reacción medicamentosa era un posible diagnóstico diferencial, principalmente en el segundo caso. Pero en el primero, las lesiones se presentaron con anterioridad a la administración de ningún fármaco y, en el segundo caso, aunque ciertamente se había tratado con muchos fármacos, hacía 6 meses que estos se habían suspendido, excepto el alopurinol y el tratamiento tópico. Ciertamente existen reacciones medicamentosas que se presentan como un pénfigo desencadenado por fármacos (drug-triggered pemphigus), cuya sintomatología permanece incluso después de retirar la medicación18, pero las lesiones histológicas orientaban el diagnóstico hacia otra dirección, haciéndolo menos probable. Así, el diagnóstico, en ambos casos, fue de DPE asociada a LC o leishmaniosis pustular.
El tratamiento clásico de leishmaniosis suele basarse en una terapia combinada que incluye principalmente alopurinol y antimonio de meglumina9-10,12. Sin embargo, la respuesta al tratamiento puede variar según la gravedad de la enfermedad y la respuesta inmune del individuo. En cuanto al tratamiento de la leishmaniosis asociada a DPE, se puede decir que implica un enfoque multidisciplinario que aborda, tanto la infección por Leishmania, como la DPE; entonces, además de los fármacos específicos para afrontar la LC mencionados, probablemente, será necesario el uso de terapia inmunomoduladora como prednisolona, ciclosporina A o azatioprina para controlar la respuesta inflamatoria y los signos clínicos asociados4-5.
Los casos descritos requirieron ambos de terapia inmunomoduladora; el primero, con dosis bajas de prednisolona durante un corto periodo para controlar la DPE asociada a LC y, el segundo requirió la combinación de prednisolona y ciclosporina A para controlar los signos clínicos sin poder, hasta la fecha, prescindir de ellos y, aunque los demás signos clinicopatológicos estuvieran controlados, ambos pacientes se encuentran actualmente en riguroso control clínico de manera periódica.
En resumen, la DPE como signo clínico de la LC, aunque sea poco común, puede suceder y representa un desafío clínico debido a la dificultad en el diagnóstico y tratamiento que conlleva. Esta presentación clínica debe tenerse en cuenta especialmente en áreas endémicas y considerar la LC en el diferencial de dermatitis pustulosas estériles en perros. La terapia inmunomoduladora es una opción normalmente efectiva, aunque no siempre4-5, en casos refractarios al tratamiento convencional.
Bibliografía
- Ordeix L, Fondati A. Manifestaciones clínicas cutáneas. In: L Solano-Gallego. ed. Leishmaniosis canina. Una revisión actualizada. Zaragoza, SP: Servet, 2013; 69–95.
- Saridomichelakis M.N, and Koutinas AF. Cutaneous involvement in canine leishmaniosis due to Leishmania infantum (syn. L. chagasi). Vet Dermatol 2014;25: 61–e22
- Ferrer Ll, Rabanal R, Fontdevila d. Skin lesions in canine leishmaniasis. J Small Anim Pract 1988; 29: 381-388.
- Colombo S, Abramo F, Borio S, Albanese F, Noli C, Dedola C, et al. Pustular dermatosis in dogs affected by leishmaniosis: 22 cases. Vet Dermatol. 2016; 27: 9–e4.
- Bardagi M, Monaco M and Fondevila D.. Sterile or non antibiotic-responsive pustular dermatitis and canine leishmaniosis: a 14 case series description and a statistical association study on 2420 cases Vet Dermatol 2020;31: 197–e41.
- Koutinas AF, Koutinas CK. Pathologic mechanisms underlying the clinical findings in canine leishmaniosis due to Leishmania infantum/chagasi. Vet Pathol 2014; 51: 527–538.
- Saridomichelakis, M. Advances in the pathogenesis of canine leishmaniosis: epidemiologic and diagnostic implications. Vet Dermatol 2009;20, 471–489
- Villanueva S, Ordeix L and Solano-Gallego L. patogénesis y respuesta inmunitaria. In: L Solano-Gallego. ed. Leishmaniosis canina. Una revisión actualizada. Zaragoza, SP: Servet, 2013; 33–51.
- Solano-Gallego L, Miró G, Koutinas A et al. LeishVet guidelines for the practical management of canine leishmaniosis. Parasit Vectors 2011; 4 (1): 86.
- Noli C, Saridomichelakis MN. An update on the diagnosis and treatment of canine leishmaniosis caused by Leishmania infantum (syn L. chagasi). Vet J 2014; 202: 425–435.
- Paltrinieri S, Gradoni L, Roura X et al. Laboratory tests for diagnosing and monitoring canine leishmaniasis. Vet Clin Pathol 2016; 45: 552–578.
- Solano-Gallego L, Koutinas A, Miró G et al. Directions for the diagnosis, clinical staging, treatment and prevention of canine leishmaniosis. Vet Parasitol 2009; 165: 1–18.
- Solano-Gallego L, Villanueva S. Diagnóstico de la leishmaniosis canina, in: L Solano-Gallego. ed. Leishmaniosis canina. Una revisión actualizada. Zaragoza, SP: Servet, 2013; 130-164.
- Lima T, Martinez- Sogues L, Montserrat-Sagrá S, Solano-Gallego Laia, Ordeix Laura. Diagnostic performance of a qPCR for Leishmania on stained cytological specimens and on filter paper impressions obtained from cutaneous lesions suggestive of canine leishmaniosis. Vet Dermatol 2019;30: 318–e89.
- Moreira OC, Yadon ZE, Cupolillo E. The applicability of real-time PCR in the diagnostic of cutaneous leishmaniasis and parasite quantification for clinical management: current status and perspectives. Acta Trop 2018; 184: 29–37.
- Miller WH, Griffin CE, Campbell KL, Muller and Kirk’s Small Animal Dermatology, 7th edition. St Louis,MO: Elsevier Mosby 2013:440-445
- Olivry T, A review of autoimmune skin diseases in domestic animals: I: superficil pemphigus. Vet dermatol 2006: 17:291-305
- Voie KL, Campbell KL, Lavergne SN. Drug hypersensitivity reactions targeting the skin in dogs and cats review. J Vet Intern Med 2012; 26:863-87
 by Multimédica
by Multimédica