Dermatofitosis ¿Realidad clínica o tendencia en caninos y felinos?
Resumen breve
La dermatofitosis es una enfermedad cutánea fúngica superficial. El patógeno más comúnmente aislado es el Microsporum canis. La infección ocasionada por otras especies de dermatofitos no microspóricos aunque patógenos, rara vez se asocian a brotes infecto-contagiosos, en lugares de concentración animal (criaderos, refugios, guarderías, etc).Índice de contenidos
Etiología
La dermatofitosis es una enfermedad cutánea fúngica superficial. El patógeno más comúnmente aislado es el Microsporum canis. La infección ocasionada por otras especies de dermatofitos no microspóricos aunque patógenos, rara vez se asocian a brotes infecto-contagiosos, en lugares de concentración animal (criaderos, refugios, guarderías, etc).
Es una entidad morbosa micótica (fúngica) cosmopolita, causada por hongos filamentosos con tropismo por la queratina (de las estructuras queratinizadas de la piel) invadiendo y colonizando pelo, estrato córneo y anexos tegumentarios queratinizados (uñas). Es ocasionada principalmente por dermatofitos de los géneros Microsporum, Tricophyton y Epidermophyton.
Se ha documentado que tres especies de dermatofitos causan enfermedad en perros y gatos. Son Microsporum canis, M. gypseum y Trichophyton mentagrophytes. La causa más común en los gatos es M. canis, y en los perros M. canis y M. gypseum. Otras especies menos frecuentes son Trichophyton mentagrophytes, M. persicolor, T. erinacei, M. verrucosum, M. equinum y T. equinum.
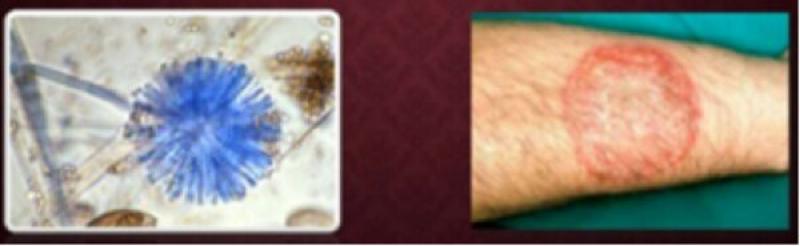
En la piel humana, las esporas emiten filamentos radiados (estructuras fúngicas) en división permanente, que irradian a partir del punto de inoculación en forma periférica – centrífuga, generando alopecia circular (tiña-tinea-apolillado), fenómeno que en caninos y felinos tan solo ocurre en forma ocasional (Figura 1).
En humanos la dermatofitosis es causada primordialmente por hongos tricofíticos: T. rubrum, es el más frecuente (36–80 %) de la casuística; T. tonsurans (15-18 %); T. mentagrophytes; E. flocossum (3-8 %); y M. canis (14-24 %).
La fuente de las infecciones por M. canis (zoofílico), suele ser un gato o un fómite contaminado por gatos. M. gypseum es geofílico, y se encuentra en suelos contaminados y cargados de materia orgánica, con la cual entran en contacto perros y gatos. Trichophyton mentagrophytes se asocia a los roedores o a sus nidos y la enfermedad suele estar relacionada con la exposición a una de estas fuentes.
Se ha propuesto que los gatos persas están predispuestos a la dermatofitosis acorde a su sobrerrepresentación en los estudios clínicos y a las descripciones de infecciones dermatofíticas subcutáneas predominantes en esta raza.
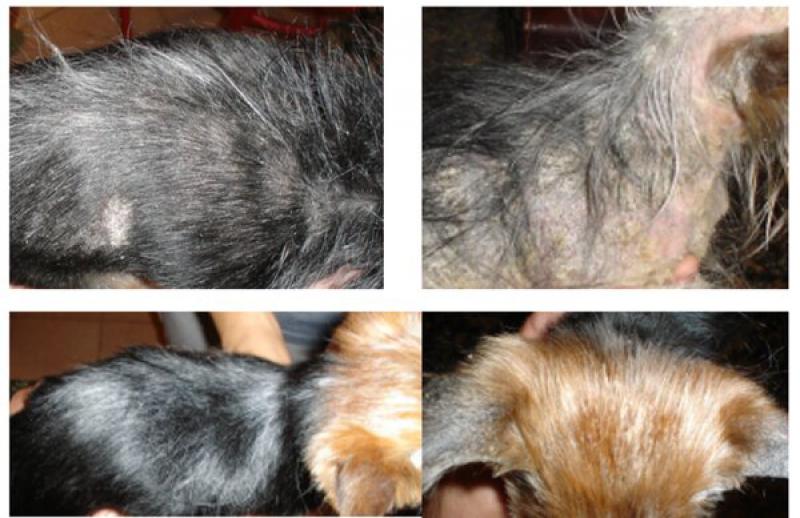
Asímismo, estudios observacionales similares, han sugerido que el Yorkshire terrier (Figura 2), es el equivalente canino del gato persa, en lo que respecta a esta enfermedad. Sin embargo, la verdadera prevalencia y la predisposición por raza son difíciles de evaluar, ya que las tasas de enfermedad y las especies causantes varían geográficamente.
Los hongos patógenos se están reclasificando según recientes hallazgos moleculares y su nomenclatura podría cambiar en el futuro, por ejemplo, los dermatofitos se están clasificando en el género Arthoderma, y el complejo Arthroderma otae incluye M. canis, M. furrugineum, M. equimum y M. audouinii.
Biopatogenia
La infección se produce por contacto con animales, elementos o ambientes infectados. La dermatofitosis, afecta con mayor frecuencia gatos, que pueden ser portadores asintomáticos y así, fuentes de infección para otros mamíferos, incluyendo humanos.
Los pelos infectados pueden contaminar los collares, cepillos, juguetes, etc. El pelo infectado por dermatofitos puede permanecer viable en el medio ambiente durante años; las alfombras y la tapicería son entornos especialmente óptimos para albergar pelos infectados, pero el suelo también es una fuente de exposición.
El contacto de esporas de dermatofitos con la piel y anexos, es capaz de generar la enfermedad, dependiendo de la predisposición tisular individual, genética e inmunológica.Los factores que predisponen a la infección son edad, inmunosupresión, sub-, des- o malnutrición, enfermedades concurrentes, altas temperaturas, humedad y la condición sine qua non, es el trauma cutáneo. Así, ácaros, pulgas u otras causas de trauma tegumentario, facilitan la instauración de la infección micótica.
El periodo de incubación varía de 1-3 semanas. Los dermatofitos infectan los pelos en fase anágena y la piel viva. La dermatofitosis suele tener resolución espontánea en pacientes inmunocompetentes, los cuales desarrollan resistencia a posteriores exposiciones con microorganismos infectantes.
Características clínicas
Los signos clínicos tegumentarios incluyen alopecia focal o multifocal, con descamación, que afecta áreas: facial, craneal, pabellones auriculares y patas. Otros signos clínicos incluyen foliculitis-furunculosis, acné (principalmente mentoniano), onicomicosis, granulomas y en ocasiones queriones.
El prurito y la inflamación suelen ser mínimos, pero ocasionalmente se producen formas gravemente pruriginosas, pustulosas o con costras especialmente en pacientes mayores e inmunocomprometidos. Estos signos pueden simular o coexistir con alergias, ectoparásitos, dermatitis miliar, pioderma o pénfigo foliáceo.
Los micetomas o pseudomicetomas por dermatofitos son formas subcutáneas nodulares y ulceradas con drenaje de los senos paranasales que se observan en gatos persas y, también, en mestizos u otras razas de capa larga. A menudo se asocia con seborrea oleosa generalizada.
En perros el T. mentagrophytes, suele causar grave inflamación, alopecia, foliculitis- furunculosis, encostramiento, granulomas en facial y extremidades, especialmente en caninos terreros.
Diagnósticos diferenciales
Como la presentación clínica puede ser tan variable, la dermatofitosis debe considerarse como posibilidad diagnóstica, casi en cualquier paciente, pero especialmente en gatos, que presentan alopecia focal a multifocal, descamación y costras; alopecia difusa, seborrea y descamación; nódulos y tractos sinusales drenantes; inflamación, eritema, erosiones y úlceras; y/o foliculitis- furunculosis.
El enlistamiento de diagnósticos diferenciales en pacientes con alopecia centrífuga focal o multifocal, acorde con el historial catamnésico, anamnésico, motivo de consulta dermatológica y los hallazgos clínicos, deben incluir pioderma, demodicosis, dermatofitosis, desorden incretorio, alopecia por dilución del color, distrofia folicular y aún alopecia areata.
Es de vital importancia en los animales de compañía, tener en cuenta que las lesiones alopécicas (apolilladas) centrífugas, ocurren con mayor frecuencia en procesos tegumentarios ocasionados por bacterias (piodermas) y no deben considerarse en primera instancia como dermatofitosis y mucho menos como ocurre en la realidad del día a día, prescribir terapias contra dermatofitos, sin tener una objetiva y comprobada evidencia diagnóstica.
Diagnóstico
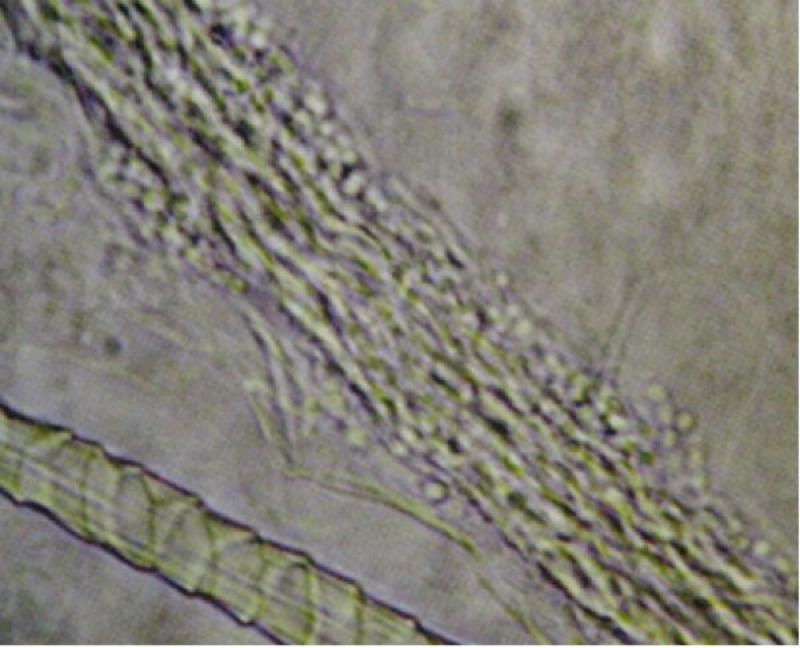
El diagnóstico de la dermatofitosis y la identificación de las especies se basa en el cultivo de muestras del pelo y/o escamas. Los pelos pueden examinarse inicialmente por estudio tricográfico, para la identificación de las hifas rotas, que permiten la liberación de las artrosporas de invasión ectotrix (Figura 3), las cuales lesionan (destruyen) los pelos en fase de crecimiento activo (anagen).
Lámpara de Wood
El Microsporum canis, es el único hongo patógeno de importancia en medicina veterinaria que es fluorescente. El hallazgo de pelos que fluorescen, por sí solo no constituye diagnóstico de una infección por dermatofitos. Sin embargo, el examen microscópico de los pelos y la identificación de esporas e hifas ectothrix es definitivo. Es muy importante observar la diferencia en el diámetro de los pelos afectados y los no afectados, pues las hifas fúngicas lineales corren dentro del tallo y el extremo fracturado.
Esto es lo que crea el clásico aspecto de "tronco de árbol podrido" que se observa en los pelos infectados por dermatofitos. La lámpara de Wood emite radiación ultravioleta (UV) de onda larga a través de un filtro de vidrio (silicato de bario con óxido de níquel) que emite rayos de luz entre 320 y 400 nm, con una media alrededor de 354 nm.
La lámpara de Wood es una herramienta de cribado para la dermatofitosis en la medicina de pequeños animales. Cuando está presente, produce una fluorescencia característica de color verde manzana sobre el pelo afectado (una fluorescencia negativa no descarta la dermatofitosis).
Sólo un número limitado de especies de dermatofitos producen fluorescencia, que incluyen Microsporum canis, M. distortum, M. audouinii y Trichophyton schoeleinni. La única de estas especies que es de importancia clínica en medicina veterinaria es M. canis.
Para realizar el cribado se debe encender la lámpara y dejar que se caliente. La prueba debe realizarse en una habitación oscura y la lámpara debe mantenerse a varios centímetros de las lesiones sospechosas.Es necesario exponer los pelos a la luz durante varios minutos, ya que algunas cepas tardan en producir la fluorescencia característica. Si se observa fluorescencia, los pelos deben ser cultivados y se deben epilar (periferia de la lesión) para realizar un tricograma y confirmar la infección.
Los factores de error más comunes son no utilizar una lámpara de Wood real, realizar la prueba en una habitación incompletamente oscura, y no tomarse el tiempo suficiente para realizar la prueba.
Evidente fluorescencia - 50 % cepas o más de M.Canis, pelos afectados, gran ayuda para recolectar las muestras para cultivo. La fluorescencia dada por metabolitos del triptófano (pteridina), localizado dentro de la corteza y la médula del pelo, que se produce como resultado de la infección. El punto clave es que esta reacción sólo tiene lugar en el pelo, es elaborada por el hongo invasor y no se detecta en escamas o costras.
Observar la fluorescencia sobre tallos pilosos, no sobre otras estructuras, pues se ha reconocido, falsa fluorescencia por medicamentos tópicos, material seborreico (queratina), residuos de jabón y fibras de alfombras.
Históricamente, se ha sugerido que aproximadamente el 50 % de las cepas de M. canis son fluorescentes, pero recientes directrices publicadas sobre el diagnóstico y el tratamiento de la dermatofitosis sugieren, que esto puede ser una gran subestimación y de hecho, es probable que el examen con la lámpara de Wood sea positivo en la mayoría de los casos de M. canis.
Se pueden realizar biopsias de piel, pero la histología no es tan sensible como el cultivo y a menudo requiere tinciones especiales (por ejemplo, tinción de ácido periódico de Schiff [PAS] o tinción de plata de Grocott-Gomori). Los dermatofitos producen fácilmente colonias blanquecinas y esponjosas en el medio de prueba de dermatofitos (MDT), induciendo un cambio de color rojo que coincide con crecimiento fúngico temprano, normalmente en 7-10 días (más rápido incubando a más de 25°C).
Los dermatofitos desarrollan una morfología característica de las colonias y producen más fácilmente, macroconidias en el agar de Saboraud. Sin embargo, esto lleva al menos 3 semanas y conocimiento micológico especializado para interpretarlo.
Las pruebas de reacción en cadena de la polimerasa (PCR), son muy sensibles, pero pueden producirse falsos positivos, por contaminación transitoria no patógena de la piel.La clasificación de las dermatofitosis según el dermatofito causal, sólo tiene interés epidemiológico y académico, ya que el tratamiento en muy contadas ocasiones se beneficia de la identificación del género y la especie.
Terapia
La curación clínica se produce antes de la curación micológica, y los pacientes no deben considerarse curados hasta que hayan tenido dos cultivos negativos, con un espacio de tiempo mínimo de 7 días.
Tópica
La terapia tópica limita la contaminación ambiental y reduce el tiempo de curación clínica y fúngica. Las soluciones de cal sulfurada son eficaces y bien toleradas, aunque manchan e inducen picor.
La inmersión de enilconazol también es muy eficaz y bien tolerada por los perros, pero en gatos se observan ocasionalmente reacciones idiosincrásicas, que incluyen aumento de las enzimas hepáticas, debilidad muscular y aún muerte.
La clorhexidina sola, frente a los dermatofitos no es tan efectiva, pero la forma galénica de champú que asocia clorhexidina 2 % y miconazol 2 %, es un recurso terapéutico eficaz. Muchos otros champús antifúngicos están disponibles y tienen eficacia variable.
La terapia tópica debe aplicarse una o dos veces por semana hasta la cura clínica y micológica del paciente. Los antifúngicos tópicos, son recurso terapéutico útil, pero deben prescribirse únicamente para aplicación en caso de lesiones focales y son principalmente eficaces las formas galénicas en loción, cuando son aplicadas directamente sobre la piel (no sobre el pelo).
Sistemática
El itraconazol (5 mg/kg/24 h) es muy eficaz y bien tolerado en perros y gatos. Puede administrarse diariamente. También puede administrarse en días alternos o en semanas alternas. El itraconazol persiste en el pelo durante 3-4 semanas después de su administración. Las concentraciones terapéuticas se mantienen en la piel y pelo, durante al menos 2 semanas después de la dosis final.
La terbinafina (30 mg/kg/24 h) se ha utilizado con éxito para la dermatofitosis y también para los micetomas dermatofíticos. Su actividad es de larga duración y esto puede permitir cursos de terapia relativamente cortos, seguido de una cuidadosa observación. Este principio activo hasta el momento, ha mostrado ser bien tolerado por caninos y felinos.
El ketoconazol (5-10 mg/kg/24 h) es eficaz y por lo general bien tolerado, pero puede inducir anorexia y vómitos, es hepatotóxico y potencialmente teratogénico. Debe administrarse con comida. Los gatos son especialmente susceptibles a los efectos secundario. El itraconazol o la terbinafina, son mejores opciones.
La dosis de griseofulvina depende de la formulación: la formulación micronizada 50-100 mg/kg/24 h y en formulación ultramicronizada (PEG), 10-30 mg/kg/24 h. Las dosis pueden dividirse y ser administrada cada 12 h, con una comida (grasa) hasta la resolución. Debe prescribirse con precaución y monitoreo, en pacientes jóvenes, pero nunca en menores de 6 semanas. Los efectos secundarios incluyen prurito, anorexia, vómitos, diarrea, daño hepático, ataxia y supresión de la médula ósea. Adicionalmente la griseofulvina es teratogénica y puede afectar la calidad espermática.
La griseofulvina sólo debe utilizarse si no existe otra opción terapéutica disponible, y se debe considerar primero itraconazol, terbinafina o aún ketoconazol.
Prevalencia
La prevalencia notificada de M. canis es muy variable, dependiendo de la región geográfica, la población muestreada, si el cultivo se correlaciona con la enfermedad clínica, y de los criterios de recopilación y datos. Entre las diversas encuestas sobre cultivos fúngicos realizadas en Europa y EE.UU. en los últimas 2 décadas, la prevalencia de gatos con cultivos positivos ha oscilado entre el 4 y el 100 %.
Las referidas cifras y porcentajes son muy poco confiables y al ser sometidas a análisis exhaustivos, sobreestiman la prevalencia real de la enfermedad, por diversos factores, entre otros: gatos reportados como positivos, pero que solo actúan como transportadores mecánicos de esporas y pacientes con lesiones alopécicas centrífugas (aparentemente circulares), sin comprobación diagnóstica. Es importante enfatizar, que el material infeccioso puede crecer y multiplicarse en el pelo o en la piel, pero no, en el medio ambiente.
Un estudio retrospectivo de un refugio que comparaba cultivos y exámenes post-cultivo, con un representativo n = de 5644 gatos, durante un periodo de 24 meses reveló: 584 gatos con cultivo positivo (10.3 %), 381 gatos con lesiones tegumentarias al momento del ingreso (6.75 %). Sin embargo, sólo 94/5644 gatos reportaron lesiones y cultivo positivo (1.6 %); los 490 gatos restantes con cultivo positivo eran transportadores, sin lesiones y negativos en la repetición del cultivo fúngico.
Información inconsistente de este tipo, induce a error en el diagnóstico, terapia prolongada e innecesaria, confinamiento injustificado e incluso eutanasia. Cuando se sospecha de dermatofitosis, es imperativo confirmar el diagnóstico y la diferenciación e identificación de los realmente infectados (verdaderos positivos), de aquellos que son tan solo portadores.
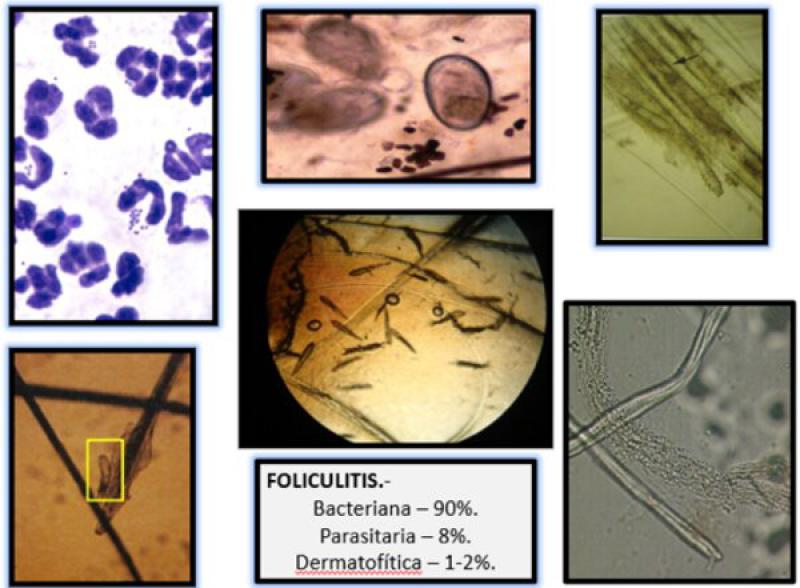
Del ejemplo anterior se concluye, que tan solo una cuarta parte de los ejemplares que mostraban lesiones tegumentarias alopécicas, padecian dermatofitosis, lo que ratifica que la observación de lesiones cutáneas compatibles, es una metodología de cribado imprecisa y altamente riesgosa para un diagnóstico certero, pronósticos e instauración terapéutica.
En experiencia del autor, de cada 10 pacientes, recibidos para consulta dermatológica, con antecedente de diagnóstico y con terapia instaurada para la patología en mención, tan solo 1, resulta positivo a la misma. La gran mayoría, 9 de cada 10, padecen piodermas, piodemodexias u otras patologías alopeciantes tegumentarias inducidas y/o detonadas por endectoparasitismos diversos. Se debe tener siempre presente que las lesiones primarias que inducen los referidos agentes etiológicos son clínicamente indiferenciables (Figura 4).
La dermatofitosis es en general, una entidad morbosa tegumentaria, comúnmente sobredagnosticada y en consecuencia, prescrita y tratada. Como causas más fecuentes, de la gran cantidad de pacientes con sobrediagnosis de dermatofitos en gatos y perros, están:
- Asumir que las lesiones alopeciantes centrífugas (redondeadas) son características en la dermatofitosis de nuestros pacientes caninos y felinos, lo cual es incorrecto.
- Confirmar equívocamente la presencia de artrosporas e hifas en el estudio tricográfico (usualmente por falta de experticia), al punto de asegurar invasiones endótrix.
- No descartar y/o confirmar las causas más frecuentes del proceso alopeciante centrífugo-apolillado (Bacterias, ectoparásitos o combinación de ambos agentes infecciosos).
- No confrmar otras causas sistémicas generadoras de pioderma e hipermultiplicación de ácaros demodéxicos.
- Utilización incorrecta de la lámpara de Wood, identificación de fluorescencia sobre artefactos diferentes a los pelos infectados.
Antes de emitir un diagnóstico de dermatofitosis, debemos haber realizado:
- Raspado y estudio tricográfico para confirmar o descartar ácaros.
- Trial terapéutico frente a endectoparasitismos diversos.
- Citología evidenciando o descartando pioderma, pio-demodexia, levurosis, u otras patologías compatibles.
- Cultivo para dermatofitos, empleando la técnica de barrido de áreas (cepillo dental).
- Las técnicas de PCR son de utilidad, aunque hay que recordar que pueden dar resultados falsos positivos en casos de infecciones no activas, al detectar ADN de elementos fúngicos no viables
- Finalmente, puede recurrirse al estudio histopatológico (biopsia), en casos de kerion fúngico o sosprecha de falsos negatvos del DTM.
El objetivo de esta publicación, es reafirmar la universal tendencia al sobrediagnóstico de esta dermatopatía, sugiriendo no subdimensionarla, dado su comprobado potencial como antropozoonosis.
Bibliografía
- Baldo A, Monod M, Mathy A, Cambier L, Bagut ET, defaweux V, et al. Mechanisms of skin adherence and invasión by dermatophytes. Mycoses 2012; 55: 218–223.
- Moriello KA and deBoer dJ. Cutaneous fungal infections:dermatophytosis. in: Greene C (ed). infectious diseases of the dog and cat. 4th ed. St Louis, Mo: Elsevier Saunders, 2012, pp 588–602.
- Moriello KA and Newbury S. Dermatophytosis. in: Miller L and Hurley K (eds). infectious disease management in animal shelters. Ames, iA: Blackwell Publishing, 2009, pp 243–273.
- Cafarchia C, Romito d, Capelli G, Guillot J and otranto d. Isolation of Microsporum canis from the hair coat of pet dogs and cats belonging to owners diagnosed with M. canis tinea corporis. Vet Dermatol 2006; 17: 327–331.
- Baldo A, Tabart J, Vermout S, Mathy A, Collard A, Losson B, et al. Secreted subtilisins of Microsporum canis are involved in adherence of arthroconidia to feline corneocytes. J Med Microbiol 2008; 57: 1152–1156.
- DeBoer dJ, Moriello KA, Blum JL and Volk LM. Effects of lufenuron treatment in cats on the establishment and course of Microsporum canis infection following exposure to infected cats. J Am Vet Med Assoc 2003; 222: 1216–1220.
- Bourdeau P, Costiou F and Peron C. Comparison of carpet and toothbrush methods for the detection of asymptomatic carriage of dermatophytes in cats [Abstract]. Vet Dermatol 2004; 15: 44.
- Carlotti dN, Guinot P, Meissonnier E and Germain PA. Eradication of feline dermatophytosis in a shelter: a field study. Vet Dermatol 2010; 21: 259–266.
- Frymus T, Gruffydd-Jones T, Pennisi MG, Addie d, Belák S, Boucraut-Baralon C, et al. Dermatophytosis in cats. ABCD guidelines on prevention and management. J Feline Med Surg 2013; 15: 598–604.
- Duarte A, Castro i, Pereira da Fonseca iM, Almeida V, Madeira de Carvalho LM, Meireles J, et al. Survey of infectious and parasitic diseases in stray cats at the Lisbon Metropolitan Area, Portugal. J Feline Med Surg 2010; 12: 441–446.
- Foust AL, Marsella R, Akucewich LH, Kunkle G, Stern A, Moattari S, et al. Evaluation of persistence of terbinafine in the hair of normal cats after 14 days of daily therapy. Vet Dermatol 2007; 18: 246–251.
- Grills CE, Bryan PL, o’Moore E and Venning VA.Microsporum canis: report of a primary school outbreak. Australas J Dermatol 2007; 48: 88–90.
- Moriello KA. Diagnostic techniques for dermatophytosis. Clin Tech Small Anim Pract 2001; 16: 219–224.
- Moriello K, Coyner K, Trimmer A, Newbury S and Kunder d. Treatment of shelter cats with oral terbinafine and concurrent lime sulphur rinses. Vet Dermatol 2013; 24: 618–e150.
- Moriello K and deBoer dJ. Dermatophytosis. in: Greene CE (ed). infectious diseases of the dog and cat. 4th ed. St Louis, Mo: Elsevier Saunders, 2012, pp 599–601.
- Moriello KA, Kunder d and Hondzo H. Efficacy of eightcommercial disinfectants against Microsporum canis and Trichophyton spp. infective spores on an experimentally contaminated textile surface. Vet Dermatol. Epub ahead of print 17 September 2013. doi: 10.1111/vde.12074.
- Moriello KA and Hondzo H. Efficacy of disinfectants containing hydrogen peroxide against conidial arthrospores and isolated infective spores of Microsporum canis and Trichophtyon sp. Vet Dermatol. Epub ahead of print 12 Mar 2014. doi: 10.1111/vde.12122.
- Moriello K, Coyner K, Trimmer A, Newbury S and Kunder d. Treatment of shelter cats with oral terbinafine and concurrent lime sulphur rinses. Vet Dermatol. Epub ahead of print 23 August 2013. doi: 10.1111/vde.12069.
- Moriello KA and deBoer dJ. Efficacy of griseofulvin and itraconazole in the treatment of experimentally induced dermatophytosis in cats. J Am Vet Med Assoc 1995; 207: 439–444.
- Newbury S, Moriello K, Verbrugge M and Thomas C. Use of lime sulphur and itraconazole to treat shelter cats naturally infected with Microsporum canis in an annex facility: an open field trial. Vet Dermatol 2007; 18: 324–331.
- Moriello KA, Verbrugge MJ and Kesting RA. Effects of temperatura variations and light exposure on the time to growth of dermatophytes using six different fungal culture media inoculated with laboratory strains and samples obtained from infected cats. J Feline Med Surg 2010; 12: 988–990.
- Newbury S, Moriello KA, Kwochka KW, Verbrugge M and Thomas C. Use of itraconazole and either lime sulphur or Malaseb Concentrate Rinse® to treat shelter cats naturally infected with Microsporum canis: an open field trial. Vet
Dermatol 2011; 22: 75–79. - Moriello KA, deboer dJ, Schenker R, Blum JL and Volk LM. Efficacy of pre-treatment with lufenuron for the prevention of Microsporum canis infection in a feline direct topical challenge model. Vet Dermatol 2004; 15: 357–362.
- Tabart J, Baldo A, Vermout S, Losson B and Mignon B. Reconstructed interfollicular feline epidermis as a model for the screening of antifungal drugs against Microsporum canis. Vet Dermatol 2008; 19: 130–133.
 by Multimédica
by Multimédica