Dermatopatía isquémica en un Pastor de Shetland. Caso clínico.
Resumen breve
El caso clínico expuesto trata sobre un Pastor de Shetland de 5 meses de edad con atrofia, descamación y alopecia en áreas distales del cuerpo al que se le diagnosticó una dermatopatía isquémica estabilizada con éxito con pentoxifilina y vitamina E.Índice de contenidos
Resumen
Las dermatopatías isquémicas son enfermedades cutáneas vasculopáticas que causan, como consecuencia de la isquemia cutánea, lesiones atróficas y potencialmente ulcerativas acompañadas de alopecia multifocal e hiper-hipopigmentación. Se clasifican en cinco subtipos, incluyendo la dermatomiositis familiar canina. El diagnóstico se basa en el aspecto clínico, el descartar otras enfermedades del diferencial y la confirmación histopatológica. Aunque la patogénesis exacta de esta enfermedad se desconoce, la predisposición de ciertas razas como collies y Pastor de Shetland sugiere una predisposición genética. El caso clínico expuesto trata sobre un Pastor de Shetland de 5 meses de edad con atrofia, descamación y alopecia en áreas distales del cuerpo al que se le diagnosticó una dermatopatía isquémica estabilizada con éxito con pentoxifilina y vitamina E.
Introducción
Las dermatopatías isquémicas son un grupo de enfermedades cutáneas vasculopáticas inmunomediadas con etiologías diferentes que comparten características clínicas e histológicas similares1.Se han agrupado en los siguientes 5 subtipos: la dermatomiositis familiar canina, la dermatopatía isquémica familiar en razas atípicas, la vasculitis post-vacunal local, la dermatopatía isquémica post-vacunal generalizada y finalmente la dermatopatía isquémica idiopática generalizada2.
En cuanto a las características clínicas, las lesiones cutáneas incluyen atrofia cutánea, alopecia, hipo-hiperpigmentación, descamación, costras, úlceras y cicatrices. Se suelen presentar en extremidades distales como la cola, el margen de los pabellones auriculares, la cara y los dedos pudiendo afectar el crecimiento de las uñas (onicodistrofia y onicomadesis)3. Los animales presentan estas lesiones en zonas periféricas del cuerpo ya que en esas zonas la piel dispone de poca vascularización colateral y, al bloquearse un vaso sanguíneo, se llega a la isquemia cutánea más fácilmente (en zonas más vascularizadas los vasos colaterales asegurarían la llegada de oxígeno)1.
Ante una alopecia multifocal, antes de realizar un examen histopatológico, se requiere descartar otras causas como una demodicosis, una dermatofitosis y una foliculitis bacteriana. La histopatología de las dermatopatías isquémicas se caracteriza como una dermatitis de interfase pobre en células con vacuolización y apoptosis de los queratinocitos basales, una atrofia folicular severa y vasculopatía afectando a los capilares4.
El pilar del tratamiento de las dermatopatías isquémicas es la pentoxifilina combinada con la vitamina E1. La pentoxifilina es un derivado de la teobromina que pertenece a la clase de los fármacos de metilxantinas5. Tiene propiedades antiinflamatorias e inmunomoduladoras, posee la capacidad de reducir la viscosidad sanguínea e inhibe citocinas proinflamatorias. Esta molécula se ha descrito como una terapia exitosa para las dermatopatías isquémicas y la dosis varía entre 10-30 mg/kg/12 h6.
Por otro lado, la vitamina E en su forma más activa como el tocoferol, es un potente antioxidante que tiene múltiples beneficios para el manejo de enfermedades alérgicas, estrés oxidativo y daño por radiación UV, y la dosis varía entre 200-800 UI/12 h1,7.
Caso clínico
Se presentó en consulta un paciente canino, macho, de raza Pastor de Shetland de 5 meses, entero, adquirido a la edad de 2 meses y medio en un criadero de Toulouse (Francia). Se le recibió en consulta para la exploración de unas lesiones alopécicas que el animal presentaba desde los 3 meses de vida.
El protocolo vacunal lo tenía al día con la vacuna heptavalente. Al no ser obligatoria la vacunación antirrábica en Francia, nuestro paciente no estaba vacunado. El control de los ectoparásitos se realizaba mensualmente con afoxolaner (Nexgard ®, Boehringer Ingelheim) y cada mes recibía un antihelmíntico con praziquantel, pirantel y febantel (Veloxa ®, Boehringer Ingelheim). Vivía en una casa con jardín con libre acceso al exterior, tenía contacto ocasional con los perros de las clases de adiestramiento y del vecindario. Los tutores no habían observado ninguna contagiosidad, ni presentaba lesiones cutáneas. El animal no había viajado fuera de Toulouse. El perro comía pienso Royal Canin mini puppy® y premios hipoalergénicos de Hill’s®. No recibía restos de comida. Se le cepillaba de media 2 veces por semana y todavía no había recibido ningún baño.
El paciente fue remitido por unas lesiones alopécicas localizadas en el hocico, alrededor de los ojos y en las patas, con un prurito estimado por los tutores 7/10 según la escala análoga visual del prurito. En el momento de la visita recibía un bálsamo hidratante de aceites esenciales (Securiderm®, Laboratoire GreenVet) y tomaba un complemento alimentario a base de aceites grasos esenciales (Megaderm®, Virbac). Duración y cantidades no comunicadas.
El examen clínico general no presentaba anomalías:
- Peso: 4.450 kg, índice de condición corporal 5/9, estado mental alerta.
- Aparato cardiovascular y respiratorio: ausencia de anomalías a la auscultación.
- Palpación abdominal: compatible con la normalidad.
- Nódulos linfáticos periféricos: normales de tamaño y consistencia.
Examen dermatológico:
- Alopecia multifocal con piel atrófica, eritematosa y descamación de localización facial (Figura 1A-B).
- Alopecia con piel atrófica, eritematosa y descamación en partes distales de las extremidades (Figura 2A-B).
- Alopecia y ligera descamación desde la base a la punta de la cola (Figura 3A).
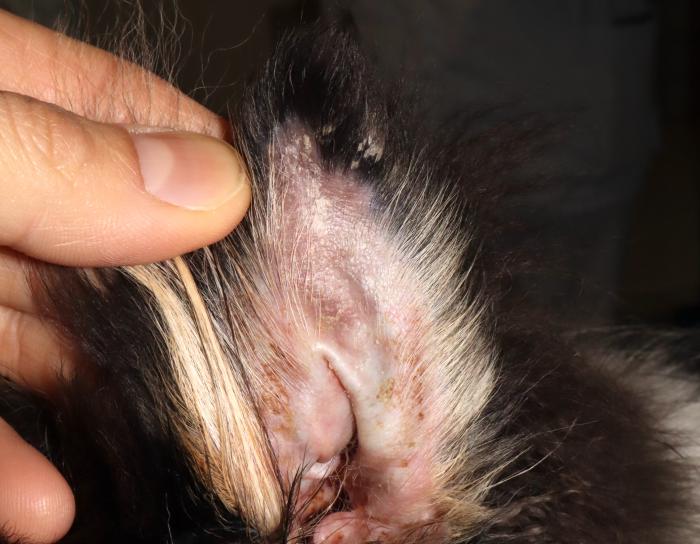
- Alopecia y pequeñas costras en la punta de ambos pabellones auriculares (Figura 3B).

Figura 1. (A) Lesiones faciales alopécicas, eritematosas e hipopigmentadas. (B) Piel atrófica del lado izquierdo de la cara asociado a alopecia, eritema e hipopigmentación.
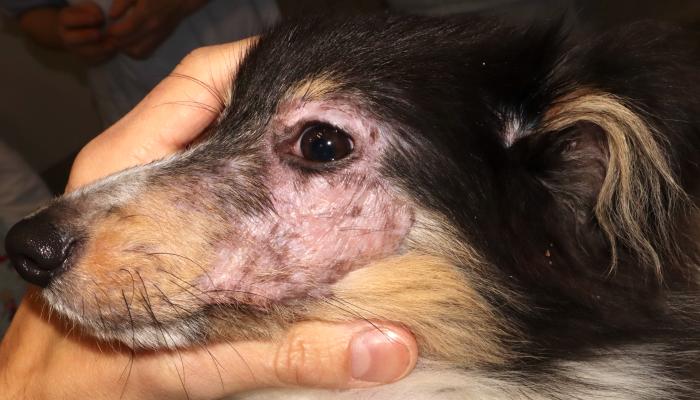
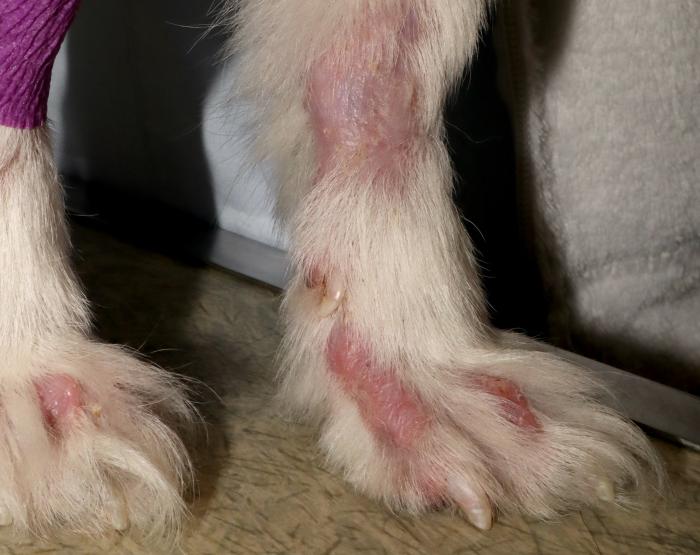
Figura 2. Extremidades distales (A) torácicas con alopecia, eritema, ligera descamación y atrofia de la piel y (B) pélvicas con abundante descamación, alopecia, eritema y atrofia de la piel.
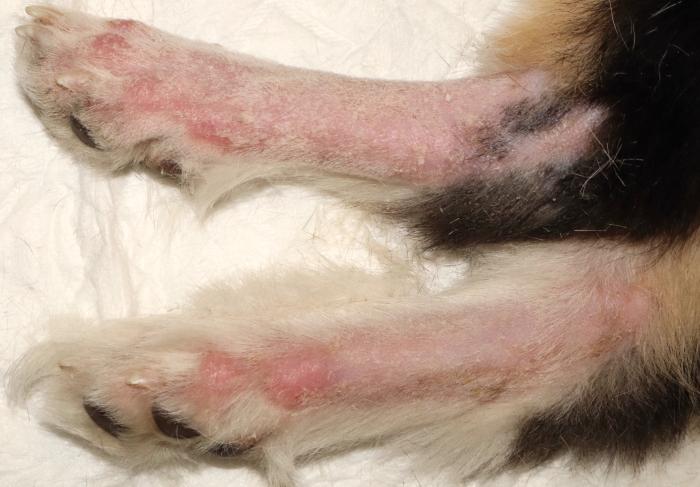
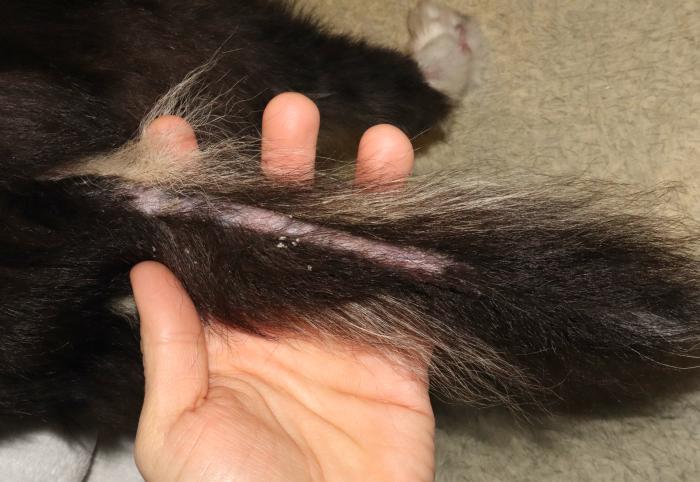
Figura 3. (A) Alopecia y descamación de la cola. (B) Costras y descamación en la punta de la oreja.
El patrón clínico se definió como una alopecia multifocal.
Teniendo en cuenta la anamnesis y las lesiones presentes en nuestro paciente se plantea el siguiente diagnóstico diferencial:
- Demodicosis.
- Dermatofitosis.
- Foliculitis bacteriana.
- Dermatopatía isquémica.
- Vasculitis de causa infecciosa (leishmaniosis).
- Pseudopelada.
En base a los hallazgos dermatológicos y nuestra lista de diagnósticos diferenciales se propusieron los siguientes exámenes complementarios:
- Tricograma.
- Lámpara de Wood.
- Citología.
- Hemograma y bioquímica sanguínea.
- Serología de Leishmania.
- Biopsia cutánea para estudio histopatológico.
El examen microscópico del pelo descartó la presencia de Demodex spp. así como la presencia de dermatofitos. El examen con la lámpara de Wood fue igualmente negativo. También se tomaron muestras para estudio citológico y no se observaron agentes bacterianos de manera que la foliculitis bacteriana quedó eliminada. El hemograma no presentó ninguna anomalía significativa mientras que en la bioquímica se observó un aumento de la creatinina quinasa (CK) a 724 U/L [valores de referencia 25-467 U/L]. La serología por inmunofluorescencia indirecta resultó negativa para Leishmania spp.
Los resultados del estudio histopatológico fueron compatibles con el diagnóstico de dermatopatía isquémica. Se evidenció una dermatitis de interfase pobre en células, con vacuolización y apoptosis de los queratinocitos basales, severa atrofia folicular y una vasculopatía crónica afectando a los capilares. También se observó una ligera infiltración linfocítica alrededor y entre las fibras musculares dérmicas (Figura 4A-D).
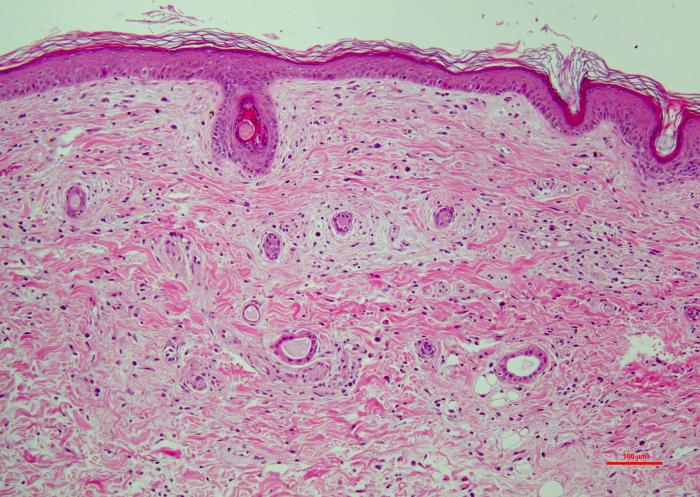
Figura 4. (A) Atrofia folicular severa (faded follicles). (B) Dermatitis de interfase pobre en células (degeneración hidrópica y apoptosis de las células basales de la epidermis, exocitosis linfocítica). (C) Vasculopatía afectando vasos superficiales (pared engrosada, hialinizada y con ausencia de endotelio vascular). (D) Porción profunda de la biopsia, se observan discretas infiltraciones linfocíticas en el perimisio (alrededor de las fibras musculares).
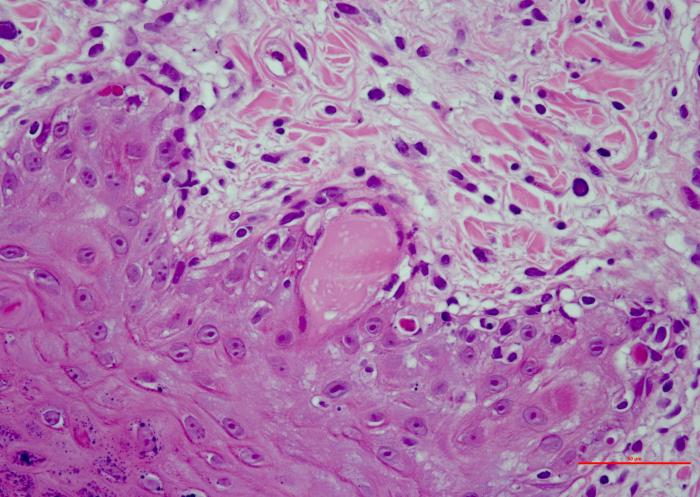
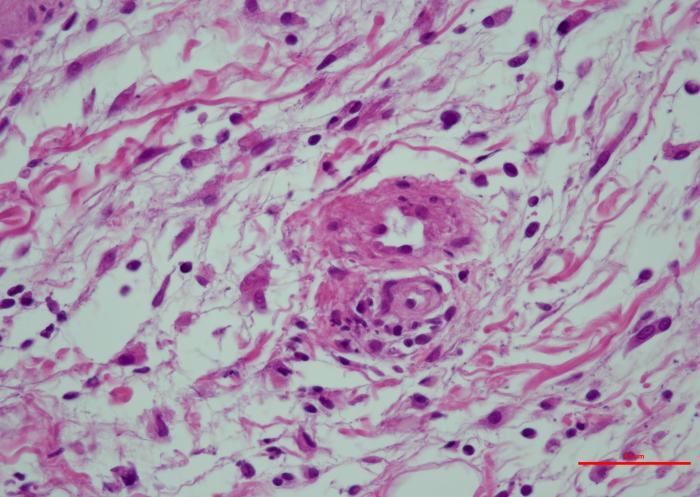
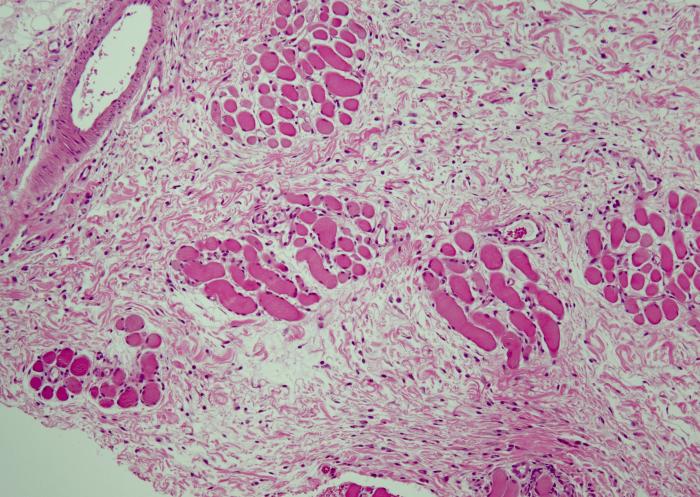
Teniendo en cuenta el resultado histopatológico, la edad de la aparición de las lesiones, la localización y la raza, se confirmó el diagnóstico de dermatomiositis familiar canina sin sintomatología muscular.
Considerando que nuestro paciente no manifestó una clínica relacionada con un disfuncionamiento muscular y la baja edad del paciente, se optó por comenzar el tratamiento con medicamentos con pocos efectos secundarios. Nuestra elección terapéutica se basó en utilizar propentofilina 7 mg/kg (Vitofylllin®, Axience S.A.S) asociado a moléculas antioxidantes como la vitamina E 400 UI al día, una hidratación cutánea diaria con un bálsamo (Sensiderm® Balm, MP labo) y una alimentación rica en ácidos grasos. Además, con el fin de proteger al máximo la piel se aconsejó a los tutores evitar cualquier traumatismo e impedir al máximo la radiación solar.
En el trascurso del seguimiento, el perro fue mejorando sin presentar sintomatología muscular asociada. Al mes y medio de tratamiento, las lesiones alopécicas de la cara tenían un aspecto cicatricial, con una pigmentación moteada y se notaban algunas áreas de crecimiento de pelo (Figura 5A). A los 3 meses tras empezar el protocolo terapéutico el paciente continuaba estable, presentando lesiones de alopecia cicatricial, pigmentación moteada, ausencia de eritema y descamación (Figura 5B).
Dos meses más tarde, el paciente seguía sin presentar ningún signo de debilidad muscular, se notaba un crecimiento notorio del pelo en la cola y las áreas cicatriciales estaban idénticas con respecto a la visita anterior (Figura 5C). No se modificó el tratamiento y se le citó para otra revisión 6 meses después.

Figura 5. (A) Tras mes y medio de tratamiento: alopecia cicatricial, pigmentación moteada de la cara y áreas de crecimiento del pelo. (B) A los 3 meses de tratamiento: extremidades distales torácicas con alopecia y ausencia de descamación. (C) A los 5 meses de tratamiento: crecimiento del pelo de la cola.

Discusión
En el caso presentado, el examen histopatológico nos confirmó que se trataba de una dermatopatía isquémica. Tratándose de un pastor de Shetdland de 5 meses de edad y teniendo en cuenta la infiltración linfática entre las fibras musculares, nuestro diagnóstico clínico fue que se trataba de una dermatomiositis familiar canina.
Se trata de una dermatopatía y miopatía isquémica hereditaria poco común, que se presenta principalmente en Pastor de Shetland, Rough Collie de pelo largo y sus cruces4,8.También puede presentarse en otras razas como en el Jack Russell, el Rotweiller, el Pastor alemán, Pembroke welsh corgi, Chow-chow y Mestizo, entre otros3,9.
Esta enfermedad se caracteriza por lesiones cutáneas y miositis generalizada, con una aparición temprana de las lesiones entre las 7 semanas y los 6 meses de edad10. Las lesiones cutáneas se localizan en la cara, orejas, extremidades distales, prominencias óseas y punta de la cola, con alopecia multifocal cicatricial, eritema, descamación y costras. Aunque las lesiones musculares son raras y no siempre están clínicamente aparentes, cuando lo están se trata de las formas clínicas más graves. Suelen presentarse después que las lesiones cutáneas y los músculos más afectados son los masticatorios. Además, los animales gravemente afectados pueden desarrollar una miositis generalizada y megaesófago4,11. De manera general, parece que la miositis cuando está presente es más común en los Collie que en los Pastor de Shetland12.
El diagnóstico de dermatomiositis familiar canina consiste en reconocer las lesiones cutáneas, descartar otros procesos como demodicosis, dermatofitosis, foliculitis bacteriana y leishmaniosis, y finalmente, confirmar la sospecha clínica mediante examen histopatológico. La histopatología se caracteriza como una dermatitis de interfase pobre en células con atrofia folicular4. Las muestras deben tomarse con un punch de mínimo de 6 mm de diámetro para maximizar la visualización de los folículos pilosos. En cuanto a la biopsia muscular, rara vez se suele realizar en clínica por la dificultad que conlleva tomar muestras del músculo con un sacabocados. De preferencia, la técnica más sensible para el diagnóstico de miositis es la electromiografía1.
En nuestro caso, utilizamos un punch de 8 mm de diámetro para la biopsia y, aunque fue difícil alcanzar la profundidad adecuada en todas las muestras, logramos obtener algunas en las que se apreciaban fibras musculares en la parte profunda. Sin embargo, nuestro paciente presentó unas concentraciones séricas de CK por encima de los valores de referencia a 724 U/L [25-467 U/L]. Y aunque las enzimas musculares se consideran marcadores poco sensibles de miositis activa para el diagnóstico de dermatomiositis familiar13, nosotros iremos controlando estos parámetros en el caso de que nuestro animal empiece a presentar signos clínicos compatibles.
La etiopatogenia de la enfermedad es poco conocida, se ha visto que son animales genéticamente predispuestos a los que en la mayoría de las veces se les ha sumado un desencadenante ambiental (vacunación, estrés, exposición a la luz ultravioleta y el estro, entre otros)4,14. Los estudios de herencia en los Collie de pelo largo han sugerido un modo de herencia autosómico dominante con penetración incompleta15. En cuanto a los Pastor de Shetland, se ha visto que uno de los genes de riesgo está ubicado en el cromosoma 3512. Además, un estudio reciente, identificó polimorfismos genéticos asociados principalmente a dos genes, PAN2 y MAP3K7CL en los cromosomas 10 y 31, respectivamente en collies y Pastor de Shetland, lo que sugiere que estos animales están genéticamente más predispuestos16.
En cuanto al manejo terapéutico, en medicina humana para tratar la dermatomiositis en los niños, los médicos utilizan corticosteroides orales asociados a otras moléculas que van a permitir ahorrar en el uso de corticoides y obtener un mejor pronóstico. Para ello se usan moléculas como la ciclosporina, el micofenolato de mofetilo y el metotexato17. En medicina veterinaria, intentamos evitar el uso de corticosteroides orales por sus efectos adversos como pueden ser la atrofia cutánea y muscular, por lo que intentamos preservar su utilización para los brotes más graves. Para intentar ahorrar en su uso, se pueden asociar con moléculas como la ciclosporina, el micofenolato de mofetilo y también junto a la asociación de tetraciclina y niacinamida. Pero el tratamiento de elección cuando la manifestación clínica no es grave es la pentoxifilina asociada a la vitamina E; la pentoxifilina tiene buenas propiedades antiinflamatorias y, además, tiene la capacidad de reducir la viscosidad sanguínea5. La vitamina E en su forma más activa como el tocoferol es un potente antioxidante que neutraliza los radicales libres de oxígeno y, además, es un componente importante del sebo1,5-7. Recientemente, se ha estudiado el papel del oclacitinib en el tratamiento de las dermatopatías isquémicas y parece que asociado con corticoides las primeras semanas de terapia, se consigue utilizar como tratamiento único y de mantenimiento a largo plazo dando buenos resultados18. Por la tanto, actualmente no existe un tratamiento universalmente aceptado para las dermatopatías isquémicas.
En conclusión, las dermatopatías isquémicas son un grupo de enfermedades cutáneas vasculopáticas que comparten características clínicas e histopatológicas. Para llegar al diagnóstico se deben descartar otros procesos como una demodicosis, una dermatofitosis, una leishmaniosis y una foliculitis bacteriana. La etiopatogenia es poco conocida y combina un componente genético con desencadenantes ambientales a menudo difíciles de reconocer (vacunación, exposición a luz ultravioleta, factor estresante). Y finalmente, aunque no existe una terapia comúnmente aceptada, la elección del tratamiento depende de la estabilidad del animal y la gravedad de los síntomas clínicos. En animales estables y sin síntomas graves, se prefiere el uso de pentoxifilina asociada con vitamina E, mientras que en casos agudos o de difícil control, los glucocorticoides son el tratamiento de elección. Además, el oclacitinib se presenta como una alternativa terapéutica prometedora.
Bibliografía
1. Morris, D. O. Ischemic Dermatopathies. Veterinary Clinics of North America - Small Animal Practice vol. 43 99–111 Preprint at https://doi.org/10.1016/j.cvsm.2012.09.008 (2013).
2. Gross, T. L., Ihrke, P. J., Walder, E. J. & Affolter, V. K. Skin Diseases of the Dog and Cat: Clinical and histopathologic Diagnosis. John Wiley & Sons (2008).
3. Backel, K. A. et al. Canine ischaemic dermatopathy: a retrospective study of 177 cases (2005–2016). Vet Dermatol 30, 403-e122 (2019).
4. Hargis, A. M., Haupt, K. H., Hegreberg, G. A., Prieur, D. J. & Moore, M. P. Familial canine dermatomyositis.Initial characterization of the cutaneous and muscular lesions. Am J Pathol (1984).
5. Bergvall, K. E. et al. Therapeutic response to pentoxifylline and its active metabolites in dogs with dermatomyositis. Vet Dermatol 13, 211–229 (2002).
6. Dzanis, D. et al. Dosing regimen and hematologic effects of pentoxifylline and its active metabolites in normal dogs. Vet Ther 4, 188–196 (2003).
7. Jewell, D. E. et al. Effects of Serum Vitamin E Levels on Skin Vitamin E Levels in Dogs and Cats. Vet Ther (2002).
8. Hargis, A., Haupt, K., Prieur, D. & Moore, M. A skin disorder in three Shetland Sheepdogs: Comparison with familial canine dermatomyositis of Collies. (1985).
9. Bresciani, F. et al. Dermatomyositis-like disease in a Rottweiler. Vet Dermatol 25, (2014).
10. Hargis, A. M., Haupt, K. H., Prieur, D. J. & Moore, M. P. Animal model of human disease. Dermatomyositis. Familial canine dermatomyositis. Am J Pathol 120, 323 (1985).
11. Ferguson, E. A., Cerundolo, R., Lloyd, D. H., Rest, J. & Cappello, R. Dermatomyositis in five Shetland sheepdogs in the United Kingdom. Veterinary Record 146, 214–217 (1999).
12. Clark, L. A., Credille, K. M., Murphy, K. E. & Rees, C. A. Linkage of dermatomyositis in the Shetland Sheepdog to chromosome 35. Vet Dermatol 16, 392–394 (2005).
13. Haupt, K. H. et al. Familial canine dermatomyositis: clinicopathologic, immunologic, and serologic studies. Am J Vet Res 46, 1870–1875 (1985).
14. Gross, T. L. & Kunkle, G. A. The Cutaneous Histology of Dermatomyositis in Collie Dogs. Vet Pathol 24, 11–15 (1987).
15. Haupt, K. H. et al. Familial canine dermatomyositis: clinical, electrodiagnostic, and genetic studies. Am J Vet Res 46, 1861–1869 (1985).
16. Evans, J. M. et al. Beyond the MHC: A canine model of dermatomyositis shows a complex pattern of genetic risk involving novel loci. PLoS Genet 13, (2017).
17. Stringer, E. et al. Treatment approaches to juvenile dermatomyositis (JDM) across North America: the Childhood Arthritis and Rheumatology Research Alliance (CARRA) JDM treatment survey. J Rheumatol 37, 1953–61 (1953).
18. Levy, B. J., Linder, K. E. & Olivry, T. The role of oclacitinib in the management of ischaemic dermatopathy in four dogs. Vet Dermatol 30, 201-e63 (2019).
 by Multimédica
by Multimédica