Bronconeumonía por Aelurostrongylus abstrusus en un gato joven
Resumen breve
Se describe el caso clínico de un gatito de 6 meses de edad que se presenta en consulta con un cuadro de tos e intolerancia al ejercicio, confirmándose la infección por la especie Aelurostrongylus abstrusus. El objetivo de este caso es señalar la importancia de incluir los parásitos pulmonares en el diagnóstico diferencial de los cuadros respiratorios de los gatos, especialmente si se trata de animales jóvenes con acceso libre al exterior y hábitos predatorios.Índice de contenidos
Resumen
Se describe el caso clínico de un gatito de 6 meses de edad, macho no castrado Común europeo, correctamente vacunado y desparasitado, negativo frente a retrovirus, que se presenta en consulta con un cuadro de tos e intolerancia al ejercicio. Su hábitat es una zona rural de la isla de Mallorca. Mediante radiografías de tórax y examen directo de heces frescas se hace un diagnóstico presuntivo de bronconeumonía por nematodos pulmonares, confirmándose posteriormente mediante la técnica de Baermann la infección por la especie Aelurostrongylus abstrusus. El paciente responde positivamente a tratamiento antihelmíntico y antiinflamatorio. El objetivo de este caso es señalar la importancia de incluir los parásitos pulmonares en el diagnóstico diferencial de los cuadros respiratorios de los gatos, especialmente si se trata de animales jóvenes con acceso libre al exterior y hábitos predatorios.
Introducción
Aelurostrongylus abstrusus (Strongylida, Angiostrongylidae) es el nematodo pulmonar más frecuente en el gato común (Felis catus) y su papel en el desarrollo de cuadros respiratorios de diferente gravedad está claramente establecido en esta especie. Sin embargo, en las últimas décadas se ha demostrado el papel patógeno de otras especies de nematodos en félidos domésticos, tales como Troglostrongylus brevior (Strongylida, Crenosomatidae) y Capillaria aerophila (Trichurida, Trichinellidae). Esta última tiene importancia por su papel zoonótico, ya que puede provocar enfermedad pulmonar severa en el ser humano. De forma poco frecuente se han encontrado en el tracto respiratorio de los gatos domésticos algunos parásitos sin papel patógeno claro, como son Oslerus rostratus (Rhabditida, Filaroididae), Troglostrongylus subcrenatus (Strongylida, Crenosomatidae) y Angiostrongylus chabaudi (Strongylida, Angiostrongylidae)1-3. Sin embargo, es importante tener en cuenta la existencia de esta variedad de parásitos, pues por un lado los estadios larvarios de algunos de ellos (p. ej., T. brevior y O. rostratus) son muy parecidos a los de A. abstrusus y pueden dar lugar a errores diagnósticos y, por otro lado, porque pueden darse coinfecciones de varias especies parásitas en el mismo animal.
El gato doméstico se considera el hospedador definitivo de Aelurostrongylus abstrusus, que presenta un ciclo de vida indirecto. Los hospedadores intermediarios del parásito son gasterópodos invertebrados (caracoles y babosas), donde las larvas en estadio 1 (L1) maduran y se transforman en las larvas infectivas en estadio 3 (L3). Estas son ingeridas por hospedadores paraténicos (roedores, aves y pequeños anfibios) al comerse los gasterópodos, quedando sus tejidos infectados. Los gatos se infectan al comerse dichos hospedadores paraténicos (presa más habitual para ellos que los gasterópodos)4. Una vez ingeridas, las L3 migran hasta los pulmones del hospedador definitivo a través de los vasos linfáticos, madurando hasta estadios adultos. Tras la fertilización las hembras ponen huevos que eclosionan en los alveolos y conductos pulmonares. Las L1 migran hasta la faringe, donde son deglutidas, hacen todo el recorrido del tracto gastrointestinal y pasan al ambiente a través de las heces del gato. Estas L1 penetran en los caracoles y las babosas, cerrando el ciclo5.
El ciclo de vida de T. brevior y C. aerophila es parecido, con la peculiaridad de que se ha demostrado la transmisión vertical de T. brevior de la madre a los gatitos a través del calostro y/o la leche1. En cualquier caso y debido a la ubicuidad de sus hospedadores intermedios, la prevalencia de estos parásitos pulmonares en Europa es elevada y muy posiblemente creciente, con una mayor incidencia en las regiones del sur y este continental3.
A. abstrusus tiene la capacidad de colonizar los bronquiolos y los alveolos del gato, produciendo un cuadro clínico muy variable, desde asintomático a severo, raramente fatal y normalmente más grave en gatitos jóvenes1,2. Por otro lado T. brevior se localiza frecuentemente en los bronquios y bronquiolos y, aunque suele provocar infecciones subclínicas o leves, puede ser fatal en gatitos2. C. aerophila se encuentra en la submucosa de la tráquea, bronquios y bronquiolos y normalmente provoca infecciones subclínicas, pero ocasionalmente se han descrito casos graves6.
La severidad del cuadro respiratorio depende de la especie involucrada y de la carga parasitaria1, así como de la cronicidad de la infección. Parece ser que los gatitos desarrollan cuadros más graves que los gatos adultos, lo cual se puede explicar por el menor diámetro de sus vías aéreas, que pueden quedar más fácilmente bloqueadas por los parásitos. La inmadurez del sistema inmunitario de los animales jóvenes también puede estar implicada en la mayor gravedad de la presentación clínica en estos individuos, sugiriéndose la existencia de cierto efecto protector de la inmunidad pasiva en pacientes infectados de forma experimental (aunque en otros estudios este efecto protector para prevenir la infección no ha quedado tan claro). El daño causado por A. abstrusus se atribuye a la reacción inflamatoria que se produce en el hospedador en respuesta a la presencia de los diferentes estadios del parásito en el tracto respiratorio5. Los gatos infectados pueden presentar signos clínicos moderados inespecíficos (fiebre, apatía, pérdida de peso y aumento de tamaño de los linfonodos) y signos respiratorios (tos, disnea, secreción nasal y ocular, aumento de sonidos respiratorios). Si bien no suelen observarse alteraciones bioquímicas, no es rara la presencia de leucocitosis, eosinofilia y linfocitosis en algunos pacientes, así como anomalías de la coagulación en algunos gatos afectados. Los parásitos provocan una reacción inflamatoria en los pulmones, principalmente a nivel bronquial, lo que se traduce en signos clínicos similares a los descritos en pacientes con bronquitis crónica o asma. En casos severos puede haber neumotórax o derrame pleural e incluso hipertensión arterial pulmonar con o sin fallo cardiaco derecho1.
El diagnóstico definitivo se realiza evidenciando la presencia de las L1 en heces frescas mediante la técnica de Baermann, que se basa en el hidrotropismo de las larvas vivas. Dicho diagnóstico debe ser realizado por personal cualificado ya que los estadios larvarios de los diferentes nematodos pulmonares son muy similares. Además, teniendo en cuenta la excreción intermitente habitual en los nematodos es altamente recomendable que se recojan heces frescas de varios días consecutivos para aumentar la sensibilidad de la prueba. Por otro lado, se debería evitar la contaminación con tierra, donde podría haber larvas de nematodos terrestres que pueden dar lugar a errores diagnósticos, así como minimizar la cantidad de arena del arenero, ya que se ha demostrado su poder deshidratante sobre las larvas, alterando su morfología y dificultando su posterior identificación7. Las características propias de la técnica de Baermann hacen que solo permita diagnosticar la patología en la fase clínica y depende directamente de que haya excreción de larvas en las heces8. En algunos casos la detección molecular de ADN parasitario mediante PCR de muestra de heces, hisopo faríngeo o incluso muestras obtenidas a través de lavado broncoalveolar puede aumentar la sensibilidad y especificidad, sobre todo en aquellos casos donde existe elevada sospecha clínica pero no se detectan las larvas en heces. Con fines de investigación se ha desarrollado una técnica ELISA para la detección de anticuerpos frente a A. abstrusus en suero8,9, pero a conocimiento de la autora no está disponible a nivel comercial. La seroconversión depende de la presencia de gusanos adultos machos, por lo que esta prueba tampoco sirve para diagnosticar infecciones inmaduras. Por otro lado, la seropositividad no permite diferenciar entre infección activa o pasada, ya que los anticuerpos pueden persistir hasta 30 días después de la muerte parasitaria1,8.
Los signos radiográficos no son patognomónicos de la parasitosis; es frecuente el hallazgo de patrones pulmonares alveolares, bronquiales y/o intersticiales, siendo el patrón intersticial difuso quizás el más frecuente. No es rara la detección de linfadenopatía esternal y la presencia de neumotórax y/o derrame pleural en casos graves5,10. Por otro lado, si bien la tomografía axial computarizada (TAC) es un método diagnóstico más sensible que la radiología para el diagnóstico de patologías torácicas extracardiacas, la necesidad de anestesia y el coste hacen que su uso no esté tan extendido para el diagnóstico de esta patología10. Es interesante tener en cuenta que hay varios casos descritos de hipertensión arterial pulmonar secundaria a infección por parásitos pulmonares (A. abstrusus y T. brevior) en gatos; se trata de casos aislados en los que no está claro el motivo por el que los pacientes desarrollaron esta complicación, hasta hace poco considerada rara en esta parasitosis y no habiéndose observado en infecciones experimentales10-13. También se han descrito casos graves por localización aberrante del parásito A. abstrusus14.
El tratamiento de los diferentes cuadros clínicos dependerá de la severidad de estos. De esta manera los cuadros leves únicamente requieren tratamiento antihelmíntico, mientras que los cuadros respiratorios más severos necesitarán tratamiento específico, desde glucocorticoides para reducir la inflamación bronquial, hasta broncodilatadores, oxigenoterapia o incluso toracocentesis en casos de neumotórax y/o derrame pleural. Se ha propuesto como tratamiento antihelmíntico oral el fenbendazol a dosis de 50 mg/kg/24 h durante 3, 5 o 15 días, así como la combinación de milbemicina y praziquantel como dosis única administrada 3 veces con 15 días de separación entre ellas. Entre los productos tópicos que sirven tanto para el tratamiento como para la prevención se encuentran las formulaciones tópicas de imidacloprid 10 % y moxidectina 1 %, emodepsida 2.1 % y praziquantel 8.6 %, selamectina, fluralaner 280 mg/ml y moxidectina 14 mg/ml y esafoxalaner, eprinomectina y praziquantel. Algunos recomiendan un tratamiento único mientras que otros requieren repetición, por lo que es importante revisar las fichas técnicas de los diferentes productos antiparasitarios1,15-17.
El pronóstico de la enfermedad es variable y normalmente está asociado a la presentación clínica, siendo favorable en los casos leves y reservado en los moderados y graves.
Caso clínico
Se presentó en consulta un gatito macho no castrado, Común europeo de unos 6 meses de edad, por un cuadro de varios días de tos e intolerancia al ejercicio que había empeorado en las 24 horas previas a la visita. La historia del paciente era parcialmente desconocida ya que había sido rescatado dos meses y medio antes en la zona rural donde vivían sus tutores. El gato había estado con su madre, una gata silvestre, pero tras una tormenta tanto ella como el resto de los gatitos de la camada habían desaparecido y el que permaneció en la zona fue rescatado y adoptado. Se le realizó una prueba ELISA frente a retrovirus en el momento de la adopción y se repitió a los dos meses, resultando en ambos casos negativa frente al virus de la leucemia felina y el virus de la inmunodeficiencia felina. De acuerdo con las recomendaciones de vacunación actuales el gatito recibió tres dosis de vacuna frente a calicivirus felino, herpesvirus felino y panleucopenia y dos dosis de vacuna frente al virus de la leucemia felina. Se desparasitó dos veces separadas por 15 días con una dosis adecuada para su peso de milbemicina oxima y praziquantel. Según sus tutores el gatito había estado clínicamente normal hasta unas semanas antes de la visita, cuando había empezado a toser puntualmente. La tos fue aumentando en intensidad y frecuencia, apareciendo cierta fatiga tras el juego los días previos a la visita.
En consulta el gato estaba alerta y activo, pero presentaba una moderada disnea mixta de tipo inspiratorio-espiratorio y taquipnea (60 respiraciones por minuto). Las membranas mucosas estaban rosadas y húmedas, la auscultación cardiaca no reveló sonidos anormales, pero si una taquicardia de 240 lpm, a la auscultación pulmonar se detectó un aumento de sonidos respiratorios a nivel dorsal, no se detectaron linfadenopatías periféricas ni alteraciones en la palpación abdominal y la temperatura rectal era normal.
Se sedó ligeramente al paciente con butorfanol a una dosis de 0.3 mg/kg en inyección intramuscular y se colocó en la jaula de oxigenoterapia durante 20 minutos. Posteriormente se realizó una única radiografía lateral derecha de tórax (Figura 1) para minimizar el estrés y las posibles complicaciones derivadas del mismo.
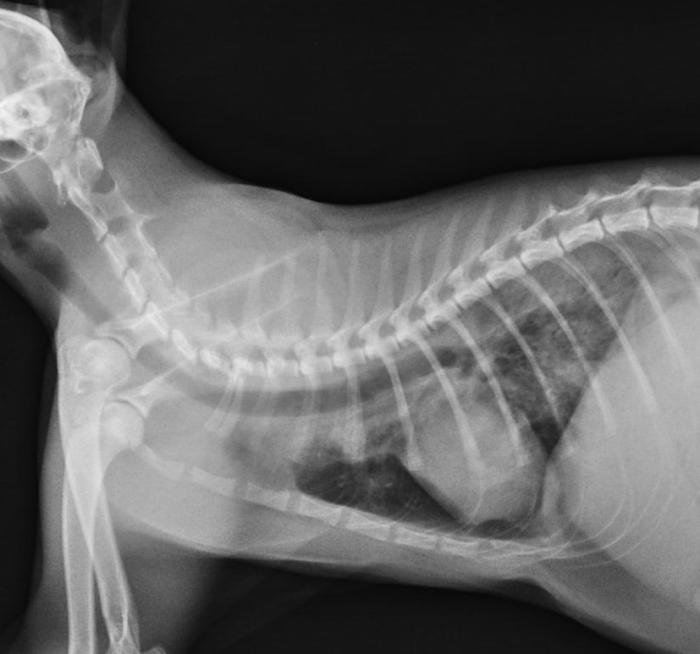
Figura 1. Radiografía laterolateral derecha de tórax (día 1).
En la imagen radiográfica se observó una ligera elevación de la silueta cardiaca sobre el esternón con aumento de la radiolucidez de los campos pulmonares ventrales, compatible con un neumotórax leve, así que un patrón pulmonar broncointersticial moderado y generalizado. Se obtuvo una muestra de sangre para la realización de una hematología y una bioquímica séricas y se examinó al microscopio una muestra de heces frescas obtenidas con el termómetro. Si bien no se detectaron alteraciones analíticas en las muestras sanguíneas, sí se observaron larvas móviles de pequeño tamaño en las muestras de heces frescas (Figura 2, Vídeo 1).
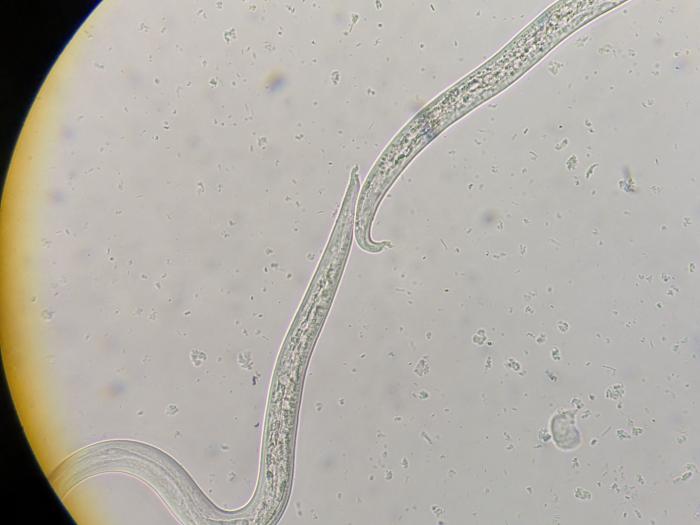
Figura 2. Imagen microscópica a 10x de dos colas de L1 de A. abstrusus.
Vídeo 1. L1 de A. abstrusus.
Se procedió entonces a recoger una muestra un poco mayor del paciente y se procesó para su envío al laboratorio, solicitándose la realización de la técnica de Baermann sobre la misma.
Se realizó un diagnóstico presuntivo de bronconeumonía verminosa y se pautó un tratamiento con fenbendazol a 50 mg/kg/24 h durante 15 días y metilprednisolona a 0.7 mg/kg/24 h VO, citándose al paciente a las 48 horas para comprobar la evolución del cuadro y descartar que fuese necesario realizar una toracocentesis. En dicha visita se confirmó que el paciente estaba estable, se había reducido la intensidad y frecuencia de la tos y se confirmó radiográficamente la resolución del neumotórax (Figura 3).
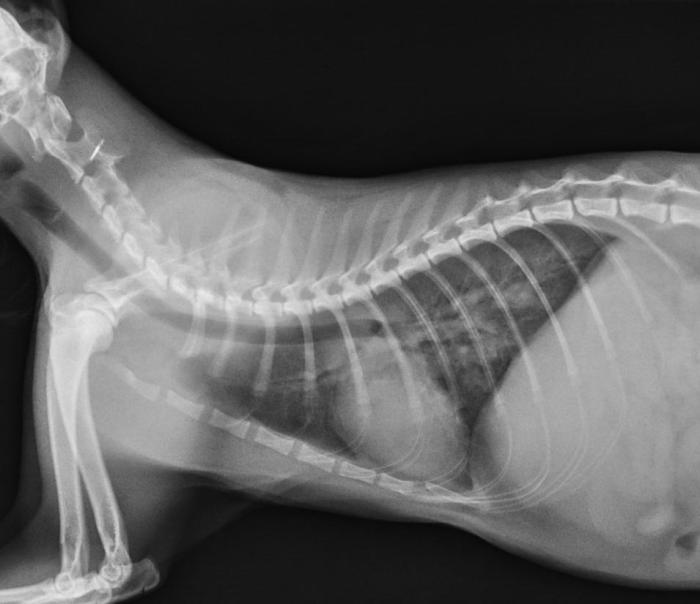
Figura 3. Radiografía laterolateral derecha de tórax (día 3).
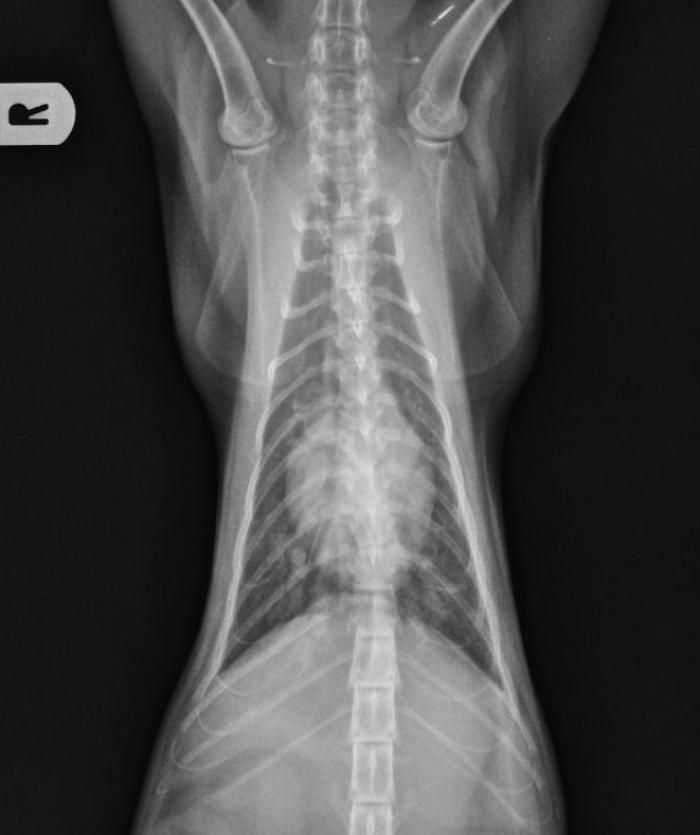
Al día siguiente llegaron los resultados laboratoriales que confirmaron la presencia de múltiples larvas L1 del nematodo Aelurostrongylus abstrusus en la muestra de heces enviada. Se mantuvo el mismo tratamiento y se citó al paciente 12 días después, cuando se cumplían los 15 días del tratamiento antihelmíntico y antiinflamatorio. En esa visita la tutora reportó una mejoría sustancial, habiendo desaparecido la tos, pero persistiendo una leve intolerancia al ejercicio. Se realizaron dos proyecciones radiográficas de control (laterolateral derecha y ventrodorsal, Figura 4A-B) donde se observó una mejoría del patrón pulmonar pero no la resolución total de las alteraciones radiográficas.
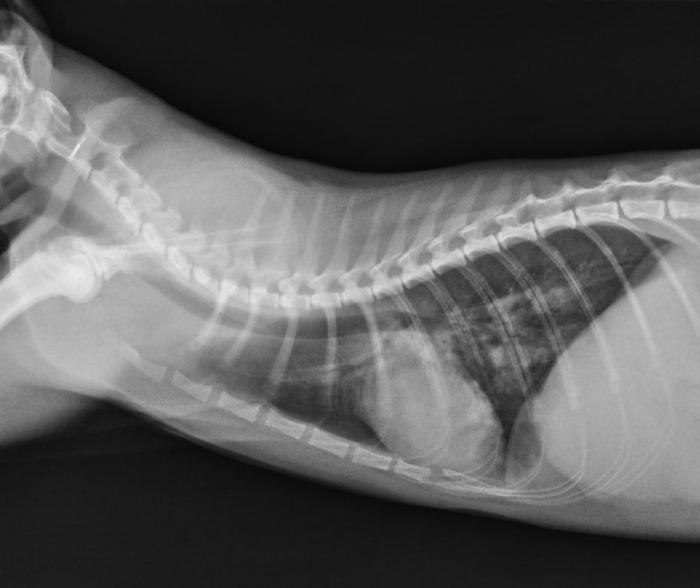
Figura 4. Radiografía (A) laterolateral derecha y (B) ventrodorsal de tórax (día 15).
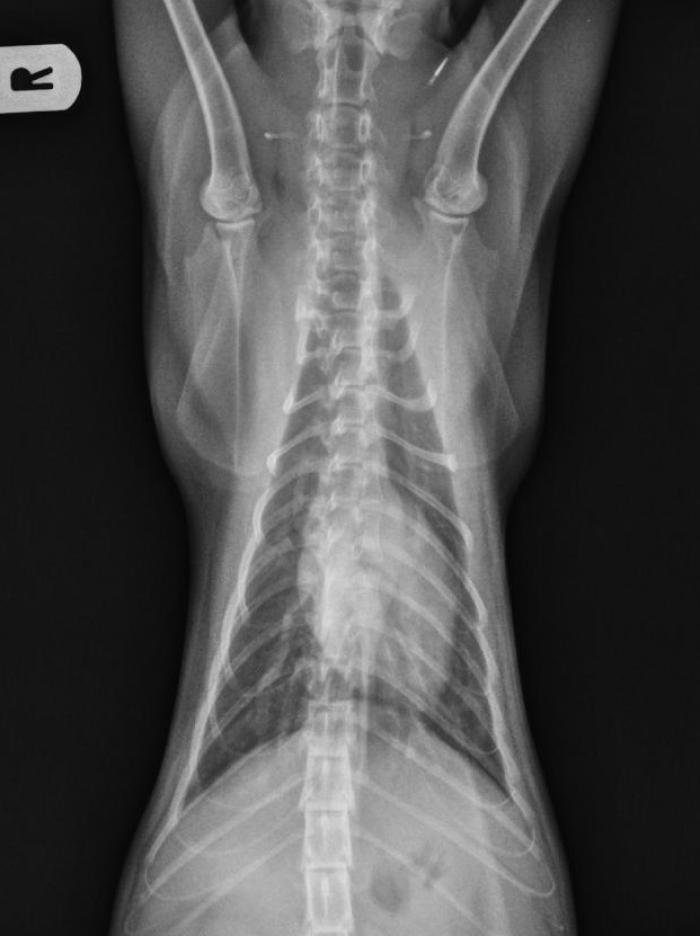
En ese momento se inició una reducción progresiva de la dosis de metilprednisolona hasta su suspensión total una semana después y se citó al paciente a las dos semanas. La anamnesis reveló una mejoría clínica total y las radiografías de tórax (Figura 5A-B) mostraron mejoría del patrón pulmonar broncointersticial, aunque no su normalización.
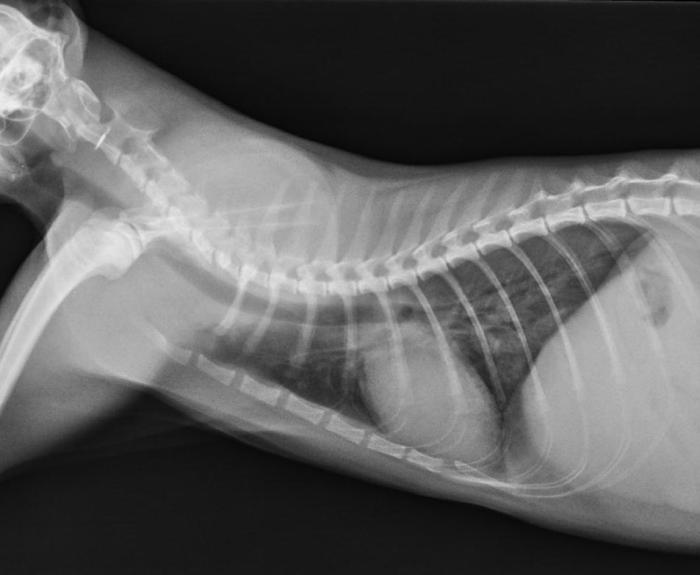
Figura 5. Radiografía (A) laterolateral derecha y (B) ventrodorsal de tórax (día 30).
Teniendo en cuenta la clínica del paciente se le dio el alta médica, pautándose como tratamiento preventivo a partir de ese momento el uso continuado de un producto tópico antiparasitario con efectividad demostrada frente a nematodos pulmonares, ya que el gatito iba a tener una estilo de vida con libre acceso al exterior en la misma zona rural.
Discusión
Las infecciones por nematodos pulmonares se consideran un problema creciente en el gato doméstico y la información científica que tenemos sobre ellas ha aumentado de forma notable en los últimos años. Numerosas publicaciones hacen referencia a la distribución, métodos de transmisión y cuadros clínicos provocados por estos parásitos, habiendo quedado claramente demostrada su ubicuidad y, muy probablemente, el aumento de su prevalencia, que muchos expertos asocian al aumento de las temperaturas asociado al cambio climático1-3. Si bien Aelurostrongylus abstrusus es el clásico gusano pulmonar felino, otras especies anteriormente no descritas o detectadas únicamente en felinos salvajes empiezan a encontrarse en nuestros pacientes domésticos, algunas provocando cuadros clínicos y otras de curso asintomático1,17.
Es por tanto imprescindible tener estos parásitos presentes al elaborar el diagnóstico diferencial de los gatos que se presenten en la clínica con cuadros respiratorios, sobre todo si se trata de gatos con acceso al exterior y hábitos predatorios (debido al ciclo de vida del nematodo), pero también en gatitos jóvenes con historia previa desconocida, ya que se ha demostrado la transmisión transmamaria de Troglostrongylus brevior, parásito considerado emergente y sobre el que cada vez tenemos más información sobre su prevalencia y patogenicidad1-3. Es también importante incluir la infección por nematodos pulmonares en gatos que se presenten con cuadros de hipertensión arterial pulmonar, ya que esta puede ser una complicación rara de la parasitosis en ciertos individuos1,11-13.
En el caso aquí presentado la observación de larvas móviles en heces frescas de un paciente joven con un cuadro respiratorio de tipo bronquial orientó el diagnóstico a una bronquitis verminosa; sin embargo, es importante tener en cuenta que no siempre nos encontramos con situaciones tan claras debido a varios factores; por un lado, los nematodos pulmonares, como otros parásitos, se caracterizan por presentar excreción intermitente en heces, con lo cual pueden no estar presentes en las deposiciones del animal en el momento de la visita veterinaria. Por ello se recomienda siempre la recogida de heces de tres días consecutivos para su análisis en el laboratorio. Esto tiene, a su vez, tres limitaciones importantes: la primera es que muchos de los gatos afectados por parásitos pulmonares tienen un estilo de vida libre en el exterior y por tanto defecan fuera de la casa (y del arenero), lo que implica que muchos tutores no puedan recoger las muestras requeridas. En segundo lugar, las larvas de nematodos se deshidratan a medida que pasa el tiempo tras la deposición, fenómeno que empeora por el contacto con el material del arenero, con lo que la diferenciación de las especies de nematodos puede verse dificultada. Y, en tercer lugar, la técnica de Baermann tarda un mínimo de 24 horas, lo cual retrasa el diagnóstico definitivo de la parasitosis pulmonar5,7. La detección de ADN parasitario tampoco es un proceso rápido y la realización de broncoscopias con toma de muestras por lavado broncoalveolar puede facilitar el diagnóstico, pero no es una técnica exenta de riesgos en pacientes con compromiso respiratorio. A todo esto, hay que añadir que A. abstrusus no es la única especie que puede afectar a nuestros pacientes felinos, por lo que cada vez más es importante obtener un diagnóstico etiológico certero.
En cuanto al tratamiento de la infección por A. abstrusus se han publicado múltiples opciones con diferentes resultados1. En nuestro caso optamos por el uso de fenbendazol oral por varias razones: el paciente ya había recibido dos dosis de una combinación de milbemicina oxima y praziquantel antes del desarrollo del cuadro; si bien las referencias sobre este tratamiento indican que la máxima eficacia se alcanzó tras tres tratamientos separados por 15 días1, nos pareció más oportuno usar un antihelmíntico diferente. Por otro lado, el paciente toleraba la administración oral de comprimidos y convivía con otros gatos con los que tenía una relación cercana, acicalándose entre ellos, lo que nos hizo pensar que un producto formulado para su administración tópica no era la mejor opción inicialmente.
La necesidad de administrar tratamientos complementarios al antihelmíntico en estas infecciones depende de la severidad del cuadro clínico; en este caso la presencia de tos e intolerancia al ejercicio nos hizo optar por la administración concomitante de prednisolona a dosis antiinflamatoria para controlar la inflamación bronquial.
En cuanto al pronóstico, tal y como se observa en nuestro caso, es favorable si se realiza un diagnóstico temprano, pero el retraso en la detección del parásito y su tratamiento puede dar lugar a lesiones pulmonares o cardiopulmonares que pueden llegar a ser fatales1,12-14.
Bibliografía
- Traversa D, Morelli S, Di Cesare A, Diakou A. Felid Cardiopulmonary Nematodes: Dilemmas Solved and New Questions Posed. Pathogens. 2021 Jan 2;10(1):30.
- Pennisi MG, Hartmann K, Addie DD, Boucraut-Baralon C, Egberink H, Frymus T, Gruffydd-Jones T, Horzinek MC, Hosie MJ, Lloret A, Lutz H, Marsilio F, Radford AD, Thiry E, Truyen U, Möstl K; European Advisory Board on Cat Diseases. Lungworm disease in cats: ABCD guidelines on prevention and management. J Feline Med Surg. 2015 Jul;17(7):626-36.
- Giannelli A, Capelli G, Joachim A, Hinney B, Losson B, Kirkova Z, René-Martellet M, Papadopoulos E, Farkas R, Napoli E, Brianti E, Tamponi C, Varcasia A, Margarida Alho A, Madeira de Carvalho L, Cardoso L, Maia C, Mircean V, Mihalca AD, Miró G, Schnyder M, Cantacessi C, Colella V, Cavalera MA, Latrofa MS, Annoscia G, Knaus M, Halos L, Beugnet F, Otranto D. Lungworms and gastrointestinal parasites of domestic cats: a European perspective. Int J Parasitol. 2017 Aug;47(9):517-528.
- Colella V, Knaus M, Lai O, Cantile C, Abramo F, Rehbein S, Otranto D. Mice as paratenic hosts of Aelurostrongylus abstrusus. Parasit Vectors. 2019 Jan 22;12(1):49.
- Elsheikha HM, Schnyder M, Traversa D, Di Cesare A, Wright I, Lacher DW. Updates on feline aelurostrongylosis and research priorities for the next decade. Parasit Vectors. 2016 Jul 7;9(1):389.
- Knaus M, Shukullari E, Rapti D, Rehbein S. Efficacy of Broadline against Capillaria aerophila lungworm infection in cats. Parasitol Res. 2015 May;114(5):1971-5.
- Abbate JM, Arfuso F, Gaglio G, Napoli E, Cavalera MA, Giannetto S, Otranto D, Brianti E. Larval survival of Aelurostrongylus abstrusus lungworm in cat litters. J Feline Med Surg. 2019 Oct;21(10):992-997.
- Raue K, Raue J, Hauck D, Söbbeler F, Morelli S, Traversa D, Schnyder M, Volk H, Strube C. Do All Roads Lead to Rome? The Potential of Different Approaches to Diagnose Aelurostrongylus abstrusus Infection in Cats. Pathogens. 2021 May 14;10(5):602.
- Zottler EM, Strube C, Schnyder M. Detection of specific antibodies in cats infected with the lung nematode Aelurostrongylus abstrusus. Vet Parasitol. 2017 Feb 15;235:75-82.
- Lacava G, Zini E, Marchesotti F, Domenech O, Romano F, Manzocchi S, Venco L, Auriemma E. Computed tomography, radiology and echocardiography in cats naturally infected with Aelurostrongylus abstrusus. J Feline Med Surg. 2017 Apr;19(4):446-453.
- Napoli E, Pugliese M, Basile A, Passantino A, Brianti E. Clinical, Radiological, and Echocardiographic Findings in Cats Infected by Aelurostrongylus abstrusus.Pathogens. 2023 Feb 7;12(2):273.
- Vezzosi T, Perrucci S, Parisi F, Morelli S, Maestrini M, Mennuni G, Traversa D, Poli A. Fatal Pulmonary Hypertension and Right-Sided Congestive Heart Failure in a Kitten Infected with Aelurostrongylus abstrusus. Animals (Basel). 2020 Dec 1;10(12):2263.
- Crisi PE, Traversa D, Di Cesare A, Luciani A, Civitella C, Santori D, Boari A. Irreversible pulmonary hypertension associated with Troglostrongylus brevior infection in a kitten. Res Vet Sci. 2015 Oct;102:223-7.
- Tinoco FV, Morelli S, de Farias Brito M, Oliveira Pereira G, Correia Oliveira M, Diakou A, Colombo M, Frangipane di Regalbono A, Traversa D. Hemorrhagic Meningoencephalomyelitis Due to Ectopic Localization of Aelurostrongylus abstrusus in a Cat: First Case Report. Animals (Basel). 2022 Jan 6;12(2):128.
- Raulf MK, Raue K, Rohdich N, Zschiesche E, Raue J, Merhof K, Volk HA, Schnyder M, Morelli S, Traversa D, Roepke RKA, Strube C. Efficacy of Bravecto® Plus spot-on solution for cats (280 mg/ml fluralaner and 14 mg/ml moxidectin) in the prevention of feline Aelurostrongylus abstrusus infection evaluated in a multi-diagnostic approach. Parasit Vectors. 2024 Apr 24;17(1):193.
- Beugnet F. NexGard® Combo (esafoxolaner, eprinomectin, praziquantel), a new endectoparasiticide spot-on formulation for cats. Parasite. 2021;28:1.
- Morelli S, Diakou A, Colombo M, Di Cesare A, Barlaam A, Dimzas D, Traversa D. Cat Respiratory Nematodes: Current Knowledge, Novel Data and Warranted Studies on Clinical Features, Treatment and Control. Pathogens. 2021 Apr 10;10(4):454.
 by Multimédica
by Multimédica
