Doble infección de un gato con parásitos broncopulmonares: Dirofilaria immitis y Aelurostrongylus abstrusus
Resumen breve
La dirofilariosis felina y la aelurostrongilosis felina son dos enfermedades parasitarias pulmonares que han sido infradiagnosticadas durante mucho tiempo en el gato doméstico. Esto se debe principalmente a su semejanza con otras patologías respiratorias más comunes. Con el paso del tiempo, estas enfermedades han tomado importancia entre los clínicos veterinarios, así como también ha aumentado su conocimiento entre los propietarios. Sin embargo, siguen siendo dos patologías cuya prevalencia…Índice de contenidos
Introducción
La dirofilariosis felina y la aelurostrongilosis felina son dos enfermedades parasitarias pulmonares que han sido infradiagnosticadas durante mucho tiempo en el gato doméstico. Esto se debe principalmente a su semejanza con otras patologías respiratorias más comunes. Con el paso del tiempo, estas enfermedades han tomado importancia entre los clínicos veterinarios, así como también ha aumentado su conocimiento entre los propietarios. Sin embargo, siguen siendo dos patologías cuya prevalencia se ha estudiado en pocos lugares del territorio español. Aquellos gatos que viven en zonas con acceso al exterior se pueden ver expuestos a los hospedadores intermediarios y/o paraténicos, por lo que presentarán una mayor probabilidad de infección. En contraposición, los gatos que únicamente habitan en el interior del hogar no están exentos de contagio; por ejemplo, están expuestos al vector de la dirofilariosis felina. Por estos motivos, el objetivo principal de este artículo es señalar la importancia de estas parasitosis respiratorias en el gato mediante la descripción de un caso clínico.
Caso clínico
Se presenta en consulta una gata hembra, entera, raza común europeo de pelo corto, 2 años de edad y 3.7 kg. La gata era residente de una zona de clima templadohúmedo (Arucas, Gran Canaria, España). Después de haber desaparecido de su hogar durante 5 meses, sus propietarios la llevaron a su clínica veterinaria habitual donde le administraron un antibiótico y un antiparasitario a base de imidacloprid y moxidectina en spot-on.Tras llegar a casa, la gata comenzó a mostrar disnea y toses, por lo que se trasladó al centro veterinario de referencia.
Durante la consulta, la propietaria refirió que el animal no se encontraba vacunado ni desparasitado. Asimismo, desconocía el antibiótico que le habían administrado en su veterinario habitual. Antes de desaparecer, la gata vivía dentro de casa junto con otros dos perros y tenía acceso al exterior. No presentaba patologías previas. En el examen físico se encontraba decaída y mostraba presencia de un moderado patrón restrictivo de vías aéreas inferiores con evidente esfuerzo respiratorio mixto. Asimismo, presentaba respiración oral y ausencia de descarga nasal.
Las mucosas estaban levemente pálidas y presentaba una deshidratación del 7%. A la auscultación, se evidenciaron crepitaciones húmedas en ambos hemitórax, además de leves sibilancias y ronquido bronquial; no se apreciaba soplo ni arritmias cardiacas. En el examen del pulso femoral se concluye fuerte, regular, igual, simétrico y sincrónico. Los linfonodos estaban dentro de los límites normales. La temperatura rectal era de 38ºC (Figura 1).
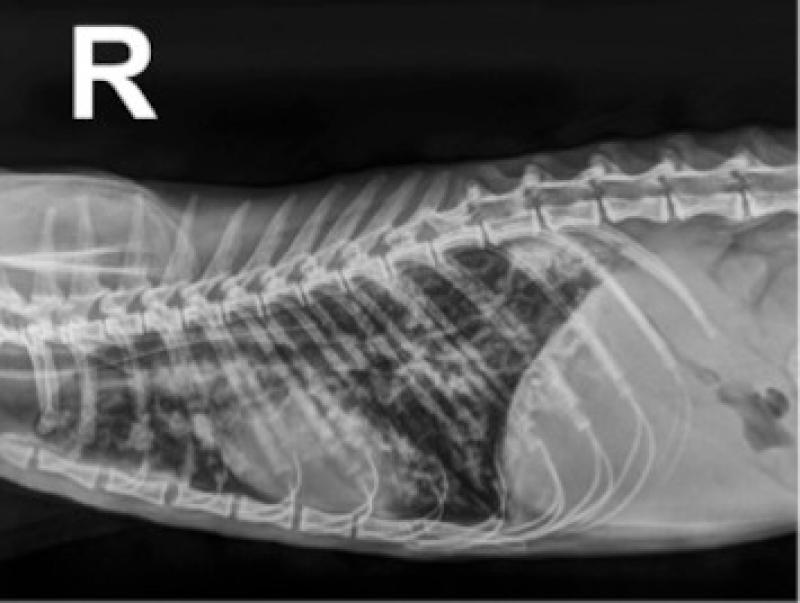
Se procedió a realizar dos proyecciones radiológicas a nivel torácico (laterolateral derecha y dorso-ventral). Estas radiografías mostraron un moderado patrón bronco-intersticial difuso bilateral a nivel del parénquima pulmonar, más evidente en los lóbulos caudales. No se observó cardiomegalia ni aumento de la vasculatura pulmonar.También se descartó la presencia de efusión pleural (Figura 2).
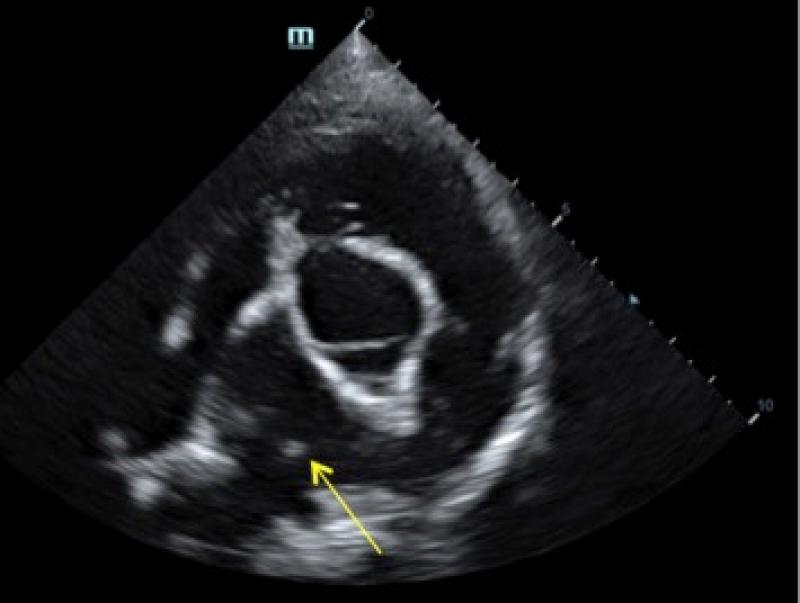
Posteriormente, se recolectaron muestras de sangre para realizar hemograma y bioquímica. Los resultados del hemograma mostraron reticulocitosis y leucocitosis, con neutrofilia, monocitosis, basofilia y eosinofilia. En los resultados de la bioquímica no se reportaron alteraciones relevantes. Además, se realizó un test rápido de antígenos específicos del virus de la Leucemia Felina (FeLV) y anticuerpos específicos contra el virus de la Inmunodeficiencia Felina (FIV) (Uranotest FeLV-FIV, UranoVet S.L., Barcelona), obteniendo un resultado positivo para FIV. A su vez, la muestra de sangre fue analizada empleando el kit de inmunocromatografía para detección de antígenos de Dirofilaria immitis (Uranotest Dirofilaria, UranoVet S.L., Barcelona), cuyo resultado fue positivo. Tras estos resultados, se decidió realizar un estudio ecocardiográfico completo. No se observaron alteraciones significativas a nivel funcional ni hemodinámico del corazón y se descartaron posibles enfermedades congénitas. Sin embargo, en el corte paraesternal derecho en eje corto, se observaron 2 imágenes compatibles con adultos de D. immitis a nivel de la bifurcación de las arterias pulmonares (Figura 3). Se decidió hospitalizar al animal para estabilizarlo mediante terapia de soporte (oxigenoterapia y fluidoterapia) y tratamiento sintomático, administrando doxiciclina VO a 10 mg/kg/12 horas durante 15 días, y prednisona VO a dosis decrecientes, empezando por 1 mg/kg/24 horas durante otros 3 días, y posteriormente, 0.5 mg/ kg/24 horas durante 3 días. Asimismo, se realizaron nebulizaciones con suero fisiológico cada 12 horas para mantener las vías aéreas húmedas.
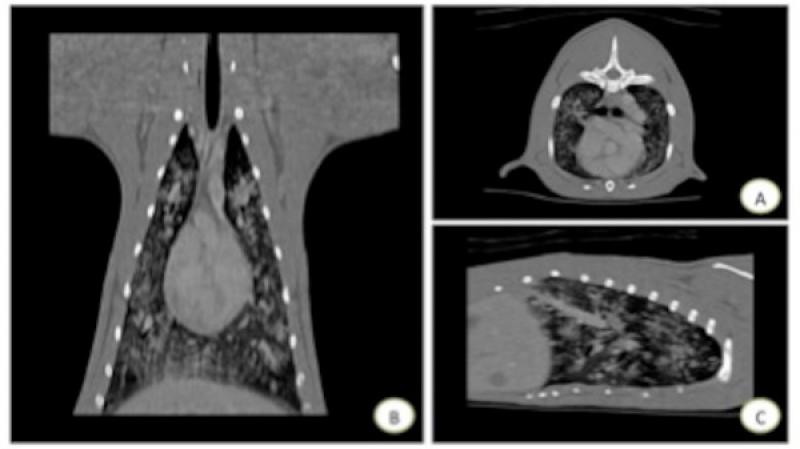
Durante la hospitalización, se recogieron muestras de heces de tres días diferentes para descartar la presencia de otros nematodos broncopulmonares empleando técnicas de flotación con ClNa, sedimentación y método de Baermann. Tras la prueba de flotación no se detectó ningún parásito, pero con la técnica de sedimentación y la técnica de Baermann se vieron numerosas larvas de nematodos broncopulmonares, identificadas como Aelurostrongylus abstrusus. Tras el diagnóstico, se administró fenbendazol 50 mg/kg/24 horas durante 3 días, repitiendo el tratamiento a los 15 días. Además, una vez estabilizada la paciente, se realizó un estudio de Tomografía Axial Computerizada (TAC) en el que se identificó un moderado patrón bronco-intersticial con aumento de atenuación de tejido blando de forma difusa en ambos pulmones, con buena visualización de la vasculatura y sin presencia de broncogramas aéreos ni signo lobar. Se observaron múltiples lesiones consolidadas de atenuación de tejido blando, aunque con márgenes irregulares y en algunos casos mal definidos, de forma aleatoria, afectando principalmente a los lóbulos caudales de ambos hemitórax. Se apreciaron ligeros signos de linfadenopatía y no se visualizó fisura pleural (Figura 4). En base a las pruebas diagnósticas realizadas, se concretó el diagnóstico definitivo de parasitación múltiple por nematodos broncopulmonares (D. immitis y A. abstrusus).
El animal estuvo hospitalizado durante 5 días, en los cuales se llevaron a cabo controles radiológicos cada 24 horas. En base a la evolución radiológica y mejoría sintomatológica, se decidió dar el alta a la paciente, continuando con el tratamiento en su domicilio.
Una vez finalizado el tratamiento, se llevó a cabo una revisión. La propietaria refirió que el animal mostró una considerable mejoría, tras la cual no presentaba tos ni disnea. Durante la consulta, se realizó un último estudio radiológico torácico con dos proyecciones (latero-lateral derecha y dorso-ventral), en el que se pudo observar la persistencia de ligeras áreas compatibles con lesiones broncointersticiales. A pesar de ello, se confirmó la ausencia de toses, respiración bucal, dificultad respiratoria, así como de sonidos respiratorios patológicos durante la auscultación torácica. Asimismo, se realizó una ecocardiografía de control, en la que se evidenció la persistencia de imágenes compatibles con adultos de D. immitis. Dado que no existe un tratamiento eficaz para los adultos de D. immitis en gatos, se recomendaron revisiones cardiorrespiratorias cada seis meses, y se propuso el uso de moxidectina en spot-on para evitar reinfecciones de ambos parásitos.
Discusión
D. immitis y A. abstrusus son dos nematodos que afectan al sistema respiratorio de la especie felina. El primero se observa con muy poca frecuencia en la clínica veterinaria diaria, ya que los gatos son hospedadores imperfectos y se caracterizan por ser más resistentes a la infección que los perros. Por ello, no es frecuente que las larvas pre-adultas sobrevivan cuando alcanzan el pulmón de los gatos. Este hecho explica que el número de parásitos adultos que puede desarrollar la especie felina sea mucho menor (1-3 gusanos adultos) en comparación a los cánidos. La prevalencia en España es desconocida, aunque se han realizado estudios en las regiones de Cataluña, Madrid, Zaragoza e Islas Canarias. Sin embargo, se reconoce que la prevalencia de dirofilariosis en gatos es del 5 al 20% de la prevalencia en los perros de esa misma región. Por ello, se considera que es una enfermedad en expansión y que está siendo infradiagnosticada.
Por otro lado, A. abstrusus es considerado el parásito broncopulmonar más común en el gato, siendo esta especie un hospedador natural o definitivo. Además, al igual que D. immitis, se han reportado casos de infección por este parásito en otras especies felinas. En Europa se ha informado de bastantes casos clínicos y estudios de epidemiológicos de la enfermedad en el gato; sin embargo, en España hasta la fecha sólo se han descrito casos clínicos en Bilbao, Logroño, León, Madrid, Ibiza y las Islas Canarias, lo que indica que sea una patología que posiblemente también esté siendo subestimada.
Estos parásitos tienen una distribución mundial, aunque requieren unas condiciones climatológicas específicas para poder desarrollarse (climas húmedos y cálidos), por lo que su incidencia varía según la zona geográfica en la que nos encontremos. Por un lado, D. immitis se transmite a través de la picadura de mosquitos culícidos que previamente han ingerido larvas de un hospedador definitivo (perro) infectado. De esta manera, los gatos que vivan tanto en el interior como en el exterior del hogar están expuestos al parásito. Por el contrario, la transmisión de A. abstrusus se basa en la ingesta de gasterópodos terrestres, por lo que es más frecuente observar la infección en gatos de hábitat mixto o exterior estricto. La infección también puede producirse si se ingieren hospedadores paraténicos, que suelen ser roedores, pájaros o reptiles, entre otros. Debido al cambio climático, la modificación del paisaje mediante la creación de zonas de cultivos y núcleos urbanos por parte del ser humano, o la introducción de nuevas especies de mosquitos, las prevalencias de estas parasitosis se están viendo incrementadas.
D. immitis es también conocido como el “gusano del corazón”, ya que habita en la vasculatura pulmonar (tronco pulmonar, arterias y arteriolas pulmonares) y, en algunos casos, puede llegar a las cámaras cardiacas derechas. Por otro lado, A. abstrusus recibe el nombre coloquial de “gusano pulmonar”, puesto que se localiza en alveolos, conductos alveolares y bronquiolos del gato infectado.
Estas dos enfermedades se caracterizan por padecer una presentación clínica muy similar: toses intermitentes, estornudos, esfuerzo respiratorio (disnea, taquipnea, respiración abdominal) y otras afecciones de las vías respiratorias bajas. Con frecuencia, el hecho de compartir esta sintomatología tan semejante conlleva a su confusión en la clínica diaria que, a su vez, frecuentemente son confundidos con otras patologías respiratorias más comunes como el asma felino, bronquitis crónica o neumonía no parasitaria. Además, ambas enfermedades pueden causar signos inespecíficos y generalizados, tales como vómitos, anorexia, pérdida de peso o fiebre, e incluso pueden ser aparentemente asintomáticos. Asimismo, se han descrito casos clínicos en los que se han observado signos ecocardiográficos compatibles con hipertensión pulmonar.
Por esta razón, son necesarias diferentes pruebas diagnósticas para reconocer la etiología de la sintomatología respiratoria.
Por un lado, el diagnóstico de D. immitis en la especie felina es muy complicado y muchas veces no es concluyente. Por ello, se deben emplear múltiples pruebas diagnósticas, como son las radiografías torácicas, test de detección de antígenos, test de detección de anticuerpos, y ecocardiografía. En ocasiones, el estudio radiológico puede mostrar un aumento y mayor tortuosidad de las arterias lobares principales, arterias pulmonares periféricas y lobares caudales.
También es frecuente observar un patrón pulmonar bronco-intersticial focal o multifocal, o bien hiperinsuflación pulmonar o consolidación de algún lóbulo pulmonar.
No es habitual que la silueta cardiaca se vea modificada. El test de antígenos es útil para diagnosticar la enfermedad; sin embargo, un resultado negativo no descarta la infección. Esto es debido a que el test solo detecta antígenos de parásitos adultos, principalmente hembras, y es posible obtener un resultado falso negativo debido a la baja carga parasitaria, a la presencia únicamente de filarias adultas macho, o bien a que la sintomatología esté siendo producida por las fases juveniles parasitarias.
Por otro lado, un resultado positivo en la prueba de detección de anticuerpos no indica necesariamente infección, sino que únicamente demuestra la exposición al parásito, de manera de que un resultado positivo puede ser indicativo tanto de infección presente como pasada. Además, en la actualidad los test de anticuerpos todavía no se encuentran comercializados en España. La ecocardiografía es la prueba más sensible para detectar imágenes compatibles con parásitos adultos en las arterias pulmonares y, si llegase a ser el caso, en las cámaras cardiacas derechas. Sin embargo, se requiere experiencia por parte del operador, ya que se pueden confundir fácilmente con artefactos.

El estudio radiológico resulta de utilidad para el diagnóstico de A. abstrusus; los gatos infectados suelen presentar un patrón bronco-intersticial difuso, muy similar al que suele mostrar la infección por D. immitis. También es frecuente hallar un patrón alveolar generalizado en estadios tempranos y en casos severos. Es posible realizar lavados broncoalveolares, frotis mediante hisopos faríngeos y secreción respiratoria de los animales infectados. Sin embargo, estas técnicas sólo pueden detectar la presencia de larvas de primer estadio (L1) cuando hay una alta producción de larvas. El lavado broncoalveolar también muestra elevación de eosinófilos, pero éste no es un hallazgo patognomónico, ya que tanto D. immitis como el asma felina, entre otros, también pueden inducir una alta producción de eosinófilos en las vías respiratorias bajas. Por otro lado, son pruebas que requieren sedación lo que podría ser un inconveniente en animales inestables. El método diagnóstico definitivo se basa en la realización de pruebas coprológicas, siendo la técnica de Baermann el gold standard debido a su alta sensibilidad (Figura 5). Esta prueba diagnóstica tiene como objetivo detectar L1. Puesto que la eliminación de las larvas es intermitente o con un número muy bajo en las heces, se recomienda analizar las muestras fecales de varios días (generalmente de 3 días). El inconveniente de esta prueba es que el resultado tarda en obtenerse entre 12-24 horas.
Asimismo, al realizar pruebas coprológicas es necesario conocer todas las características morfológicas del parásito, ya que es necesario discriminar de otros parásitos pulmonares, como Troglostrongylus spp., u Oslerus rostratus. Actualmente no existen pruebas serológicas comerciales para el diagnóstico de A. abstrusus. En anteriores ensayos serológicos se encontraron limitaciones debido a las reacciones cruzadas con los antígenos de otros parásitos y las escasas discriminaciones entre infecciones actuales y antiguas. A pesar de ello, se han seguido realizando varias investigaciones al respecto, y se han conseguido pruebas serológicas bastante prometedoras, de modo que existe la probabilidad de que en un futuro no muy lejano podamos estar al alcance de dichos ensayos. A pesar de que ambos parásitos afectan al sistema respiratorio de la especie felina, el tratamiento difiere y por lo tanto, se requiere un certero diagnóstico para delimitar la terapia más adecuada. En general, la infección por A. abstrusus puede ser tratada fenbendazol (20-50 mg/kg/24 horas de 3 a 20 días), aunque hoy en día este tratamiento queda en desuso frente al empleo de emodepsida y lactonas macrocíclicas, cuya eficacia es muy elevada y su aplicación mucho más sencilla. Los productos de aplicación tópica que contienen emodepsida, moxidectina y eprinomectina han demostrado ser altamente eficaces tras una única aplicación, deteniendo la producción de larvas y logrando la desaparición de los signos clínicos. Además, se ha visto que la eficacia es aún mayor si se administra una segunda o tercera aplicación en intervalos de 1 mes. Por otro lado, no existe un tratamiento efectivo frente a la dirofilariosis cardiopulmonar felina y éste se basa en aliviar la sintomatología que presente el paciente y usar lactonas macrocíclicas para evitar reinfecciones.
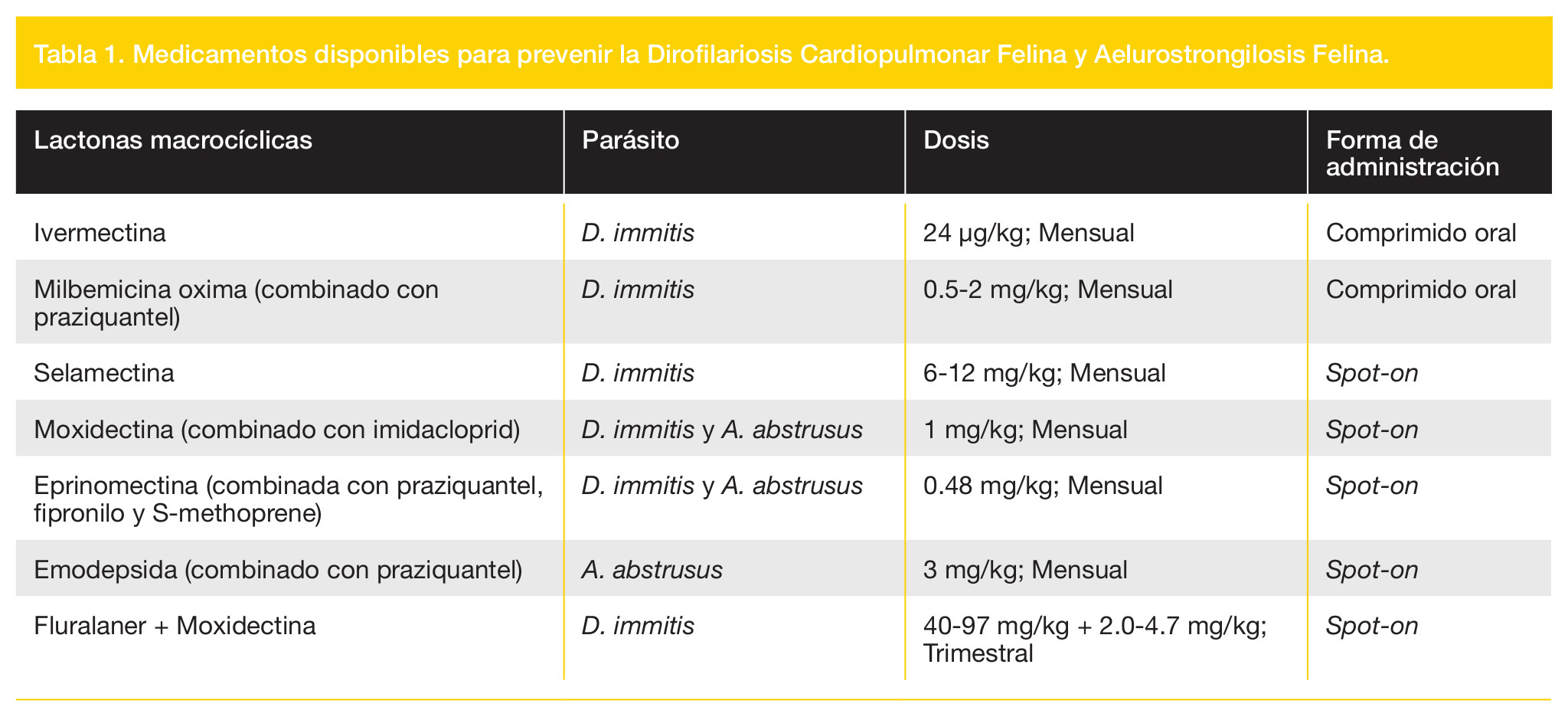
El pronóstico de la dirofilariosis cardiopulmonar felina se considera siempre reservado debido a que un único gusano adulto puede ser mortal para el animal. Mientras tanto, la aelurostrongilosis 14 ] tiene un pronóstico favorable si se trata convenientemente. En consecuencia, es muy importante realizar una correcta prevención de ambas enfermedades. La aplicación tópica mensual de emodepsida, moxidectina y eprinomectina han resultado ser útiles para prevenir la infección de A. abstrusus. Asimismo, se han visto resultados satisfactorios para la prevención de D. immitis mediante los comprimidos orales de ivermectina y milbemicina oxima, así como también con la aplicación tópica de selamectina, moxidectina, eprinomectina y fluralaner + moxidectina (Tabla 1).
Este caso clínico remarca la necesidad por parte de los veterinarios de reconocer la presencia e importancia de estas parasitosis en gatos residentes en áreas endémicas que no siguen la terapia profiláctica adecuada contra dichos parásitos. Por ello, estos parásitos broncopulmonares se deben incluir en el diagnóstico diferencial en los pacientes que se presenten con signos clínicos compatibles.
Videos
Bibliografía
Baker, Ch., McCall, J., Mansour, A., McCall, S., Shaffer, T., Wakeland, K., et al. Efficacy of a novel topical combination of esafoxolaner, eprinomectin and praziquantel for the prevention of heartworm disease in cats. Parasite. 2021;28:30.
Borisov, B., Rafailov, R., Hadzhimitev, D., Marinov, G., Zlateva, N., & Magkrioti, E. Aelurostrongylus abstrusus in cats – diagnostic and treatment. Tradition and Modernity in Veterinary Medicine. 2018;3:1(4):91-96.
Carretón, E., Costa, N., García, S., Matos, J., Falcón, Y., Montoya, J. A., et al. Parásitos respiratorios felinos. Suplemento Argos. Febrero 2022.
Dillon, A., Blagburn, B., Tillson, M., Brawner, W., Wlles, B., Johnson, C., et al. Heartworm-associated respiratory disease (HARD) induced by inmature adult Dirofilaria immitis in cats. Parasites and Vectors, 2017;10(2):209-224.
Garrity, S., Lee-Fowler, T., & Reinero, C. Feline asthma and heartworm disease. Clinical features, diagnostics and therapeutics. Journal of Feline Medicine and Surgery. 2019;21:825-834.
Gianelli, A. Efficacy of Broadline® spot-on against Aelurostrongylus abstrusus and Troglostrongylus brevior lungworms in naturally infected cats from Italy. Veterinary Parasitology. 2015;209:273-277.
Knaus, M., Chester, S. T., Rosentel, J., Kühnert, A., & Rehbein, S. Efficacy of a novel combination of fipronil, (S)-methoprene, eprinomectin and praziquantel against larval and adult stages of the cat lungworm, Aelurostrongylus abstrusus. Veterinary Parasitology. 2014;202:64-68.
Little, S. E., Hostetler, J. A., Thomas J. E., Bailey K. L., Barrett, K. L., Gruntmeir, K., et al. Moxidectin steady prior to inoculation protects cats from subsequent, repeated infection with Dirofilaria immitis. Parasites and Vectors. 2015;8:107.
Méndez, J. C., Carretón Gómez, E., & Montoya-Alonso, J. A. Dirofilariosis cardiopulmonar felina. En: Multimédica Ediciones Veterinarias (eds.), Dirofilariosis: pautas de manejo clínico. 2012;131-156. Barcelona: Gráfica IN-Multimédica S.A.
Morchón, R., Hernández de la Fuente, I., Calvo-López, A., Lambea, A., Falcón-Cordón, Y., & Carretón, E. Dirofilariosis felina: Epidemiología y situación actual en España. Suplemento Argos. Abril 2019;1-8.
Pennisi, M. G., Tasker, S., Hartmann, K., Belák, S., Addie, D., Boucraut-Baralon, C., et al. Dirofilarioses in cats: European guidelines from the ABCD on prevention and management. Journal of Feline Medicine and Surgery. 2020;22(5):442-451.
Raue, K., Rohdich, N., Hauck, D., Zschiesche, E., Morelli, S., Traversa, D., et al. Efficacy of Bravecto® Plus spot-on solution for cats (280 mg/ml fluralaner and 14 mg/ml moxidectin) for the prevention of aelurostrongylosis in experimentally infected cats. Parasites and Vectors. 2021;14:110.
Stannard, R. The facts about feline heartworm disease. American Heartworm Society. 2015.
Venco, L., Marchesotti, F., & Manzocchi, S. Feline heartworm disease: a ‘Rubik’s-cube-like’ diagnostic and therapeutic challenge. Journal of Veterinary Cardiology. 2015;17:190-201.
 by Multimédica
by Multimédica