Coinfección por Ehrlichia canis y Babesia gibsoni en un perro proveniente de Sri Lanka
Resumen breve
Se describe el caso de una perra cruzada de 9 meses de edad que se presenta por un cuadro agudo de vómitos y apatía, y en la que se diagnostica una coinfección por Ehrlichia canis y Babesia gibsoni. Los tutores la adoptaron 3 semanas antes en Sri Lanka y la trajeron a Barcelona. Este caso recalca la importancia de buscar y detectar las coinfecciones en paciente con enfermedades transmitidas por vectores.Índice de contenidos
Resumen
Se describe el caso de una perra cruzada de 9 meses de edad que se presenta por un cuadro agudo de vómitos y apatía. Los tutores la adoptaron 3 semanas antes en Sri Lanka y la trajeron a Barcelona. En el examen físico destacan las mucosas rosadas-pálidas y fiebre de 40.7 ºC, así como la detección de garrapatas. En las pruebas iniciales realizadas se detecta una serología positiva a Ehrlichia spp. y la presencia de estructuras compatibles con babesias pequeñas intraeritrocitarias en el frotis. La paciente responde favorablemente al tratamiento instaurado con doxiciclina. Posteriormente, se reciben los resultados del panel de PCRs donde se detecta tanto Ehrlichia spp. como Babesia gibsoni, por lo que se añade tratamiento para la babesia que consiste en la combinación de atavacuona y azitromicina. La respuesta clínica es completa. Este caso recalca la importancia de buscar y detectar las coinfecciones en paciente con enfermedades transmitidas por vectores.
Introducción
Las enfermedades de transmisión vectorial son frecuentes en España, pero su prevalencia varía en función de la región geográfica. Además, el cambio climático y el aumento de la importación de mascotas son responsables de los cambios de prevalencia de los últimos años1. Se presenta el caso clínico de una perra joven importada de Sri Lanka con coinfección por Ehrlichia canis y Babesia gibsoni.
Caso clínico
Se refiere el caso de una perra cruzada de 14 kg de 9 meses de edad por un cuadro agudo de vómitos, apatía y alteraciones hematológicas. Se trata de una perra proveniente de Sri Lanka que los actuales tutores han adoptado y traído a vivir a Barcelona hace 3 semanas. Los tutores describen que en el momento de la adopción había una parasitación externa importante por garrapatas, por lo que le administran un antiparasitario frente a ectoparásitos en ese momento. Vacunada correctamente y sin conocimiento de desparasitación interna. Cuatro días antes de acudir al veterinario empieza con vómitos agudos, y el mismo día desarrolla apatía marcada. Los tutores describen heces blandas y posible poliuria-polidipsia, pero por lo demás ha estado bien hasta ahora. El veterinario referidor realiza una analítica general donde observa una anemia moderada microcítica no regenerativa y trombocitopenia grave, y la refiere para su investigación (Tabla 1).
| Hemograma | ||
|---|---|---|
| Parámetro | Resultado | Valores de referencia |
| Hematíes | 4.40 | 5.65-8.87 M/μl |
| Hematocrito | 24.7 | 37.3-61.7 % |
| Hemoglobina | 9.1 | 13.1-20.5 g/dl |
| VCM | 56.1 | 61.6-73.5 fl |
| HCM | 20.7 | 21.2-25.9 pg |
Tabla 1. Analítica general inicial (día 0) del veterinario referidor. Los parámetros del hemograma y de la bioquímica que han resultado dentro de los valores de referencia no han sido incluidos en la tabla.
En consulta, la paciente está animada con una condición corporal de 3/9. Presenta mucosas rosadas-pálidas, linfonodos preescapulares levemente aumentados, una frecuencia cardíaca de 164 lpm con un pulso hipercinético y temperatura de 40.7 ºC. A la palpación abdominal no presenta dolor evidente. Se detecta una alopecia focal en la mejilla derecha y se retiran dos garrapatas pequeñas de entre los dedos de la extremidad anterior derecha.
En este momento se consideran varios problemas para investigar: cuadro agudo de vómitos y diarreas, fiebre, anemia microcítica no regenerativa y trombocitopenia, linfadenopatía, alopecia focal facial, infestación por garrapatas y posible poliuria-polidipsia. La principal sospecha es la presencia de una enfermedad de transmisión vectorial con un proceso concomitante digestivo.
Se empieza el protocolo diagnóstico con la realización en el mismo hospital de una prueba de aglutinación en porta, un frotis sanguíneo, una prueba rápida de Ehrlichia spp., Dirofilaria, Anaplasma spp. y Borrelia burgdorferi, así como un análisis de orina completo. La prueba de aglutinación en porta es negativa. En el frotis se confirma la trombocitopenia, aunque menos grave que la detectada en el hemograma con un recuento medio de 5 plaquetas por campo de inmersión, lo que equivale a unas 75000 plaquetas/μl. Se manda el frotis a un servicio de patología externa para buscar parásitos hemáticos. La prueba rápida es positiva para Ehrlichia spp. y negativa para el resto de patógenos evaluados. El análisis de orina es normal con una densidad de 1.042, lo que descarta la posible poliuria-polidipsia (Tabla 2).
| Parámetro | Resultado |
|---|---|
| Método de recogida | Cistocentesis |
| Color | Amarillo oscuro |
| Turbidez | Claro |
| Densidad | 1.042 |
| pH | 8.0 |
| Proteínas en orina | 1+ |
| Glucosa | Negativo |
| Cetonas | Negativo |
| Sangre/hemoglobina | Negativo |
| Bilirrubina | Negativo |
| Urobilinógeno | Negativo |
| Leucocito esterasa | Negativo |
| Sedimento | Inactivo |
Tabla 2. Análisis de orina.
Se realizan citologías de los linfonodos preescapulares que también se mandan a patología. El servicio de dermatología realiza un raspado de la alopecia focal facial sin detectarse ectoparásitos.
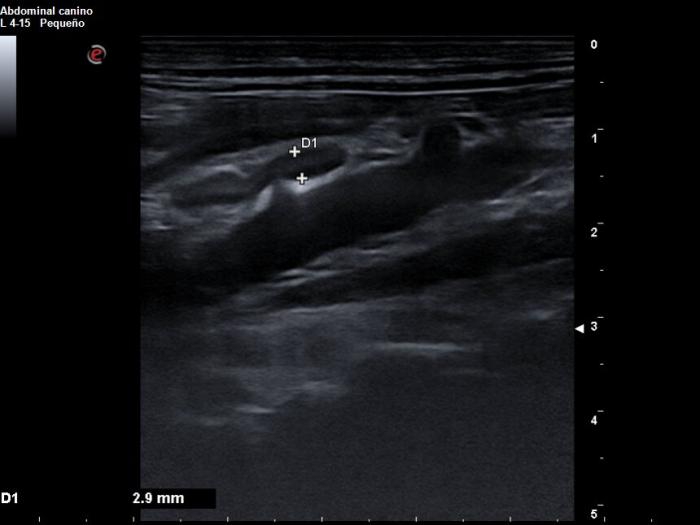
Se realizan pruebas de imagen de tórax y abdomen. Las radiografías torácicas son compatibles con la normalidad. En la ecografía abdominal se detecta una esplenomegalia moderada con parénquima levemente heterogéneo y las glándulas adrenales de pequeño tamaño (2.9 cm de grosor en adrenal izquierda y 3.1 cm de grosor en adrenal derecha) (Figura 1). El resto de abdomen es compatible con la normalidad, incluyendo el tracto gastrointestinal.
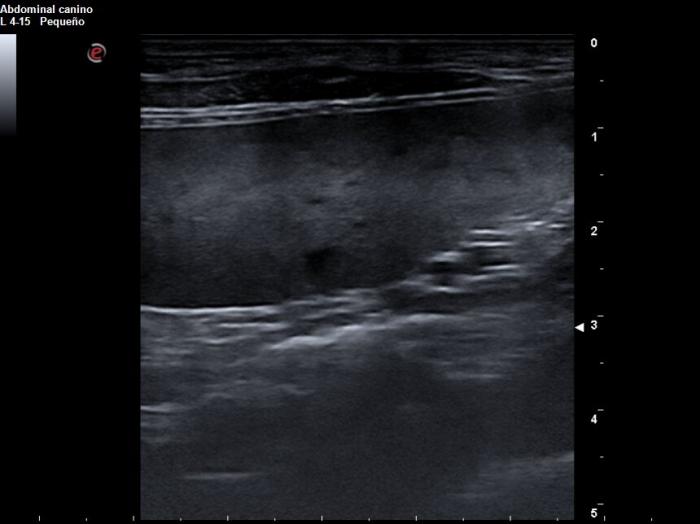
Figura 1. Imágenes ecográficas abdominales obtenidas el día de la presentación. (A) Se observa un bazo aumentado de tamaño y con parénquima levemente heterogéneo. (B) Glándula adrenal izquierda de tamaño reducido (2.9 cm).
Con estos resultados, se sospecha de una infección por Ehrlichia canis y un cuadro digestivo inespecífico concomitante. Sin embargo, la presencia de anticuerpos en un perro proveniente de una zona altamente endémica de ehrlichiosis no es confirmatorio de enfermedad y además no se puede descartar la coinfección con otros patógenos transmitidos por vectores, por lo que se amplia la investigación con la realización de un proteinograma, serología cuantitativa de Leishmania y Ehrlichia, y un panel de PCRs que incluye Leishmania spp., Ehrlichia spp., Hepatozoon spp., Babesia spp., Anaplasma spp., Mycoplasma haemocanis, Candidatus Mycoplasma haematoparvum, Rickettsia conorii y Neoehrlichia mikurensis.
En este punto, y pendiente de resultados externos, se instaura un tratamiento ambulatorio múltiple. Por un lado, se prescribe un tratamiento digestivo sintomático con la administración de maropitant (1 mg/kg/24 h PO durante 3 días) y probiótico (1 sobre/24 h durante 7 días). Por otro lado, se inicia tratamiento de la ehrlichiosis con doxiciclina (5 mg/kg/12 h durante 4 semanas). Por último, se recomienda la administración de sarolaner (Simparica 40 mg: 1 comprimido/3 semanas durante 3 veces) para el tratamiento de una sospecha de demodicosis facial focal y para la desparasitación externa de garrapatas.
La evolución clínica es muy buena. Los signos digestivos resuelven a las 24 horas sin recidivas al parar el tratamiento sintomático. La apatía mejora progresivamente y los tutores describen una resolución completa a partir de los 5 días de tratamiento.
A los pocos días se reciben todos los resultados. En el frotis se observan unas estructuras compatibles con babesias pequeñas intraeritrocitarias (Figura 2). En los linfonodos se aprecia una hiperplasia linfoide reactiva e inflamación eosinofílica sin observarse la presencia de patógenos (Figura 3).
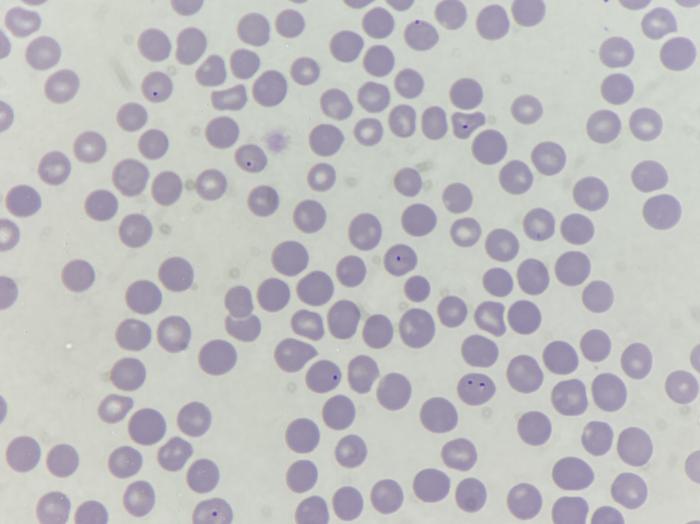
Figura 2. Frotis sanguíneo. Se observa la presencia de estructuras intraeritrocitarias compatibles con babesias pequeñas (imagen cortesía de T-cito).
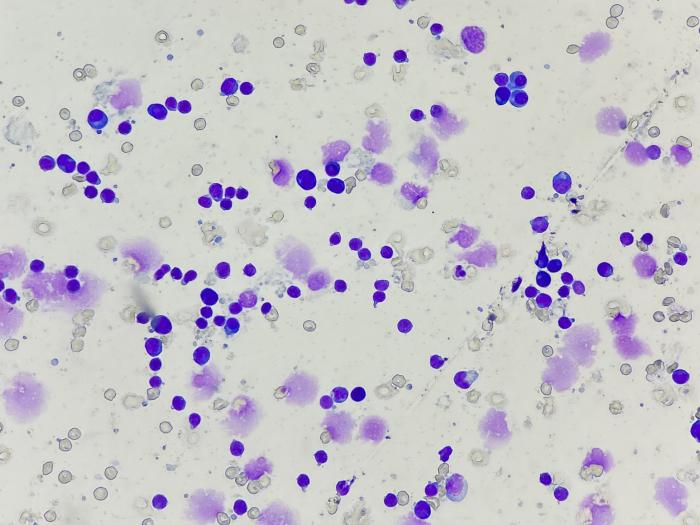
Figura 3. Citología de linfonodo preescapular. Se observa una hiperplasia linfoide reactiva e inflamación eosinofílica sin observarse la presencia de patógenos (imagen cortesía de T-cito).
El proteinograma es normal y la serología de Leishmania es negativa. La serología de Ehrlichia canis, como era esperable, es positiva. En el panel de PCRs mandado se detecta la presencia de Ehrlichia spp. y Babesia gibsoni, siendo negativas para el resto de patógenos. Así pues, el diagnóstico final es coinfección por Ehrlichia canis y Babesia gibsoni.
El día 6 tras la presentación, la paciente acude a revisión. En el examen físico persiste la palidez de mucosas, la alopecia focal facial ha mejorado y el resto del examen es normal, con una temperatura de 38.8 ºC. Se repite el hemograma y un frotis sanguíneo. En el hemograma se observa una anemia leve del 35 % muy regenerativa y resolución de la trombocitopenia (Tabla 3).
| Parámetro | Día 6 | Día 21 | Día 90 | Valores de referencia |
|---|---|---|---|---|
| Hematíes | 5.36 | 7.54 | 8.70 | 5.65-8.87 M/μl |
| Hematocrito | 35.20 | 47.10 | 54.9 | 37.3-61.7 % |
| Hemoglobina | 12.10 | 16.80 | 19.5 | 13.1-20.5 g/dl |
| Reticulocitos | 438.4 | 53.50 | 31.5 | 10.0-110.0 K/μl |
| % de reticulocitos | 8.18 | 0.71 | 0.4 | % |
Tabla 3. Controles hematológicos. Los parámetros hematológicos que han resultado dentro de los valores de referencia no han sido incluidos en la tabla.
Se mantiene el tratamiento instaurado con doxiciclina y se añade tratamiento para la babesiosis, consistente en la combinación de atovacuona (13.3 mg/kg/8 h PO durante 10 días) y azitromicina (10 mg/kg/24 h PO durante 10 días). A las dos semanas se realiza otro control en el cual la paciente clínicamente está perfecta, la alopecia ha resuelto y el hemograma se ha normalizado. Se repite la PCR de Babesia siendo negativa. Se recomienda terminar el tratamiento con doxiciclina y repetir hemograma en dos meses. La paciente se mantiene asintomática y el hemograma de control a los dos meses de haber finalizado todos los tratamientos se mantiene normal, por lo que se le da el alta definitiva.
Discusión
Los patógenos transmitidos por vectores son un conjunto de agentes infecciosos transmitidos por artrópodos hematófogos como, por ejemplo, las garrapatas, las pulgas, los piojos o los mosquitos. La distribución mundial de los vectores, así como de los patógenos que transmiten, ha ido cambiando con el tiempo. El cambio climático y el aumento de la importación de mascotas son algunos de los factores más importantes1. El caso presentado en este artículo es un claro ejemplo. Se trata de un perro adoptado de un país asiático y exportado con sus vectores y patógenos.
La coinfección por múltiples patógenos transmitidos por vectores es habitual, especialmente en zonas altamente endémicas. En Sri Lanka, dos estudios epidemiológicos recientes han demostrado una prevalencia de Babesia gibsoni de entre 13.8-37.4 % y Ehrlichia canis de entre el 4.5-9.7 %. Otros patógenos transmitidos por garrapatas detectados habitualmente incluían Hepatozoon canis (0.1-21 %), micoplasmas hemotrópicos (10.2 %), Babesia vogeli (5 %) y Anaplasma platys (3.8-4.3 %). Se detectó más de un patógeno en un 15-30 % de los perros infectados en estos estudios, por lo que la prevalencia de coinfecciones es alta2,3. En España, la prevalencia de Ehrlichia canis varía según la región y la población estudiada, pero está entre el 1-5 %4-7, siendo la prevalencia de Babesia spp. menor8. Dependiendo del estudio, la prevalencia de dos o más infecciones por patógenos transmitidos por vectores es habitual y puede llegar al 13 %6. Además, se ha descrito la posibilidad de que la infección por más de un patógeno produzca un efecto sinergístico entre ellos induciendo un cuadro clínico más grave9.
Así pues, cuando se presenta un paciente con signos de enfermedades vectoriales, deberemos tener presente varios puntos importantes. Primero, valorar la región en la que vive el paciente, de donde proviene, y en qué otras regiones ha vivido recientemente o ha viajado, para decidir con qué enfermedades de transmisión vectorial ha podido tener contacto. Segundo, hay que recordar que las coinfecciones son relativamente habituales en zonas endémicas y, por lo tanto, será interesante evaluar más de una enfermedad, incluso cuando detectemos la presencia de una de ellas en las pruebas iniciales. Y tercero, cuando la respuesta al tratamiento no sea la esperada, por ejemplo, por persistencia de signos clínicos o alteraciones clinicopatológicas, replantear el diagnóstico y buscar enfermedades concomitantes que puedan justificar la falta de respuesta. En el caso descrito aquí, si se hubiera parado la investigación en el momento en el que la prueba rápida salió positiva a Ehrlichia, no se hubiera detectado Babesia gibsoni y probablemente hubiera habido persistencia de signos clínicos a pesar del tratamiento con doxiciclina. Hoy en día, la disponibilidad de paneles diagnósticos en los laboratorios facilita el trabajo del veterinario clínico para la detección de coinfecciones, pero es necesario conocer las enfermedades endémicas de la zona donde reside o ha viajado el paciente para adaptar estos paneles a cada paciente en particular.
Otro punto importante a la hora de diagnosticar enfermedades transmitidas por vectores es la correcta interpretación de las distintas pruebas diagnósticas: citologías, pruebas de antígeno, detección de anticuerpos, PCRs, etc10. En el caso presentado, la prueba rápida salió positiva a anticuerpos de Ehrlichia spp. Sin embargo, los anticuerpos frente a Ehrlichia no son siempre diagnósticos de enfermedad activa11. Por este motivo, se realizaron pruebas de detección del patógeno. Las citologías no evidenciaron la presencia del parásito y esto no es sorprendente, ya que la sensibilidad de la citología para la detección de mórulas en monocitos es muy baja, menor del 10 % en sangre y del 50 % en linfonodo. La PCR en sangre confirmó la presencia del parásito. Las técnicas de PCR son muy interesantes en enfermedades vectoriales debido a su alta sensibilidad y a la correlación con infección activa11.
El caso descrito se presenta con signos inespecíficos (apatía) junto con signos digestivos agudos (vómitos de cuatro días de evolución). Los signos digestivos no son frecuentes en la mayoría de las enfermedades de transmisión vectorial, aunque han sido descritos11. En el presente caso no se detectó ninguna otra causa concomitante para los signos digestivos y es probable que estuviera asociado a las enfermedades vectoriales, aunque no se puede descartar otras causas autolimitantes leves. En la ecografía abdominal, se observaron unas glándulas adrenales más pequeñas de lo habitual, lo que puede sugerir hipoadrenocorticismo. Se decidió no realizar pruebas hormonales (cortisol basal o prueba de estimulación con ACTH) en ese momento, debido a la presencia de enfermedades concomitantes que justificaban la mayor parte de los signos clínicos y la rápida respuesta clínica al tratamiento. Sin embargo, dado que se trata de un paciente joven, se recomendó a los tutores y veterinario referente monitorizar clínicamente e investigar en caso de presentar signos compatibles con la enfermedad de Addison en el futuro.
Como conclusión, se presenta un caso clínico con coinfección por Ehrlichia canis y Babesia gibsoni, en un paciente importado de un país asiático endémico para dichas enfermedades. La rápida detección de ambos patógenos e instauración del tratamiento adecuado resultó en una rápida recuperación del paciente. Este caso recalca la importancia de buscar y detectar las coinfecciones en paciente con enfermedades transmitidas por vectores.
Bibliografía
1. Cevidanes A, Di Cataldo S, Muñoz-San Martín C, et al. Co-infection patterns of vector-borne zoonotic pathogens in owned free-ranging dogs in central Chile. Vet Res Commun. 2023 Jun;47(2):575-585.
2. AtapattuU,ColellaV,WorsleyA, et al.Prevalence, Distribution, and Factors Associated with Vector-Borne Pathogen Infections in Pet Dogs from Different Geoclimatic Zones in Sri Lanka.Transboundary and Emerging Diseases,2023, 9467314, 21 pages.
3. Jayatilaka PS, Ranatunga RAS, Wijerathna HSU, et al. Canine vector-borne infections of working dogs of the Sri Lanka Air Force, and free roaming, and privately-owned dogs. Sci Rep. 2024 Oct 7;14(1):23355.
4. Pérez Pérez P, Rodríguez-Escolar I, Carretón E, et al. Serological Survey of Canine Vector-Borne Infections in North-Center Spain. Front Vet Sci. 2021 Dec 6;8:784331.
5. Díaz-Regañón D, Roura X, Suárez ML, León M, Sainz Á. Serological evaluation of selected vector-borne pathogens in owned dogs from northern Spain based on a multicenter study using a commercial test. Parasit Vectors. 2020 Jun 10;13(1):301.
6. Montoya-Alonso JA, Morchón R, Costa-Rodríguez N, Matos JI, Falcón-Cordón Y, Carretón E. Current Distribution of Selected Vector-Borne Diseases in Dogs in Spain. Front Vet Sci. 2020 Oct 22;7:564429.
7. Miró G, Montoya A, Roura X, Gálvez R, Sainz A. Seropositivity rates for agents of canine vector-borne diseases in Spain: a multicentre study. Parasit Vectors. 2013 Apr 22;6:117.
8. Solano-Gallego L, Sainz Á, Roura X, Estrada-Peña A, Miró G. A review of canine babesiosis: the European perspective. Parasit Vectors. 2016 Jun 11;9(1):336.
9. Baxarias M, Álvarez-Fernández A, Martínez-Orellana P, et al. Does co-infection with vector-borne pathogens play a role in clinical canine leishmaniosis? Parasit Vectors. 2018 Mar 20;11(1):135.
10. De Tommasi AS, Otranto D, Dantas-Torres F, Capelli G, Breitschwerdt EB, de Caprariis D. Are vector-borne pathogen co-infections complicating the clinical presentation in dogs? Parasit Vectors. 2013 Apr 15;6:97.
11. Sainz Á, Roura X, Miró G, et al. Guideline for veterinary practitioners on canine ehrlichiosis and anaplasmosis in Europe. Parasit Vectors. 2015 Feb 4;8:75.
 by Multimédica
by Multimédica
