Diagnóstico de aspergilosis invasiva diseminada en un Pastor alemán: a propósito de un caso clínico
Resumen breve
Se describe el caso clínico de Pastor alemán, macho no castrado, diagnosticado con aspergilosis invasiva diseminada mediante citología de aspirado de riñón y detección de antígeno de Aspergillus en sangre. El objetivo de este artículo es la descripción del diagnóstico de aspergilosis invasiva diseminada (AID) sistémica en un perro con fiebre y daño renal.Índice de contenidos
Resumen
Se describe el caso clínico de Pastor alemán, macho no castrado, diagnosticado con aspergilosis invasiva diseminada mediante citología de aspirado de riñón y detección de antígeno de Aspergillus en sangre. El perro es visitado por pérdida de peso, vómitos y diarreas de 6 meses de duración, reticencia a moverse, y poliuria y polidipsia reciente. En el examen físico hay fiebre, hepatomegalia, dolor lumbar y caquexia. La analítica muestra azotemia moderada, hipercalcemia y elevación de las concentraciones de proteína C reactiva. En la ecografía abdominal se observa una masa mineralizada en abdomen craneal y linfadenopatía mesentérica. La tomografía computarizada torácica y abdominal confirma la presencia de una masa abdominal de grandes dimensiones, linfadenopatía mesentérica e identifica también lesiones quísticas en ambos riñones, osteolisis en múltiples vértebras lumbares compatibles con discospondilitis, y una lesión osteoproliferativa en la escápula. La citología del aspirado renal es compatible con inflamación macrofágica/histiocítica asociada a una infección fúngica. Sin embargo, el cultivo del aspirado es negativo. La detección de antígeno (galactomanano) de Aspergillus en suero mediante ELISA es positivo, dando un valor 10 veces superior al rango de referencia. El diagnóstico final es de aspergilosis sistémica. Se instaura terapia con itraconazol vía oral, y tratamiento analgésico. Debido al mal pronóstico, y al dolor severo, se decide la eutanasia del animal a los pocos días del diagnóstico.
Introducción
Los hongos del género Aspergillus están omnipresentes en el medio ambiente y pueden causar ocasionalmente infecciones oportunistas en personas y animales. En los perros, la aspergilosis suele presentarse como una infección sinonasal localizada. En la aspergilosis invasiva diseminada (AID), existe infección activa en ≥ 2 áreas separadas del cuerpo y/o se produce diseminación hematógena1,2. No hay afectación nasal, y ocurre con mayor frecuencia en individuos inmunodeprimidos. Sin embargo, la AID se diagnostica también en perros jóvenes sin otras enfermedades ni tratamientos inmunosupresores. En estos casos, los perros de raza Pastor alemán están claramente sobrerrepresentados1-3. Aunque el motivo por la predisposición en esta raza no se ha confirmado, se sospecha una deficiencia o disfunción hereditaria de IgA a nivel de mucosas3.
Entre los órganos que pueden verse afectados por AID se incluyen los músculos, el pericardio, el miocardio, los linfonodos, los ojos (uveítis, celulitis orbitaria, desprendimiento de retina), los huesos (osteomielitis), riñones (por ejemplo, pielonefritis), hígado, bazo, páncreas, sistema nervioso central, discos intervertebrales (discoespondilitis) y articulaciones (poliartritis)1,4.
Pueden aparecer signos inespecíficos en las fases iniciales de la infección, seguidos de signos generalizados de diseminación en unos pocos meses. Pueden observarse déficits neurológicos, debilidad, atrofia muscular y/o signos oculares. Dependiendo de la localización de la infección, puede aparecer dolor en los huesos, la columna vertebral o el abdomen1,2,4.
El objetivo de este artículo es la descripción del diagnóstico de aspergilosis invasiva diseminada (AID) sistémica en un perro con fiebre y daño renal.
Caso clínico
Se presenta a consulta un perro Pastor alemán macho no castrado de 3 años de edad por pérdida de peso progresiva (8 kg en 6 meses), mal aspecto del pelaje, reticencia a moverse, vómitos recurrentes desde hace 6 meses y poliuria y polidipsia de 2 semanas de duración. Un mes antes, el perro fue visitado por vómitos recurrentes. Entonces, analíticas de sangre, incluyendo hemograma, bioquímica, serología de Leishmania y proteinograma, fueron normales. El análisis coprológico fue negativo. Ante la sospecha de enteropatía crónica, se recomendó un cambio a dieta hipoalergénica. Al no haberse observado mejoría, y tras la aparición de dolor y poliuria y polidipsia, es visitado de nuevo. En el examen físico el perro presenta caquexia (BCS 3/9), fiebre y dolor a la palpación toracolumbar. Su pelaje es corto y deslucido. El examen oftalmológico es normal (Figura 1).
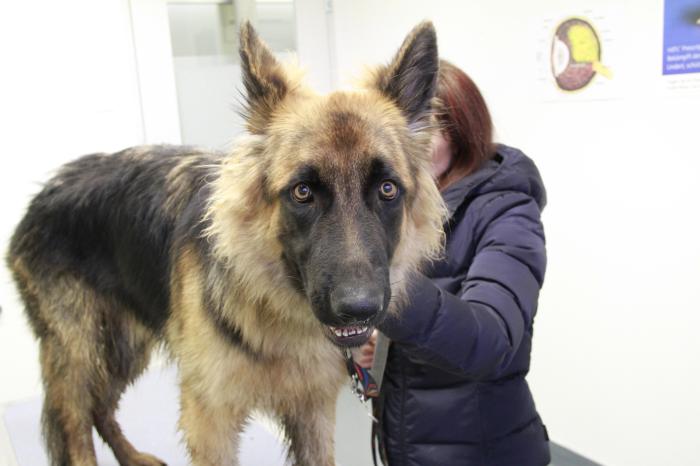
Figura 1. Perro Pastor alemán de 3 años con signos gastrointestinales crónicos, PUPD reciente fiebre y dolor toracolumbar.
El hemograma es normal, y en la bioquímica se detecta azotemia moderada (creatinina 4.7 (0.5-1.5), urea 120 (10-68)) e hiperglobulinemia de 5.2 g/dl (2.5-4.5). La concentración de proteína C reactiva está elevada > 150 (< 10). Existe ligera hipercalcemia ionizada 1.49 (1.18-1.37 mmol/l). Su densidad urinaria es isostenúrica a 1.012, sin proteinuria ni sedimento activo. En la ecografía abdominal se identifica una masa mineralizada en abdomen craneal, la cual no se consigue localizar con exactitud. Existe también linfadenopatía mesentérica y cambios nodulares en ambos riñones. Se procede a realizar punción de la masa abdominal pero su consistencia dura impide la obtención de muestra. La citología de linfonodos muestra linfadenopatía reactiva, mientras que las citologías de riñón evidencian inflamación macrofágica con presencia de hifas fúngicas aisladas (Figura 2).
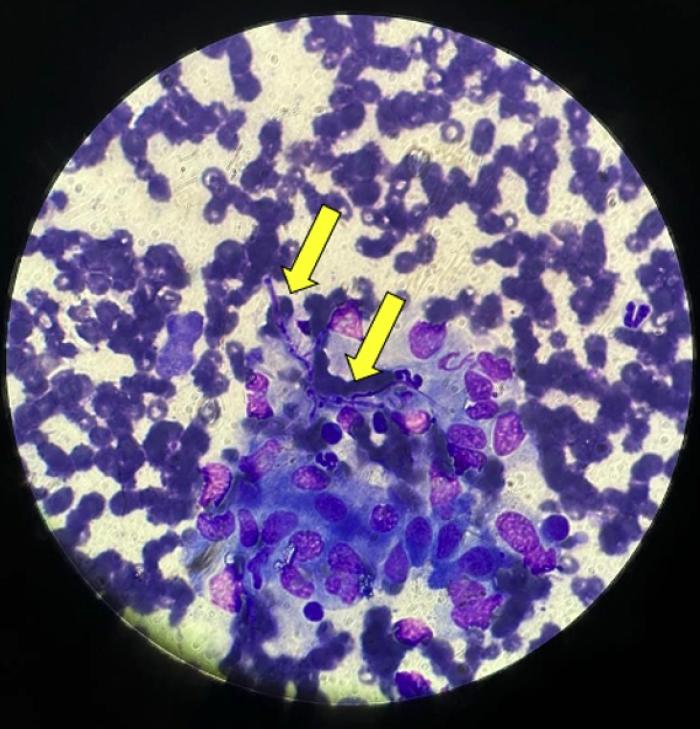
Figura 2. Citología de riñón donde se identifican estructuras alargadas, gruesas, septadas y ramificadas compatibles con hifas, asociadas a macrófagos/histiocitos (flechas).
Debido al bajo número de estas estructuras, no se puede determinar la especie fúngica implicada. El cultivo del aspirado renal es negativo. A continuación, se lleva a cabo una tomografía computarizada de tórax y abdomen, donde se confirma la masa abdominal, la cual es irregular, capta contraste de forma heterogénea, mineralizada y mide 6 x 3.5 cm de tamaño. Se sospecha un granuloma fúngico (Figura 3).
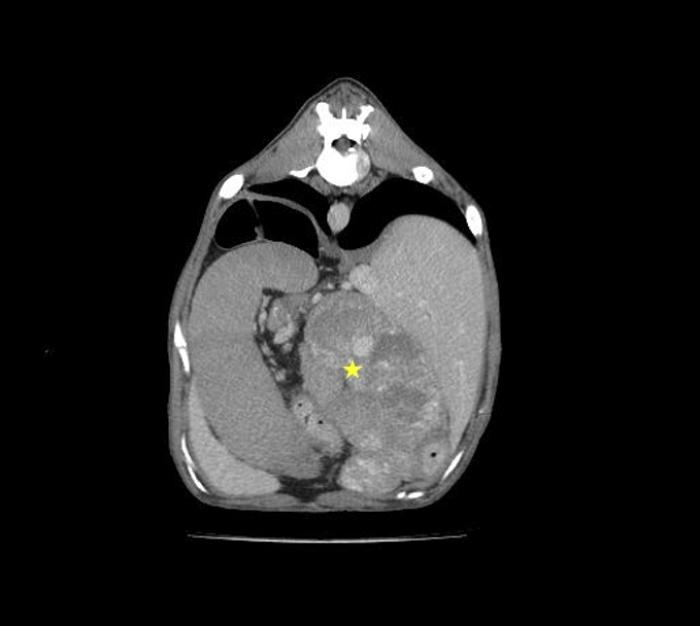
Figura 3. Imagen de tomografía computarizada poscontraste en plano axial de abdomen donde se identifica una masa/granuloma (estrella amarilla) en abdomen craneal, entre el hígado (derecha) y el bazo (izquierda).
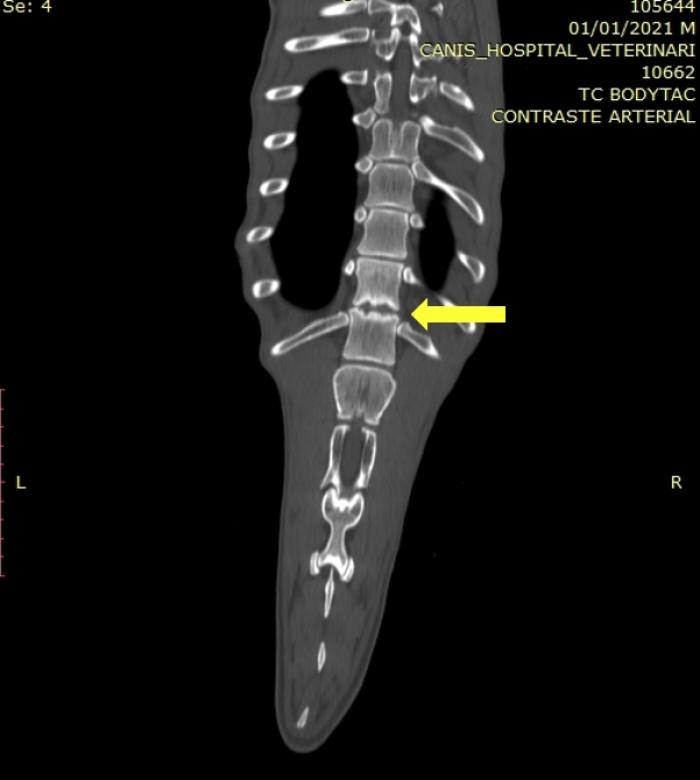
Figura 4. Tomografía computarizada en plano dorsal de la columna, donde se observa una lesión compatible con discospondilitis entre T12-T13 (flecha).
A nivel de la espina escapular de la extremidad anterior izquierda se observa una marcada reacción osteoproliferativa por encima del periostio con áreas de osteolisis (Figura 5).
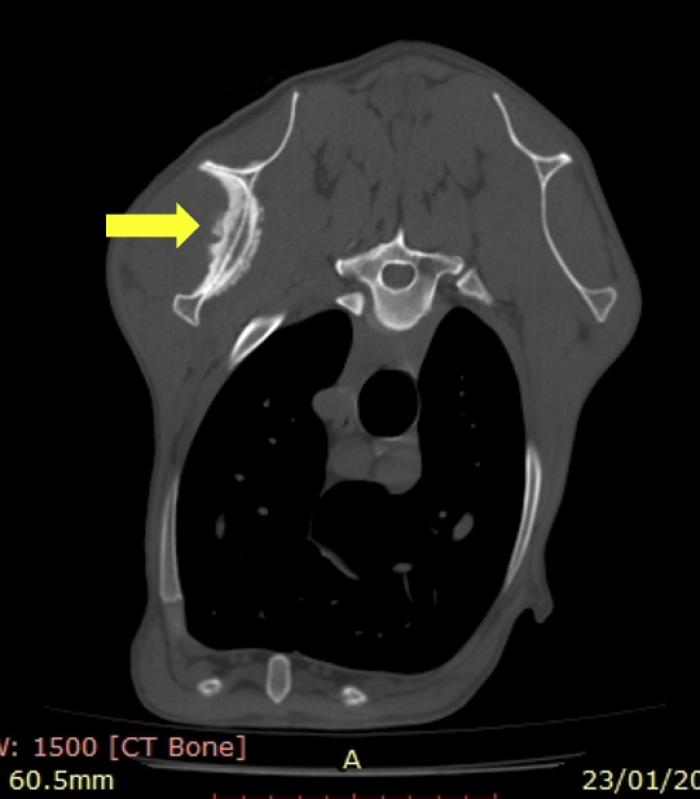
Figura 5. Imagen de tomografía computerizada poscontraste en plano axial donde se identifica una lesión osteoproliferativa en la escápula izquierda (flecha).
La detección sérica del antígeno galactomanano de Aspergillus da un valor muy alto 6.69 (< 0.5) confirmando una aspergilosis invasiva o sistémica.
Se instaura tratamiento con fluidoterapia, metadona a 0.1 mg/kg/4 h IV, gabapentina a 10 mg/kg/8 h PO e itraconazol a 10 mg/kg/12 h IV. Dos días más tarde, la fiebre desaparece, pero el perro muestra dolor severo y postración. Debido al mal pronóstico, se decide eutanasia humanitaria.
Discusión
La aspergilosis invasiva diseminada es causada por hongos saprófitos del género Aspergillus. Los agentes causales más frecuentes de AID son Aspergillus (Circumdati) terreus y Aspergillus (Nidulantes) deflectus1,2. A diferencia de la aspergilosis nasal, la aspergilosis diseminada es rara en perros y gatos.
Los conidios de Aspergillus son ubicuos en el medio ambiente. Tras la inhalación o inoculación, dependiendo del estado inmunitario del huésped, la infección puede propagarse localmente o diseminarse a múltiples órganos1. Aunque no se conoce la vía de infección primaria en nuestro caso, es probable que el patógeno entrara en el organismo por inhalación o por el tracto gastrointestinal.
Aspergillus tiene la capacidad de causar enfermedades y de resistir la respuesta del sistema inmunitario del huésped mediante la producción de diversos factores de virulencia2. Entre estos factores se encuentran la creación de biofilms y la secreción de enzimas hidrolíticas como hemolisinas, proteasas, proteinasas, lipasas, fosfolipasas, amilasas y ribonucleasas. Los biofilms ofrecen protección a Aspergillus contra la fagocitosis y la acción de los antifúngicos, permitiendo un crecimiento exponencial del hongo. Las enzimas hidrolíticas facilitan la degradación de células y de distintas moléculas de los tejidos. Esto puede dañar la función celular, causando la lisis y necrosis de las células y contribuyendo así al deterioro clínico del paciente1,2.
En personas, los factores de riesgo subyacentes son las neoplasias hematológicas, el trasplante de células madre, el trasplante de órganos sólidos y tratamiento prolongado con quimioterapia/corticoides, así como infecciones víricas, como la gripe o la COVID-191,2. La susceptibilidad genética a las infecciones fúngicas, incluida la aspergilosis, se observa entre individuos con mutación por pérdida de función en el gen del transductor de señales y activador de la transcripción 3 (STAT 3), que da lugar a una respuesta inmunitaria adaptativa defectuosa contra Aspergillus spp.
En perros, la AID se ha observado tanto en pacientes inmunosuprimidos como en perros jóvenes que no presentan otras enfermedades ni reciben tratamientos inmunosupresores1. Los Pastor alemán tienen una mayor incidencia de casos de AID, lo cual se atribuye a una deficiencia selectiva de IgA en las mucosas3. Esta condición afecta principalmente a individuos jóvenes, especialmente a hembras. La AID también se ha documentado en perros jóvenes de otras razas y en mestizos. A diferencia de los humanos, no se ha registrado la mutación del gen STAT 3 en perros1,2.
Los signos clínicos asociados a la AID en perros varían en función de la localización de la infección, siendo frecuentes la fiebre, dolor, signos gastrointestinales y respiratorios4.
Las alteraciones laboratoriales incluyen neutrofilia, azotemia, aumento de las concentraciones totales de proteínas séricas e isostenuria. En un estudio retrospectivo, la elevación de creatinina se vinculó a un mal pronóstico, aunque la frecuencia y asociación con daño renal agudo en perros con AID no está bien establecida4. Posibles mecanismos que explican la azotemia en nuestro caso incluyen una infiltración granulomatosa renal, y la hipercalcemia. La hipercalcemia fue el hallazgo laboratorial más frecuente en 30 perros con AID, y la mitad de los perros con hipercalcemia desarrollan azotemia4. En la aspergilosis, como en otras infecciones fúngicas diseminadas, la hipercalcemia está causada por macrófagos activados que poseen el enzima 1α-hidroxilasa, capaz de convertir la 25-hidroxivitamina-D en calcitriol.
Como en este caso, los perros con AID suelen tener lesiones radiográficas de discospondilitis y/o osteomielitis4.
El diagnóstico de una micosis sistémica se realiza mediante la identificación de hifas fúngicas en muestras de tejido u orina5. El diagnóstico morfológico de las especies fúngicas suele ser impreciso y no puede diferenciar especies estrechamente relacionadas o las denominadas crípticas. En casos de aspergilosis, el cultivo es positivo en la mayoría de los casos, pero no se dispone de datos sobre su sensibilidad y especificidad. Cuando el cultivo es negativo, podemos obtener un diagnóstico mediante la detección del antígeno de la pared celular fúngica galactomanano en sangre u orina. En un estudio con 13 perros con AID, la prueba de antígeno dio una sensibilidad y especificidad muy altas (92 y 86 % en suero, y 88 and 92 % en orina). Este ensayo es insensible para el diagnóstico de la aspergilosis nasal5.
Otra prueba complementaria, sobre todo si sólo se dispone de tejido en parafina, es la PCR panfúngica, la cual tiene una sensibilidad del 91.4 % y especificidad del 92 %6.
Las pruebas serológicas disponibles para la detección de anticuerpos frente a Aspergillus no son útiles para el diagnóstico5.
La AID en perros está relacionada con bajas tasas de curación clínica, altas tasas de recaída y una elevada letalidad1,2,4,7. La mejor estrategia para su tratamiento no está claramente definida, y el manejo de la enfermedad se basa principalmente en el criterio del veterinario, en evidencias anecdóticas y en las pocas series de casos retrospectivas disponibles.
En un estudio con 30 casos de AID, el 57 % de los perros fueron eutanasiados en los 7 días posteriores al diagnóstico4. En nuestro caso, el paciente fue eutanasiado a los 3 días de iniciar el tratamiento con itraconazol a 10 mg/kg/12 h PO, debido al dolor severo del animal a pesar de tratamiento con metadona a 0.1 mg/kg/4 h IV y gabapentina a 10 mg/kg/8 h PO, y al mal pronóstico.
La osteomielitis fúngica es difícil de tratar ya que los antifúngicos no penetran fácilmente los tejidos óseos y aquellos con mejor penetración tiene un coste prohibitivo. El itraconazol a 5-10 mg/kg/24 h PO es el tratamiento de elección, pero puede ser necesario administrarlo durante toda la vida7,8. En otro estudio con 10 perros, posaconazol a 5 mg/kg/12 h PO durante más de 1 mes consiguió una mejoría clínica en un 100 % de los casos, y 6/10 tuvieron supervivencias de > 1 año, pero hubo recaída tras interrumpir el tratamiento en un 50 % de los perros que entraron en remisión. La principal limitación del tratamiento con posaconazol es su alto coste. Un perro Pastor alemán sobrevivió > 5 años tras recibir tratamiento con posaconazol y terbinafina durante 15 meses. La terbinafina ha demostrado tener una potente actividad in vitro contra varias especies de Aspergillus. La terbinafina tiene efectos fungicidas, y una potente acción sinérgica cuando se combina con posaconazol u otros azoles.
En un estudio australiano reciente con 34 casos de AID7, la supervivencia media tras el diagnóstico fue de 531 días para los perros tratados, independientemente del tratamiento antifúngico elegido. Ocho de estos perros (36 %) sobrevivieron más de 12 meses, superando las cifras reportadas anteriormente.
En este estudio7, la supervivencia fue mayor en aquellos perros que recibieron combinación antifúngica, comparado con itraconazol solo. La mitad de los perros tratados recibieron terbinafina como terapia complementaria.
Bibliografía
- Elad D. Disseminated canine mold infections. Veterinary Journal. 2019;243:82-90. doi:10.1016/j.tvjl.2018.11.016
- Seyedmousavi S, Guillot J, Arné P, et al. Aspergillus and aspergilloses in wild and domestic animals: A global health concern with parallels to human disease. Med Mycol. 2015;53(8):765-797. doi:10.1093/mmy/myv067
- Eger CE, Shaw SE, Penhale WJ. Immunologic study of systemic aspergillosis in german shepherd dogs. Vol 9.; 1985.
- Schultz RM, Johnson EG, Wisner ER, Brown NA, Byrne BA, Sykes JE. Clinicopathologic and Diagnostic Imaging Characteristics of Systemic Aspergillosis in 30 Dogs. J Vet Intern Med. 2008;22(4):851-859. doi:10.1111/j.1939-1676.2008.0125.x
- Renschler JS. Review of Systemic Aspergillosis in Dogs. Miravista Veterinary Diagnostics. Published online 2017:1-6.
- Meason-Smith C et al. Panfungal PCR for identification of fungal pathogens in formalin-fixed animal tissues. Vet Pathol. 2017 Jul; 54(4): 640–648. Published online 2017 Mar 27.doi:10.1177/0300985817698207
- Corrigan VK et al. Treatment of Disseminated Aspergillosis with Posaconazole in 10 Dogs. J Vet Intern Med.2016 Jan-Feb; 30(1): 167–173. Published online 2015 Nov 14.doi:10.1111/jvim.13795
- Lim YY, Mansfield C, Stevenson M, et al. A retrospective multi-center study of treatment, outcome, and prognostic factors in 34 dogs with disseminated aspergillosis in Australia. J Vet Intern Med. 2022;36(2):580-590. doi:10.1111/jvim.16366
 by Multimédica
by Multimédica