Leishmaniosis felina: una reflexión a propósito del primer caso clínico en Galicia
Resumen breve
El conocimiento y el diagnóstico de la leishmaniosis felina (LF) en España ha aumentado en los últimos años, aunque sigue existiendo desconocimiento acerca de la verdadera situación epidemiológica en algunos territorios nacionales. En este contexto, queremos presentar el primer caso clínico autóctono en un gato callejero diagnosticado en la ciudad de Ourense (Galicia).Índice de contenidos
Resumen
El conocimiento y el diagnóstico de la leishmaniosis felina (LF) en España ha aumentado en los últimos años mostrando tasas de seroprevalencia que difieren según la zona. No obstante, sigue existiendo desconocimiento acerca de la verdadera situación epidemiológica en algunos territorios nacionales, en gran parte debido al curso asintomático que presentan muchas de las infecciones o por haberse considerado tradicionalmente como zonas no endémicas. En este contexto, queremos presentar el primer caso clínico autóctono en un gato callejero diagnosticado en la ciudad de Ourense (Galicia). El paciente presentaba lesiones cutáneas (inflamación interdigital y un nódulo en el párpado superior derecho) y lesiones oculares. Las muestras obtenidas para estudios citológicos e histológicos resultaron positivas a Leishmania spp y la PCR realizada en una muestra de médula ósea detectó el ADN de L. infantum. Hasta la fecha, ésta es la primera descripción de LF en Galicia, por lo que son necesarias más investigaciones para reconocer el estado epidemiológico de la enfermedad en esta región geográfica. Mientras tanto, se advierte de la posible circulación del parásito entre la población felina local y se sugiere la inclusión de la LF como diagnóstico diferencial en casos compatibles.
Introducción
La leishmaniosis es una enfermedad parasitaria zoonótica que en España está causada por el protozoo Leishmania infantum y transmitida por la picadura de una hembra de flebótomo de las especies Phlebotomus perniciosus y Phlebotomus ariasi. Los perros domésticos son consideraros los hospedadores primarios o principales reservorios y las principales manifestaciones clínicas son la leishmaniosis cutánea (LC) y leishmaniosis visceral (LV)1. Sin embargo, el parásito también se ha aislado de otros animales domésticos y salvajes2-4 como por ejemplo en hurones5 y lagomorfos6. Asimismo, se ha demostrado que los felinos desempeñan un papel importante en la epidemiología de esta enfermedad, aunque su categorización como hospedador primario o secundario sigue siendo controvertida7.
En Europa los casos autóctonos de LF se han diagnosticado principalmente en los países mediterráneos donde también la leishmaniosis canina es endémica8. Sin embargo y a pesar del aumento del número de casos en las últimas décadas, probablemente debido a la concienciación de los veterinarios, todavía se desconocen los datos epidemiológicos reales. Esto probablemente se deba a que las infecciones subclínicas son comunes y en otros casos las lesiones cutáneas se asocian principalmente al virus de la inmunodeficiencia felina (FIV), el virus de la leucemia felina (FeLV) o lesiones cancerosas9. A esto se le suma el desconocimiento de la prevalencia de LF en determinadas regiones y por tanto aumenta el riesgo de infradiagnosticar.
En este sentido, diferentes estudios llevados a cabo en España demuestran que la seroprevalencia de la LF varía según la región geográfica. Por ejemplo, en los gatos callejeros de las Islas Baleares y del sur de España la seroprevalencia se puede considerar alta con porcentajes de 13.2 % y 28.3 % respectivamente10,11; mientras que los porcentajes de anticuerpos frente a L. infantum son menores en las zonas centro (3.2 %) y noreste del país (8.5 %)6,12. También se han registrado notificaciones esporádicas de leishmaniosis felina visceral, cutánea y ocular en la cuenca mediterránea13-15 y territorios del sur16. En cualquier caso, se ha observado que las elevadas seroprevalencias y la aparición de casos clínicos en gatos coinciden con las zonas endémicas para la leishmaniosis canina17 aunque cabe destacar que los casos clínicos en felinos no son tan abundantes como en los perros, lo que podría explicarse por el infradiagnóstico y la resistencia natural felina9.
El norte de España se ha considerado tradicionalmente una zona no endémica, aunque algunos estudios reflejan un cambio de perspectiva17-20. Un buen ejemplo es la comunidad autónoma de Galicia donde investigaciones previas han documentado que la seroprevalencia de L. infantum en perros alcanza el 35 %, siendo incluso mayor que en otras zonas consideradas endémicas17,18,21. Asimismo, en la última década se han notificado casos autóctonos de leishmaniosis cutánea en humanos22. A pesar de estos datos, hasta la fecha no existen estudios de seroprevalencia felina en la región y no hay constancia de casos clínicos. Por ello, en el presente artículo se describe por primera vez un caso clínico autóctono de infección por L. infantum en un gato callejero en la ciudad gallega de Ourense.
El presente caso clínico fue diagnosticado en la ciudad de Ourense, situada en el sur de Galicia (Figura 1). Según la clasificación climática de Köppen y en términos generales, el territorio interior gallego presenta un clima Csb (tiempo seco con veranos calurosos)23. No obstante, dentro de este territorio, Ourense tiene condiciones climáticas que encajan mejor con el tipo Csa (clima mediterráneo)24, ya que los veranos son calurosos y secos con temperaturas medias superiores a 22°C25.
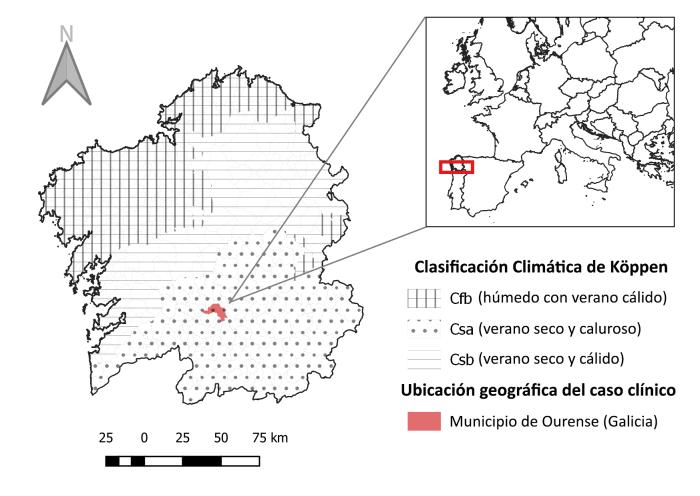
Figura 1. Localización geográfica del caso LF y clasificación climática de Köppen para Galicia.
Historia clínica
Un gato macho de pelo corto y de raza Común europeo de 6 años encontrado en la calle fue remitido por una protectora a la clínica veterinaria CatroGatos durante el mes de julio de 2020. El paciente presentaba una condición corporal subóptima y un pelaje áspero y sin brillo. En la exploración clínica, la opacidad corneal bilateral y la vascularización observadas se asociaron inicialmente a una posible queratitis herpética (Figura 2).
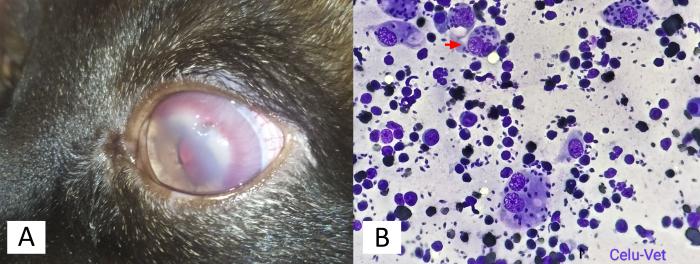
Figura 2. (A) Inflamación y opacidad corneal en el paciente. (B) Imagen citológica de inflamación interdigital de miembro anterior izquierdo con presencia de amastigotes de Leishmania spp en macrófago (flecha roja).
Asimismo, se detectó un nódulo en el párpado superior del ojo derecho de aproximadamente medio centímetro de tamaño, de consistencia sólida y bien delimitado, y también se observó inflamación interdigital en la extremidad anterior izquierda. El resto de la exploración y la ausencia de historial médico no proporcionaban suficiente información para el diagnóstico, por lo que se realizaron pruebas adicionales. Se tomó una muestra de sangre para hematología y bioquímica, y se realizaron pruebas de detección de FIV y FeLV para determinar el estado inmunológico del paciente. Además, se realizó una aspiración con aguja de la lesión interdigital para citología y se extirpó quirúrgicamente el nódulo del párpado, que se envió a un laboratorio externo para su diagnóstico. Por último, ante la sospecha de que pudiera tratarse de una infección de Leishmania spp se extrajo una muestra de médula ósea que se envió al laboratorio Instituto de estudios Celulares y Moleculares (ICM) para completar el diagnóstico molecular. El ADN se aisló de esta muestra siguiendo las instrucciones del fabricante del QIAsymphony DSP DNA MiniKit® (QIAGEN, Alemania) y posteriormente empleando los primers: directo (5'- GTGGATAACGGCTCACATAACG -3') inverso (3'- AATATGCGCACAACACAAACAC 5') para la detección de Leishmania a un nivel específico dentro del complejo Leishmania donovani.
Los resultados de la analítica de sangre revelaron niveles bajos de hemoglobina (8.2 g/dL, referencia 12-18 g/dL) y hematocrito (25.4 %, referencia 37-55 %), sin embargo, en la bioquímica no se observaron alteraciones. Las pruebas serológicas dieron positivo para FIV y FeLV y la citología de la muestra interdigital confirmó la presencia de amastigotes de Leishmania spp (Figura 2). Asimismo, la biopsia del nódulo palpebral reveló un infiltrado inflamatorio compuesto principalmente por numerosos macrófagos con amastigotes de Leishmania spp, células plasmáticas y, en menor medida, neutrófilos y linfocitos. El diagnóstico final para esta muestra fue, por tanto, una dermatitis granulomatosa crónica con presencia intralesional del parásito. El producto de amplificación del ensayo PCR específico fue un fragmento de ADN de 311 pb. La especificidad de la amplificación del ADN se confirmó mediante la secuencia de nucleótidos de Sanger. Los productos amplificados resultantes se analizaron y compararon con las secuencias depositadas en la base de datos GenBank utilizando la herramienta Basic Local Alignment Search Tool (Standard Nucleotide BLAST) del National Center for Biotechnology Information (NCBI), observándose una homología de secuencia del 100 % con L. infantum.
En base a la exploración física y los resultados, se confirmó el caso de leishmaniosis felina y se prescribió el tratamiento. Para la resolución de la queratitis y debido al difícil manejo del animal, se decidió probar con un implante subconjuntival de ciclosporina de acción prolongada utilizado frecuentemente para resolver problemas oftalmológicos en équidos (https://cvm.ncsu.edu/nc-state-vet-hospital/equine/ophthalmology/recurrent-uveitis/). El implante ocular se adaptó a la anatomía del paciente y se colocó bajo sedación. Tras un breve periodo de tiempo la mejoría fue notable. El régimen de tratamiento se completó en un inicio con Milteforan® (2 mg/kg PO cada 24 h durante 28 días) por su fácil administración, pero se terminó cambiando a alopurinol (10 mg/kg PO cada 12 h a largo plazo).
Discusión
El objetivo de exponer este caso es contribuir al conocimiento de la situación de LF en el sur de Galicia, subrayando la importancia de considerar esta enfermedad transmitida por vectores como parte del diagnóstico diferencial en la práctica clínica veterinaria y destacando la necesidad de implementar medidas de protección en los hospedadores felinos sobre todo en zonas en las que hay evidencia de la circulación del parásito y hay riesgo de exposición al vector.
El sur de Galicia se caracteriza por su clima mediterráneo (tipo Csa según Köppen) y por tanto presenta condiciones favorables para la transmisión de L. infantum y la supervivencia de los vectores17. De hecho, estudios entomológicos en el pasado han mostraron la presencia de flebotomos de las especies P. perniciosus y P. ariasi en la comunidad autónoma18,27,28, y un estudio preliminar de la fenología de estos insectos en otra zona gallega con la misma clasificación climática, sugirió que su actividad inicia en junio y termina a finales de verano27. Sin embargo, a pesar de la confirmación de la presencia de vectores competentes y la alta circulación de L. infantum en esta región, llegando incluso a considerarse para algunos autores como una zona hiperendémica17,18,21, todavía no hay investigaciones adicionales acerca de cómo se ven afectados los gatos y hasta la fecha, este caso clínico de LF autóctona supone el primero registrado en el noroeste de España.
La infección del paciente se produjo en el entorno urbano de la ciudad de Ourense (Figura 1) y se sospecha que, al tratarse de un animal callejero, no tenía ningún control veterinario ni ninguna otra medida preventiva antiparasitaria. La exploración física y el estado de inmunológico del paciente llevaron a considerar en un primer momento que el daño ocular podría estar asociado a una infección vírica. No obstante, debido a la alta seroprevalencia de L. infantum en la región, también se consideró la enfermedad parasitaria como un diagnóstico diferencial válido dado que las lesiones cutáneas, como la dermatitis nodular en los párpados, son las manifestaciones más frecuentes8,29. Asimismo, la afectación ocular también se ha relacionado con la enfermedad15,30,31. Por otro lado, se ha demostrado que la inmunosupresión por los virus FeLV y FIV favorece la replicación del parásito10 y que la coinfección por retrovirus aumenta la probabilidad de signos clínicos en gatos 9, lo que parece coherente con la historia clínica de nuestro paciente. En la confirmación del diagnóstico se utilizaron métodos citológicos, histológicos porque son herramientas de diagnóstico de rutina relativamente rápidas y de bajo coste en la práctica veterinaria15. Además, la técnica de PCR molecular se implementó por su alta sensibilidad y especificidad y para la caracterización de la especie parasitaria8. No se tomaron en cuenta otras pruebas de laboratorio, considerando que las mencionadas anteriormente son técnicas válidas para el diagnóstico de LF8,9 y el resultado positivo de los exámenes junto con la clínica y la respuesta positiva al tratamiento, corroboraron el diagnóstico.
Para el manejo de los casos clínicos en medicina felina se suele emplear el enfoque empleado en la leishmaniosis canina. La administración de alopurinol se considera la mejor opción26,31,32 y aunque el uso de miltefosina en gatos se incluye entre las posibilidades, se necesita seguir investigando para conocer los posibles efectos secundarios 31,33. En este caso la elección inicial de Milteforan® se hizo debido al difícil manejo del paciente y la facilidad de administración. Finalmente fue necesario cambiar a alopurinol de larga duración. La administración oral junto con el implante subconjuntival de ciclosporina de acción prolongada mostró resultados favorables ya que se observó la desaparición de la queratitis con una recuperación de la transparencia corneal y la reducción de la inflamación de la pata afectada. Se continuó con el seguimiento periódico para comprobar la evolución y durante los 3 años siguientes al diagnóstico se administró alopurinol intermitentemente en función de la aparición de los síntomas, manteniendo al paciente estable hasta su muerte en el verano del 2023.
La detección de este primer caso autóctono de LF en Galicia es relevante desde la perspectiva de Una Salud o One Health, ya que los felinos son una fuente de infección para los flebótomos34,35 y puede considerarse que tiene un impacto significativo a nivel regional e internacional. En primer lugar, esta situación plantea un problema sobre todo en la población de gatos callejeros, donde la falta de medidas de protección contra estos vectores junto con la limitada atención veterinaria puede contribuir a la perpetuación de los ciclos urbanos y periurbanos del parásito. Esto, a su vez, aumenta el riesgo de infección en otros mamíferos, incluyendo a los seres humanos12. Por otro lado, la detección de este primer caso autóctono sirve como una llamada de atención sobre la posible circulación de L. infantum en la población felina autóctona. Esto es especialmente relevante para mejorar la gestión de casos futuros y considerar esta infección en pacientes con síntomas clínicos compatibles, especialmente en aquellos con el sistema inmunológico comprometido.
No obstante, también tiene relevancia a nivel internacional, ya que en Europa la leishmaniosis a menudo se percibe de manera errónea como un problema local y no como un desafío transfronterizo. Por lo tanto, la notificación de todos los casos sigue siendo un reto36. Esta falta de información puede representar un riesgo significativo, especialmente cuando se trasladan hospedadores infectados a áreas que no son endémicas para la enfermedad como ocurre en situaciones de viajes o adopciones. En este contexto, es importante señalar que no es la primera vez que gatos procedentes de España han sido diagnosticados con leishmaniosis felina en el país de destino37,38. En consecuencia, no sería descabellado evaluar la inclusión de técnicas de vigilancia serológica cuando se plantee la adopción de un gato procedente de una zona endémica de Galicia o tras realizar un viaje con mascotas a lugares con esta clasificación dentro del territorio, especialmente cuando se sospeche de una posible exposición a picaduras del vector32. Con respecto a esto último, conviene recordar la importancia de la quimioprofilaxis para evitar la infección, sobre todo teniendo en cuenta el periodo de actividad del vector en la región (entre junio y finales de verano) 27.
Finalmente, este caso debería sentar un precedente no solo en Ourense sino también en otras zonas de Galicia que compartan condiciones climáticas similares, donde ya se haya documentado la presencia del parásito y la incidencia de leishmaniosis canina sea elevada. Sin embargo, es importante recordar que en el futuro podrían surgir circunstancias que conduzcan a la aparición de casos en zonas actualmente no consideradas endémicas, debido a que la globalización y el cambio climático son los principales factores que propician la expansión de esta enfermedad. Por lo tanto, resulta crucial continuar con la investigación para obtener una comprensión más precisa de la epidemiología de esta enfermedad en la población felina en Galicia. Esto permitirá desarrollar protocolos de control más eficaces a nivel local, contribuyendo así a reducir tanto el riesgo para la salud de los animales como para la salud pública.
Agradecimientos
Este trabajo no habría sido posible sin la ayuda y los recursos del laboratorio ICM, así como el interés de los veterinarios involucrados en el caso; una mención especial al oftalmólogo Rubén Ripplinger (Oculus Vet). Los autores también desean agradecer a Mamen Rastrilla Calleja (CeluVet) por donar amablemente las imágenes citológicas. Finalmente, expresamos nuestro sincero agradecimiento a la organización de protección animal (Asociación Protectora Patrulla Callejera) por la excelente labor que realizan.
Bibliografía
- Gramiccia M, Gradoni L. The current status of zoonotic leishmaniases and approaches to disease control. Int J Parasitol. 2005; 35 (11–12):1169–80.
- Souza TD, Turchetti AP, Fujiwara RT, Paixão TA, Santos RL. Visceral leishmaniasis in zoo and wildlife. Vet Parasitol. 2014; 200 (3–4):233–41.
- Alcover MM, Ribas A, Guillén MC, Berenguer D, Tomás-Pérez M, Riera C, et al. Wild mammals as potential silent reservoirs of Leishmania infantum in a Mediterranean area. Prev Vet Med. 2020; 175 (September 2019):104874.
- Cardoso L, Schallig H, Persichetti MF, Pennisi MG. New epidemiological aspects of animal Leishmaniosis in Europe: The role of vertebrate hosts other than dogs. Pathogens. 2021; 10(3):307.
- Giner J, Basurco A, Alcover MM, Riera C, Fisa R, López RA, et al. First report on natural infection with Leishmania infantum in a domestic ferret (Mustela putorius furo) in Spain. Vet Parasitol Reg Stud Reports. 2020; 19(January):100369.
- Miró G, Rupérez C, Checa R, Gálvez R, Hernández L, García M, et al. Current status of L. infantum infection in stray cats in the Madrid region (Spain): implications for the recent outbreak of human leishmaniosis? Parasit Vectors. 2014; 7(1):112.
- Asfaram S, Fakhar M, Teshnizi SH. Is the cat an important reservoir host for visceral leishmaniasis? A systematic review with meta-analysis. J Venom Anim Toxins Incl Trop Dis. 2019; 25(May):1–10.
- Pereira A, Maia C. Leishmania infection in cats and feline leishmaniosis: An updated review with a proposal of a diagnosis algorithm and prevention guidelines. Curr Res Parasitol Vector-Borne Dis. 2021; 1(April):100035.
- Pennisi M-G, Cardoso L, Baneth G, Bourdeau P, Koutinas A, Miró G, et al. LeishVet update and recommendations on feline leishmaniosis. Parasit Vectors. 2015; 8(1):302.
- Martín Sánchez J, Acedo C, Muñóz-Pérez M, Pesson B, Marchal O, Morillas-Márquez F. Infection by Leishmania infantum in cats: Epidemiological study in Spain. Vet Parasitol. 2007 ;145(3–4):267–73.
- Sherry K, Miró G, Trotta M, Miranda C, Montoya A, Espinosa C, et al. A Serological and Molecular Study of Leishmania infantum infection in cats from the Island of Ibiza (Spain). Vector-Borne Zoonotic Dis. 2011; 11(3):239–45.
- Alcover MM, Basurco A, Fernandez A, Riera C, Fisa R, Gonzalez A, et al. A cross-sectional study of Leishmania infantum infection in stray cats in the city of Zaragoza (Spain) using serology and PCR. Parasit Vectors. 2021; 14(1):178.
- Leiva M, Lloret A, Pena T, Roura X. Therapy of ocular and visceral leishmaniasis in a cat. Vet Ophthalmol. 2005; 8(1):71–5.
- Dalmau A, Osso M, Oliva A, Anglada L, Sarobé X, Vives E. Leishmaniosis felina a propósito de un caso clínico. ¿Nos olvidamos de que existe? Clínica Vet pequeños Anim. 2008; 28(4):233–7.
- Fernandez-Gallego A, Feo Bernabe L, Dalmau A, Esteban-Saltiveri D, Font A, Leiva M, et al. Feline leishmaniosis: diagnosis, treatment and outcome in 16 cats. J Feline Med Surg. 2020; 22(10):993–1007.
- Hervás J, Chacón-Manrique de Lara F, López J, Moreno A, Guerrero M-J, Gómez-Villamandos JC. Granulomatous (pseudotumoral) iridociclitis associated with leishmaniasis in a cat. Vet Rec. 2001; 149(20):624–5.
- Gálvez R, Montoya A, Cruz I, Fernández C, Martín O, Checa R, et al. Latest trends in Leishmania infantum infection in dogs in Spain, Part I: mapped seroprevalence and sand fly distributions. Parasit Vectors. 2020; 13(1):204.
- Miró G, Checa R, Montoya A, Hernández L, Dado D, Gálvez R. Current situation of Leishmania infantum infection in shelter dogs in northern Spain. Parasit Vectors. 2012;5(1):60.
- Del Río L, Chitimia L, Cubas A, Victoriano I, De la Rúa P, Gerrikagoitia X, et al. Evidence for widespread Leishmania infantum infection among wild carnivores in L. infantum periendemic northern Spain. Prev Vet Med. 2014; 113(4):430–5.
- Oleaga A, Zanet S, Espí A, Pegoraro de Macedo MR, Gortázar C, Ferroglio E. Leishmania in wolves in northern Spain: A spreading zoonosis evidenced by wildlife sanitary surveillance. Vet Parasitol. 2018; 255(January):26–31.
- Amusategui, I., Sainz, A., Aguirre, E., Tesouro MA. Seroprevalence of Leishmaniasis infantum in Northwest Spain, an area traditionally considered free of leishmaniasis. 2004; 1026:154–7.
- RENAVE. La leishmaniasis en España: evolución de los casos notificados en la Red Nacional de Vigilancia Epidemiológica desde 2005 a 2016 y resultados de la vigilancia de 2014 a 2017. Boletín epidemiológico Sem. 2019; 27(2):27.
- AEMET. Mapas climáticos de España (1981-2010) y ETo (1996-2016). Agencia Estatal de Meteorología. Ministerio para la Transición Ecológica. 2018.
- Concello da Cultura Gallega. Historia da meteoroloxía e da climatoloxía de Galicia [Internet]. Santiago de Compostela: Consello da Cultura Galega; 2008. 209 p. Disponible en: http://books.google.es/books?id=FF0QuOQ3AwoC
- Peel MC, Finlayson BL, McMahon TA. Updated world map of the Köppen-Geiger climate classification. Hydrol Earth Syst Sci. 2007 11;11(5):1633–44.
- Pennisi MG, Persichetti MF. Feline leishmaniosis: Is the cat a small dog? Vet Parasitol. 2018; 251(December 2017):131–7.
- Silva-Torres MI. Epidemiología de díptreos que actúan como vectores de zoonosis en Galicia. Diseño de una red de vigilancia de vectores. University of Santiago de Compostela; 2021.
- ReGaViVec. Vixilancia de Mosquitos Vectores de Enfermidades Humanas e Animais. 2020.
- Abramo F, Albanese F, Gattuso S, Randone A, Fileccia I, Dedola C, et al. Skin Lesions in Feline Leishmaniosis: A systematic review. Pathogens. 2021; 10(4):472.
- Navarro JA, Sánchez J, Peñafiel-Verdú C, Buendía AJ, Altimira J, Vilafranca M. Histopathological lesions in 15 cats with leishmaniosis. J Comp Pathol. 2010; 143(4):297–302.
- Garcia-Torres M, López MC, Tasker S, Lappin MR, Blasi-Brugué C, Roura X. Review and statistical analysis of clinical management of feline leishmaniosis caused by Leishmania infantum. Parasit Vectors. 2022; 15(1):253.
- Rocha R, Pereira A, Maia C. A global perspective on non-autochthonous canine and feline Leishmania infection and leishmaniosis in the 21st century. Acta Trop. 2023; 237 (September 2022):106710.
- Leal RO, Pereira H, Cartaxeiro C, Delgado E, Peleteiro M da C, Pereira da Fonseca I. Granulomatous rhinitis secondary to feline leishmaniosis: report of an unusual presentation and therapeutic complications. J Feline Med Surg Open Reports. 2018 ; 4(2):205511691881137.
- De Colmenares M, Portús M, Botet J, Dobaño C, Gállego M, Wolff M, et al. Identification of Blood Meals of Phlebotomus perniciosus (Diptera: Psychodidae) in Spain by a Competitive Enzyme-Linked Immunosorbent Assay Biotin/Avidin Method. J Med Entomol. 1995; 32(3):229–33.
- Pereira A, Cristóvão JM, Vilhena H, Martins Â, Cachola P, Henriques J, et al. Antibody response to Phlebotomus perniciosus saliva in cats naturally exposed to phlebotomine sand flies is positively associated with Leishmania infection. Parasit Vectors. 2019; 12(1):128.
- Berriatua E, Maia C, Conceição C, Özbel Y, Töz S, Baneth G, et al. Leishmaniases in the European Union and Neighboring Countries. Emerg Infect Dis. 2021; 27(6):1723–7.
- Rüfenacht S, Sager H, Müller N, Schaerer V, Heier A, Welle MM, et al. Two cases of feline leishmaniosis in Switzerland. Vet Record. 2005; (156):542–5.
- Schäfer I, Kohn B, Volkmann M, Müller E. Retrospective evaluation of vector-borne pathogens in cats living in Germany (2012–2020). Parasit Vectors. 2021;14(1):123.
 by Multimédica
by Multimédica