La giardiasis en criaderos, una parasitosis difícil de erradicar
Resumen breve
La giardiasis es una enfermedad común en perros, especialmente entre cachorros provenientes de criaderos. Este artículo pretende hacer una revisión sobre los conocimientos actuales de la enfermedad, para luego centrarse en las medidas terapéuticas e higienicosanitarias a tomar en los criaderos, donde con frecuencia está profundamente arraigada y resulta sumamente complicado erradicarla.Índice de contenidos
Resumen
La giardiasis es una enfermedad común en perros, especialmente entre cachorros provenientes de criaderos. Su tratamiento suele resultar frustrante y las recidivas son frecuentes debido a su elevada capacidad infectiva y de resistencia en el entorno. Este artículo pretende hacer una revisión sobre los conocimientos actuales de la enfermedad, para luego centrarse en las medidas terapéuticas e higienicosanitarias a tomar en los criaderos, donde con frecuencia está profundamente arraigada y resulta sumamente complicado erradicarla.
Introducción
Giardia spp. es un protozoo flagelado perteneciente al orden Diplomonanida. La especie más común es G. duodenalis, también conocida como G. intestinalis y G. lamblia, aunque este último nombre carece de base taxonómica y ya no se usa. G. duodenalis es una zoonosis que afecta a muchos mamíferos incluyendo perros, gatos y humanos. A su vez se clasifica en 8 genotipos denominados de la A a la H, donde A y B afectan principalmente a humanos y los 6 restantes (C a H) se encuentran en diversas especies de animales domésticos y salvajes, siendo C y D los más frecuentes en perros y F en gatos1,2.
Su método de transmisión es directo, fundamentalmente por vía orofecal debido a la contaminación del agua, los alimentos, el pelaje o el ambiente. Su ciclo vital se divide en 2 fases. Los trofozoítos viven adheridos a las vellosidades del intestino delgado, principalmente del duodeno, donde se alimentan y reproducen asexualmente hasta perder los flagelos y enquistarse. Bastan unos pocos ooquistes para infectar al nuevo hospedador. Al ser ingeridos y llegar al duodeno, se disuelve la pared quística y el individuo, ahora tetranucleado, se divide en 2 trofozoítos binucleados que se anclan a las vellosidades intestinales3. El periodo de prepatencia es de 4-16 días y el periodo de patencia suele ser de varias semanas o incluso meses. Ooquistes y trofozoítos son infectantes desde que son eliminados con las heces. Los trofozoítos son sensibles al medio exterior y mueren rápidamente, pero los ooquistes, aunque sensibles a la desecación y a las bajas temperaturas (su número disminuye durante el invierno), pueden sobrevivir incluso meses1.
Un metaanálisis de 374 artículos concluyó que el 15 % de perros y el 12 % de gatos presentan Giardia spp.4. En concreto, en la región de Madrid se detectaron giardias en un 16 % de los perros y un 5 % de los gatos5, mientras que en Castellón se detectaron en el 36 % de los perros, aumentando al 40 % en perreras y criaderos6.
Cualquier colectividad, y en especial los criaderos, reúne las condiciones ideales para la proliferación de Giardia spp.: la concentración de individuos, la entrada de nuevos perros, la dificultad de gestión de la higiene de los locales y la predisposición de los cachorros a padecer la enfermedad favorece la diseminación del parásito. Estas condiciones hacen de la giardiasis en los criaderos una parasitosis endémica imposible de erradicar.
Sintomatología
Se desconocen a ciencia cierta las razones por las que unos perros altamente infestados de G. duodenalis son asintomáticos mientras que otros presentan sintomatología. El sexo, la edad, las coinfecciones con otros patógenos, el estado nutricional y de salud, la dieta, la vida en colectividad o el microbioma podrían tener una relación, si bien diversos artículos lo desmienten2,7. Actualmente, se cree que una infección inicial induce inmunidad parcial disminuyendo la gravedad del cuadro clínico y en algunas ocasiones incluso la eliminación del patógeno, aunque generalmente estos portadores asintomáticos continúan diseminando la parasitosis. Además, existe una resistencia limitada a la reinfección, lo que explica la recidiva de los perros tratados1.
El principal síntoma es la diarrea, tanto aguda como crónica intermitente o persistente. La más típica es maloliente y con esteatorrea, aunque puede tener otras presentaciones (Figura 1A-B).
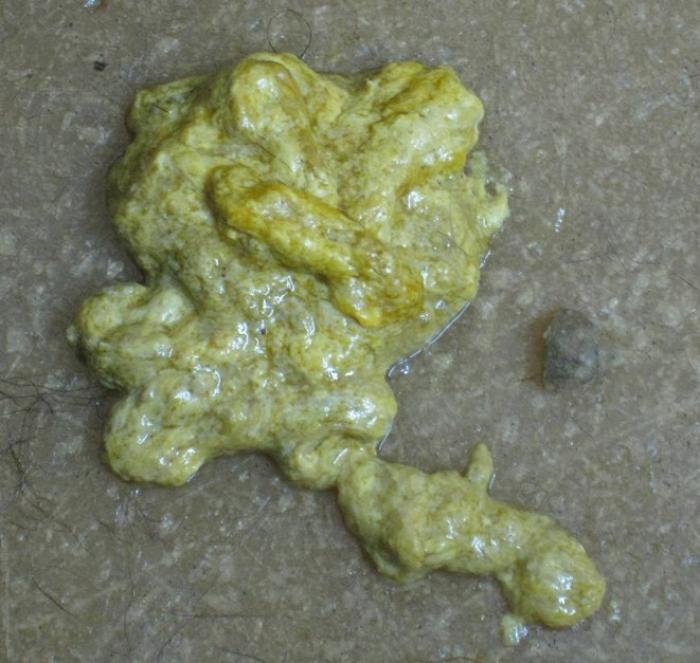
Figura 1. Diarrea con (A) esteatorrea y (B) hematoquecia.

En caso de enteritis severa puede cursar con dolor abdominal, anorexia, náuseas, vómitos, maldigestión y malabsorción, responsable de pérdida de peso y retraso del crecimiento en cachorros. Algunos perros pueden presentar lesiones cutáneas y prurito8. Por el momento no se han correlacionado los signos clínicos a los diferentes genotipos de G. duodenalis, salvo por la presencia de diarrea mucosa, que parece ser más característica del genotipo C2.
Las coinfecciones con diferentes parásitos, bacterias o virus son un factor predisponente para la presentación de síntomatología. Los parásitos más frecuentes que provocan signos digestivos además de G. duodenalis son Ancylostoma caninum, Isospora canis, Uncinaria stenocephala y Trichuris vulpis, siendo frecuente su coinfestación9.
Métodos diagnósticos
Los ooquistes miden 8-17 x 7-10 μm y los trofozoítos tienen una forma piriforme y un tamaño de 9-21 x 5-12 μm. Los trofozoítos en movimiento pueden observarse directamente en las heces recién eliminadas por los animales con signos clínicos o tras un proceso de concentración por flotación en una solución de sulfato de zinc (ZnSO4). Los restos fecales, la similitud de los huevos con levaduras y la excreción intermitente dificultan la técnica. Se recomienda la recogida de heces durante 3-5 días para incrementar la posibilidad de detección de los mismos1.
Las técnicas de referencia utilizadas por muchos laboratorios son la inmunofluorescencia directa (IFD) y la ELISA ProSpec© Giardia/Cryptosporidium (Thermo Fisher Scientific, Pittsburgh, USA). Ambas son muy sensibles, siendo la IFD algo superior10.
Actualmente hay muchas pruebas de inmunodiagnóstico rápido en el mercado. Tomando como referencia los resultados de IFD, un estudio comparativo reveló una disparidad destacable entre las pruebas rápidas ofertadas por las principales marcas internacionales y la flotación en ZnSO410 (Tabla 1).
| Método diagnóstico | Sensibilidad (%) | Especificidad (%) |
|---|---|---|
| SNAP© Giardia Test (IDEXX) | 87.1 | 93.4 |
| Anigen© Rapid CPV-CCV-Giardia Antigen Test (BioNote) | 80.2 | 80.3 |
| Witness© Giardia Test (Zoetis) | 73.3 | 71.1 |
| VetScan© Canine Giardia Rapid Test (Abaxis) | 70.0 | 85.5 |
| Detección de ooquistes y trofozoítos por flotación en ZnSO4 | 81.2 | 93.4 |
Tabla 1. Comparativa entre las pruebas rápidas y la técnica de flotación tomando como referencia la IFD10.
Otro estudio similar también concluye que el SNAP® Giardia de IDEXX es la prueba rápida más sensible y específica11.
Debido a su gran capacidad de reinfestación, los falsos negativos durante la monitorización del tratamiento influyen de forma considerable en el manejo de la parasitosis.
Tratamiento
Las opciones recomendadas clásicamente son fenbendazol 50 mg/kg/24 h durante 5 días y el metronidazol a 25 mg/kg/12 h durante 5 días. Estos tratamientos pueden repetirse mientras persistan los signos clínicos o la excreción de ooquistes. En un estudio sobre la eficacia de estos dos tratamientos en perros infestados naturalmente que no convivían con otros animales, se evaluó la presencia de ooquistes mediante flotación los días 7, 14, 21 y 50 tras el primer día de tratamiento. Si se detectaban quistes, se volvía a administrar otro ciclo. En el primer control, el 71 y 81 % de los perros respectivamente no presentaban ooquistes y el 100 % de ellos fueron negativos el día 21. No se detectaron diferencias en ambos tratamientos, pero un 3 % de ellos volvió a dar positivo el día 50, tal vez por la reinfestación del ambiente, una administración inapropiada de la medicación, la dieta, una excreción intermitente de ooquistes o por las limitaciones diagnósticas propias de las pruebas de flotación12. Seguramente el hecho de que los perros examinados no convivían con otros animales contribuyó a la buena respuesta terapéutica.
Por otro lado, otros estudios sugieren una falta de respuesta al tratamiento con fenbendazol. En otro estudio realizado en condiciones similares (perros de propietario viviendo aislados en su casa y sometidos a medidas higiénicas adaptadas), la consistencia fecal mejoró en el 76 % de ellos, pero solo el 35 % de los perros redujeron más del 90 % la excreción de ooquistes y solo el 17 % de ellos la eliminaron por completo el parásito, sugiriendo una falta de eficacia del fenbendazol13.
La combinación de febantel/pirantel/praziquantel a la dosis estándar (15 mg/kg, 14.4 mg/kg y 5 mg/kg respectivamente), una vez al día durante 3 días es otra opción de tratamiento, aunque las referencias bibliográficas son escasas y de poco calado. Un pequeño estudio sobre 7 perros tratados y 7 control mostró una buena respuesta al tratamiento, pero algunos de los perros tratados volvieron a excretar ooquistes 6 días después del último día de tratamiento. Al ser el periodo de prepatencia de G. duodenalis tan corto como 4 días, se interpretó como una reinfestación14.
El ronidazol también se ha sugerido como tratamiento alternativo. Administrado a 30 mg/kg/12 h durante 7 días consiguió que todos los perros tratados fueran negativos a los 19 días, pero volvieron a dar positivo al cabo de 30 a 60 días incluso a pesar de haber mantenido unas intensas medidas higiénicas tanto de los perros como de las instalaciones durante todo el estudio15.
Los probióticos a base de Enterococcus faecium SF68 (Fortiflora®, Purina) tampoco han resultado eficaces frente a G. duodenalis ni reduciendo la excreción de ooquistes ni mejorando la inmunidad16.
Aunque hace referencia a un escaso número de efectivos, los perros con giardiasis que fueron alimentados con dietas altas en fibras mixtas no presentaban diarrea al 9º día de tratamiento, al contrario de los alimentados con su dieta habitual17.
Profilaxis
Las instalaciones de un criadero y un protocolo de limpieza y desinfección apropiado juegan un papel crucial en prevenir y contener no solo la giardiasis, sino cualquier otro parásito o virus. Desgraciadamente, este tipo de instalaciones y rutina de trabajo precisan tiempo, esfuerzo e inversión económica, recursos que en muchos criaderos familiares o no se disponen o no se está dispuesto a implementar. Los criadores no suelen entender su necesidad hasta que se presenta el problema y a partir de ahí, en especial los parásitos como G. duodenalis son muy complicados de erradicar.
Las medidas higiénicas reposan en cuatro grandes principios:
- Sectorización.
- Marcha en adelante.
- Protocolos de limpieza y desinfección.
- Aseo rutinario de los perros.
Sectorización
Consiste en la separación de los individuos según su grado de sensibilidad a la enfermedad. Los animales más sensibles son los cachorros y deben separarse de los adultos, que a menudo son portadores asintomáticos de parásitos o virus. Se crearán locales o zonas denominadas maternidad (hembras gestantes y neonatos) y guardería (cachorros tras el destete). Los animales enfermos deben ser aislados del resto en la enfermería y los adultos deben tener sus propios locales. Estas zonas deberán tener su propio acceso al exterior, que no deberá ser compartido entre grupos. El material de limpieza debe ser propio de cada zona y los comederos y bebederos propios de cada perrera. Además, los animales provenientes del exterior deben pasar un periodo de aislamiento de al menos 15 días antes de ser integrados con el resto. La cuarentena debe estar completamente separada del resto de locales y solo puede usarse para este fin. Su estancia en ella tiene el doble objetivo de detectar enfermedades contraídas en el exterior y es el momento idóneo para efectuar un protocolo apropiado de desparasitación, higienización y vacunación antes de ponerlos en contacto con el resto de animales. Es un buen momento para efectuar un examen coprológico general incluyendo al menos una prueba rápida de giardiasis.
Marcha en adelante
Es un principio complementario a la sectorización que consiste en aplicar en sentido único desde las zonas más sensibles a los sectores de mayor riesgo. Las visitas a las instalaciones se empiezan por la maternidad, seguido de la guardería, los adultos, la enfermería y, finalmente, la cuarentena (Figura 2). Este circuito debe ser respetado durante cualquier acto en el criadero (limpieza, administración de comida o cualquier otra visita de la colectividad). Debería cambiarse el calzado o ponerse cubrebotas antes de cambiar de sector. Así mismo, deberían limitarse las visitas externas y, en caso de que vengan, suministrarles calzado, cubrebotas y una bata o ropa propias del criadero. Los pediluvios entre cada zona son útiles siempre y cuando se respete un tiempo de remojo del calzado al cambiar de zona.
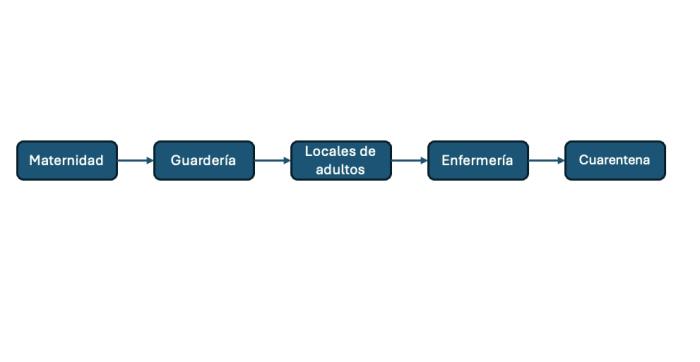
Figura 2. Marcha en adelante: flujo de trabajo en un criadero organizado por sectores según grupos de riesgo infeccioso.
Limpieza-desinfección
Tiene como objetivo reducir la carga infecciosa de la colectividad. Es un punto difícil de abordar con los criadores porque todos están convencidos de aplicarlo correctamente. Sin embargo, los errores son abundantes: utilización de productos todo en uno, confusión de las etapas, desinfección sin limpieza, etc. Tiene un orden específico y unos tiempos que deben respectarse para que sea eficaz (Figura 3).
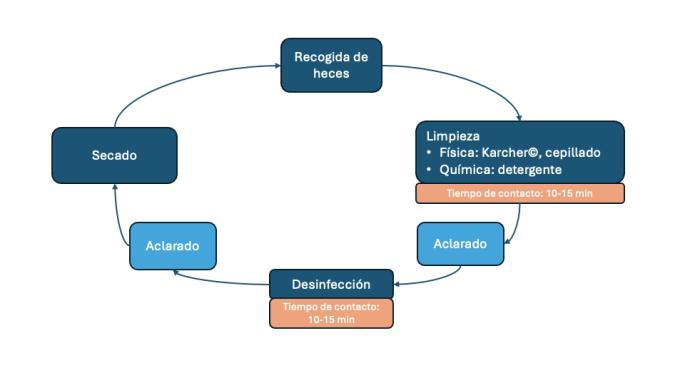
Figura 3. Orden a seguir en el proceso de limpieza y desinfección de instalaciones zoosanitarias.
La limpieza empieza por retirar las heces tan pronto como sean detectadas. Tras haber evacuado los animales a sus zonas anexas (generalmente exteriores en los adultos) se procede a limpiar, para desincrustar la suciedad y los biofilms de las superficies mediante un producto detergente y/o la propia acción mecánica. Puede usarse una Karcher© seguido de la aplicación de un detergente, preferentemente alcalino, con un cepillo. Tras esperar unos 10 a 15 minutos a que el producto haga efecto y se aclara.
Ladesinfecciónconsiste en la aplicación de productos con acción virucida, bactericida, fungicida y parasiticida. Es importante hacer comprender al criador que es un paso independiente de la limpieza, ya que los productos desinfectantes solo son eficaces cuando se aplican sobre superficies limpias, donde previamente se ha eliminado la materia orgánica. Se considera que los ooquistes de Giardia spp. son sensibles a lejía diluida a más de 2 mg/l (la lejía de supermercado diluida a 1:10 supera dicha concentración, cabe recordar que el agua debe estar a menos de 45 ºC porque si no la lejía se evapora con ella) y al amonio cuaternario, siempre respetando un tiempo de contacto de al menos 10 a 15 minutos18. Tal vez el producto más indicado para Giardia spp. sea el 4-cloro-m-cresol (Neopredisan©), cuya ficha técnica especifica su eficiencia frente a ooquistes de Criptosporidium spp. e Isospora spp. entre otros endoparásitos, aunque no cita Giardia spp. específicamente15. Serían interesantes estudios recientes para corroborar la eficiencia de dichos productos desinfectantes frente a Giardia spp.
Todos los microorganismos precisan humedad para resistir en el medio exterior, por lo que el secado es indispensable e implica unas buenas instalaciones de drenaje y ventilación. También pueden usarse rastrillos de agua y secadores. Ahí donde sea posible, se favorecerá la exposición al sol, de gran capacidad germicida.
La superficie de las perreras e instalaciones condiciona la eficacia de la limpieza y desinfección. La maternidad y la guardería deberían estar alicatadas, cuantas menos juntas, mejor. La paridera puede ser de tablero marino, MDF o cualquier otra superficie lisa, uniforme y resistente a los lavados. En la paridera hay que renovar con frecuencia los empapadores y cambiar las mantas, toallas, etc. No hay un sustrato bueno para la guardería, pero es necesario. La viruta o el papel de periódico hecho trizas es preferible a la paja, pero también deben cambiarse muy regularmente, ya que es un medio perfecto para acumular humedad, gérmenes y parásitos. En las zonas de adultos, el suelo puede ser de cemento, con algo de pendiente hacia los sumideros y evitando cualquier zona húmeda. Las casetas o camas tienen que estar elevadas del suelo, ser de un material no poroso y fáciles de desmontar y limpiar. Hay que evitar todos los juguetes u objetos prescindibles. Es preferible que los comederos y bebederos sean de acero inoxidable y deben limpiarse y desinfectarse diariamente. Los bebederos automáticos evitan el agua estancada, que atrae mosquitos y otros animales y sirve de caldo de cultivo de gérmenes.
Aseo de los animales
Debe mantenerse el pelo corto o rasurado, en especial la zona perianal de los perros afectados y lavarlos diariamente con champú de clorhexidina al 4 % dejándolo actuar 10 minutos, al menos la zona lumbar15. Para agilizar una aplicación más regular, pueden alternarse los lavados con champú y la utilización de pulverizadores o lociones de este mismo producto.
Inmunoprofilaxis
La vacunación frente a Giardia spp. se encuentra disponible en ciertos países fuera de la Unión Europea. Se ha demostrado la falta de eficiencia de esta vacuna entre los perros asintomáticos, que continúan excretando ooquistes favoreciendo la diseminación del parásito y pudiendo suponer un riesgo para la salud pública19.
Conclusión
G. duodenalis es un parásito común entre los perros tanto de propietario como de colectividad, siendo los cachorros particularmente sensibles. Es una enfermedad terriblemente complicada de eliminar en criaderos debido a su gran capacidad de replicación, asociada a un periodo de prepatencia muy corto y la capacidad de sus ooquistes para sobrevivir en el exterior. Por ello, el tratamiento no solo se basa en la administración de parasiticidas, sino también en el establecimiento de medidas higiénicas de las instalaciones y de los animales, idealmente antes de que se presente el problema.
Bibliografía
- Guía ESCCAP (2013). Control de Protozoos Intestinales en Perros y Gatos. Guía 6:6-8.
- Smit I, Potocnjak D, Matijatko V, et col. (2023). The Influence of Giardia duodenalis on the Occurrence of Clinical Signs in Dogs. Vet. Sci. 10, 69.
- Balweber LR (2001). Parasites of the Gastrointestinal Tract III—Protozoans In: Veterinary Parasitology, The Practical Veterinarian, Balweber LR, Butterworth–Heinemann Ed., Woburn, 191-218.
- Bouzid M, Halai K, Jeffreys D, Hunter PR (2015). The prevalence of Giardia infection in dogs and cats, a systematic review and meta-analysis of prevalence studies from stool simples. Vet Parasitol 207:181-202.
- Dado D, Montoya A, Blanco MA, et col. (2012). Prevalence and genotypes of Giardia duodenalis from dogs in Spain: possible zoonotic transmission and public health importance. Parasitol Res 111:2419-22.
- Adell-Aledón M, Köster PC, Lucio A, et col (2018). Occurrence and molecular epidemiology of Giardia duodenalis infection in dog populations in eastern Spain. BMC Veterinary Research 14:26.
- Kuzi S, Zgairy S, Byrne BA, et col. (2024). Giardiasis and diarrhea in dogs: Does the microbiome matter? J Vet Intern Med. 38:152–160.
- Williams LBA (2021). Generalized Cutaneous Urticaria Associated with Giardia Infection in a Five-Month Old Puppy. Vet Parasitol Reg Stud Rep 26, 100643.
- Sommer MF, Rupp P, Pietsch M, et col. (2018). Giardia in a Selected Population of Dogs and Cats in Germany—Diagnostics, Coinfections and Assemblages. Vet. Parasitol 249, 49–56.
- Barbecho JM, Bowman DD, Liotta JL (2018). Comparative performance of reference laboratory tests and in-clinic tests forGiardiain canine feces. Parasites & Vectors 11:444.
- Uehlingera FD, Naqvie SA, Greenwoodb SJ, et col. (2017). Comparison of five diagnostic tests forGiardia duodenalisin fecal samples from young dogs. Vet Parasitol 244, 91-96.
- Ciuca L, Pepe P, Bosco A, et col. (2021). Effectiveness of Fenbendazole and Metronidazole Against Giardia Infection in Dogs Monitored for 50-Days in Home-Conditions. Front Vet Sci 8:626424.
- Kaufmann H, Zenner L, Benabed S, et col. (2022). Lack of efficacy of fenbendazole against Giardia duodenalis in a naturally infected population of dogs in France. Parasite 29, 49.
- Bowman DD, Liotta JL, Urich M, et col. (2009). Treatment of Naturally Occurring, AsymptomaticGiardiasp. in Dogs with Drontal® Plus Flavour Tablets. Parasitol Research 105, 125-134.
- Fietchter R, Deplazes P, Schnyder M. (2012). Control ofGiardiainfections with ronidazole and intensive hygiene management in a dog kennel. Vet Parasitol 187:93-98.
- Simpson KW, Rishniw M, Bellosa M, et col. (2009). Influence ofEnterococcus faeciumSF68 Probiotic on Giardiasis in Dogs. J Vet Intern Med 23:476-481.
- Lappin MR, Zug A, Hovenga C (2022). Efficacy of feeding a diet containing a high concentration of mixed fiber sources for management of acute large bowel diarrhea in dogs in shelters. J Vet Intern Med 36:488–492.
- Jarroll EL, Hoff JC (1988). Effect of disinfectants onGiardiacysts. Critical Reviews in Environmental Control18:1–28.
- Anderson KA, Brooks AS, Morrison AL et col. (2004). Impact of Giardia vaccination on asymptomatic Giardia infections in dogs at a research facility. Can Vet J 45:924–930.
 by Multimédica
by Multimédica