Diagnóstico de leptospirosis en perros y gatos
Resumen breve
La leptospirosis es una enfermedad zoonótica re-emergente causa por una bacteria del género Leptospira. Es la zoonosis más extendida en todo el mundo. Su reservorio principal son los mamíferos y suele propagarse a través de suelos y aguas contaminadas.Índice de contenidos
Introducción
La leptospirosis es una enfermedad zoonótica re-emergente causa por una bacteria del género Leptospira. Es la zoonosis más extendida en todo el mundo. Su reservorio principal son los mamíferos y suele propagarse a través de suelos y aguas contaminadas.
Etiología
La leptospirosis está causada por bacterias espiroquetas del género Leptospira. Se trata de bacterias muy móviles, alargadas y enrolladas helicoidalmente que se diferencian morfológicamente de otras espiroquetas por tener un extremo en forma de "signo de interrogación" o de gancho1-3. El género Leptospira se dividía originalmente en dos especies: Leptospira interrogans, que contiene los serovares patógenos, y Leptospira biflexa, que contiene los serovares saprofíticos no patógenos4. Sin embargo, esta clasificación fenotípica ha sido sustituida por la clasificación genética, basada en técnicas de identificación genotípica, que incluye todos los serovares de L. interrogans sensu lato y L. biflexa sensu lato (sensu lato es una expresión latina que significa "en sentido amplio" y a menudo se utiliza taxonómicamente para indicar un complejo de especies)3.
Actualmente, se han identificado 22 especies de Leptospira4; al menos 10 de ellas son patógenas, 7 son saprofitas y 5 patogenicidad indeterminada5. Probablemente en el futuro se describirán más especies. Las especies patógenas de Leptospira se dividen en serovares, cada uno con una composición antigénica distinta; hasta la fecha, se han identificado más de 260 serovares patógenos, ordenados en 26 serogrupos. Esta clasificación serológica, basada en la determinación de las características antigénicas, es más útil desde el punto de vista diagnóstico y también sirve mejor para fines epidemiológicos.
Todos los mamíferos pueden ser susceptibles de contraer la infección por Leptospira spp.3. Existen hospedadores primarios (definitivos) o portadores o reservorios de algunos serovares (por ejemplo, los perros son portadores de Canicola; las vacas y ovejas de Hardjo; los cerdos de Pomona y Bratislava; y las ratas de Icterohaemorrhagiae y Copenhageni). Los huéspedes reservorios alojan leptospiras en los túbulos renales y las eliminan por la orina contaminando el entorno. Estos contribuyen en mayor medida a la propagación de la bacteria en el medio ambiente en comparación con los hospedadores primarios o definitivos (sufren una enfermedad aguda y es poco probable que sirvan como fuente de transmisión; por ejemplo, los seres humanos). El huésped definitivo suele infectarse a una edad temprana y suele presentar enfermedad clínica mínima, mientras que los animales infectados con serovares no adaptados al hospedador presentan signos clínicos más graves3.
Epidemiología
La leptospirosis es endémica en casi todas las regiones del mundo2. Su incidencia suele aumentar al final de los meses de verano, mientras que en los trópicos la mayoría de las infecciones se producen durante y después de los periodos de lluvia1,2. Las especies patógenas de Leptospira experimentan un crecimiento óptimo a temperaturas de 28-30ºC. Aunque no se replican fuera del huésped, pueden sobrevivir durante meses en suelos húmedos saturados de orina1,2.
El determinar qué serovares son la causa principal de la enfermedad es difícil, porque la mayoría de los estudios informan resultados serológicos que pueden no representar el serovar infectante6. En perros los anticuerpos contra los serovares Grippotyphosa, Bratislava, Canicola, Icterohaemorrhagiae, Autumnalis y Pomona se observan con frecuencia y se ha demostrado experimentalmente que los serovares Canicola, Pomona, Bratislava, Icterohaemorrhagiae y Grippotyphosa inducen la enfermedad6,7. Los serovares más frecuentes implicados en la leptospirosis en gatos, en Europa, según la declaración de consenso europeo sobre la leptospirosis, pertenecen a los serogrupos Australis, Autumnalis, Ballum, Canicola, Grippotyphosa, Icterohaemorrhagiae, Pomona y Sejroe8. Los serovares más comúnmente descritos en los Estados Unidos pertenecen a los serogrupos Australis, Autumnalis, Grippotyphosa y Pomona9,10.
Es necesario realizar más estudios epidemiológicos para comprender plenamente qué serovares son los principales responsables de la enfermedad en los perros y gatos (Tabla 1).
| Tabla 1. Serovares de Leptospira sp asociados a animales enfermos. |
| Especie canina | Especie felina |
| L. Grippotyphosa | L. Australis |
| L. Canicola | L. Autumnalis |
| L. Pomona | L.Grippotyphosa |
| L. Bratislava | L. Pomona |
| L. Icterohaemorrhagiae | L. Ballum |
La infección por leptospiras en los gatos se ha asociado con el consumo de presas infectadas11, que implican serovares de los serogrupos Autumnalis y Ballum3. Los gatos de exterior tienen un mayor riesgo de infectarse con leptospiras ya que están en estrecho contacto con los huéspedes reservorios. En las zonas rurales, los gatos también pueden infectarse a través de la orina de los cerdos y las vacas12-15. La presencia de otro gato en el hogar aumenta significativamente el riesgo de seropositividad para la leptospirosis16. En los Estados Unidos, los factores de riesgo asociados para perros son: vivir en la proximidad de agua al aire libre, nadar o beber de fuentes de agua al aire libre y tener una exposición indirecta a la fauna silvestre17. En un estudio, los perros clínicamente sanos que vivían en perreras tenían una mayor prevalencia de anticuerpos contra Leptospira spp. que los perros que se presentaban a las revisiones veterinarias18. Así mismo, los perros que viven en refugios tienen una mayor prevalencia de excreción urinaria de leptospiras patógenas en comparación con los que asisten a visita en hospitales de referencia en Irlanda19. Esto se debe probablemente a la aglomeración de perros y a las normas de higiene potencialmente deficientes que facilitan la transmisión de perro a perro.
Patogénesis
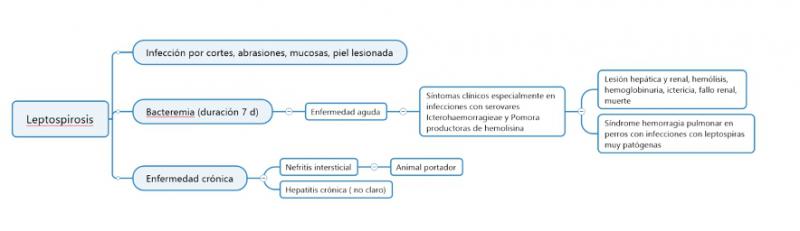
Dependiendo del huésped y del serovar infectante, la infección puede causar un espectro de síndromes, desde el portador asintomático hasta la enfermedad aguda y fulminante3.
Las leptospiras pueden entrar en el cuerpo de perros y gatos, a través de cortes y abrasiones, mucosas (como la conjuntival), o a través de la piel húmeda débil. La bacteriemia dura unos 7 días. La enfermedad aguda se produce en la fase de bacteriemia1,3,20.
Se observa principalmente en huéspedes jóvenes y suele estar asociada a bacterias productoras de hemolisina, como los serogrupos Icterohaemorrhagiae o Pomona, que causan enfermedad hemolítica, hemoglobinuria, ictericia y, en casos graves, la muerte21. Una vez que las leptospiras han alcanzado un nivel crítico en la sangre, los signos clínicos aparecen debido a la acción de las toxinas de la bacteria o de los componentes celulares tóxicos1,3,20. La lesión en los órganos se produce como resultado de la replicación de las leptospiras, la producción de citoquinas y la invasión directa de las células inflamatorias3.
Las lesiones primarias se desarrollan en el endotelio de los pequeños vasos sanguíneos, lo que conduce a una isquemia localizada y da lugar a la necrosis tubular renal, entre otros daños en los órganos diana. La colonización renal se produce en la mayoría de los animales infectados porque las bacterias se replican y persisten en las células del epitelio del túbulo renal. Este proceso de multiplicación provoca la liberación de citoquinas y el reclutamiento de células inflamatorias, que desencadenan nefritis1,3,20. La nefritis intersticial crónica, que puede desencadenar un daño renal crónico, se ha descrito en gatos infectados con leptospiras22. Después de 10 días de infección, las leptospiras entran en el lumen tubular y se eliminan en la orina durante un periodo de días a meses. La duración de la eliminación a través de la orina y su intensidad varía de una especie a otra, de un animal a otro, y depende del serovar infectante3. El desarrollo del estado de portador y se desconocen los mecanismos específicos necesarios para que las leptospiras entren en el lumen de los túbulos renales proximales, se adhieran a las células epiteliales renales, evaden los anticuerpos en el filtrado y adquieran los nutrientes que necesitan para replicarse3.
El síndrome de hemorragia pulmonar leptospiral (por sus siglas en inglés, LPHS) ha sido reconocido en humanos y perros. Puede estar presente en el 70 % de los perros infectados con leptospiras más patógenas23. Los signos clínicos asociados con el LPHS canino son principalmente agudos y los hallazgos corresponden a hemorragias alveolares y subpleurales graves, que causan una disnea asociada. Hasta la fecha, el LPHS no se ha descrito en gatos.
Diagnóstico
Existen diferentes pruebas para el diagnóstico de la leptospirosis en perros y gatos, se clasifican en 2 grandes grupos: las que están dirigidas a la identificación de la bacteria directamente (antígeno) y las que detectan los anticuerpos específicos dirigidos a la bacteria. El primer grupo incluye la visualización directa de las leptospiras mediante cultivo, microscopía de campo oscuro o detección del ADN bacteriano mediante la reacción en cadena de la polimerasa (PCR). Estas pruebas de diagnóstico son más útiles al principio del curso de la enfermedad y antes del uso de medicamentos antimicrobianos, cuando el número de bacterias es mayor en la sangre y la orina. El segundo grupo son pruebas diseñadas para detectar anticuerpos contra Leptospira spp, como lo es la aglutinación microscópica (MAT), ELISA y pruebas rápidas.
Alteraciones analíticas
Los leucocitos pueden fluctuar según el estadio y la gravedad de la infección. Es posible encontrar durante la leptospiremia, leucopenia o leucocitosis por neutrofilia con desviación a la izquierda7,8,24. Las concentraciones de urea y creatinina están aumentadas en el 80-90 % de los casos de leptospirosis canina7. La mayoría de los gatos infectados presentan azotemia en el momento del diagnóstico. El aumento suele ser de moderado a grave25,26. En los perros afectados, los aumentos de las enzimas hepáticas séricas (fosfatasa alcalina [ALP], más comúnmente que la alanina aminotransferasa [ALT]) y de la bilirrubina total se asocian con la disfunción hepática7,20,27. Por el contrario, en la leptospirosis felina estos aumentos no son tan característicos, y sólo se han notificado ligeros aumentos de las transaminasas24,28,29. Las toxinas de las leptospiras inhiben la actividad de la Na+K+-ATPasa en las células epiteliales de los túbulos renales en gatos y perros, lo que puede llevar a pérdidas renales significativas de electrolitos, dando lugar a una hipopotasemia grave. En los gatos, al igual que en los perros, se han notificado aumentos de la concentración de fósforo en suero7, probablemente asociado a una disminución de la tasa de tasa de filtración glomerular. En relación al uroanálisis, los hallazgos en perros incluyen isostenuria, ocasionalmente hipostenuria, glucosuria, proteinuria, bilirrubinuria, hematuria, piuria y la presencia de cilindros en el sedimento urinario fresco7,20. En los gatos, se ha informado de hipostenuria, hematuria y proteinuria15,28. Las leptospiras no son visibles en el sedimento urinario fresco, ya que el tamaño de las bacterias está por debajo de la resolución de la microscopía óptica8.
Diagnóstico por imagen
Se ha descrito la afectación pulmonar en perros con leptospirosis y se han descrito anomalías en la radiografía torácica hasta en el 70 % de los casos23,30. Las anormalidades radiográficas pueden observarse con o sin signos clínicos respiratorios. Lo más habitual es que se observe un patrón intersticial de leve a moderado. En raras ocasiones, se observa un patrón nodular intersticial a alveolar, todas estas alteraciones relacionadas con el síndrome de hemorragia pulmonar leptospiral23,31,32. La ecografía abdominal puede revelar cambios inespecíficos asociados a la lesión renal en el 85 al 100 % de los perros, incluyendo: aumento de la ecogenicidad cortical, renomegalia, pielectasia leve, signo del borde medular o derrame perirrenal. Otros cambios ecográficos pueden incluir cambios hepáticos, como parénquima hipoecoico hepatomegalia y evidencia de lodo biliar33,34. Los pocos informes publicados sobre la leptospirosis en gatos, describen hallazgos ultrasonográficos renales renal que son similares a los de los perros25,28.
Pruebas diagnósticas para la identificación directa de leptospiras (figura 2)
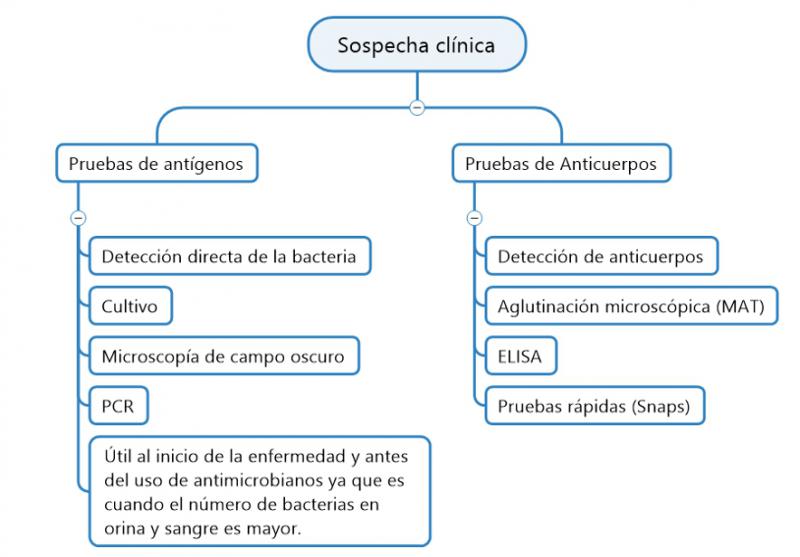
Microscopía de campo oscuro:
La visualización de leptospiras en sangre y orina de perros infectados, necesita el uso de microscopía de campo oscuro3. La sensibilidad es baja debido a varios factores, incluyendo la corta duración de la leptospiremia o la terapia previa con medicamentos antimicrobianos. Puede haber falsos positivos cuando los restos se confunden con espiroquetas. Debido a estas limitaciones, este método no se utiliza de forma rutinaria en el diagnóstico clínico de la leptospirosis3.
Cultivos bacterianos:
El cultivo permite detectar las leptospiras, pero es técnicamente difícil, debido a que requieren medios de crecimiento especiales. Las muestras deben ser transportadas en un medio de crecimiento especial a los laboratorios de referencia. Dado que normalmente no se conoce la fecha de la infección, se deben enviar sangre (primeros 10 días de infección) y orina (después de 10 días de infección) simultáneamente para aumentar la sensibilidad de la prueba. Se requieren tiempos de incubación de cultivos de hasta varios meses para identificar el crecimiento bacteriano, lo que hace que esta prueba sea menos útil para obtener un diagnóstico clínico. Sin embargo, es una herramienta útil para identificar los serovares infectantes y puede proporcionar información epidemiológica valiosa. Aunque el cultivo de leptospiras es muy específico, la sensibilidad es bastante baja35.
Reacción en cadena de la polimerasa:
La PCR identifica directamente el ADN leptospiral. No determina el serogrupo o serovar infectante, pero puede indicar la especie de Leptospira. La prueba puede realizarse en sangre, orina, líquido cefalorraquídeo y tejidos corporales. En casos de leptospirosis aguda, esta sería la prueba de elección para realizar en sangre. En comparación con el cultivo, la PCR da resultados rápidos, contribuyendo a un diagnóstico temprano36. Se recomiendan las técnicas cuantitativas de PCR en tiempo real, debido a su mayor sensibilidad y especificidad. Los genes diana deben ser el lig o el rrs y los presentes solo en especies patógenas, con el fin de aumentar la sensibilidad de la técnica37. Un resultado positivo de la PCR significa que el ADN leptospiral está presente en la muestra. En las infecciones agudas o en los portadores crónicos, la prueba sería positiva en la orina, indicando que el ADN bacteriano está siendo eliminado. Sin embargo, los resultados negativos en sangre y orina no descartan la leptospirosis, ya que la leptospiraemia es transitoria (sólo se produce en las fases iniciales de la de la enfermedad); también los resultados suelen ser negativos si el animal ha recibido terapia antibiótica7,8 y la excreción en la orina puede ser intermitente3. En un estudio, se cultivaron leptospiras de la orina del gato y los resultados confirmados por PCR demostraron la presencia de la bacteria38, lo que sugiere que los gatos pueden eliminar Leptospiras spp. vivas, viables e infectantes y no sólo su ADN.
Diagnóstico de laboratorio mediante pruebas serológicas
Prueba de micro aglutinación microscópica (MAT):
Es la técnica recomendada para el diagnóstico de la leptospirosis, ya que la reactividad de la MAT a un serovar sugiere la exposición a un serovar perteneciente al serogrupo correspondiente (aunque no necesariamente al serovar específico analizado)39. La selección de los serogrupos y de los serovares a evaluar depende de la ubicación geográfica del paciente. Los anticuerpos (IgM e IgG) se detectan en torno a los 15 días después de la infección.
Deben analizarse tanto las muestras agudas como las convalecientes (recogidas entre 7 y 14 días después) y un aumento de 4 veces en los títulos de anticuerpos para serovares individuales es consecuencia de una infección activa3. Es posible que la seroconversión en los gatos se exprese a un título más bajo en comparación con los perros40. La interpretación de los títulos positivos debe tener en cuenta la exposición previa y el estado de vacunación. La interpretación de la prueba puede ser más fiable en los gatos que en los perros, porque no existe interferencia con los anticuerpos de las vacunas, ya que los gatos no están vacunados41.
Ensayos de inmunoabsorción enzimática (ELISA):
Los ELISAs utilizados para el diagnóstico de la leptospirosis, identifican la presencia de anticuerpos leptospirales (anticuerpos específicos de clase IgM, IgG o los dos). Las pruebas que detectan la IgM pueden identificar la respuesta de anticuerpos antes que el MAT, entre 4 y 6 días después de la infección3, pero hasta hace poco estas pruebas no se encontraban fácilmente disponibles para los clínicos. Las principales ventajas del ELISA comparado con la MAT son, la estabilidad de las preparaciones antigénicas, no requieren cultivos vivos de leptospiras y la especificidad de género, lo que significa que todos los tipos de leptospiras pueden diagnosticarse con una única preparación antigénica, independientemente del serovar causante35. En perros, se recomienda una combinación de ELISA más MAT para el diagnóstico de la leptospirosis8. Actualmente no existen este tipo de pruebas desarrolladas para gatos42.
Pruebas rápidas para uso intrahospitalario:
Estas pruebas de diagnóstico están diseñadas para ser realizadas en la clínica y proporcionar resultados iniciales rápidos al profesional, fueron diseñadas hace una década43. Ninguna de las pruebas distingue entre serovares, ni proporcionan una magnitud de título, son pruebas cualitativas de tamizaje. SNAP Lepto (IDEXX), se basa en el uso de LipL32 recombinante y la detección de IgM específica de Leptospira spp., ha demostrado una sensibilidad y especificidad del 100 % y del 95.3 %. Por lo tanto, puede detectar perros con sospecha clínica de leptospirosis aguda, así como perros previamente vacunados. Por lo tanto la interpretación del test debe ser tomada con precaución44. El Witness Lepto (Zoetis) es un ensayo de flujo lateral que detecta anticuerpos IgM utilizando extractos de células enteras de L. kirschneri sv Grippotyphosa y L. interrogans sv Bratislava. La sensibilidad reportada oscila entre 75-98 %, con una especificidad del 93.5 %.
Al igual que el anterior también puede detectar perros vacunados recientemente45. Las dos pruebas tienen una adecuada sensibilidad en las fases sub-aguda y aguda de la enfermedad. Al igual que en el ELISA, no existen pruebas rápidas para el diagnóstico de la leptospirosis en gatos42.
Ninguna de las pruebas diagnósticas descritas en este artículo es adecuada en todos los contextos clínicos; cada prueba tiene sus propias ventajas y limitaciones; por lo tanto, se sugiere el uso de una combinación de pruebas para maximizar el diagnóstico. Los clínicos deben tener en cuenta el momento en que se sospecha que se ha producido la infección al recoger las muestras, para optimizar el rendimiento de las pruebas de diagnóstico. En un entorno clínico, no suele conocerse el momento exacto de la infección, por lo que puede estar justificado el uso de múltiples pruebas en paralelo o en serie para garantizar un diagnóstico rápido y preciso.
Bibliografía
- Levett, P N. (2001). Leptospirosis. Clinical Microbiology, 14(2), 296–326. https://doi.org/10.1128/CMR.14.2.296
- Adler, Ben and De la Peña Moctezuma, A. (2010). Leptospira and leptospirosis. Veterinary Microbiology, (140), 287–296. https://doi.org/10.1080/00219266.1991.9655201
- Adler, B. (2014). Current Topics in Microbiology and Immunology. (Ben Adler, Ed.), Leptospira and leptospirosis (Vol. 387). Berlin Heidelberg 2015: Springer. https://doi.org/10.1007/978-3-662-45059-8
- Faine, S., & Stallman, N. D. (1982). Amended Descriptions of the Genus Leptospira Noguchi 1917 and the Species L. interrogans (Stimson 1907) Wenyon 1926 and L. biflexa (Wolbach and Binger 1914) Noguchi 1918. International Journal of Systematic Bacteriology, 32(4), 461–463. https://doi.org/10.1099/00207713-32-4-461
- Fouts, D. E., Matthias, M. A., Adhikarla, H., Adler, B., Amorim-Santos, L., Berg, D. E., … Vinetz, J. M. (2016). What Makes a Bacterial Species Pathogenic?:Comparative Genomic Analysis of the Genus Leptospira. PLoS Neglected Tropical Diseases, 10(2), e0004403. https://doi.org/10.1371/journal.pntd.0004403
- Levett, Paul N. (2003). Usefulness of Serologic Analysis as a Predictor of the Infecting Serovar in Patients with Severe Leptospirosis. Clinical Infectious Diseases, 36(4), 447–452. https://doi.org/10.1086/346208
- Sykes, J. E., Hartmann, K., Lunn, K. F., Moore, G. E., Stoddard, R. A., & Goldstein, R. E. (2011). 2010 ACVIM Small Animal Consensus Statement on Leptospirosis: Diagnosis, Epidemiology, Treatment, and Prevention. Journal of Veterinary Internal Medicine, 25(1), 1–13. https://doi.org/10.1111/j.1939-1676.2010.0654.x
- Schuller, S., Francey, T., Hartmann, K., Hugonnard, M., Kohn, B., Nally, J. E., & Sykes, J. (2015). European consensus statement on leptospirosis in dogs and cats. Journal of Small Animal Practice, 56(3), 159–179. https://doi.org/10.1111/jsap.12328
- Markovich, J. E., Ross, L., & McCobb, E. (2012). The prevalence of leptospiral antibodies in free roaming cats in Worcester County, Massachusetts. Journal of Veterinary Internal Medicine, 26(3), 688–689. https://doi.org/10.1111/j.1939-1676.2012.00900.x
- Palerme, J., Lamperelli, E., Gagne, J., Cazlan, C., Zhang, M., & Olds, J. E. (2018). Seroprevalence of Leptospira spp., Toxoplasma gondii , and Dirofilaria immitis in Free-Roaming Cats in Iowa 1. Vector Borne and Zoonotic Diseases (Larchmont, N.Y.), 0(0), 1–6. https://doi.org/10.1089/vbz.2017.2255
- Shophet, R, & Marshall, R. B. (1980). An experimentally induced predator chain transmission of Leptospira ballum from mice to cats. The British Veterinary Journal, 136(3), 265–270. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/7388590
- Shophet, Rashel. (1979). A serological survey of leptospirosis in cats. New Zealand Veterinary Journal, 27(11), 236–246. https://doi.org/10.1080/00480169.1979.34662
- Azócar-Aedo, L., Monti, G., & Jara, R. (2014). Leptospira spp. in Domestic Cats from Different Environments: Prevalence of Antibodies and Risk Factors Associated with the Seropositivity. Animals, 4(4), 612–626. https://doi.org/10.3390/ani4040612
- Talebkhan Garoussi, M., Mehravaran, M., Abdollahpour, G., & Khoshnegah, J. (2015). Seroprevalence of leptospiral infection in feline population in urban and dairy cattle herds in Mashhad, Iran. Veterinary Research Forum : An International Quarterly Journal, 6(4), 301–304. https://doi.org/26973765
- Ojeda, J., Salgado, M., Encina, C., Santamaria, C., & Monti, G. (2018). Evidence of interspecies transmission of pathogenic Leptospira between livestock and a domestic cat dwelling in a dairy cattle farm. Journal of Veterinary Medical Science, 80(8), 1305–1308. https://doi.org/10.1292/jvms.16-0361
- Rodriguez, J., Lapointe, C., Arsenault, J., Carioto, L., & Harel, J. (2014). 11:13 Serologic and Urinary PCR Survey of Leptospirosis in Healthy Cats and in Cats with Kidney Disease, 284–293.
- Ghneim, G. S., Viers, J. H., Chomel, B. B., Kass, P. H., Descollonges, D. A., & Johnson, M. L. (2007). Use of a case-control study and geographic information systems to determine environmental and demographic risk factors for canine leptospirosis. Veterinary Research, 38(1), 37–50. https://doi.org/10.1051/VETRES:2006043
- Scanziani, E., Origgi, F., Giusti, A. M., Iacchia, G., Vasino, A., Pirovano, G., … Tagliabue, S. (2002). Serological survey of leptospiral infection in kennelled dogs in Italy. The Journal of Small Animal Practice, 43(4), 154–157. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/11996391
- Rojas, P., Monahan, A. M., Schuller, S., Miller, I. S., Markey, B. K., & Nally, J. E. (2010). Detection and quantification of leptospires in urine of dogs: a maintenance host for the zoonotic disease leptospirosis. European Journal of Clinical Microbiology & Infectious Diseases, 29(10), 1305–1309. https://doi.org/10.1007/s10096-010-0991-2
- Craig E. Greene, Jane E. Sykes , George E. Moore , Richard E. Goldstein, and R. D. S. (2015). Leptospirosis. In C. E. Greene (Ed.), Infectious Diseases of the Dog and Cat 4th Edition (4th ed., Vol. 1, pp. 431–447). St. Louis, Missouri: Elsevier. https://doi.org/10.1017/CBO9781107415324.004
- Adler, B. (2015). History of Leptospirosis and Leptospira. In Current topics in microbiology and immunology (Vol. 387, pp. 1–9). https://doi.org/10.1007/978-3-662-45059-8_1
- Millán, J., Candela, M. G., López-Bao, J. V., Pereira, M., Jiménez, M. Á., & León-Vizcaíno, L. (2009). Leptospirosis in Wild and Domestic Carnivores in Natural Areas in Andalusia, Spain. Vector-Borne and Zoonotic Diseases, 9(5), 549–554. https://doi.org/10.1089/vbz.2008.0081
- Kohn, B., Steinicke, K., Arndt, G., Gruber, A. D., Guerra, B., Jansen, A., … Nöckler, K. (2010). Pulmonary Abnormalities in Dogs with Leptospirosis. Journal of Veterinary Internal Medicine, 24(6), 1277–1282. https://doi.org/10.1111/j.1939-1676.2010.0585.x
- Agunloye, C. A., & Nash, A. S. (1996). Investigation of possible leptospiral infection in cats in Scotland, 126–129.
- Beaudu-Lange, C., & Lange, E. (2014). Unusual clinical presentation of leptospirosis in a cat. Revue Veterinaire Clinique, 49(3), 115–122. https://doi.org/10.1016/j.anicom.2014.05.001
- Lapointe, C., Plamondon, I., & Dunn, M. (2013). Feline leptospirosis serosurvey from a Quebec referral hospital. Canadian Veterinary Journal, 54(5), 497–499.
- Goldstein, R. E. (2010). Canine Leptospirosis. Veterinary Clinics of North America: Small Animal Practice, 40(6), 1091–1101. https://doi.org/10.1016/j.cvsm.2010.07.008
- Arbour, J., Blais, M.-C., Carioto, L., & Sylvestre, D. (2012). Clinical Leptospirosis in Three Cats (2001–2009). Journal of the American Animal Hospital Association, 48(4), 256–260. https://doi.org/10.5326/JAAHA-MS-5748
- Weis, S., Rettinger, A., Bergmann, M., Llewellyn, J. R., Pantchev, N., Straubinger, R. K., & Hartmann, K. (2017). Detection of Leptospira DNA in urine and presence of specific antibodies in outdoor cats in Germany. Journal of Feline Medicine and Surgery, 19(4). https://doi.org/10.1177/1098612X16634389
- Knöpfler, S., Mayer-Scholl, A., Luge, E., Klopfleisch, R., Gruber, A. D., Nöckler, K., & Kohn, B. (2017). Evaluation of clinical, laboratory, imaging findings and outcome in 99 dogs with leptospirosis. Journal of Small Animal Practice, 58(10), 582–588. https://doi.org/10.1111/jsap.12718
- Birnbaum, N., Barr, S. C., Center, S. A., Schermerhorn, T., Randolph, J. F., & Simpson, K. W. (1998). Naturally acquired leptospirosis in 36 dogs: serological and clinicopathological features. The Journal of Small Animal Practice, 39(5), 231–236. https://doi.org/10.1111/j.1748-5827.1998.tb03640.x
- Mastrorilli, C., Dondi, F., Agnoli, C., Turba, M. E., Vezzali, E., & Gentilini, F. (2007). Clinicopathologic features and outcome predictors of Leptospira interrogans Australis serogroup infection in dogs: a retrospective study of 20 cases (2001-2004). Journal of Veterinary Internal Medicine, 21(1), 3–10. https://doi.org/10.1892/0891-6640(2007)21[3:cfaopo]2.0.co;2
- Forrest, L. J., O’Brien, R. T., Tremelling, M. S., Steinberg, H., Cooley, A. J., & Kerlin, R. L. (1998). Sonographic renal findings in 20 dogs with leptospirosis. Veterinary Radiology & Ultrasound : The Official Journal of the American College of Veterinary Radiology and the International Veterinary Radiology Association, 39(4), 337–340. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/9710138
- Sonet, J., Barthélemy, A., Goy-Thollot, I., & Pouzot-Nevoret, C. (2018). Prospective evaluation of abdominal ultrasonographic findings in 35 dogs with leptospirosis. Veterinary Radiology & Ultrasound : The Official Journal of the American College of Veterinary Radiology and the International Veterinary Radiology Association, 59(1), 98–106. https://doi.org/10.1111/VRU.12571
- Hartskeerl, R. A., Smits, H. L., Korver, H., Goris, M. G. ., & Terpstra, W. J. (2006). International course on laboratory methods for the diagnosis of leptospirosis (5th ed.). Amsterdam, The Netherlands.
- Reagan, K. L., & Sykes, J. E. (2019). Diagnosis of Canine Leptospirosis. Veterinary Clinics of North America - Small Animal Practice, 49(4), 719–731. https://doi.org/10.1016/j.cvsm.2019.02.008
- Bourhy, P., Bremont, S., Zinini, F., Giry, C., & Picardeau, M. (2011). Comparison of real-time PCR assays for detection of pathogenic Leptospira spp. in blood and identification of variations in target sequences. Journal of Clinical Microbiology, 49(6), 2154–2160. https://doi.org/10.1128/JCM.02452-10
- Dorsch, R., Ojeda, J., Salgado, M., Monti, G., Collado, B., Tomckowiack, C., … Hartmann, K. (2020). Cats shedding pathogenic Leptospira spp.-An underestimated zoonotic risk? PloS One, 15(10). https://doi.org/10.1371/JOURNAL.PONE.0239991
- Cole, J. R., Sulzer, C. R., & Pursell, A. R. (1973). Improved microtechnique for the leptospiral microscopic agglutination test. Applied Microbiology, 25(6), 976–980. https://doi.org/10.1128/AM.25.6.976-980.1973
- Shropshire, S. B., Veir, J. K., Morris, A. K., & Lappin, M. R. (2016). Evaluation of the Leptospira species microscopic agglutination test in experimentally vaccinated cats and Leptospira species seropositivity in aged azotemic client-owned cats. Journal of Feline Medicine and Surgery, 18(10), 768–772. https://doi.org/10.1177/1098612X15593902
- Hartmann, K., Egberink, H., Pennisi, M. G., Lloret, A., Addie, D., Belák, S., … Horzinek, M. C. (2013). Leptospira Species Infection in Cats. Journal of Feline Medicine and Surgery, 15(7), 576–581. https://doi.org/10.1177/1098612X13489217
- Murillo, A., Goris, M., Ahmed, A., Cuenca, R., & Pastor, J. (2020). Leptospirosis in cats: Current literature review to guide diagnosis and management. Journal of Feline Medicine and Surgery, 22(3). https://doi.org/10.1177/1098612X20903601
- Abdoel, T. H., Houwers, D. J., van Dongen, A. M., Adesiyun, A. A., Jiménez-Coelloe, M., Cardoso, L., … Smits, H. L. (2011). Rapid test for the serodiagnosis of acute canine leptospirosis. Veterinary Microbiology, 150(1–2), 211–213. https://doi.org/10.1016/j.vetmic.2011.01.015
- Lizer, J., Velineni, S., Weber, A., Krecic, M., & Meeus, P. (2018). Evaluation of 3 Serological Tests for Early Detection Of Leptospira-specific Antibodies in Experimentally Infected Dogs. Journal of Veterinary Internal Medicine, 32(1), 201–207. https://doi.org/10.1111/jvim.14865
- Kodjo, A., Calleja, C., Loenser, M., Lin, D., & Lizer, J. (2016). A Rapid In-Clinic Test Detects Acute Leptospirosis in Dogs with High Sensitivity and Specificity. BioMed Research International, 2016. https://doi.org/10.1155/2016/3760191
 by Multimédica
by Multimédica