Actualización en micoplasmosis en perros y gatos
Resumen breve
Dentro de las micoplasmosis caninas y felinas se incluye la presencia de infecciones a nivel hemático, respiratorio y del tracto genitourinario causada por estos microorganismos. Existen un total de 5 micoplasmas hemotrópicos o hemoplasmas asociados al desarrollo de cuadros clínicos de anemia, de mayor o menor relevancia en perros (Mycoplasma haemocanis, Candidatus Mycoplasma haematoparvum) y gatos (Mycoplasma haemofelis, Candidatus Mycoplasma haemominutum, Candidatus Mycoplasma turicensis) y…Índice de contenidos
Resumen
Dentro de las micoplasmosis caninas y felinas se incluye la presencia de infecciones a nivel hemático, respiratorio y del tracto genitourinario causada por estos microorganismos. Existen un total de 5 micoplasmas hemotrópicos o hemoplasmas asociados al desarrollo de cuadros clínicos de anemia, de mayor o menor relevancia en perros (Mycoplasma haemocanis, Candidatus Mycoplasma haematoparvum) y gatos (Mycoplasma haemofelis, Candidatus Mycoplasma haemominutum, Candidatus Mycoplasma turicensis) y 4 micoplasma asociados a infecciones respiratorias en ambas especies (Mycoplasma felis, Mycoplasma feliminutum, Mycoplasma gateae, Mycoplasma cynos). Aunque la evidencia actual demuestra cada vez más su papel como patógenos primarios, es su capacidad de interacción con otros patógenos, enmarcados dentro de procesos de inmunosupresión o de complejos respiratorios multifactoriales, lo que facilita el desarrollo de las micoplasmosis del perro y el gato. Aunque existe antibioterapia efectiva para el control de las infecciones por estos patógenos, es esencial un buen control de los factores de riesgo asociados para poder combatir estos procesos patológicos de forma efectiva.
Introducción
La relevancia de las infecciones causadas por micoplasmas en el campo de la veterinaria ha tenido, por regla general, sus máximos exponentes en aquellos procesos clínicos relacionados con animales de producción. Sin embargo, cada vez es más relevante su papel como patógenos primarios en el perro y el gato, o como miembros del complejo respiratorio felino y canino en combinación con otros agentes etiológicos de tipo bacteriano y/o viral.
Los micoplasmas, nomenclatura habitual para aquellos microorganismos del género Mycoplasma, son considerados como los organismos más pequeños con capacidad de autorreplicación descritos hasta la fecha1. Filogenéticamente relacionados con microorganismos del género Clostridium, la evolución de estos microorganismos está caracterizada por una reducción progresiva de su material genético, la ausencia de membrana celular, su incapacidad para sintetizar determinados aminoácidos y una alta especificidad de hospedador2. En la tabla 1 se detallan las principales especies de micoplasmas descritas en perro y gatos.
| Tabla 1. Principales especies de micoplasmas caninos y felinos. |
| Agente etiológico | Especie diana | Presentación clínica primaria | Información adicional |
| Mycoplasma haemofelis | Gato | Anemia | Principal hemoplasma felino. Se presenta en animales con y sin evidencia de inmunosupresión. |
| Candidatus Mycoplasma haemominutum | Gato | Anemia | Asociado a anemia en animales inmunodeprimidos |
| Candidatus Mycoplasma turicensis | Gato | Anemia | Asociado a anemia en animales inmunodeprimidos |
| Mycoplasma felis | Gato | Procesos respiratorios | Principal micoplasma respiratorio felino |
| Mycoplasma feliminutum | Gato | Procesos respiratorios | |
| Mycoplasma gateae | Gato | Procesos respiratorios | |
| Mycoplasma cynos | Perro | Procesos respiratorios | |
| Mycoplasma canis | Perro | Afección del tracto urogenital | |
| Mycoplasma haemocanis | Perro* | Anemia | *Descrito ocasionalmente en gatos |
| Candidatus Mycoplasma haematoparvum | Perro | Anemia | Asociado a anemia en animales inmunodeprimidos |
Las micoplasmosis de perro y gatos presentan una distribución global, habiéndose demostrado su presencia tanto en animales domésticos como en cánidos y félidos salvajes, actuando como hospedadores naturales, principalmente para los micoplasmas hemotrópicos o hemoplasmas. Hasta la fecha se ha demostrado la presencia de alguno de los hemoplasmas descritos en la tabla 1 en lobo (Canis lupus), zorro (Vulpes vulpes), tejón (Meles meles), marta (Martes martes), garduña (Martes foina), comadreja (Mustela nivalis), gineta (Genetta genetta), jaguar (Panthera onca), puma (Puma concolor), ocelote (Leopardus pardalis), yaguarundí (Puma yagouaroundi), leopardo tigre (Leopardus tigrinus), gato montés (Felis silvestris silvestris), guepardo (Acinonyx jubatus), leopardo (Panthera pardus), león (Panthera leo), tigre siberiano (Panthera tigris altaica), leopardo de las nieves (Uncia uncia), gato de Geoffroy (Oncifelis geoffroyi), margay (Leopardus wiedii), colocolo (Oncifelis colocolo) y puma (Puma concolor)3–5.
Los micoplasmas caninos y felinos tienen un especial tropismo por el aparato respiratorio y la sangre, asociándose generalmente a procesos infecciosos del tracto respiratorio inferior, y de anemia, que suele progresar en algunos casos a anemia hemolítica inmunomediada. Además, se ha observado en la especie canina la presencia de infecciones genitourinarias causadas por micoplasmas, caracterizada por la presencia de infertilidad, epididimitis y endometritis6. Asimismo, se han descrito de forma ocasionales presentaciones clínicas atípicas asociadas a micoplasmas caninos y felinos, entre las que se incluyen casos de meningoencefalomielitis y artritis asociados a M. felis7,8, junto a la identificación de micoplasmas caninos en casos de mordidas a humanos9 y del micoplasma hemotrópico M. haematoparvum en la sangre de una veterinaria con sintomatología neurológica, en infección simultánea con Anaplasma platys y Bartonella henselae10.
Por lo general, las infecciones respiratorias causadas por micoplasmas en perros y gatos son especialmente prevalentes en colectivos de estas especies animales. Debido a este hecho, todos aquellos establecimientos que fomenten la presencia de altas densidades de individuos (refugios de animales, colonias felinas, perreras, criaderos, etc.) suponen un factor de riesgo para el desarrollo de micoplasmosis respiratorias11,12. En relación a las infecciones causadas por hemoplasmas, existe variabilidad en lo que a su transmisión se refiere. En el caso de hemoplasmas caninos, su transmisión se ha asociado principalmente a la presencia de la garrapata Rhipicephalus sanguineus13. Mientras que en lo que respecta a los hemoplasmas felinos, principalmente en el caso de M. haemofelis, su transmisión se asocia a picaduras de la pulga Ctenocephalides felis, sin que hasta la fecha se haya podido confirmar su transmisión por esta pulga de forma experimental14. Otro mecanismo de transmisión descrito para este microorganismo incluye la interacción agresiva entre individuos (mordidas y arañazos)15.
Hemoplasmas felinos
La primera descripción de la presencia de micoplasmas hemotrópicos felinos se remonta al año 1942, bajo la denominación de Eperythrozoon felis16, que aproximadamente 10 años después sería modificada por el término Haemobartonella felis17. La nomenclatura actual, que pasa a incluir este patógeno dentro del género Mycoplasma, no ocurrió hasta el año 200118, clasificación que considera a M. haemofelis como el hemoplasma felino tipo.
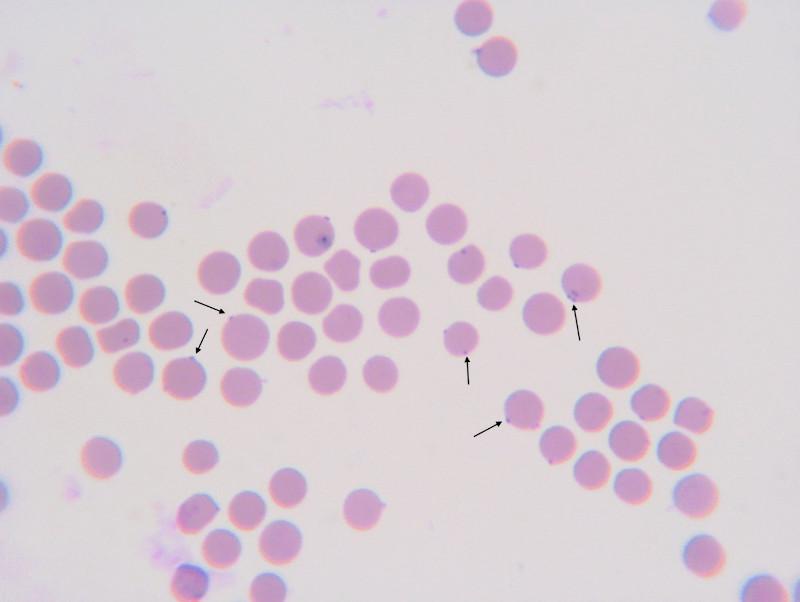
M. haemofelis es considerado como el hemoplasma más relevante en clínica felina, debido principalmente a su asociación con casos de anemia en esta especie animal sin la necesidad de que la infección se presente en animales inmunocomprometidos19. Este micoplasma se ha asociado a casos de anemia hemolítica inmunomediada, que en algunos casos puede llegar a ser severa20. La principal presentación clínica de las infecciones por M. haemofelis es aquella asociada a anemia o al proceso inmunomediado asociado. La sintomatología incluye letargo, debilidad, depresión, palidez, taquicardia, disnea, taquipnea, hepatoesplenomegalia, linfadenopatía, deshidratación, fiebre, pérdida de peso, pica, e ictericia21. Se sugiere que la anemia ocurre como consecuencia del daño directo del micoplasma sobre la superficie del eritrocito, que a su vez puede combinarse con el desarrollo de anticuerpos contra los propios eritrocitos infectados, desencadenando el proceso de anemia inmunomediada22. Debido a esto, en casos de infección aguda por M. haemofelis es común observar autoaglutinación eritrocitaria y test de Coombs positivo. En la figura 1 se observa la presencia de célula típica localización de M. haemofelis en la superficie de los eritrocitos sin penetrar en los mismos.
Se han descritos prevalencias de este patógeno, basadas en técnicas de detección molecular, que varían entre 0.7 y 21 %19, aunque la información debe analizarse con cautela, ya que en muchos estudios se trata de muestras de conveniencia que podrían sesgar la interpretación. En España se ha descrito una prevalencia de este patógeno de un 3.7 % en estudios realizados en hospitales universitarios de Barcelona y Madrid23,24.
El tratamiento de elección para las infecciones por M. haemofelis se basa en el uso de tetraciclinas y fluoroquinolonas19. Se ha demostrado efectividad en el tratamiento de animales infectados experimentalmente usando doxiciclina 5 mg/kg por vía oral dos veces al día durante 14 días. También ha resultado efectivo el uso de fluoroquinolonas (enrofloxacina 5 mg/kg o 10 mg/kg por vía oral una vez al día durante 14 días, marbofloxacina 2 mg/kg por vía oral una vez al día durante 28 días, marbofloxacina 2.75 mg/kg por vía oral una vez al día durante 14 días, pradofloxacina 5 mg/kg o 10 mg/kg por vía oral una vez al día durante 14 días)21. El consejo asesor europeo de enfermedades felinas (ABCD) recomienda el uso de doxiciclina 10 mg/kg por vía oral una vez al día o 5 mg/kg por vía oral dos veces al día de 2 a 4 semanas como primera elección, siempre valorando el riesgo de esofagitis causada por algunas formulaciones de este antibiótico25.
Sin embargo, estos tratamientos no logran la eliminación completa de este patógeno, por lo que el estado de portador crónico juega un papel muy relevante en la epidemiología de esta enfermedad. En la actualidad existe un protocolo que ha conseguido la total eliminación de M. haemofelis de gatos infectados basado en el uso de doxiciclina (5 mg/kg por vía oral dos veces al día durante 28 días) seguido de un tratamiento con marbofloxacina (2 mg/kg por vía oral una vez al día durante 14 días) en caso de demostrarse todavía la presencia de patógenos en sangre26.
Los otros dos hemoplasmas descritos en gatos, M. haemominutum y M. turicensis son menos relevantes desde el punto de vista clínico, habiéndose descrito generalmente en casos de anemia leve a moderada en animales inmunocomprometidos, sobre todo en casos de animales infectados con retrovirus25. Por lo general, las prevalencias descritas para M. haemominutum son más elevadas que las observadas en el caso de M. haemofelis. En España, la prevalencia observada varía entre 8.1 y 9.9 %, mientras que en el caso de M. turicensis se limita al 0.5 % de los animales evaluados23,24. Se sugiere que el tratamiento para el control de estos dos hemoplasmas es similar al descrito para M. haemofelis. No obstante, al asociarse principalmente a animales portadores inaparentes, se debe limitar su uso para cuando haya una presentación clínica evidente.
Los factores de riesgo asociados a infecciones por hemoplasmas incluyen el sexo, con una mayor frecuencia de infección gatos macho, la edad, siendo los gatos jóvenes más propensos a desarrollar infecciones por M. haemofelis y los mayores por M. haemominutum, la raza, siendo los mestizos aquellos donde se ha demostrado una mayor prevalencia, ser un gato de exterior y el estatus positivo frente al virus de la leucemia y de la inmunodeficiencia felina22,24,25.
Al no poder ser cultivados in vitro, el diagnóstico de las hemoplasmosis felinas se basa principalmente en el uso de protocolos de reacción en cadena de la polimerasa a partir de muestras de sangre conservadas en EDTA. Hasta la fecha no existen pruebas serológicas disponibles comercialmente para el diagnóstico de hemoplasmas.
La prevención de las hemoplasmosis felinas se basa en la eliminación de factores de riesgo, el cribado de la sangre usada en transfusión para determinar la ausencia de hemopatógenos y la eliminación de artrópodos que puedan actuar como vectores21,25.
Hemoplasmas caninos
M. haemocanis es el hemoplasma más relevante en perros. Con una distribución mundial, su relevancia clínica es limitada, presentándose la mayoría de los casos en asociación con cuadros de inmunosupresión o en animales esplenectomizados6,27. Por lo general, la clínica, caracterizada por la presencia de anemia, se resuelve sin la necesidad de intervención clínica, aunque en casos puntuales se ha observado el desarrollo de procesos de anemia inmunomediada e incluso mortalidad en algunos animales con factores predisponentes28. En España se ha observado una prevalencia de este patógeno de un 14.3 %23 en la población general de perros. Algunos autores han descrito una elevada prevalencia en perros presentes en perreras, con prevalencias que variaron entre 30 y 87 % de los animales evaluados, por lo que se considera la presencia de una alta densidad de animales como un potencial factor de riesgo para el desarrollo de infecciones por M. haemocanis29. Además de la transmisión por garrapatas descrita anteriormente, se ha demostrado la transmisión vertical de este patógeno, hecho que puede jugar un papel fundamental en el mantenimiento del perro como reservorio de este patógeno30.
La doxiciclina es el antibiótico de elección para combatir las infecciones causadas por M. haemocanis, habiéndose llegado a la eliminación completa del patógeno en un tratamiento con 10 mg/kg diarios por vía oral tras 87 días de administración31.
M. haematoparvum representa al otro hemoplasma canino descrito hasta la fecha. Este microorganismo, aislado a partir de sangre de un perro esplenectomizado con una neoplasia hemática32, también presenta una distribución mundial, sin embargo, su relevancia clínica es mucho más limitada en comparación con M. haemocanis.
Micoplasmas respiratorios
Las micoplasmosis respiratorias en perros y gatos suelen aparecer de forma asociada a otros patógenos y a fenómenos de estrés ambiental englobados dentro de los complejos respiratorios caninos y felinos.
En perros, aunque todavía se discuta su papel como patógeno primario o secundario, M. cynos es el microorganismo que se asocia más comúnmente con cuadros de enfermedad respiratoria. En inoculación experimental, este patógeno es capaz de producir ciliostasis y desarrollo de infiltrado broncoalveolar de células mononucleares en pulmón33. La presencia de M. cynos en lugares donde hay una alta densidad de perros ha demostrado un aumento en la severidad de los cuadros de enfermedad infecciosa respiratoria canina, asociándose a animales jóvenes (< 1 año)34. M. cynos es considerado como un patógeno respiratorio canino emergente35, habiéndose demostrado la presencia de infecciones concomitantes con otros patógenos caninos relevantes como el virus del moquillo canino, adenovirus canino tipo 2, coronavirus canino, parainfluenza y Bordetella bronchiseptica34,36,37. También se han descrito casos de mortalidad en camadas de Golden Retriever debidas a este patógeno38.
En gatos, la enfermedad respiratoria causada por micoplasmas se asocia a enfermedad del tracto respiratorio superior, en combinación con el herpesvirus y coronavirus felino, Bordetella bronchiseptica y Chlamydophila felis39. M. felis es el principal micoplasma asociado a infecciones respiratorias en gatos, donde al igual que en el caso de las micoplasmosis respiratorias caninas, la alta densidad de animales juega un papel clave en el desarrollo de infecciones por este patógeno40. En lo que respecta al tracto respiratorio inferior, aunque existe menor frecuencia de infección, los datos sugieren que puede actuar como patógeno primario en esta localización anatómica41.
El diagnóstico de ambos micoplasmas respiratorios es idéntico, basándose en el uso de cultivo in vivo específico en laboratorio especializado y en la detección por la técnica de PCR35,41. La doxiciclina es el tratamiento de elección para procesos respiratorios causados por micoplasmas en perros y gatos6,41. En gatos se recomiendan tratamientos de un mínimo de 4 semanas. Además, hay que destacar que la recurrencia post tratamiento es bastante elevada.
Micoplasmas del tracto urogenital
Las micoplasmosis con afección del tracto urogenital se centran principalmente en la especie canina, siendo M. canis el principal micoplasma asociado a sintomatología clínica, habiéndose asociado a cuadros de infertilidad, epididimitis y cistitis42. Cabe destacar que la presencia de micoplasmas en el tracto reproductor de hembras sanas y en líquido seminal sin alteraciones clínicas es bastante elevada43,44, por lo que su papel como patógeno primario en esta localización anatómica necesita de más estudio.
Bibliografía
- Razin, S. Peculiar properties of mycoplasmas: The smallest self-replicating prokaryotes. FEMS Microbiol. Lett. 100, 423–431 (1992).
- Pitcher, D. G. & Nicholas, R. A. J. Mycoplasma host specificity: Fact or fiction? Vet. J. 170, 300–306 (2005).
- André, M. R., Adania, C. H., Allegretti, S. M. & Machado, R. Z. Hemoplasmas in Wild Canids and Felids in Brazil. J. Zoo Wildl. Med. 42, 342–347 (2011).
- Willi, B. et al. Worldwide Occurrence of Feline Hemoplasma Infections in Wild Felid Species. J. Clin. Microbiol. 45, 1159–1166 (2007).
- Millán, J. et al. High diversity of hemotropic mycoplasmas in Iberian wild carnivores. Comp. Immunol. Microbiol. Infect. Dis. 60, 11–16 (2018).
- Chalker, V. J. Canine mycoplasmas. Res. Vet. Sci. 79, 1–8 (2005).
- Beauchamp, D. J. et al. Mycoplasma felis -associated meningoencephalomyelitis in a cat. J. Feline Med. Surg. 13, 139–143 (2011).
- Liehmann, L., Degasperi, B., Spergser, J. & Niebauer, G. W. Mycoplasma felis arthritis in two cats. J. Small Anim. Pract. 47, 476–479 (2006).
- Klein, S., Klotz, M. & Eigenbrod, T. First isolation of Mycoplasma canis from human tissue samples after a dog bite. New Microbes New Infect. 25, 14–15 (2018).
- Maggi, R. G., Mascarelli, P. E., Havenga, L. N., Naidoo, V. & Breitschwerdt, E. B. Co-infection with Anaplasma platys, Bartonella henselae and Candidatus Mycoplasma haematoparvum in a veterinarian. Parasit. Vectors 6, 103 (2013).
- Le Boedec, K. A systematic review and meta-analysis of the association between Mycoplasma spp and upper and lower respiratory tract disease in cats. J. Am. Vet. Med. Assoc. (2017). doi:10.2460/javma.250.4.397
- Jambhekar, A., Robin, E. & Le Boedec, K. A systematic review and meta‐analyses of the association between 4 mycoplasma species and lower respiratory tract disease in dogs. J. Vet. Intern. Med. 33, 1880–1891 (2019).
- Messick, J. B. New perspectives about Hemotrophic mycoplasma (formerly, Haemobartonella and Eperythrozoon species) infections in dogs and cats. Vet. Clin. North Am. Small Anim. Pract. 33, 1453–1465 (2003).
- Woods, J. E., Wisnewski, N. & Lappin, M. R. Attempted transmission of Candidatus Mycoplasma haemominutum and Mycoplasma haemofelis by feeding cats infected Ctenocephalides felis. Am. J. Vet. Res. 67, 494–497 (2006).
- Museux, K. et al. In vivo transmission studies of ‘Candidatus Mycoplasma turicensis’ in the domestic cat. Vet. Res. (2009). doi:10.1051/vetres/2009028
- Clark, R. Eperythrozoon felis (sp. nov.) in a cat. J. S. Afr. Vet. Assoc. 13, 15–16 (1942).
- Flint, J. C. & Moss, L. C. Infectious anemia in cats. J. Am. Vet. Med. Assoc. 122, 45–8 (1953).
- Neimark, H., Johansson, K. E., Rikihisa, Y. & Tully, J. G. Proposal to transfer some members of the genera Haemobartonella and Eperythrozoon to the genus Mycoplasma with descriptions of ‘Candidatus Mycoplasma haemofelis’, ‘Candidatus Mycoplasma haemomuris’, ‘Candidatus Mycoplasma haemosuis’ and ’Candidatus Mycopl. Int. J. Syst. Evol. Microbiol. (2001). doi:10.1099/00207713-51-3-891
- Sykes, J. E. Feline hemotropic mycoplasmas. J. Vet. Emerg. Crit. Care 20, 62–69 (2010).
- Tasker, S. et al. Description of outcomes of experimental infection with feline haemoplasmas: Copy numbers, haematology, Coombs’ testing and blood glucose concentrations. Vet. Microbiol. 139, 323–332 (2009).
- Barker, E. N. Update on Feline Hemoplasmosis. Vet. Clin. North Am. Small Anim. Pract. 49, 733–743 (2019).
- Tasker, S. & Lappin, M. R. Update on Hemoplasmosis. in Consultations in Feline Internal Medicine 605–610 (Elsevier, 2006). doi:10.1016/B0-72-160423-4/50066-4
- Roura, X. et al. Prevalence of Hemotropic Mycoplasmas in Healthy and Unhealthy Cats and Dogs in Spain. J. Vet. Diagnostic Investig. 22, 270–274 (2010).
- Díaz-Regañón, D. et al. Epidemiological study of hemotropic mycoplasmas (hemoplasmas) in cats from central Spain. Parasit. Vectors 11, 140 (2018).
- Tasker, S. et al. Haemoplasmosis in cats: European guidelines from the ABCD on prevention and management. J. Feline Med. Surg. 20, 256–261 (2018).
- Novacco, M. et al. Consecutive antibiotic treatment with doxycycline and marbofloxacin clears bacteremia in Mycoplasma haemofelis -infected cats. Vet. Microbiol. 217, 112–120 (2018).
- Seneviratna, P., Weerasinghe & Ariyadasa, S. Transmission of Haemobartonella canis by the dog tick, Rhipicephalus sanguineus. Res. Vet. Sci. 14, 112–4 (1973).
- West, H. J. Haemobartonellosis in the dog. J. Small Anim. Pract. 20, 543–549 (1979).
- Kemming, G. I. et al. Mycoplasma haemocanis infection - A kennel disease? Comp. Med. 54, 404–409 (2004).
- Lashnits, E., Grant, S., Thomas, B., Qurollo, B. & Breitschwerdt, E. B. Evidence for vertical transmission of Mycoplasma haemocanis , but not Ehrlichia ewingii , in a dog. J. Vet. Intern. Med. 33, 1747–1752 (2019).
- Pitorri, F. et al. Use of real-time quantitative PCR to document successful treatment of Mycoplasma haemocanis infection with doxycycline in a dog. Vet. Clin. Pathol. 41, 493–496 (2012).
- Sykes, J. E. et al. Identification of a novel hemotropic mycoplasma in a splenectomized dog with hemic neoplasia. J. Am. Vet. Med. Assoc. 224, 1946–1951 (2004).
- Rosendal, S. Mycoplasmas as a possible cause of enzootic pneumonia in dogs. Acta Vet. Scand. 13, 137–139 (1972).
- Chalker, V. J. et al. Mycoplasmas associated with canine infectious respiratory disease. Microbiology 150, 3491–3497 (2004).
- Priestnall, S. L., Mitchell, J. A., Walker, C. A., Erles, K. & Brownlie, J. New and Emerging Pathogens in Canine Infectious Respiratory Disease. Vet. Pathol. 51, 492–504 (2014).
- Chvala, S. et al. Simultaneous Canine Distemper Virus, Canine Adenovirus Type 2, and Mycoplasma Cynos Infection in a Dog with Pneumonia. Vet. Pathol. 44, 508–512 (2007).
- Maboni, G., Seguel, M., Lorton, A., Berghaus, R. & Sanchez, S. Canine infectious respiratory disease: New insights into the etiology and epidemiology of associated pathogens. PLoS One 14, e0215817 (2019).
- Zeugswetter, F., Weissenbock, H., Shibly, S., Hassan, J. & Spergser, J. Lethal bronchopneumonia caused by Mycoplasma cynos in a litter of golden retriever puppies. Vet. Rec. 161, 626–628 (2007).
- Sykes, J. E. Pediatric Feline Upper Respiratory Disease. Vet. Clin. North Am. Small Anim. Pract. 44, 331–342 (2014).
- Le Boedec, K. A systematic review and meta-analysis of the association between Mycoplasma spp and upper and lower respiratory tract disease in cats. J. Am. Vet. Med. Assoc. 250, 397–407 (2017).
- Lee-Fowler, T. Feline respiratory disease. J. Feline Med. Surg. 16, 563–571 (2014).
- L’Abee-Lund, T. M., Heiene, R., Friis, N. R., Ahrens, P. & Sorum, H. Mycoplasma canis and urogenital disease in dogs in Norway. Vet. Rec. 153, 231–235 (2003).
- Maksimović, Z., Maksimović, A., Halilbašić, A. & Rifatbegović, M. Genital mycoplasmas of healthy bitches. J. Vet. Diagnostic Investig. 30, 651–653 (2018).
- Kustritz, M. V. R., Johnston, S. D., Olson, P. N. & Lindeman, C. J. Relationship between inflammatory cytology of canine seminal fluid and significant aerobic bacterial, anaerobic bacterial or mycoplasma cultures of canine seminal fluid: 95 cases (1987–2000). Theriogenology 64, 1333–1339 (2005).
 by Multimédica
by Multimédica