La Leishmaniosis Canina en España. Actualización de los conocimientos sobre esta enfermedad vectorial emergente.
Resumen breve
Debido al incremento de casos tanto en humanos como en animales, la Leishmaniosis se considera una enfermedad emergente en los países de la cuenca mediterránea. La prevalencia en personas no es elevada sin embargo es una de la de las enfermedades crónicas de mayorimpacto en la clínica canina. También se ha diagnosticado en otros animales domésticos como el gato y el hurón incluso en animales de producción como los équidos y el ganado vacuno.Índice de contenidos
Resumen
Debido al incremento de casos tanto en humanos como en animales, la Leishmaniosis se considera una enfermedad emergente en los países de la cuenca mediterránea. La prevalencia en personas no es elevada sin embargo es una de la de las enfermedades crónicas de mayorimpacto en la clínica canina. También se ha diagnosticado en otros animales domésticos como el gato y el hurón incluso en animales de producción como los équidos y el ganado vacuno.
En los últimos años se ha detectado la parasitación por Leishmania en una amplia variedad de especies de mamíferos silvestres lo que hace pensar en la existencia de un ciclo selvático natural que pueden mantener la enfermedad en el medio ambiente y actuar como reservorios de un ciclo urbano/periurbano cada vez más importante.
Se trata de una enfermedad vectorial, por lo que la presencia de flebotomos responsables de su transmisión juega un papel determinante y condiciona la existencia de la misma. Su abundancia y fenología se relaciona por lo tanto con la prevalencia de la enfermedad así como con el periodo de transmisión
El cambio climático y crecimiento de las ciudades están alterando el medio ambiente y modificando la biología de estos vectores La ampliación de su área de dispersión, del periodo de actividad de los adultos y sobre todo la adaptación a hábitats urbanos, están favoreciendo y aumentando el riesgo de transmisión de los patógenos como la Leishmania, sobre todo en las grandes urbes.
Ofrecemos en este trabajo una revisión actualizada de los aspectos más destacables de estos cambios en los determinantes epidemiológicos vectoriales de la Leishmaniosis en España .
Los vectores de la Leishmaniosis canina en España
En España la única Leishmaniosis endémica es la leishmaniosis visceral zoonótica o Leishmaniosis canina, que está producida por el protozoo Leishmania infantum (Alvar, 1997). Es una enfermedad de transmisión vectorial, aunque recientemente se han comprobado otras formas de transmitir el parásito como es por contacto directo por mordeduras, o por coito, también por transfusiones sanguíneas o por vía materno fetal (Naucke et al 2016; Ribeiro et al 2018) pero por ahora todas ellas son de un impacto epidemiológico puntual. La transmisión por vectores sigue siendo la principal vía de transmisión.
Los vectores de la Leishmaniosis canina son pequeños los dípteros del género Phlebotomus. De las especies conocidas en nuestro país solo tres de ellas están relacionadas con la transmisión de este parásito: Phlebotomus perniciosus, Phlebotomus ariasi y Phlebotomus) langeroni. Las dos primeras se han encontrado parasitadas por Leishmania infantum en diversos focos estudiados por toda la Península Ibérica y Baleares (Branco et al, 2013; Jiménez et al., 2013, González et al., 2017), mientras que Ph. langeroni que es una especie más adaptada a ambientes áridos se ha encontrado implicada en la transmisión de la enfermedad en un foco silvestre en Granada (Díaz-Sáez et al 2018). Solo las Islas Canarias se encuentran libres de la enfermedad (Morillas et al., 2017), ya que la presencia de estos vectores es puntual y no se encuentran en todas las islas del archipiélago.
La especie más abundante es Ph. perniciosus y la mejor distribuida pues había sido citada prácticamente por toda España menos en la cornisa Cantábrica. Por su parte Ph. ariasi aunque se detecta en densidades más bajas también se ha encontrado distribuida por parte de la Península e Islas Baleares, pero en general más localizada y menos abundante (Gil Collado et al., 1989; Gállego el al., 1992). La tercera especie, Ph. langeroni se ha descubierto en España recientemente y está ligada a ambientes naturales de las provincias de Zaragoza, Madrid y Granada (Lucientes et al., 1994; Martínez Ortega et al., 1996; Díaz-Sáez et al 2018).
La plasticidad ecológica con la que se caracteriza Ph. perniciosus (Gálvez et al 2010) le permite adaptarse a condiciones climáticas muy variadas que van desde ambientes muy cálidos y secos hasta zonas de montaña con mayor humedad ambiental ocupando zonas bioclimáticas de tipo meso y termomediterráneo. Por su parte Ph. ariasi parece necesitar ambientes más húmedos y fríos, estando mejor representado en zonas de montaña con zonas bioclimáticas de tipo supramediterráneo (Aransay et al., 2004). En muchos enclaves se encuentran las dos especies de forma simpátrica, predominando Ph. ariasi en las zonas más frías y húmedas.
Los flebotómos y el cambio climático
El cambio climático influye de forma directa en las poblaciones de flebotomos y está modificando el patrón de transmisión de la Leishmaniosis en nuestro país y en toda Europa. El incremento de las temperaturas originado por el cambio climático influye principalmente en estos vectores de dos maneras, por un lado ampliando el área de distribución ocupada por estas especies, y por otro incrementando el periodo de actividad voladora de los adultos (Trajer et al, 2013).
El aumento de temperaturas les facilita la colonización de nuevas zonas estableciendo poblaciones estables en áreas donde las bajas temperaturas no lo permitían previamente. Ya sea ampliando su dispersión hacia el norte de su área habitual de presencia (Fischer et al, 2011) o bien subiendo en altitud en las zonas de montaña como los Pirineos (Ballart et al. 2012 b, 2014).
El Programa de Vigilancia Entomológica de la Lengua Azul y otras Enfermedades Vectoriales del Ministerio de Agricultura, Pesca y Alimentación (MAPA), en el que se están realizando muestreos de dípteros vectores adultos en explotaciones ganaderas de toda España, nos ha permitido disponer de una información actualizada sobre la distribución espacial y temporal de este tipo de insectos.
Lo más destacable es que en los últimos 10 años se han colonizado las provincias de la Cordillera Cantábrica por las dos especies de Phlebotomus vectores (Figuras 1 y 2) donde no se conocía su presencia. Igualmente se ha podido comprobar la presencia de Phlebotomus ariasi en gran parte de las provincias del interior peninsular donde hasta la fecha no estaba citada.
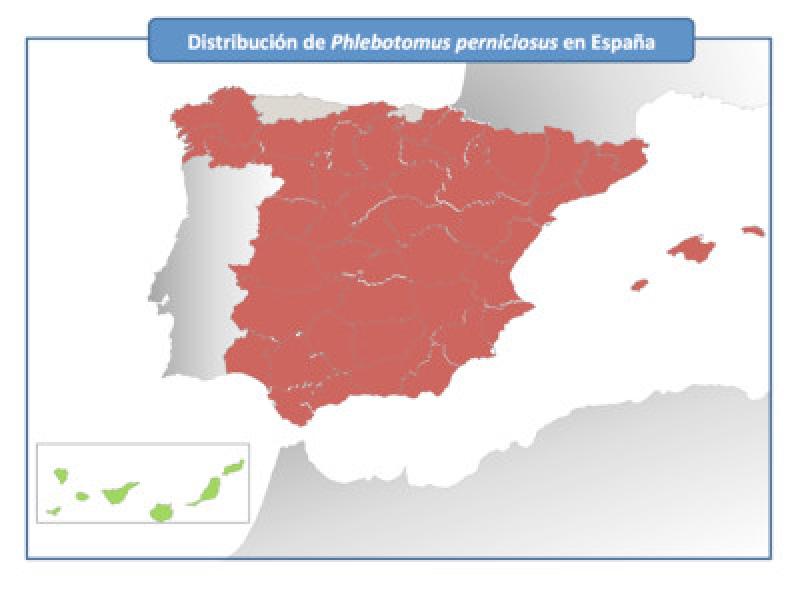
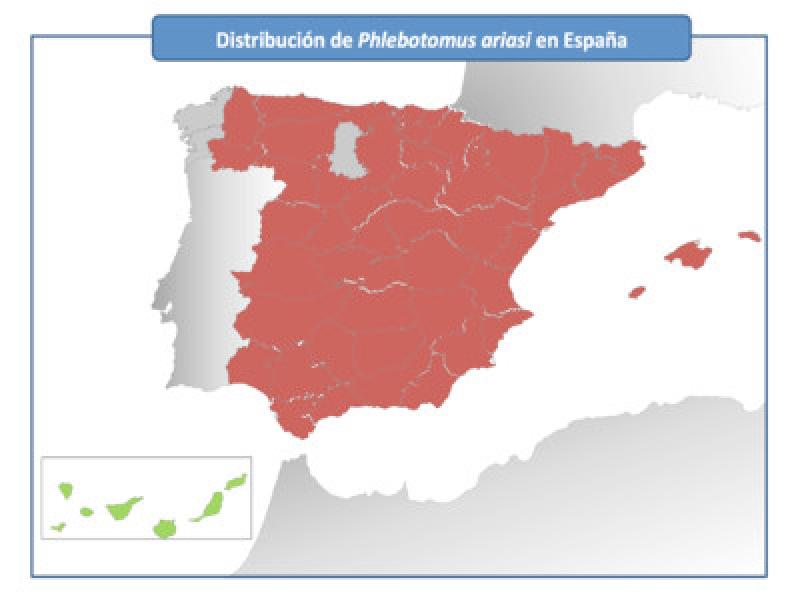
Podemos decir que en este momento tenemos vectores apropiados para la transmisión de la enfermedad en todo el territorio español, menos en el archipiélago canario, ocupando todos los ambientes tanto las zonas más áridas del centro peninsular como las zonas de montaña más húmedas. La presencia de flebótomos en las nuevas áreas explicaría los casos autóctonos de Leishmaniosis diagnosticados en zonas previamente sin infección (Amusategui et al 2004; Ballart et al. 2012; Miró et al 2012).
Otro factor importante en el que está influyendo el cambio climático es que se está alargando el periodo de actividad de los adultos de estas especies. Las temperaturas invernales más suaves aceleran y adelantan el ciclo larvario terrestre permitiendo que los adultos puedan estar activos, volando y picando, meses antes de lo conocido y esperado, pero lo más importante por su implicación en la transmisión de la Leishmaniosis es el retraso en finalizar su periodo de actividad.
Los trabajos previos realizados en diversas regiones nos indicaban que, dependiendo de la climatología de los años, el periodo de actividad normal está comprendido desde primeros de mayo hasta finales de octubre, dependiendo de la localización (Alten et al., 2016). Con la información conseguida por los muestreos del Programa de Vigilancia de Vectores del MAPA, se ha visto que en los últimos años se está incrementado el periodo de vuelo de estas especies, sobre todo hacia el final de año, y en las provincias costeras.
Se ha detectado que comienzan a volar en el mes de marzo, incluso en febrero en enclaves térmicamente apropiados. Además en aquellas zonas donde el clima es más cálido pueden permanecer activos hasta diciembre (Figura 3), de tal manera que su periodo de actividad en muchas zonas de España es de al menos 9 e inccluso 10 meses.

Este aumento importante de su periodo de actividad le permite tener varias generaciones al año, incrementando paulatinamente las densidades, sobre todo en otoño, ampliando de forma considerable el periodo de tiempo en el que se puede transmitir la Leishmaniosis. Es precisamente en estos últimos meses de actividad anual de los vectores cuando se produce el momento de máximo riesgo de transmisión de la enfermedad, ya que una gran parte de la población de hembras presentes a finales de verano y sobretodo en otoño han picado más de una vez y por lo tanto el porcentaje de ellas que pueden estar infectadas es más elevado, aumentando la intensidad de transmisión (González et al. 2017).
Es decir en algunas zonas el periodo de máximo riesgo de transmisión de Leishmania ha aumentado de dos a tres meses más, sobre todo en aquellas de clima más cálidos con inviernos menos rigurosos. Como es la costa mediterránea y la mitad sur de la península.
Flebotómos y las ciudades
La leishmaniosis canina siempre se ha considerado como una enfermedad rural en el sur de Europa (Cortes et al 2007), pero este concepto está cambiando de forma acelerada. En nuestro país la población se está concentrando en las grandes ciudades abandonando los pequeños núcleos rurales. De hecho, se calcula que en los próximos 30 años, el 88 % de la población de España va a estar concentrada en las ciudades o áreas metropolitanas (United Nations, 2018). Simultáneamente la población de mascotas también está incrementándose de forma significativa en nuestras ciudades (Ministerio Agricultura, Alimentación y Medio Ambiente, 2015) afectando sin lugar a dudas la prevalencia de la enfermedad en las mismas.
Esta concentración de la población en grandes núcleos urbanos está modificando de forma acelerada la fisionomía de nuestras ciudades. Poco a poco van creciendo las áreas metropolitanas ocupando y alterando ambientes naturales, incluyendo pequeños núcleos rurales. Este crecimiento en ocasiones es desordenado favoreciendo puntualmente la aparición de zonas habitadas que no cuentan ni con los servicios públicos sanitarios básicos (agua, vertidos, recogida de residuos) y donde se suele acumular las basuras. En conraposición se potencian zonas residenciales con jardines particulares y se crean zonas de recreo como grandes parques municipales.
Los flebótomos sobre todo Ph. perniciosus que siempre han sido abundantes en zonas rurales y en ambientes naturales se han adaptado a estos ambientes urbanos donde sobreviven incluso mejor que en sus ambientes naturales como muestran las altas densidades descritas en algunas zonas urbanas y periurbanas (Lucientes, 1988; Tello et al 2015; Tarallo 2020). Además, a pesar de que es cierto que en zonas con una alta densidad de construcciones y sin vegetación los flebotomos llegan a desaparecer (Kassem et al, 2012), la creación de parques urbanos y sobre todo de domicilios privados con jardines y arbolado, favorecen la aparición de hábitats de cría y fuente de azúcares vegetales indispensables para su supervivencia.
Los flebotomos pueden criar en cualquier lugar donde se acumule materia orgánica, sobre todo vegetal. Las zonas con presencia de vegetación resultan básicas para poder desarrollar su ciclo larvario, no solamente en la base de arboles y arbustos, también crían en madrigueras o en el interior de construcciones como leñeras, sótanos o cobertizos que estén abiertos al exterior y donde se acumule algún tipo de restos vegetales. Tanto los machos como también las hembras necesitan alimentarse de sustancias azucaradas que producen las plantas, por eso les resulta igualmente importante para su supervivencia la presencia de arboles y otros tipos de vegetación.
Vectores y reservorios de la Leishmaniosis
El estudio de la sangre de la que se alimentan las hembras de Flebotomos nos permite conocer las preferencias tróficas de estos insectos y lo más importante su relación con la transmisión de la Leishmaniosis. Lo que conocemos hasta la fecha es que tanto Phlebotomus perniciosus como Phlebotomus ariasi se comportan como parásitos oportunistas alimentándose sobre todo tipo de vertebrados de sangre caliente, tanto de mamíferos como de aves. Aparentemente no tienen ninguna preferencia y pican al primer animal apropiado que encuentran y por lo tanto no seleccionan a ninguna especie de animal en concreto alimentándose sobre todo de las más abundantes. Este hecho podría explicar la gran diversidad de especies animales que se encuentran parasitadas por Leishmania infantum, aunque pprobablemente la mayoría no tendrán capacidad para actuar como reservorio del parásito.
Sin lugar a dudas en nuestro país el perro es el hospedador que siempre ha centrado más nuestra atención por su relación con la Leishmaniosis. En los países de la cuenca Mediterránea L. infantum produce una enfermedad grave en los perros que actúan como reservorio primario del parásito. Se calcula que en los países del sudoeste de Europa viven 15 millones de perros, de ellos, 2,5 millones (16,7%) están infectados (Moreno y Alvar 2002), y aquellos que viven fuera de las casas presentan mayor riesgo de contraer la enfermedad al estar más tiempo expuestos (Gálvez et al, 2010; Cortés et al 2012).
El gato, aunque se ha considerado como resistente a la infección por L. infantum, también es afectado por este parásito produciendo cuadros menos graves que en el perro, sobre todo cutáneos, que pasan muchas veces desapercibidos (Pennisi et al 2013). Lo cierto es que aunque se discute el papel epidemiológico del gato y se le asigne un papel de reservorio secundario (Maia & Campino 2011) los gatos callejeros presentan prevalencias elevadas entre el 7 y el 33% según ciudades (Ayllón et al 2008; Can et al 2016).
No podemos olvidar que esta enfermedad también afecta al hombre. La Leishmaniosis en humanos presenta una tendencia al alza en España en los últimos 25 años, más acusada a partir de 2010 por el foco del sur de la Comunidad de Madrid (CCAES 2012).
Trabajos recientes están encontrando parasitados a otra amplia variedad de fauna doméstica como équidos, ganado vacuno, hurones (Rolāo et al, 2005; Lobsiger et al. 2010; Giner et al, 2020), pero sobre todo silvestre: lobo, zorro, liebres, conejos silvestre y muchas otras (Sobrino et al 2008; Millán et al 2014). No obstante el papel confirmado como reservorio del parásito está limitado a aquellas especies en las que se han realizado xenodiagnóstico y en las que se ha podido comprobar su alta capacidad para infectar a los vectores. Estos son: perro, gato doméstico, liebre mediterránea y conejo silvestre (Molina et al, 1994; Maroli et al 2007: Molina et al 2012: Jiménez et al 2014). Por lo tanta la presencia de la enfermedad va a estar ligada no solo a la presencia de vectores sino también a la presencia de estos reservorios primarios que sean capaces de mantener una alta carga parasitaria ambiental que permita la persistencia continuada del parásito.
Un ejemplo muy interesante lo tenemos en el reciente brote de Leishmaniosis humana en el sur de la Comunidad de Madrid, donde el perro que siempre ha sido considerado el principal reservorio del parásito ha sido sustituido por un reservorio silvestre, que hasta el momento era desconocido, como es la Liebre mediterránea (Lepus granatensis) y en menor medida el conejo silvestre (Oryctolagus cuniculus). Es un ejemplo de cómo las medidas de protección de los animales domésticos ha provocado la potenciación de otros hospedadores terminando en el hospedador más sensible que es el hombre. La abundante población canina de la zona se encontraba en altos niveles de protección por el uso de collares y pipetas con repelentes (Miro et al., 2017) y las hembras de flebotomos seleccionaron otros hospedadores alternativos entre ellos el hombre.
Una realidad emergente: La Leishmaniosis urbana.
La Leishmaniosis es una enfermedad dinámica y las circunstancias de transmisión están continuamente modificándose en relación al cambio climático y a factores ambientales así como al comportamiento humano (Antoniou et al 2013).
Hemos visto como en los últimos años algunos factores ambientales como el Cambio Climático están modificando los parámetros de la transmisibilidad de la enfermedad en España, pero hay otros que están favoreciendo el incremento de la Leishmaniosis y el principal es la urbanización.
Existe una clara tendencia de las personas en vivir a las grandes urbes. El crecimiento de las ciudades ha supuesto la ocupación de ambientes naturales y rurales, donde existía un ciclo de baja transmisión de Leishmaniasis, y ello ha conducido a la integración de la enfermedad a las zonas urbanas.
La ciudades de nuestro entorno están cambiado su estructura tradicional de grandes edificios sin apenas vegetación por urbanizaciones de viviendas unifamiliares con jardines, y un apreciable incremento de las superficies de parques municipales. Sin contar las zonas de chabolismo marginales sin servicios sanitarios donde se acumulan basuras. Esta tipo de urbanización está produciendo un aumento importante de las potenciales zonas de cría de los vectores, favoreciendo la colonización de estos desde las zonas rurales y naturales limítrofes.
Los flebótomos están integrados perfectamente a vivir en las ciudades y muchas de sus costumbres tróficas están incluso favoreciendo la transmisión de la Leishmaniosis y de otras enfermedades como el virus Toscana en las mismas (Sanbonmatsu-Gámez et al., 2005: Cotteaux-Lautard et al., 2016).
Una de las características de Ph. perniciosus el principal vector en la Península Ibérica es su atracción por la luz (fototropismo positivo) (Zariquiey 1944: Pires 1979) siendo por tanto atraídos por los focos luminosos, favoreciendo su endofilia. Es decir su capacidad de entrar voluntariamente dentro de las viviendas buscando un hospedador sobre el que alimentarse de sangre, y con mayor frecuencia si son lugares iluminados (Lucientes 1988).
La altura a la que se encuentran estas habitaciones tampoco supone un obstáculo que dificulte totalmente su entrada en las mismas. En espacios abiertos, cuando buscan a un hospedador la altura de vuelo es de menos de un metro sobre la superficie del suelo, pero cuando llegan a un obstáculo como una pared, pueden desplazarse verticalmente por la misma dando pequeños vuelos hasta alturas de varios metros de la base (Fairman et al 2011).
Es decir son especies que están altamente adaptadas para ser activos en ambientes construidos, siendo muy frecuente que entren en las habitaciones atraídos por las luces, incluso a varios pisos de altura, para alimentarse de perros, gatos o de las personas. Podemos ver que el riesgo de infectarse de Leishmaniosis no es solo de los animales que salen a pasear, también nuestras mascotas de interior, tanto perros como gatos, tienen riesgo de adquirir las enfermedades dentro de los domicilios (Baneth et al, 2020), incluso las personas.
Los datos más recientes indican que Incluso dentro de las zonas con alta densidad de edificación y menos vegetación se da una situación de riesgo. Se ha podido comprobar como los sistemas de alcantarillado pueden ser un hábitat de cría adecuado para los flebótomos (Tello 2015). La existencia de reservorios en estos ambientes permiten el mantenimiento de ciclos que son la fuente de riesgo para nuestras mascotas y para el hombre. Las ciudades poseen otro reservorio mucho más numerosos que los perros y gatos, que son los roedores sinantrópicos.
La presencia del parásito en las diversas especies de ratas y ratones ha sido constante en todos los países de nuestro entorno que los han estudiado. Con prevalencias en ocasiones altas. La mayoría de los trabajos están referenciados a la especie de Rata parda (Rattus rattus) especie más rural y asociada también a vertederos y acumulación de basuras por ejemplo solares abandonados. La importancia de estos roedores en los focos de Leishmaniosis es alta.
Por ejemplo en la isla de Montenegro se ha demostrado la capacidad de la Rata parda de actuar como reservorio primario manteniendo el ciclo del parásito sin otros reservorios domésticos como son los perros (Zanet et al. 2014). Un estudio reciente realizado en la ciudad de Barcelona han encontrado infectadas por Leishmania un 35 % de las Ratas de alcantarilla (Rattus norvegicus) analizadas (Galán-Puchades et al. 2019), . Recientemente se ha encontrado que el Ratón doméstico (Mus musculus) podría ser otra fuente importante del parásito en ambientes humanizados (Martín-Sanchez et al 2019).
Otro factor importante asociado a las ciudades es su efecto sobre el clima local. Al igual que hemos visto anteriormente sobre la acción directa del cambio climático sobre las poblaciones de estos vectores, las ciudades debido a los materiales de construcción de los edificios, a las infraestructuras y a las actividades humanas, por su capacidad de generar y retener calor, incrementan de forma importante las temperaturas de las mismas con respecto a su entorno creando lo que se denomina Islas Térmicas Urbanas (Martínez Martínez 2014).
Este fenómeno es eminentemente nocturno y la diferencia puede ser del orden de 2,5 a 6 grados entre el centro urbano y la zona rural de los extrarradios (Vicente-Serrano et al, 2005) pudiendo llegar a superar los 8 grados (Moreno-García & Serra-Pardo, 2016). Trajer et al. (2014) relacionan este fenómeno de las Islas Térmicas Urbanas con la supervivencia invernal de las poblaciones de especies de Flebotomos centroeuropeas ya que las temperaturas dentro de las ciudades de los meses más fríos en estas latitudes permiten la supervivencia de las fases larvarias, explicando por ejemplo la colonización de Phlebotomus ariasi en la ciudad de París o de Phlebotomus neglectus en Budapest, ciudades situadas a varios miles de kilómetros al norte de sus poblaciones naturales estables. Y sugiere que es el posible modelo de la futura expansión de estos vectores en Europa.
Agradecimientos: Este Trabajo ha sido subvencionado por el Programa de Vigilancia Entomológica de la Lengua Azul y otras Enfermedades Vectoriales del Ministerio de Agricultura, Pesca y Alimentación (MAPA).
Bibliografía
- Alvar Ezquerra J. Las Leishmaniasis: de la biología al control. Junta de Castilla León. 151 páginas. Depósito Legal ZA. 54-1997 (1997). Salamanca.
- Naucke TJ, Amelung S, Lorentz S. First report of transmission of canine leishmaniosis through bite wounds from a naturally infected dog in Germany. Parasites & Vectors (2016) 9: 256.
- Ribeiro RR, Michalik MSM, da Silca ME, Peixoto dos Santos CC, Frezard FJG, da Silva SM. Canine Leishmaniasis: An Overview of the Current Status and Strategies for Control. BioMed Research International Volumen 2018, Article ID 3296893, 12 pages (2018).
- Branco S, Alves-Pires C, Maia C, Cortes S, Cristovao JMS, Gonçalves L, Campino L, Afonso O. Entomological and ecological studies in a new potential zoonotic leishmaniasis focus in Torres Novas municipality, Central Región, Portugal. Acta Tropica (2013) 125: 339-349.
- Jiménez M, Gónzalez E, Iriso A, Marco E, Alegret A, Fuster F, Molina R. Detection of Leishmania infantum and identification of blood meals in Phlebotomus perniciosus from a focus of human leishmaniasis en Madrid. Spain. Parasitology Research (2013) 112: 2453-2459.
- González E, Jiménez M, Hernández S, Martín-Martín I, Molina R. Phlebotomine sand fly survey in the focus of leishmaniasis in Madrid, Spain (2012-2014): seasonal dynamics, Leishmania infantum infection rates and blood meal preferences. Parasites & Vectors (2017) 10: 368.
- Díaz-Sáez V, Morillas Márquez, F, Merino espinosa G, Corpas-López V, Morales-Yuste M, Pesson B, Barón-López S, Lucientes-Curdi J, Martín-Sánchez J. Phlebotomus langeroni Nitzulescu (Diptera, Psychodidae) a new vector for Leishmania infantum in Europe. Parasitology Research (2018) 117: 1105-1113.
- Morillas-Márquez F, Dïaz Saez V, Morillas-Mancilla MJ, Corpas-López V, Merino-Espinosa G, Gijóm-Robles P, Martín Sánchez J. Phlebotomine sandflies (Diptera; PHlebotomidae) of Lanzarote Island (Canary Islands, Spain): Ecological survey and evaluation of the risk of Leishmania transmission. Acta Tropica (2017) 168; 16-20.
- Gil Collado J., Morillas Márquez F., Sanchís Marín MC. Los flebótomos en España. Revista de Sanidad e Higiene Pública. (1989) 63: 15-34.
- Gallego Berenguer J, Botet Fregola J, Gallego Cullere M, Portus Vinyet, M. Los flebótomos de la España peninsular e Islas Baleares: identificación y corología: comentarios sobre los métodos de captura. En “In memoriam al profesor doctor D. Francisco de Paula Martínez Gómez”. Servicio de Publicaciones de la Universidad de Córdoba. (1992) 581-600.
- Lucientes J, Osacar JJ, Calvete C, Benito I, Castillo JA. Sobre la presencia de Phlebotomus (Larroussius) langeroni Nitzulescu, 1930 (Diptera: Psychodidae) en Aragón. ZAPATERI Revista Aragonesa de Entomología (1994) 4: 19–22.
- Martínez Ortega E, Conesa Gállego E, Romera Lozano H. Phlebotomus (Larroussius) langeroni Nitzulescu, 1930 (Diptera: Psychodidae), espèce nouvelle pour l’Espagne. Parasite (1996) 3:77–80.
- Gálvez R, Descalzo MA, Miró G, Jiménez MI, Martín O, Dos Santos-Brandao F, Guerrero I, Cubero E, Molina R. Seasonal trends and spatial relations between environmental/meteorological factors and leishmaniosis sand fly vectors abundances in Central Spain. Acta Tropica (2010) 115 : 95-102.
- Gálvez R, Miró G, Descalzo M, Nieto J, Dado D, Martín O, Cubero E, Molina R. Emerging trends in the seroprevalence of canine leishmaniasis in the Madrid region (central Spain). Veterinary Parasitolology (2010) 169, 327–334.
- Aransay A, Testa JM, Morillas-Márquez F, Lucientes J, Ready P. Distribution of sandfly species in relation to canine leishmaniasis from the Ebro valley to Valencia, northeastern Spain. Parasitology Research (2004) 94: 416-420.
- Trajer AJ, Bede-Fazekas A, Hufnagel L, Horvath L, Bobvos J, Paldy A. The effect of climate change on the potential distribution of the european Phlebotomus species. Applied ecology and environmental research (2013) 11(2): 189-208.
- Fischer D, Moeller P, Thomas SM, Naucke TJ, Beierkuhnlein C. Combining climatic projections and dispersal ability: a method for estimating the responses of sandfly vector especies ti climate change. PLoS Neglected Tropical Diseases (2011) 5(11) : e10.371.
- Ballart C, Barón S, Alcover MM, Portús M, Gállego M. Distribution of phlebotomine sand flies (Diptera: Psychodidae) in Andorra: First finding of P. perniciosus and wide distribution of P. ariasi. Acta Tropica (2012 b) 122: 155-159.
- Ballart C, Guerrero I, Castells X, Barón S, Castillejo S, Alcover MM, Portús M, Gállego M. Importance of individual analysis of environmental and climatic factors affecting the density of Leishmania vectors living in the same geographical área: the example of Phlebotomus ariasi and P. perniciosus in northeast Spain. Geospatial Health (2014) 8(2): 389-403.
- Amusategui A, Sainza A, Aguirre E, Tesouro MA. Seroprevalence of Leishmania infantum in Northwestern Spain, an área traditionally considered free of Leishmaniasis. Annals New York Academy of Sciences. (2004) 1026: 154-157.
- Ballart C, Alcover MM, Portús M, Gállego M. Is Leishmaniasis widespread in Spain? First data on canine leishmanasis in the province of Lleida, Catalonia, northeast Spain . Transactions of the Royal Society of Tropical Medicine and Hygiene (2012 a) 106: 134-136.
- Miró G, Checa R, Montoya A, Hernández L, Dado D, Gálvez R. Current situation of Leishmania infantum infection in shelter dogs in northern Spain. Parasites & Vectors (2012 ) 5: 60.
- Alten B, Maia C, Afonso MO, Campino L, Jiménez M, González E, Molina R, Bañuls AL, Prudhomme J, Vergnes B, Totu C, Cassan C, Rahola N, Thierry M, Sereno D, Bongiorno G,Biancho R, Khoury C, Tsirigotakis N, Dokianakis E, Antoniou M, Christodoulou V, Mazeris A, Karakus M, Ozbel Y, Arserim AK, Kasap OE, Gunay F, Oguz G, Kaynas S, Tsertsvadze N, Tskhvaradze.
- Giorgobiani E, Gramiccia M, Volf P, Gradoni L. Seasonal dynamics of Phlebotomine sand fly species proven vectors of Mediterranean Leishmaniasis caused by Leishmania infantum. PLOS Neglected Tropical Diseases (2016) 10 (2):e0004458
- Cortés S, Afomso MO, Alves-Pies C, Campino L. Stray dogs and Leishmaniasis in Urban Areas, Portugal. Emerging Infectious Diseases (2007) 13(9): 1431-1432.
- United Nations, Department of Economic and Social Affairs, Population Division (2018). World Urbanization Prospects: The 2018 Revision (https://www.un.org/en/)
- Ministerio de Agricultura, Alimentación y Medio Ambiente. Análisis y caracterización del sector de los animales de Compañía. Informe de resultados. 2015 : 75 páginas
- Lucientes Curdi J. Contribución al conocimiento epidemiológico de la Leishmaniosis visceral canina en Zaragoza: estudio biológico y ecológico de las poblaciones de flebotomos vectores.
- Resúmenes de Tesis Doctorales. Curso 1985-86. Universidad de Zaragoza. Secretariado de Publicaciones: 421-446. (1988)
- Lucientes Curdi, J., Sánchez Acedo, C., Castillo Hernández, J.A., Estrada Peña, A. Sobre la infección natural por Leishmania en Phlebotomus perniciosus Newstead, 1911 y Phlebotomus ariasi Tonnoir, 1921, en el foco de leishmaniosis de Zaragoza. Revista Ibérica de Parasitología (1988) 48, 7–8.
- Tarallo VD, Danta-Torres F, Lia RP, Otranto D. Phlebotomine sand fly population dynamics in a leishmaniasis endemic peri-urban área in southern Italy. Acta Tropica (2020) 116: 227-234.
Tello A, González Mora D, Outerelo R, Iriso A, Vázquez MA. Los flebótomos del brote de leishmaniasis en el suroeste de la Comunidad de Madrid (Diptera, Psychodidae, Phlebotominae. Boletín de la Real Sociedad española de Historia Natural. Sección Biología. (2015) 109: 57-64. - Kassem HA, El Nogoumy NN, El Sawaf BM. Impact of Urbanization of the sand fly Phlebotomus langeroni Nitzulescu in an old focus of visceral Leishmaniasis in Egypti. Journal of Egyptian Society of Parasitology (2012) 42(3): 619-624.
- Moreno J, Alvar J. Canine Leishmaniasis: epidemiological risk and the experimental model. Trends in Parasitology (2002) 18: 399-405.
- Cortés S, Vaz Y, Neves R, Maia C, Cardoso L, Campino L. Risk factors for canine leishmaniasis in an endemic Mediterranean región. Veterinary Parasitology (2012) 189: 189-216.
- Pennisi MG, Hartmann K, LLoret A, Addie D, Belák S, Boucraut-Baralon C, Egberink H, Frymus T, Gruffydd-Jones T, Hosie MJ, Lutz H, Marsilio F, Möstl K, Radford AD, Thiry E, Truyen U, Horzinek C,. Laihmaniosis in cats, ABCD guidelines on prevention and management. Journal of Feline Medicine and Surgery (2013) 15: 638-642.
- Mia C. & Campino L. Can domestic cats be considered reservoir host of zoonotic leishmaniasis? Trends in Parasitology (2011) 27 (8): 341-344.
- Ayllon T, Tesouro MA, Amusategui I, Villaescusa A, Rodríguez-Franco F, Sainz A. Serologic and Molecular Evaluation of Leishmania infantum in cats from Central Spain. Animal Biodiversity and Emerging Diseases: Annual New York Academy of Sciences (2008) 1149: 361-364.
- Can H, Döskaya M, Ózdemir HG, Sahar EA; Karakavuk M, Pektas B, Karakus M, Töz S, Caner A, Döskaya AD, Iz SG, Özbel Y, Güruz Y. Seroprevalence of Leishmania infection and molecular detection of Leishmania tropica and Leishmania infantum in stray cats of Izmir, Turkey. Experimental Parasitology (2016) 167: 109-114.
- Centro de Coordinación de Alertas y Emergencias Sanitarias (CCAES). Ministerio de Sanidad, Servicios Sociales e Igualdad. Evaluación del Riesgo de transmisión de Leishmania infantum en España. Octubre 2012. 26 páginas
- Rolāo, N, Martins MJ, Joāo A, Campino L. Equine infection with Leishmania in Portugal. Parasite (2005) 12: 183-186.
- Lobsiger L, Múller N, Schweizer T, Frey CF, Wiederkehr D, Zumkehr B, Gottstein B. An autochthonous case of cutaneous bovine leishmaniasis in Switzerland. Veterinary Parasitology (2010) 169: 408-414.
- Giner J, Basurco A, Alcover MM, Riera C, Fisa R, López RA, Juan-Sallés C, Ver MT, Fernández A, Yzuel A, Villanueva-Saz S. First report on natural infection with Leishmania infantum in a domestic ferret (Mustela putorius furo) in Spain, Veterinary Parasitology: Regional Studies and Reports, (2020) 19: 100369.
- Sobrino R, Ferroglio E, Oleaga A, Romano A, Millán J, Revilla M, Arnal MC, Trisciuoglio A, Gortazar C. Characterization of widespread canine leishmaniasis among wild carnivores from Spain. Veterinary Parasitology (2008) 155: 198-203.
- Millán J, Ferroglio E, Solano-Gállego L. Role of wildlife in the epidemiology of Leishmania infantum infection in Europe, Parasitology Research (2014) 113: 2005-2014.
- Molina, R., Amela, C., Nieto, J., San-Andres, M., Gonzalez, F., Castillo, J., Lucientes, J.,Alvar, J. Infectivity of dogs naturally infected with Leishmania infantum to colonized Phlebotomus perniciosus. Transactions Royal Society Tropical Medicine Hygiene, (1994) 88, 491–493.
- Molina R, Jiménez MI, Cruz I, Iriso A, Martín-Martín I, Sevillano O, Melero S Bernal J. The hare (Lepus granatensis) as potencial sylvatic reservoir of Leishmania infantum in Spain. Veterinary Parasitology (2012) 190 (1-2): 268-271.
- Maroli M, Pennisis MG, Di Muccio T, Khoury C, Gradoni L, Gramicia M. Infections of Sandflies by a cat Naturally Infected with Leishmania infantum. Veterinary Parasitology (2007) 145 (3-4): 357-360.
- Jimenez M, Gónzalez E, Martín-Martín E, Hernández S, Molina R. Could wild rabbits (Oryctolagus cuniculus) be reservoirs for Leishmania infantum in the focus of Madrid, Spain? Veterinary Parasitology (2014) 202 (3-4): 296-300.
- Miro G, Müller A, Montoya A, Checa R, Marino V, Marino E, Fuster F, Escacena C, Descalzo MA, Gálvez R. Eoidemiological role of dogs since the human leishmaniosis outbreak in Madrid. Parasites & Vectors (2017) 10:209.
- Antoniou M, Gramiccia M, Molina R, Dvorak V, Volf P. The role of indigenous phlebotomine sandflies and mammals in the spreading of leishmaniasis agents in the Mediterranean region.
- Euro Surveillance. 2013;18(30):pii=20540. Available online: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=20540
Sanbonmatsu-Gámez S, Pérez-Ruiz M, Collao X, Sánchez-Seca MP, Morillas-Márquez F, de la Rosa-Fraile M, Navarro-Mari JM, Tenorio A. Emerging Infectious Diseases (2005) 11 (1):1701-1707. - Cotteaux-Lautard C, Leparc-goffart I, Berenguer JM, Plumet S, Pages F. Phenology and host preferences Phlebotomus perniciosus (Diptera: Phlebotominae) in a focus of Toscana virus (TOSV) in South of France. Acta Tropica (2016) 153: 64-69.
- Zariquiey Alvárez R. Contribución al conocimiento de la distribución de los Phlebotomus en España. Graellsia (1944) 2: 15-20.
- Pires CA. Contribuçao ao conhecimento de distribuçao e bioecologia dos flebótomos em Portugal (Diptera: Psychodidae). Boletim da Sociedade Portuguesa de Ciencias Naturais (1979) 19: 197-210.
- Faiman R, Kirstein O, Moncaz A, Guetta H, Warburg A. Studies on the flight patterns of foraging sand flies. Acta Tropica (2011) 120: 110-114.
- Baneth G, Nachum-Biala Y, Zuberi A, Zipori-Barki N, Orshan L, Kleinerman G, Shmueli-Goldin, Bellaiche M, Leskowicz-Mazuz M, Salant H, Yasur-Landau Leishmania infection in cats and sogs housed together in an animal shelter reveals a higher parasite load in infected dogs despite a greater seroprevalence among cats. Parasite & Vectors (2020) 13:115. https://doi.org/10.1186/s13071-020-3989-3
- Zanet S, Sposimo P, Trisciuoglio A, Giannini F, Strumia F, Ferroglio E. Epidemiology of Leishmania infantum, Toxoplasma gondii, and Neospora caninum in Rattus rattus in absence of domestic reservoirs and definitive hosts. Veterinary Parasitology (2014) 199: 247-249.
- Galán-Purchades MT, Gómez-Samblés M, Suárez-Morán JM, Osuna A, Sanxis-Furió J, Pascual J, Bueno-Mari R, Franco S, Peracho V, Montalvo T, Fuentes MV. Leishmaniasis in Norway Rats in sewers, Barcelona, Spain. Emerging Infectious Diseases (2019) 25(6) 1222-1224.
- Martín-Sánchez J, Torres-Medina N, Corpas-López V, morillas-Márquez F, Díaz-Sáez V. Vertical transmissionmay play a greatre roles in the spread of Leishmania infantum in synanthropic Mus musculus rodents tan previously believed. Transboundary and Emerging Diseases (2019) 67 (3) https://doi.org/10.1111/tbed.13436
- Martínez Martínez J. Estudio de la isla de calor de la ciudad de Alicante. Investigaciones Geográficas (2014) 62: 81-93.
- Vicente-Serrano SM, Cuadrat-Prats JM, Saz-Sánchez MA. Spatial patterns of the urban heat island in Zaragoza (Spain). Climate Research (2005) 30: 61-69.
- Moreno García MC & Serra pardo JA. El estudio de la isla de calor urbana en el ámbito mediterráneo: una revisión bibliográfica. Biblio 3W, (2016) 31: 1.179.
- Trajer A, Mlinarik L, Jushasz P, Bede-Fazekas A. The combined impact of urban heat island, termal bridge effect of buildings and future climate change on the potential overwintwring of Phlebotomus species in a central european metrópolis. Applied ecology and environmental research (2014 12(4): 887-908).
 by Multimédica
by Multimédica