Neumonía por angiostrongilosis canina: a propósito de un caso clínico
Resumen breve
Se describe un caso clínico de un perro Mestizo, macho castrado, de 8 años y medio de edad que reside en Reino Unido, en el que el diagnóstico de angiostrongilosis se confirma con una PCR positiva en lavado broncoalveolar tras un resultado SNAP® Angio Detect (Laboratorios IDEXX) negativo.Índice de contenidos
Introducción
La angiostrongilosis es una enfermedad causada por el nematodo Angiostrongylus vasorum que afecta a perros domésticos y a otros carnívoros salvajes, principalmente zorros, aunque también se ha descrito en otras especies como chacales y tejones1-4. Los parásitos adultos viven en las arterias pulmonares del hospedador y en las cámaras cardíacas derechas, donde producen huevos que se adhieren al tracto respiratorio donde eclosiona la larva L1. La infección se produce normalmente por ingestión de hospedadores intermediarios, así como de hierba o charcos de agua contaminados. El período prepatente dura entre 38 y 57 días2-5. Actualmente, A. vasorum se considera una enfermedad infecciosa no-zoonótica y emergente4. La presentación clínica es muy variable, dificultando el diagnóstico y control endémico de la enfermedad. Sin tratamiento, puede ser una infección con consecuencias fatales, por lo que un rápido diagnóstico se considera esencial para el control de la enfermedad. A continuación, se describe un caso clínico en el que el diagnóstico de angiostrongilosis se confirma con una PCR positiva en lavado broncoalveolar tras un resultado SNAP® Angio Detect (Laboratorios IDEXX) negativo.
Caso clínico
Se describe el caso clínico de un perro Mestizo, macho castrado, de 8 años y medio de edad que reside en Reino Unido. El motivo de consulta es tos, incremento del esfuerzo espiratorio, hiporexia y apatía de una semana de evolución. Previamente, había recibido tratamiento con amoxicilina y ácido clavulánico (25 mg/kg/12 h PO), meloxicam (0.1 mg/kg/24 h PO) y codeína (0.3 mg/kg/8 h PO), sin mejoría clínica.
El examen físico reveló un aumento de los sonidos broncovesiculares de forma bilateral, aumento del esfuerzo espiratorio y taquipnea (60 respiraciones por minuto). La temperatura rectal era 39.4 ºC. El resto de la exploración física no presentaba alteraciones.
Las pruebas iniciales incluyeron un hemograma y bioquímica revelando una leve eosinofilia (1.48 x 109/l; RR: 0.06-1.23) y leve trombocitopenia (113 x109/l; RR: 148-484). A su vez, se realizó una tromboelastografía (VCM, Entegrion®) que era compatible con la normalidad. Las radiografías torácicas realizadas presentaban un patrón broncointersticial difuso y áreas multifocales periféricas asimétricas con patrón alveolar. Además, se realizó un SNAP® Angio Detect (Laboratorios IDEXX®) que fue negativo.
Posteriormente, se realizó una tomografía axial computarizada (TAC) de tórax que reveló un patrón intersticioalveolar multifocal, periférico y asimétrico similar a las radiografías (Figura 1) cuyos diagnósticos diferenciales más probables incluían, bronconeumonía parasitaria (angiostrongilosis), vírica o bacteriana, sin poder descartar hemorragias pulmonares. Además, se identificó la presencia de linfadenopatía esternal, traqueobronquial y hepática, considerada más probablemente de origen reactivo y secundaria al proceso pulmonar.
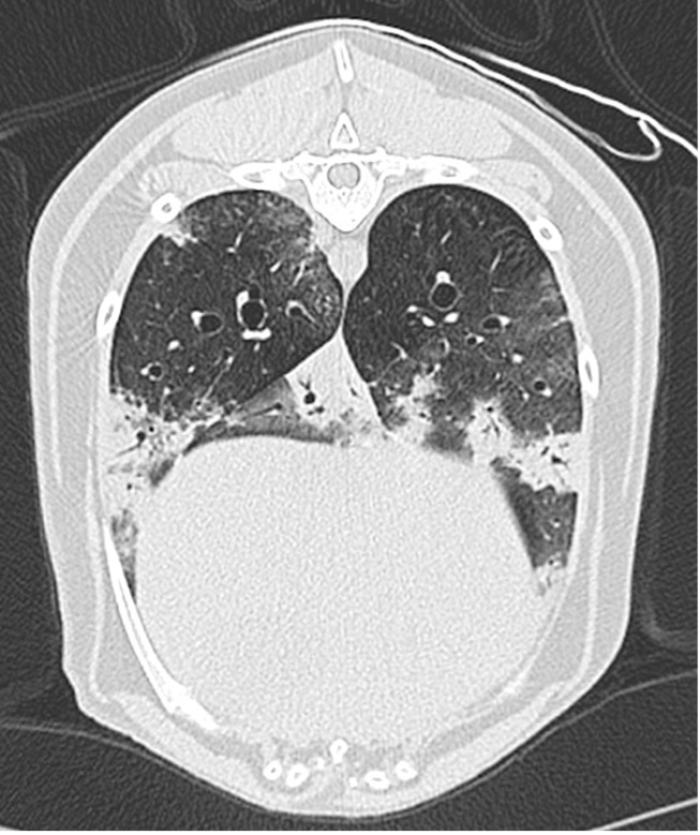
Figura 1A-B. Corte transversal en algoritmo de pulmón. Se muestran múltiples focos (flechas) de patrón alveolar situados en la periferia pulmonar y asimétricos.
A continuación, se realizó una broncoscopia donde se observó secreción serosanguinolenta en los bronquios principales y sus ramificaciones (Figura 2). Además, se realizó un lavado broncoalveolar (Figura 3) para análisis citológico, cultivo bacteriano y PCR de enfermedades respiratorias (Angiostrongylus vasorum, Crenosoma spp., Bordetella bronchiseptica, Mycoplasma cynos, virus de la parainfluenza canino, Adenovirus canino tipo 2 y Coronavirus canino). Los resultados de la citología fueron compatibles con una inflamación mixta, predominantemente eosinofílica y el cultivo bacteriano fue negativo. La PCR de Angiostrongylus vasorum fue la única positiva (Ct 27.8), confirmando el diagnóstico de angiostrongilosis.
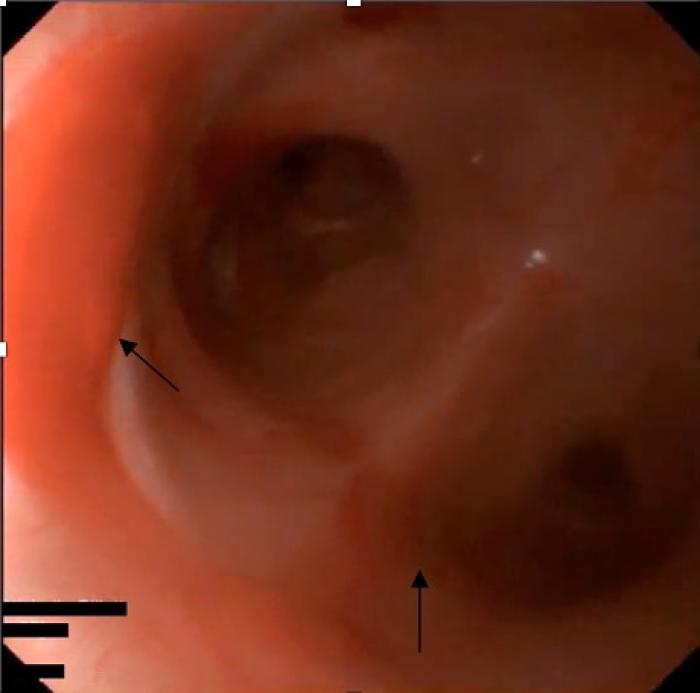
Figura 2. La imagen obtenida durante la broncoscopia muestra la presencia de secreción serosanguinolenta (flechas) a nivel de la bifurcación traqueal.

Figura 3. Muestra del lavado broncoalveolar serosanguinolento.
El perro fue tratado con una solución tópica (spot-on) de moxidectina 25 mg/ml / imidacloprid 100 mg/ml (Advocate®), mostrando una mejora clínica 24 horas después de su aplicación y se recomendó repetir este tratamiento 4 semanas después. En la revisión a las 4 semanas, los tutores reportaron que había tenido una mejora clínica completa con resolución de signos clínicos y un aumento progresivo de la tolerancia al ejercicio.
Discusión
En Europa, la angiostrongilosis se ha descrito en Francia, Austria, Dinamarca, Grecia, Alemania, Hungría, Irlanda, Italia, Portugal, Rumania, España, Suecia, Suiza, Turquía y Reino Unido, principalmente en zorros y alcanzando prevalencias de hasta 80 % en algunas regiones5-8. En España, A. vasorum se ha registrado principalmente en zorros con una prevalencia de 1.8-43.2 %, en lobos con una prevalencia de 2.1-21.6 % y en tejones con una prevalencia de 6.4 %5,9-15. Un estudio reciente evaluó la prevalencia de A. vasorum en el perro doméstico en diferentes zonas de España. En el mismo estudio, se describió una prevalencia media de 1.73 % con la prevalencia más elevada en la zona de Asturias, Cantabria y País Vasco (2.74 %)5. Además, se ha sugerido que A. vasorum tiene una gran adaptabilidad a nuevos hospedadores definitivos e intermediarios, pudiendo vivir en regiones con temperaturas tropicales, subtropicales y templadas. Un estudio estimó una temperatura media de -4 ºC en invierno como barrera para la transmisión de A. vasorum16.
La angiostrongilosiscanina es una enfermedad que se presenta con una gran variedad de signos clínicos. Algunos autores diferencian cuatro formas clínicas principales de la enfermedad: respiratoria, cardiovascular, neurológica y alteraciones de la coagulación1,2. Sin embargo, algunos animales pueden presentar más de una forma clínica simultáneamente, o presentarse con signos clínicos inespecíficos, o de forma asintomática2.
En este caso, presentó un cuadro clínico respiratorio, cuyos signos clínicos principales fueron tos y esfuerzo espiratorio sin taquipnea. La forma pulmonar o respiratoria es la más frecuente en perros con angiostrongilosis. Esta presentación clínica es muy variable donde los signos clínicos más comunes son tos y disnea con o sin taquipnea. Otro signo clínico menos común es la intolerancia al ejercicio, aunque algunos perros pueden ser asintomáticos2.
Las alteraciones cardiovasculares descritas en la angiostrongilosis incluyen, sonidos cardíacos disminuidos, miocarditis, soplo y fallo cardíaco2,17,18. El desarrollo de hipertensión pulmonar se ha reportado en el 5 % de perros infectados con A. vasorum, sin embargo, en centros de referencia el porcentaje aumenta a un tercio de los animales afectados2,19. En nuestro caso, no hubo manifestaciones cardiovasculares de la enfermedad. La realización de una ecocardiografía fue valorada pero debido a la ausencia de signos clínicos y radiográficos cardiovasculares y la limitación económica, no fue realizada.
Las alteraciones de la coagulación en la angiostrongilosis canina son menos frecuentes, pero de estar presentes, sus consecuencias son las más graves2. Se han descrito presentaciones muy variables que incluyen hemorragias debidas a la deficiencia del factor de von Willebrand, trombocitopenia inmunomediada, coagulación intravascular diseminada e hiperfibrinólisis18,20-23. En nuestro caso, se detectó una leve trombocitopenia cuyo origen no se investigó. Se sospechó que la trombocitopenia podía ser debido a un proceso inmunomediado secundario a la infección con A. vasorum o una leve trombocitopenia por consumo. En el momento de su reevaluación clínica, se realizó un recuento plaquetario manual que estaba dentro de la normalidad.
Aunque algunos autores identifican una forma neurológica, los signos neurológicos descritos en infecciones con A. vasorum normalmente están asociados a hemorragias en el sistema nervioso central o periférico como consecuencia de alteraciones de la hemostasia. Estos signos clínicos son variados e incluyen convulsiones, alteraciones del estado mental y para- y tetraparesia2,24. El presente caso descrito no manifestó signos neurológicos, probablemente debido a la ausencia de alteraciones de la hemostasia graves.
Otros signos clínicos, inespecíficos como pérdida de peso o apatía son comunes y pueden manifestarse en solitario o en combinación con otros signos clínicos1. Esto coincide con nuestro caso, en el que el paciente presentó apatía y disminución del apetito de una semana de evolución. Los signos oculares se presentan con menor frecuencia que los previamente descritos. Algunos de los signos oftalmológicos descritos más comúnmente son hemorragia de la esclera, retina o iris, generalmente a consecuencia de alteraciones de la hemostasia. Además, se ha descrito la uveítis inmunomediada secundaria a la presencia de A. vasorum y la presencia de larvas o adultos en la cámara anterior en casos con alta carga parasitaria25,26. En nuestro caso, no hubo signos oculares, probablemente debido a una presentación más leve de la enfermedad.
Actualmente, no hay hallazgos laboratoriales patognomónicos para la angiostrongilosis. Se ha descrito de forma variable la presencia de anemia, eosinofilia, trombocitopenia e hipercalcemia en algunos perros2,27-29. Sin embargo, la presencia de eosinofilia y signos clínicos compatibles de angiostrongilosis son sugestivos de infección con A. vasorum y deben sugerir la realización de pruebas diagnósticas adicionales2. En nuestro caso, la presencia de eosinofilia con signos clínicos compatibles, pero con una prueba de SNAP® Angio Detect negativa, nos llevó a la realización de más pruebas diagnósticas.
La prueba de Baermann se caracteriza por la visualización microscópica de larvas recogidas en las heces del perro. Sin embargo, las larvas de A. vasorum son eliminadas de forma intermitente y no se eliminan durante el período de prepatencia, disminuyendo la sensibilidad de la prueba2,30-32. Actualmente para aumentar la sensibilidad de la prueba, se recomienda analizar una muestra de heces proveniente de 3 días consecutivos19, lo que retrasa de forma considerable el diagnóstico, reduciendo, en algunos casos, su utilidad diagnóstica. Esto es especialmente importante en pacientes con sintomatología grave, donde el retraso del tratamiento puede tener consecuencias fatales para el animal. Por otro lado, la prueba rápida para detección de antígenos (SNAP® Angio Detect, Laboratorios IDEXX®) es actualmente una de las más utilizadas, debido a su alta sensibilidad (entre 75-97 %) y especificidad (entre 92-100 %) y a la disponibilidad de resultados en tan solo 15 minutos24,32,34. Sin embargo, se han documentado falsos negativos. En condiciones experimentales, se detectaron perros positivos a las 11 semanas posinoculación utilizando la prueba ELISA para detección de antígenos circulantes y a las 14 semanas al utilizar el SNAP® Angio Detect (Laboratorios IDEXX®), mientras que todos los casos se detectaron positivos con la técnica Baermann a las 8 semanas posinoculación33. Este hallazgo confirma la posibilidad de resultados falsos negativos utilizando la prueba SNAP ® Angio Detect, en estadios tempranos de la enfermedad. En nuestro caso se hipotetizó que el resultado negativo del SNAP ® Angio Detect junto con la manifestación clínica leve de la enfermedad reflejaban un estadio temprano de la angiostrongilosis. Recientemente se ha publicado un artículo en el cual se describen 6 casos de perros con angiostrongilosis donde la prueba SNAP® Angio Detect fue inválida, con ausencia de la línea de control y línea de test positiva. En estos pacientes, diluciones seriales séricas y la repetición del test, resultaron en una línea de control visible. Este patrón de resultado inválido puede explicarse con el efecto gancho donde el exceso de antígeno y anticuerpo favorece la formación de inmunocomplejos que pueden llevar a un resultado inválido24. Este fenómeno se debe tener en cuenta en futuros resultados inválidos en el que diluciones séricas y repetición del test pueden ser suficientes sin la necesidad de técnicas de diagnóstico complementarias. En nuestro caso, se discutió con el tutor del perro la realización de la prueba Baermann, pero ante la progresión de los signos clínicos y el tiempo de recogida de muestras y obtención de los resultados, se decidió realizar una TAC, broncoscopia y lavado broncoalveolar (BAL).
Los signos radiográficos más comunes asociados a angiostrongilosis son el infiltrado alveolar y el engrosamiento bronquial2. Aunque también se ha descrito la presencia de patrón intersticial, bronquial, o mixto, tanto difusos como localizados35. Menos frecuentemente se ha descrito neumotórax, enfisema subcutáneo y ensanchamiento del mediastino craneal36. Esto coincide con los hallazgos radiológicos de nuestro caso. La TAC de tórax reveló un patrón intersticioalveolar multifocal y asimétrico, estos hallazgos, a pesar de no ser patognomónicos, se han descrito anteriormente en perros con angiostrongilosis37,38. De hecho, en un estudio multicéntrico realizado para la caracterización de hallazgos en la TAC de tórax de perros infectados con A. vasorum, se reportaron hallazgos pulmonares en todos los animales, a pesar de la ausencia de signos clínicos. Los hallazgos radiológicos predominantes en este estudio fueron una distribución periférica con aumento de la atenuación pulmonar, nódulos mal definidos, multifocales, y patrón intersticial, sin embargo, se observó un solapamiento de hallazgos radiológicos con otras enfermedades pulmonares37.
La identificación de larvas L1 en lavado broncoalveolar, lavados traqueales o aspiración con aguja fina de lesiones pulmonares también se han descrito17,19,39,40. Sin embargo, estos métodos diagnósticos se utilizan de forma menos común debido a los riesgos asociados y a la poca sensibilidad de la técnica en casos de baja carga parasitaria19. En este caso la citología del lavado broncoalveolar no permitió la identificación de larvas L1, pero identificó la presencia de una inflamación mixta, predominantemente eosinofílica. Estos hallazgos citológicos se han descrito previamente en animales infectados con A. vasorum41. La realización de PCR en lavado broncoalveolar para el diagnóstico de A. vasorum se ha descrito en previos estudios41,42. Un estudio comparó los resultados de PCR en lavado broncoalveolar y la técnica Baermann en perros con angiostrongilosis. En dicho estudio, solo 2 de 5 perros fueron positivos usando la técnica de sedimentación Baermann en una muestra fecal de 3 días, en comparación con el diagnóstico de la infección con PCR positiva en lavado broncoalveolar en todos los perros del mismo estudio41. Otro beneficio de la realización del lavado broncoalveolar es la identificación de coinfecciones parasitarias o bacterianas que puedan requerir tratamientos específicos41.
La solución spot-on con imidacloprid 10 % y moxidectina 2.5 % (Advocate ®) ha demostrado ser efectiva para el tratamiento y prevención de la angiostrongilosis. Se ha descrito que, con una sola aplicación, la moxidectina que contiene el producto posee una eficacia del 85.2 % para el tratamiento de A. vasorum. Esta alta eficacia es similar a la de otros tratamientos previamente descritos como la administración de fenbendazol oral (25 mg/kg durante 20 días) o de milbemicina oral (0.5 mg/kg durante 4 semanas), con eficacias reportadas de 91.3 % y 84.8 % respectivamente43,44. En nuestro caso, el tratamiento con una única aplicación spot-on de moxidectina/imidacloprid fue suficiente para una mejora clínica considerable del animal y su alta del hospital. En casos donde la sospecha clínica es alta a pesar de resultados negativos o en casos a la espera de resultados, el tratamiento con moxidectina/imidacloprid es recomendable si no es posible realizar pruebas diagnósticas adicionales.
Además, algunos animales requieren tratamiento sintomático como oxigenoterapia en casos de disnea44. No obstante, también se ha descrito el tratamiento con corticosteroides para el tratamiento de trombocitopenia inmunomediada secundaria a la angiostrongilosis o para la prevención de posibles reacciones anafilácticas tras la administración del tratamiento antihelmíntico18,45. El uso de corticosteroides se ha descrito también para disminuir la inflamación pulmonar secundaria la presencia de A. vasorum19. En nuestro caso, la administración de corticoides no se realizó, debido a la sospecha de una baja carga parasitaria, así como a la buena respuesta tras la aplicación del tratamiento (Advocate®).
Conclusiones
Debido a la presencia de animales asintomáticos, la gran variedad de signos clínicos y la dificultad diagnóstica, se estima que la prevalencia actualmente descrita para A. vasorum está subestimada. Por ello, angiostrongilosis debe incluirse en el diagnóstico diferencial en perros con signos clínicos, laboratoriales y radiológicos compatibles, incluso en zonas no-endémicas. Ante la sospecha de angiostrongilosis, la prueba SNAP® Angio Detect se recomienda como primera línea de diagnóstico debido a su rapidez y a su alta especificidad. Sin embargo, un resultado negativo, no descarta la enfermedad y, en esos casos, pruebas de diagnóstico complementarias como la prueba Baermann o, incluso, la realización de PCR en el lavado broncoalveolar deben considerarse cuando las condiciones económicas del propietario y el estado clínico del animal lo permitan.
Bibliografía
1. Helm JR, Morgan ER, Jackson MW, Wotton P, Bell R. Canine angiostrongylosis: An emerging disease in Europe. Vol. 20, Journal of Veterinary Emergency and Critical Care. 2010. p. 98–109.
2. Elsheikha HM, Holmes SA, Wright I, Morgan ER, Lacher DW. Recent advances in the epidemiology, clinical and diagnostic features, and control of canine cardio-pulmonary angiostrongylosis. Vet Res. 2014 Sep 27;45(1).
3. Morgan ER, Jefferies R, van Otterdijk L, McEniry RB, Allen F, Bakewell M, et al. Angiostrongylus vasorum infection in dogs: Presentation and risk factors. Vet Parasitol. 2010 Oct 29;173(3–4):255–61.
4. Morchón R, Montoya-Alonso JA, Sánchez-Agudo JÁ, de Vicente-Bengochea J, Murcia-Martínez X, Carretón E. Angiostrongylus vasorum in domestic dogs in castilla y león, Iberian Peninsula, Spain. Animals. 2021 Jun 1;11(6).
5. Carretón E, Morchón R, Morchón R, Falcón-Cordón Y, Matos J, Costa-Rodríguez N, et al. First epidemiological survey of Angiostrongylus vasorum in domestic dogs from Spain. Parasit Vectors. 2020 Jun 12;13(1).
6. Deak G, Gillis-Germitsch N, Ionicǎ AM, Mara A, Pǎstrav IR, Cazan CD, et al. The first seroepidemiological survey for Angiostrongylus vasorum in domestic dogs from Romania. Parasit Vectors. 2019 May 14;12(1).
7. Saeed I, Maddox-Hyttel C, Monrad J, Kapel CMO. Helminths of red foxes (Vulpes vulpes) in Denmark. Vet Parasitol. 2006 Jun 30;139(1–3):168–79.
8. Alho AM, Meireles J, Schnyder M, Cardoso L, Belo S, Deplazes P, et al. Dirofilaria immitis and Angiostrongylus vasorum: The current situation of two major canine heartworms in Portugal. Vet Parasitol. 2018 Mar 15;252:120–6.
9. Alvarez F, Iglesias R, Bos J, Rey J, Sanmartin Durán ML. Lung and hearth nematodes in some Spanish mammals. Wiad Parazytology. 1991;37(4):481–90.
10. Martínez-Rondán FJ, Ruiz de Ybáñez MR, López-Beceiro AM, Fidalgo LE, Berriatua E, Lahat L, et al. Cardiopulmonary nematode infections in wild canids: Does the key lie on host-prey-parasite evolution? Res Vet Sci. 2019 Oct 1;126:51–8.
11. Gorta Âzar C, Villafuerte R, Lucientes J, Ferna Ândez-De-Luco D. Habitat related differences in helminth parasites of red foxes in the Ebro valley.
12. Mañas S, Ferrer D, Castellà J, López-Martín JM. Cardiopulmonary helminth parasites of red foxes (Vulpes vulpes) in Catalonia, northeastern Spain. Veterinary Journal. 2005;169(1):118–20.
13. Gerrikagoitia X, Barral M, Juste RA. Angiostrongylus species in wild carnivores in the Iberian Peninsula. Vet Parasitol. 2010 Nov 24;174(1–2):175–80.
14. Martínez‐Carrasco C, Ruiz de Ybáñez MR, Sagarminaga JL, Garijo MM, Moreno F, Acosta I. Parasites of the red fox (Vulpes vulpes Linnaeus, 1758) in Murcia, southeast Spain. Rev Med Vet (Toulouse). 2007;158:331–5.
15. Segovia JM, Torres J, Miquel J, Llaneza L, Feliu C. Helminths in the wolf, Canis lupus, from north‐western Spain. Helminthology. 2001;75:183–92.
16. Jeffery RA, Lankester MW, McGrath MJ, Whitney HG. Angiostrongylus vasorum and Crenosoma vulpis in red foxes (Vulpes vulpes) in Newfoundland, Canada. Canadian Journal of Zoology: Revue Canadienne de Zoologie . 2004;82:66–74.
17. Chapman PS, Boag AK, Guitian J, Boswood A. Angiostrongylus vasorum infection in 23 dogs (1999-2002).
18. Gould SM, Mcinnes EL. Immune-mediated thrombocytopenia associated with Angiostrongylus vasorunz. Vol. 40, Journal of Small Animal Practice. 1999.
19. Koch J, Willesen JL. Canine pulmonary angiostrongylosis: An update. Vol. 179, Veterinary Journal. 2009. p. 348–59.
20. Sigrist NE, Hofer-Inteeworn N, Jud Schefer R, Kuemmerle-Fraune C, Schnyder M, Kutter APN. Hyperfibrinolysis and Hypofibrinogenemia Diagnosed With Rotational Thromboelastometry in Dogs Naturally Infected With Angiostrongylus vasorum. J Vet Intern Med. 2017 Jul 1;31(4):1091–9.
21. Ramsey IK, Littlewood JD, Dunn JK, Herrtage ME. Role of chronic disseminated intravascular coagulation in a case of canine angiostrongylosis. Veterinary Record. 1996;138:360–3.
22. Garosi LS, Platt SR, McConnell JF, Wray JD, Smith KC. Intracranial haemorrhage associated with Angiostrongylus vasorum infection in three dogs. Journal of Small Animal Internal Medicine. 2005;46:93–9.
23. Birkbeck R, Humm K, Cortellini S. A review of hyperfibrinolysis in cats and dogs. Vol. 60, Journal of Small Animal Practice. Blackwell Publishing Ltd; 2019. p. 641–55.
24. Barker EN, Payne JR, Wilson H. Control line failure in Angiostrongylus vasorum point-of-care serology test in dogs with angiostrongylosis due tosuspected hook effect. Journal of Small Animal Practice. 2024 Apr 1;65(4):243–50.
25. Colella V, Lia RP, Premont J, Gilmore P, Cervone M, Latrofa MS, et al. Angiostrongylus vasorum in the eye: New case reports and a review of the literature. Parasit Vectors. 2016 Mar 21;9(1).
26. Perry AW, Hertling R, Kennedy MJ. Angiostrongylosis with disseminated larval infection associated with signs of ocular and nervous disease in an imported dog.
27. Willesen JL, Jensen AL, Kristensen AT, Kjelgaard-Hansen M, Jessen R, Koch J. Serum Fructosamine Concentrations in 59 Dogs Naturally Infected with Angiostrongylus vasorum [Internet]. Available from: www.blackwell-synergy.com
28. Schnyder M, Fahrion A, Riond B, Ossent P, Webster P, Kranjc A, et al. Clinical, laboratory and pathological findings in dogs experimentally infected with Angiostrongylus vasorum. Parasitol Res. 2010 Nov;107(6):1471–80.
29. Willesen JL, Jensen AL, Kristensen AT, Koch J. Haematological and biochemical changes in dogs naturally infected with Angiostrongylus vasorum before and after treatment. Veterinary Journal. 2009 Apr;180(1):106–11.
30. Verzberger-Epshtein I, Markham RJF, Sheppard JA, Stryhn H, Whitney H, Conboy GA. Serologic detection of Angiostrongylus vasorum infection in dogs. Vet Parasitol. 2008 Jan 21;151(1):53–60.
31. Barçante JMP, Barçante TA, Dias SRC, Vieira LQ, Lima WS, Negrão-Corrêa D. A method to obtain axenic Angiostrongylus vasorum first-stage larvae from dog feces. Parasitol Res. 2003;89(2):89–93.
32. Mcgarry JW, Morgan ER. Identification of first-stage larvae of metastrongyles from dogs. 2009.
33. Schnyder M, Stebler K, Naucke TJ, Lorentz S, Deplazes P. Evaluation of a rapid device for serological in-clinic diagnosis of canine angiostrongylosis [Internet]. 2014. Available from: http://www.parasitesandvectors.com/content/7/1/72
34. Liu J, Schnyder M, Willesen JL, Potter A, Chandrashekar R. Performance of the Angio DetectTM in-clinic test kit for detection of Angiostrongylus vasorum infection in dog samples from Europe. Vet Parasitol Reg Stud Reports. 2017;7:45–7.
35. Gallagher B, Brennan SF, Zarelli M, Mooney CT. Geographical, clinical, clinicopathological and radiographic features of canine angiostrongylosis in irish dogs: A retrospective study. Ir Vet J. 2012;65(1).
36. Martin MWS, Ashton G, Simpson VR, Neal C. Angiostron ylosis in Cornwalf: Clinical presentations of eight cases. Vol. 34, Journal of Small Animal Practice. 1993.
37. Coia ME, Hammond G, Chan D, Drees R, Walker D, Murtagh K, et al. Retrospective evaluation of thoracic computed tomography findings in dogs naturally infected by Angiostrongylus vasorum. Veterinary Radiology and Ultrasound. 2017 Sep 1;58(5):524–34.
38. Dennler M, Makara M, Kranjc A, Schnyder M, Ossent P, Deplazes P, et al. Thoracic computed tomography findings in dogs experimentally infected with angiostrongylus vasorum. Veterinary Radiology and Ultrasound. 2011 May;52(3):289–94.
39. Barçante JMP, Barçante TA, Ribeiro VM, Oliveira-Junior SD, Dias SRC, Negrão-Corrêa D, et al. Cytological and parasitological analysis of bronchoalveolar lavage fluid for the diagnosis of Angiostrongylus vasorum infection in dogs. Vet Parasitol. 2008 Nov 25;158(1–2):93–102.
40. Tebb AI, Johnson VS, Irwin PJ. Angiostrongylus vasorum (French heartworm) in a dog imported into Australia. Aust Vet J. 2007 Jan;85(1–2):23–8.
41. Canonne AM, Roels E, Caron Y, Losson B, Bolen G, Peters I, et al. Detection of Angiostrongylus vasorum by quantitative PCR in bronchoalveolar lavage fluid in Belgian dogs. Journal of Small Animal Practice. 2016 Mar 1;57(3):130–4.
42. Jefferies R, Morgan ER, Helm J, Robinson M, Shaw SE. Improved detection of canine Angiostrongylus vasorum infection using real-time PCR and indirect ELISA. Parasitol Res. 2011 Dec;109(6):1577–83.
43. Willesen JL, Kristensen AT, Jensen AL, Heine J, Koch J. Efficacy and safety of imidacloprid/moxidectin spot-on solution and fenbendazole in the treatment of dogs naturally infected with Angiostrongylus vasorum (Baillet, 1866). Vet Parasitol. 2007 Jul 20;147(3–4):258–64.
44. Traversa D, Di Cesare A. Canine angiostrongylosis: recent advances in diagnosis, prevention, and treatment. Veterinary Medicine: Research and Reports. 2014 Dec;181.
45. Ssland J, Bolt G. Hypovolaemic shock after anthelmintic treatment of canine angio-strongyloiis [Internet]. Vol. 37, Journal of Small Animal Practice. 1996. Available from: http://www.vetweb.co.uk
 by Multimédica
by Multimédica