Celulitis necrotizante por Pasteurella multocida en un perro. Caso clínico y revisión de infecciones de piel y tejidos blandos
Resumen breve
Se presenta un caso de celulitis necrotizante en región mandibular por Pasteurella multocida en un perro inmunocompetente alimentado con dieta BARF (por las siglas en inglés de Biologically Appropriate Raw Food). Se sospecha que la vía de entrada de la bacteria fue una herida punzante en mucosa oral con uno de los huesos incluidos en la dieta BARF.Índice de contenidos
Resumen breve
Se presenta un caso de celulitis necrotizante en región mandibular por Pasteurella multocida en un perro inmunocompetente alimentado con dieta BARF (por las siglas en inglés de Biologically Appropriate Raw Food). Se sospecha que la vía de entrada de la bacteria fue una herida punzante en mucosa oral con uno de los huesos incluidos en la dieta BARF. El origen de la bacteria podría estar en una contaminación de la carne, vísceras o huesos incluidos en la dieta, o en una diseminación de la bacteria comensal de la boca hacía tejidos profundos a través de la herida oral.
Reseña
Border collie, macho, castrado, de 7 años.
Anamnesis
Displasia de caderas con artrosis severa bilateral en tratamiento con bedinvetmab (Librela®) mensual desde mayo de 2022.
Hemograma y bioquímica anuales normales y test para enfermedades vectoriales negativos.
Vive en piso.
Alimentación: dieta BARF.
Correctamente vacunado y desparasitado interna y externamente.
Motivo de consulta
Acude el 6 de mayo de 2023 por anorexia y decaimiento en las últimas 12 horas.
Examen clínico general, pruebas clínicas, tratamiento y evolución
Paciente decaído. Temperatura rectal 40.4 °C. Mucosas normales. Taquicardia y taquipnea. Leve incremento linfonodo/glándula salivar submandibular izquierdos. Exploración oídos normal. Exploración de cavidad orofaríngea sin datos. Auscultación sin alteraciones. Abdomen depresible. No dolor en columna ni articulaciones. No evidencia de signos neurológicos.
Se inyectó metamizol a dosis de 30 mg/kg IM en la primera consulta.
A las 12 h la temperatura volvió a subir (40.8 °C) y el paciente se mostraba muy abatido y levemente estuporoso.
Se hizo hemograma, bioquímica, proteinograma, test 4DX, serología frente a Toxoplasma y PCR Leptospira sp. No se encontraron alteraciones, solo leve aumento de FAS y linfopenia. Negativo a anticuerpos anti-Toxoplasma IgG e IgM y PCR negativo a Leptospira.
Se inició tratamiento con amoxicilina- ácido clavulánico a dosis de 22 mg/kg/12 h, cimicoxib a dosis de 2 mg/kg/24 h y metamizol 30 mg/kg/12 h.
A las 36 h de la primera visita se palpaba una masa mal delimitada sin fluctuación en región submandibular izquierda firme y dolorosa al tacto. No se observaban heridas incisocontusas en la región ni tractos drenantes.
Además, se observó parálisis y pérdida de la expresión facial del lado izquierdo con asimetría auricular, palpebral, labios descolgados y sialorrea. Sin embargo, no se observó nistagmo, inclinación de la cabeza o ataxia. Se diagnosticó una parálisis del nervio facial (VII par craneano) sin lesión en el nervio vestibulococlear (VIII par craneano) (Figura 1).

Figura 1. A la derecha se observa la parálisis en el lado derecho de la cara.
Se realizaron citologías por PAF de la masa en las que se observó un infiltrado piogranulomatoso con la presencia de masas de bacterias cocobacilares (Figura 2).
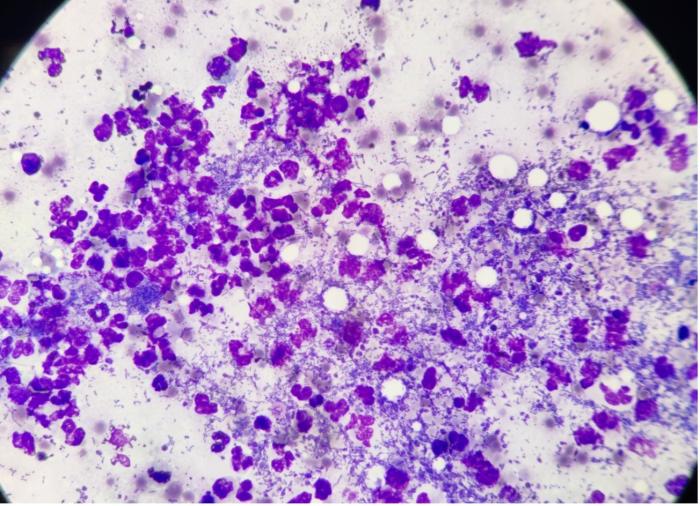
Figura 2. Infiltrado neutrofílico con abundantes bacterias cocobacilares intra y extracitoplasmáticas.
También se observaron imágenes compatibles con citología de glándula salivar y linfonodo reactivo, según el lugar de la punción. Se descartó la presencia de una neoplasia. Con estos hallazgos de citología se sospechó de una parálisis facial periférica de origen infeccioso.
Tercer día: temperatura rectal 40 °C. Se había duplicado el tamaño de la masa y presentaba severa tumefacción y edema subcutáneo (sin crepitación) en labios (Figura 3), cuello y región submandibular. Se observaban tractos drenantes en labio superior e inferior izquierdos, en párpado superior (Figura 4) y se observaba abundante exudado hemopurulento que salía por el conducto auditivo izquierdo (Figura 5). El paciente presentaba mucho dolor y los cuidadores ya no podían administrar la medicación por vía oral.
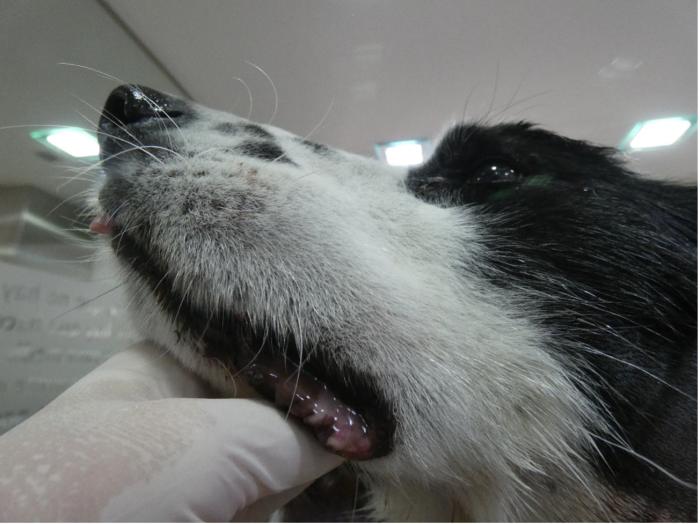
Figura 3. Severo edema y tumefacción en labios.
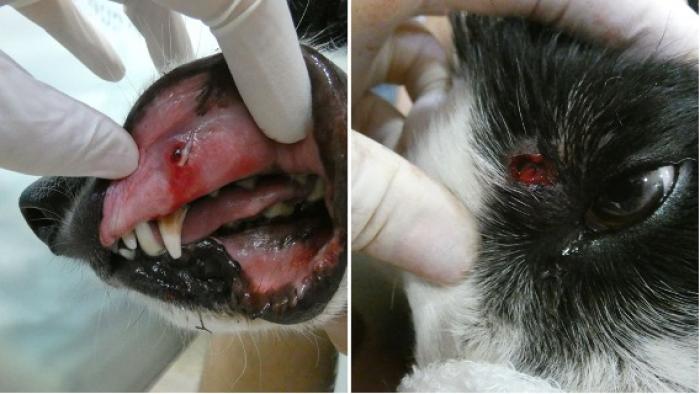
Figura 4. Tractos drenantes en mucosa oral y párpado.
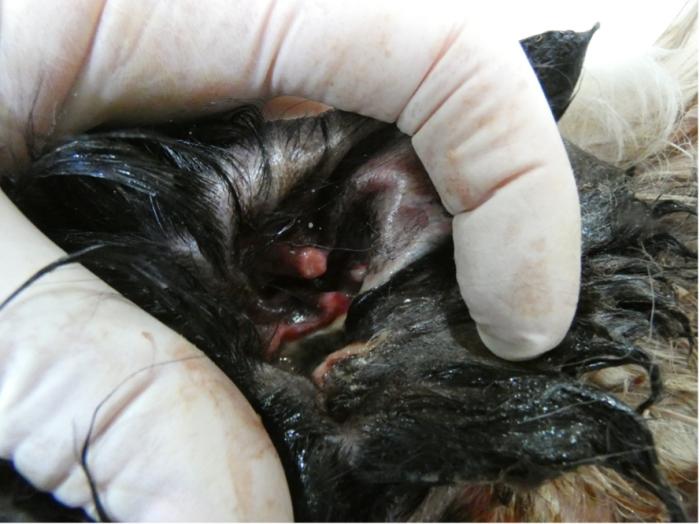
Figura 5. Necrosis de piel y cartílago y exudado purulento del conducto auditivo.
Se repitió otro hemograma donde se detectó leucocitosis (18.730 x 109) y neutrofilia sin desviación a la izquierda.
Se procedió a realizar incisión con bisturí hoja 11, drenaje y lavado con jeringa de irrigación con solución de clorhexidina (Figura 6).
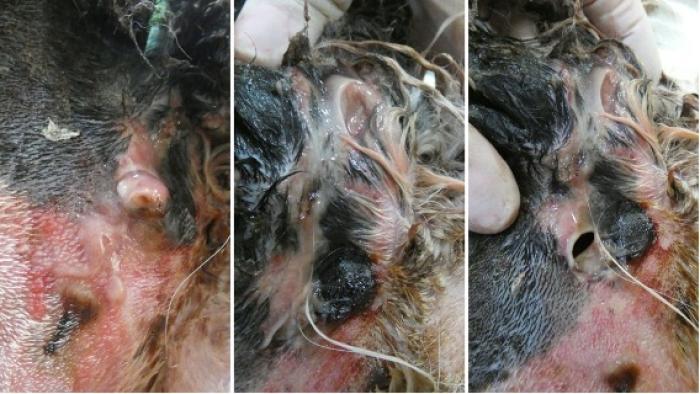
Figura 6. Tumefacción, necrosis y exudado purulento. Evolución entre los días 4 y 5.
Antes del lavado, se repitieron citologías por PAF y PAAF donde se observaban neutrófilos degenerados y bacterias. Además, se tomaron muestras aspirando con jeringas de insulina el exudado del orificio de drenaje y del conducto auditivo para impregnar el hisopo para cultivo microbiológico para aerobios.
Ante la aparente falta de respuesta del antibiótico y síntomas que indicaban diseminación de la infección, se suspendió la amoxicilina- ac. clavulánico por vía oral y se sustituyó por marbofloxacino a dosis de 2 mg/kg/24 h SC.
Se hizo un diagnóstico presuntivo de celulitis bacteriana e incluso de una fascitis necrotizante y se informó a los cuidadores de la necesidad de realizar desbridamiento quirúrgico de la lesión.
Este procedimiento se programó para 72 h después porque coincidió con el fin de semana y para observar la respuesta con el nuevo antibiótico.
Entre los días 4-7 se observó necrosis de piel y tejido subcutáneo, incluido el conducto auditivo externo. La exploración de la zona era muy difícil por la gran cantidad de exudado purulento y el dolor que presentaba el paciente.
A partir del día 6 se controló la fiebre y disminuyó el edema, la tumefacción y el exudado purulento. El paciente recuperó el apetito y estaba más animado. Se mantuvo el tratamiento con marbofloxacino, meloxicam y metamizol SC, tramadol por vía oral y las curas, drenaje y limpieza con clorhexidina.
En el día 7 se remitió a un hospital para realizar TAC de cabeza y cuello, desbridamiento quirúrgico y hospitalización.
En el TAC se encontró una celulitis severa y extensa en la zona submandibular y facial izquierda con formación de una estructura cavitada (4.8 x 4.2 cm) y con contenido gas a nivel de la glándula salivar mandibular, la cual no se identificó en el estudio. Linfadenopatía regional, submandibular, retrofaríngea y preescapular izquierda reactiva. Otitis externa izquierda severa con afectación del pabellón auditivo. Las bullas timpánicas se observaban aireadas con paredes normales y los oídos internos eran normales. No se identificó cuerpo extraño.
En el día 8 se realizó un desbridado quirúrgico de la zona para eliminar todo el tejido necrótico (Figura 7).
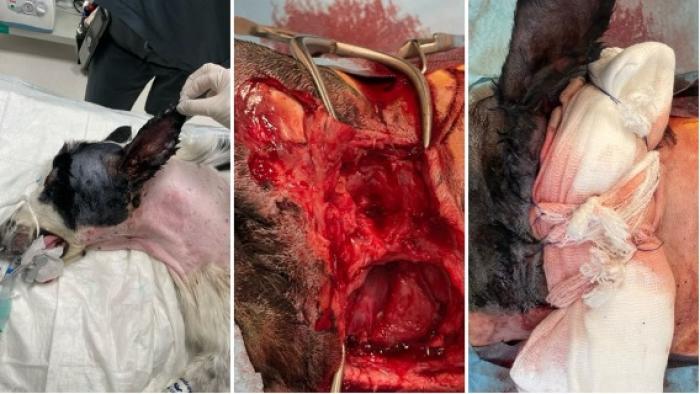
Figura 7. Desbridado quirúrgico en el día 8 (imagen cortesía de Felipe de Vicente, Hospital Veterios).
Se tomaron muestras para cultivo de tejido profundo (aerobios, anaerobios y hongos) y se enviaron 3 muestras de tejido profundo para histopatología. Estuvo hospitalizado 5 días.
La herida se dejó abierta con vendajes tipo húmedo a seco. Se realizaron curas diarias bajo sedación durante 17 días. Primero con polihexamida-betaina (Prontosan®) y posteriormente con ácido hipocloroso (Vetericyn®). Continuó el tratamiento antibiótico con marbofloxacino por vía oral.
El paciente evolucionó favorablemente formándose tejido de granulación sano y permitiendo un cierre quirúrgico de la herida el día 25 (Figura 8 y 9).
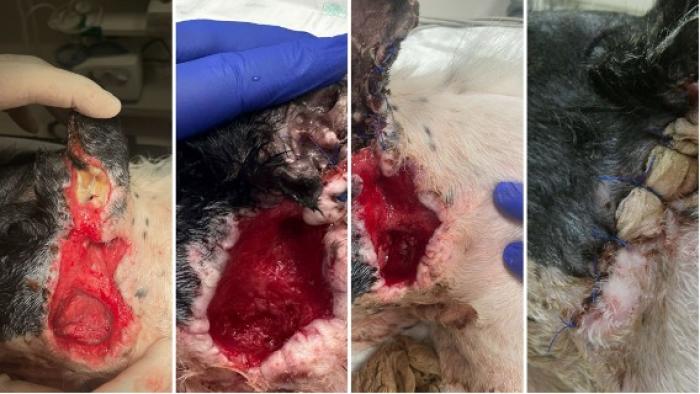
Figura 8. Evolución entre los días 12 al 24 (imágenes cortesía de Felipe de Vicente, Hospital Veterios).
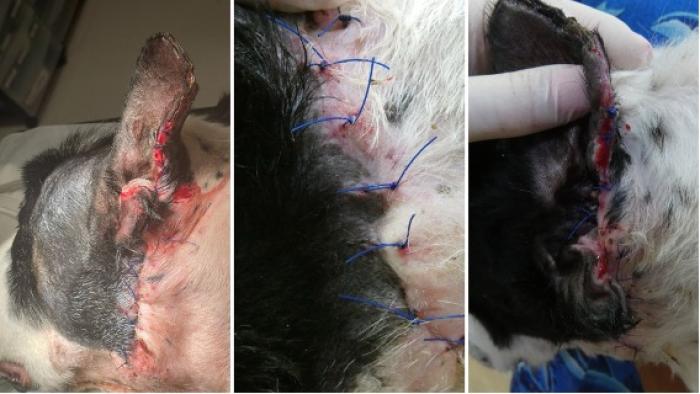
Figura 9. Aspecto de la lesión el día 32.
En el primer cultivo realizado se identificaron con tinción de Gram abundantes cocobacilos Gram-negativos y se aislaron abundantes colonias en cultivo puro de Pasteurella multocida. La identificación de la bacteria fue realizada usando un espectrómetro de masas (MALDI/TOF). La cepa aislada fue sensible a todos los antibióticos testados en el antibiograma. Incluidos la amoxicilina-ac. clavulánico y el marbofloxacino. No se incluyó clindamicina en ese antibiograma.
Las muestras para cultivo tomadas durante la cirugía fueron negativas para bacterias y hongos.
El diagnóstico histopatológico fue el de una dermatitis y paniculitis neutrofílica con necrosis y trombosis vascular tanto de la glándula salivar mandibular como de un ganglio linfático y tejido cercano.
Se dio el alta definitiva el día 40 quedando una leve parálisis del labio superior que se resolvió 3-4 semanas después y una amputación parcial del pabellón auricular (Figura 10).
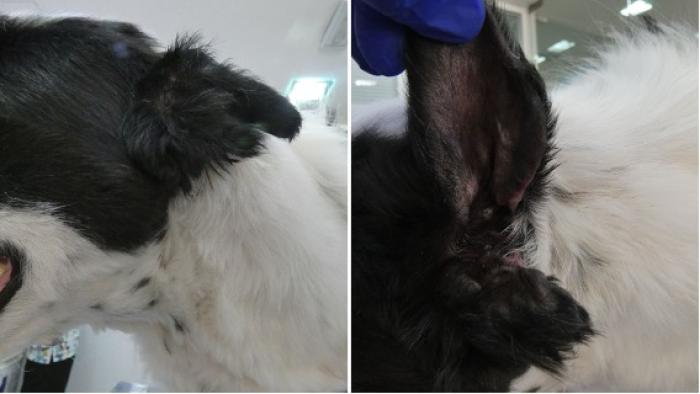
Figura 10. En el día 40 se le dio el alta definitiva.
El perro se mantiene asintomático sin recidivas ni secuelas 12 meses después (Figura 11).

Figura 11. Más de doce meses después el paciente sigue asintomático.
Discusión
La celulitis es un conjunto de infecciones bacterianas profundas que afectan a dermis y panículo con márgenes mal definidos. Pueden derivar o no de una furunculosis causada por varios agentes etiológicos, algunos productores de gas y necrotizantes, aunque normalmente se desarrollan como resultado de la entrada de bacterias a través de una barrera cutánea alterada. Su diagnóstico precoz es clave para el tratamiento oportuno del paciente1-4.
El área afectada en una celulitis bacteriana se caracteriza por aumento de temperatura, edema, dolor y eritema, tiene bordes irregulares, pero puede respetar áreas de piel en un patrón impredecible. Suele extenderse lateralmente y se acompaña de exudación y necrosis.
La clasificación de las infecciones profundas de la piel es confusa en medicina humana y mucho más lo es en medicina veterinaria2.3.
Deberíamos aunar criterios de diagnóstico que sean fáciles de recordar y aplicar y, sobre todo, que sean clínicamente útiles para reconocer qué pacientes requieren desbridado quirúrgico inmediato y el tratamiento antibiótico empírico más adecuado.
Existen criterios anatómicos (profundidad de invasión, región corporal), criterios etiológicos (anaerobios-aerobios y monomicrobiano-polimicrobiano), según la presentación clínica (supurativa-purulenta o no supurativa-no purulenta y leves a graves).
En perros y gatos la mayoría de las celulitis son focales, provocadas por bacterias aerobias y secundarias a heridas punzantes o mordeduras. La bacteria aislada con más frecuencia es S. pseudintermedius. Las celulitis provocadas por bacterias anaerobias suelen ser más rápidas, progresivas y graves. Las heridas anaeróbicas tienen olor pútrido y pueden presentar crepitación al tacto si la bacteria implicada es productora de gas como Clostridium o Bacteroides sp.
En el perro frecuentemente afectan las extremidades (64 %) al igual que en las personas.
Algunos pacientes pueden presentar síntomas sistémicos, probablemente secundarios a la respuesta inflamatoria e inmunológica ante las toxinas de algunas bacterias. Una minoría desarrolla sepsis severa, gangrena local o fascitis necrosante.
En medicina veterinaria también se describe la celulitis necrotizante que es una forma severa de celulitis que afecta a las capas más profundas de la piel y tejidos subcutáneos de rápida progresión y acompañada de necrosis de los tejidos4. A este tipo corresponde el caso descrito en este artículo.
Cuando la infección avanza y se disemina atravesando las fascias de los tejidos se denomina fascitis necrotizante. Generalmente se acompaña de shock séptico y el desenlace puede ser fatal5.
También está descrita en el perro una fascitis necrotizante que afecta a la región perineal y genitourinaria y que, en medicina humana se denomina gangrena de Fournier. Es una infección polimicrobiana que incluye microorganismos aeróbicos y anaeróbicos. Al menos se encuentra un agente anaeróbico como Bacteroides o Clostridium sp. en asociación con enterobacterias como E. coli, Proteus sp. o Klebsiella sp 6-7 (Figura 12 y 13).
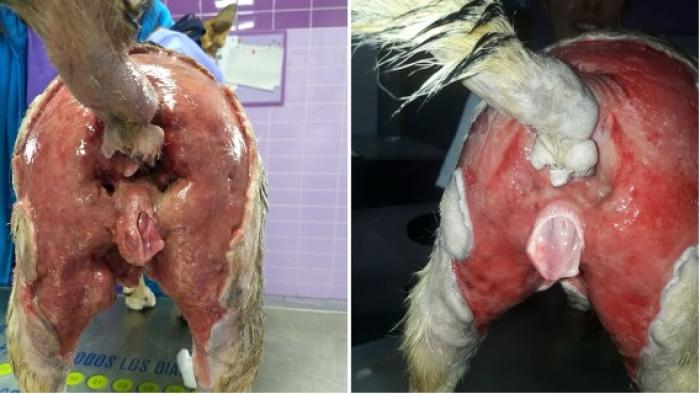
Figura 12. Gangrena de Fournier en una perra de 4 años (imagen cortesía de Elena Diéguez Ordoñez).
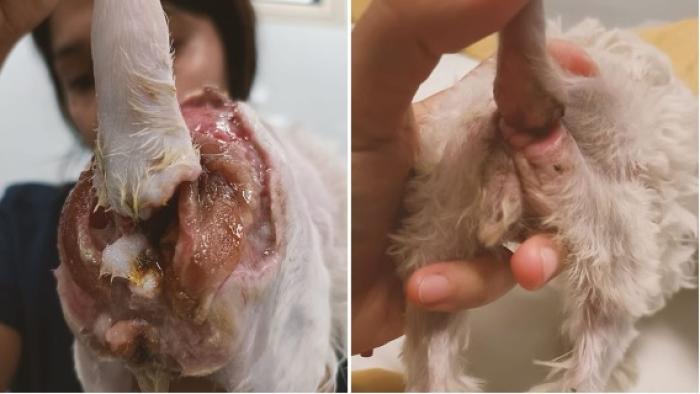
Figura 13. Gangrena de Fournier en una cachorra de 4 meses (imagen cortesía de Ioana Toader).
El género Pasteurella recibe este nombre en honor a Pasteur que en 1880 descubrió que Pasteurella multocida era el agente causal del cólera aviar8.
P. multocida (bacteria aislada en cultivo puro en este caso) es un cocobacilo pleomórfico Gram-negativo. En la tinción de Gram puede observarse como formas cocoides o como bacilos cortos o filamentosos, con una típica tinción bipolar, que pueden aparecer sueltos o agrupados en parejas o cadenas cortas8.
Es anaerobio facultativo y se considera un patógeno oportunista8.
Coloniza el tracto gastrointestinal y respiratorio de una gran variedad de mamíferos y aves, que constituyen su principal reservorio. Los animales más frecuentemente colonizados son los gatos (50-90 %) y los perros (50-65 %)8.
Las infecciones de piel y tejidos blandos, tras mordeduras o arañazos, son las formas de presentación clínica más frecuente8.
La infección se caracteriza por el rápido desarrollo de una celulitis, con o sin formación de abscesos, y drenaje purulento o serosanguinolento por la herida. Conviene revisar de cerca estos casos diariamente porque pueden evolucionar a una fascitis necrotizante en algunas ocasiones. También se describe osteomielitis. Todo esto pueden producirlo incluso cepas de baja virulencia de P. multocida.
Son varios los factores de virulencia de P. multocida. Puede producir una dermonecrotoxina implicada en la rinitis atrófica del cerdo que aumenta los osteoclastos y destruye el hueso. Tiene una cápsula o polisacárido capsular, que confiere resistencia a la fagocitosis. Fimbrias de adhesión o pili que se asocian a la colonización de superficies epiteliales del hospedador. Capacidad de formación de biopelículas y otros como la proteína de membrana externa fijadora de hemoglobina, un sideróforo quelante de hierro (multocidina), la neuraminidasa y plásmidos de resistencia a los antibióticos8.
La interacción entre la bacteria y el sistema inmunológico es determinante para que se comporte como comensal o como patógeno. Aparentemente, animales sanos pueden mantener poblaciones orofaríngeas de P. multocida durante largos períodos, pero el mecanismo exacto por el que la bacteria invade un tejido se desconoce8.
En las infecciones de heridas por mordeduras, hasta disponer de los resultados de los cultivos y de las pruebas de sensibilidad, se considera de elección el tratamiento con amoxicilina-clavulánico, por la frecuencia con que se encuentran coinfecciones por S. aureus y anaerobios en personas. La mayoría de las cepas de Pasteurella multocida procedentes de muestras clínicas son sensibles a la penicilina, tetraciclinas, cefalosporinas de segunda y tercera generación y quinolonas. Las cefalosporinas de primera generación son menos activas, sobre todo cuando se administran por vía oral, y no deben emplearse en el tratamiento de las infecciones producidas por este microorganismo. La sensibilidad a los aminoglucósidos es variable y pueden utilizarse tras la realización de pruebas de sensibilidad. La mayoría de las cepas son resistentes a la clindamicina.
En medicina humana distinguen la trasmisión por mordedura y la trasmisión sin mordedura (arañazo de gato, colonización pulmonar por inhalación o contaminación de heridas por contacto con heces, saliva o pelo de mamíferos y aves). Este paciente no estuvo en contacto con perros, gatos o roedores que pudiesen morderle o arañarle. Se establece como hipótesis de vía de entrada que alguno de los huesos crudos que ingería diariamente en su dieta pudiesen lacerar la mucosa oral y que la bacteria se diseminase desde allí a tejidos profundos de la región mandibular. La carne y vísceras crudas de pollo, conejo o vaca utilizadas en la dieta BARF pueden estar contaminadas por P. multocida y ser el origen de la infección. Aunque no se puede descartar tampoco que el origen de la infección fuese la población comensal alojada en orofaringe9-10.
Las parálisis periféricas del nervio facial pueden ser: idiopáticas, traumáticas, de origen infeccioso o de etiología neoplásica. El nervio facial sale de la cavidad craneana a través del canal facial y el agujero estilomastoideo, y rápidamente se incurva ventral y rostralmente alrededor de la base del cartílago auricular para dirigirse hacia la cara y dividirse en sus diversos ramos terminales. Los ramos terminales del nervio facial son el nervio auriculopalpebral, el ramo bucal dorsal y el ramo bucal ventral. Todos ellos, una vez en la cara, quedan cubiertos por la parte rostral de la glándula parótida, si bien luego se disponen más superficialmente cubiertos únicamente por algunos de los músculos faciales11.
En este caso, la inflamación del nervio facial ocurrió por la infección de tejido alrededor de la glándula mandibular por donde pasa este nervio. No estuvo relacionada con una otitis media ya que en el TAC se veían las bullas timpánicas aireadas con paredes normales y los oídos internos eran normales. La parálisis se resolvió por completo a las seis semanas.
El diagnóstico de celulitis se basa en las manifestaciones clínicas y el resultado de citologías y cultivos microbiológicos del tejido cutáneo y subcutáneo. Según la gravedad y la localización anatómica serán necesarios hemocultivos y pruebas avanzadas de imagen.
En este caso descrito se decidió realizar un TAC antes del desbridamiento por la complejidad anatómica de la zona con muchas estructuras vasculares y nerviosas vitales y para evaluar las bullas y el oído interno. Cuando la zona afectada es una extremidad no son necesarias estas pruebas.
Los abscesos en estas celulitis deben ser drenados y cultivados. Se aconseja realizar cultivos para anaerobios y aerobios. Debemos asegurarnos de marcar aerobios y anaerobios al enviar las muestras a nuestro laboratorio de confianza.
Consideraciones generales para la toma de muestras:
- Se recomienda obtener la muestra antes de iniciar un tratamiento antibiótico empírico.
- La limpieza y desinfección de la zona debe preceder a la toma de muestras. Al contrario de lo que se hace habitualmente en dermatología para cultivos e histopatología.
- En heridas abiertas, se recomienda eliminar el material necrótico y los tejidos desvitalizados y lavar a chorro con suero salino estéril.
- Se recomienda tomar muestra de tejido viable infectado y no de restos superficiales.
- La muestra de tejido o la obtenida por aspiración son las mejores desde el punto de vista microbiológico. En abscesos cerrados: se recomienda aspirar el pus con jeringa y aguja, preferiblemente a través de una zona de piel sana. En heridas abiertas con pus: se recomienda aspirar el pus de la zona más profunda de la herida con jeringa y aguja.
- Si la muestra se recoge con torunda, siempre que sea posible, se deben utilizar dos torundas para tomar la misma muestra; una se emplea para inocular los medios de cultivo y la otra para realizar la extensión para tinción de Gram o Diff-Quick.
- Sin embargo, lo ideal es tomar la muestra de tejido profundo eliminando la epidermis con un bisturí y enviar dermis e hipodermis en un envase con suero fisiológico. Estos cultivos de tejido profundo se toman en el momento del desbridamiento quirúrgico en el quirófano.
En este caso, se enviaron dos cultivos. El primero (solo para aerobios) mediante aspirado colocado en hisopo después de 60 h de tratamiento con amoxicilina- ac. clavulánico y en el que se aisló P. multocida en cultivo puro.
El segundo (para aerobios y anaerobios) se realizó de tejido profundo en el quirófano después de 6 días de tratamiento con marbofloxacino y no se obtuvo crecimiento.
Este resultado negativo pudo deberse a la falta de viabilidad del tejido enviado para cultivo e histopatología que estaba muy necrótico y donde es poco probable encontrar microorganismos. O al control de la infección después de 8 días de antibióticos.
La celulitis bacteriana, por tanto, requiere tratamiento antibiótico específico más drenaje y/o desbridamiento quirúrgico, porque la isquemia y la hipoxia comprometen la acción adecuada de antibióticos en el sitio de infección. El tratamiento conservador solo con antibióticos tiene poco valor.
Según la bibliografía consultada, se recomiendan tratamientos antibióticos empíricos diferentes en estos casos en veterinaria.
En medicina humana, existen guías de tratamiento antibiótico para infecciones de tejidos profundos que tienen en cuenta el uso racional de antibióticos, el tipo de infección profunda, el agente etiológico, el resultado de los antibiogramas y las comorbilidades del paciente12. Además, también existen tablas de actuación según existan signos de sepsis sistémica o signos de diseminación de la infección. Signos que indican sepsis sistémica: cambios en el estado mental, taquicardia, taquipnea e hipotensión. Signos y síntomas que indican diseminación de la infección: fiebre, taquicardia, diaforesis, fatiga, anorexia y vómito.
Bibliografía
- Stevens D., Bisno A., Chambers H., Dellinger E.P., Goldstein E., Gorbach S., Hirschmann J., Kaplan S., Montoya J., Wade J. Clinical Practice Guidelines for the Diagnosis and Management of Skin and Soft Tissue Infections: 2014 Update by IDSA. Clinical Infectious Diseases 2014; 59 (2): 10–e52.
- Stevens, D. L. and Bryant, A. E. Necrotizing Soft-Tissue Infections. New England Journal of Medicine 2017; 377(23): 2253–22
- Beco L., Guaguère E., Lorente Méndez C., Noli C., Nuttall T. and Vroom M. Suggested guidelines for using systemic antimicrobials in bacterial skin infections: part 1—diagnosis based on clinical presentation, cytology and culture. 2013 Vet Rec. 19; 172(3): 72.
- Banovic F., Linder K., Boone A., Jennings S. and Murphy K.M. Cat scratch-induced Pasteurella multocida necrotizing cellulitis in a dog. Vet Dermatol 2013; 24 (4): 463–e108.
- Scott Weese J., Poma R., James F., Buenviaje G., Foster R., and Slavic D. Staphylococcus pseudintermedius necrotizing fasciitis in a dog. Can Vet J. 2009; 50(6): 655–656.
- Okeson DM, Marrow J, Carpenter JW, Armbrust LJ, Ragsdale JM, Klocke E. Fournier's gangrene syndrome in a chimpanzee (Pan troglodytes). J Zoo Wildl Med. 2010; 41(1):169-73.
- Vaske HH, Ragan IK, Harkin KR, Lee K, Hicks SE. Successful conservative management of suspected Fournier's gangrene in cats: three cases. JFMS Open Rep. 2015; 1(1):2055116915589837.
- Boyce J.D., Harper M., Wilkie I.W., Adler B., 2010. Pasteurella. In: Gyles, C.L., Prescott, J.F., Songer, J.G., Thoen, C.O. (Eds.) Pathogenesis of Bacterial Infections in Animals, 4ed. Wiley-Blackwell, Iowa, USA, pp. 325–346.
- Davies RH, Lawes JR, Wales AD. Raw diets for dogs and cats: a review, with particular reference to microbiological hazards. J Small Anim Pract. 2019; 60(6):329-339.
- Victor, A., Mathew, B., Adekemi, O., Ayo, A., & Odunayo, A. Prevalence and antibiotic resistance of Pasteurella multocida isolated from chicken in Ado-Ekiti metropolis. International Journal of Scientific World 2016; 4 (2): 40-42.
- Varejao A. S. P., Munoz A. & Lorenzo V. (2006). Magnetic resonance imaging of the intratemporal facial nerve in idiopathic facial paralysis in the dog. 2006 Vet Radiol Ultrasound. 2006; 47 (4): 328-33.
- Guía de tratamiento antibiótico empírico de las infecciones de piel y partes blandas en el hospital universitario infanta cristina. Actualización diciembre 2021.
 by Multimédica
by Multimédica