Empleo de biomarcadores en perros y gatos con enteropatía crónica inflamatoria
Resumen breve
Las enteropatías inflamatorias crónicas (EIC) agrupan un conjunto de patologías caracterizadas por presentar signos clínicos gastrointestinales crónicos o recurrentes (> 3 semanas de evolución) junto con una evidencia histológica de inflamación de la mucosa tras la exclusión de otras enfermedades gastrointestinales y extra-gastrointestinales subyacentes1-4. Paralelamente, las EIC pueden clasificarse en función de la respuesta al tratamiento instaurado en las siguientes categorías: enteropatía…Índice de contenidos
Introducción
Las enteropatías inflamatorias crónicas (EIC) agrupan un conjunto de patologías caracterizadas por presentar signos clínicos gastrointestinales crónicos o recurrentes (> 3 semanas de evolución) junto con una evidencia histológica de inflamación de la mucosa tras la exclusión de otras enfermedades gastrointestinales y extra-gastrointestinales subyacentes1-4. Paralelamente, las EIC pueden clasificarse en función de la respuesta al tratamiento instaurado en las siguientes categorías: enteropatía responsiva a la dieta (ERD), responsiva a los antimicrobianos (ERA), responsiva a inmunosupresores (ERI) y no responsiva al tratamiento empleado (ENR)3-6. Adicionalmente, algunas formas más graves de EIC pueden cursar con pérdida de proteínas intestinales las cuales se clasifican como enteropatías perdedoras de proteínas (EPP)3,6.
En los últimos años se ha extendido el desarrollo y el empleo de biomarcadores en el área de la gastroenterología veterinaria con el objetivo de reforzar el diagnóstico de EIC, mejorar la localización de las lesiones, determinar la gravedad del proceso inflamatorio y obtener datos adicionales sobre el pronóstico de los pacientes. A continuación, se expone una breve revisión de algunos de los biomarcadores más relevantes empleados en el manejo de EIC en perros y gatos.
Concentración sérica de cobalamina (vitamina B12)
La cobalamina es una vitamina esencial hidrosoluble que se encuentra unida a la proteína de la dieta. En el estómago, la pepsina y el ácido clorhídrico llevan a cabo la digestión proteica provocando que la cobalamina se libere y se una a la proteína-R (haptocorrina), secretada en la saliva y el jugo gástrico.
Posteriormente, la proteína-R es digerida por las enzimas pancreáticas liberando nuevamente a la cobalamina. Tras este paso, el factor intrínseco (producido en el estómago y en el páncreas en los perros y únicamente en el páncreas en los gatos) actúa como transportador de la cobalamina hasta el íleon donde finalmente es absorbida por los enterocitos mediante los receptores cubam (Figura 1)7.
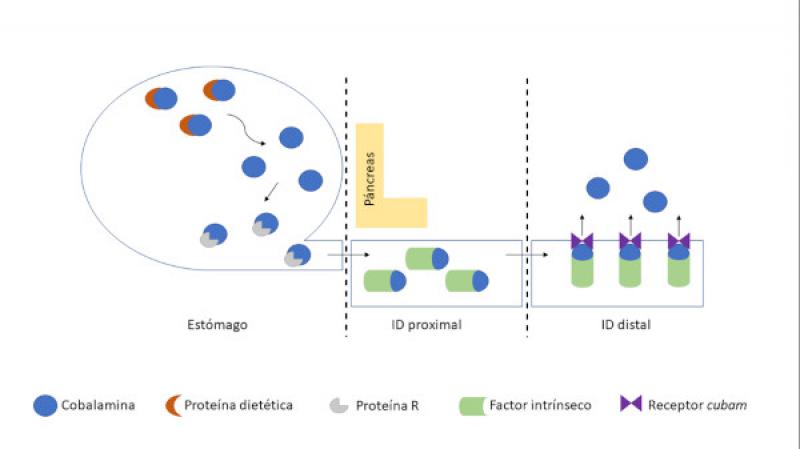
Debido a su absorción selectiva en el íleon, la cobalamina sérica se considera un marcador de funcionalidad intestinal de gran utilidad, especialmente, en enteropatías crónicas5,8,9. Se hipotetiza que lesiones inflamatorias crónicas o neoplásicas de la mucosa del íleon pueden reducir la expresión de los receptores cubam o bien afectar a su funcionalidad. Adicionalmente, estados de hipocobalaminemia en animales con EIC se han correlacionado con valores menores de albúmina, mayor infiltración linfocítica en la mucosa del íleon y menor respuesta al tratamiento, motivo por el cual se considera un factor pronóstico negativo10.
No obstante, otras patologías se han correlacionado también con estados de hipocobalaminemia:
- Patologías hereditarias: se han identificado mutaciones genéticas de los receptores cubam en algunas razas caninas (Pastor Australiano, Schnauzer Gigante, Border Collie, Beagle y Shar Pei). Dichas mutaciones provocan un déficit de cobalamina por malabsorción selectiva de esta vitamina11-16.
- Insuficiencia pancreática exocrina: la falta de enzimas pancreáticas no permite la digestión de la haptocorrina ni la producción de factor intrínseco, dificultando la posterior absorción de cobalamina17.
- Disbiosis intestinal: ciertas bacterias pueden competir con los enterocitos por nutrientes esenciales como la cobalamina. A su vez, algunas de estos agentes también pueden ser productores de folatos, ocasionando un aumento de los folatos séricos junto con hipocobalaminemia18.
- Otras patologías: la pancreatitis, la colangitis y el hipertiroidismo pueden cursar con hipocobalaminemia mediante mecanismos no determinados19,20.
La cobalamina actúa de cofactor en procesos metabólicos como en el ciclo del ácido cítrico y en la síntesis de ácidos nucleicos y aminoácidos. Por este motivo, su déficit puede implicar la aparición de varios signos clínicos como alteraciones en el desarrollo, anorexia, letargia, vómitos y diarreas. En casos graves como pacientes con malabsorción selectiva por mutaciones genéticas, pueden observarse discrasias hematológicas como anemias no regenerativas con megaloblastosis (dicha correlación está actualmente en discusión), neutropenia y presencia de neutrófilos hipersegmentados21,22.
Por otro lado, la hipercobalinemia se consideraba hasta hace unos años un hallazgo no relevante en veterinaria. No obstante, un estudio ha correlacionado los niveles altos de cobalamina con enfermedades hepáticas y neoplásicas en pacientes felinos23.
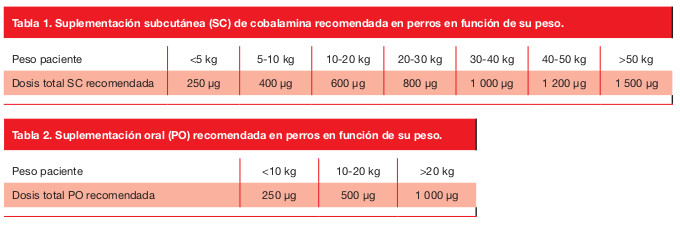
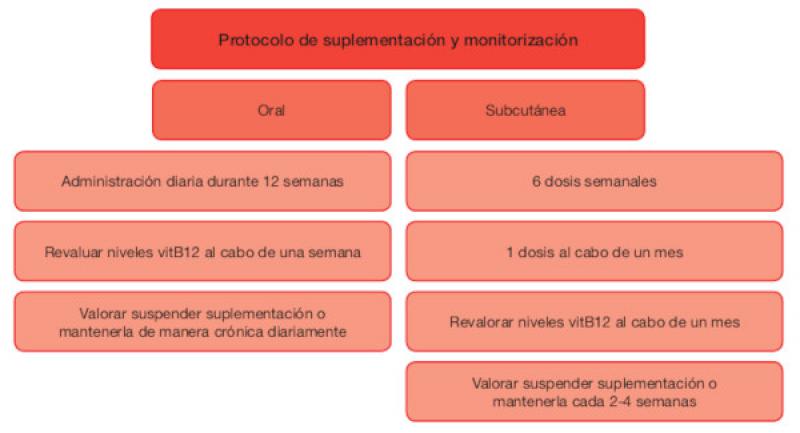
El tratamiento de los pacientes con hipocobalaminemia se basa en la suplementación de vitamina B12. En perros la dosis varía en función del peso y la ruta empleada (Tablas 1 y 2), mientras que en gatos se administran 250 µg totales24-27. La ruta de administración más comúnmente utilizada en ambas especies es la vía subcutánea. No obstante, estudios recientes sugieren que la vía oral puede suponer una alternativa válida en pacientes caninos y felinos24,25. La pauta de administración y monitorización se detalla en la Figura 2.
Concentración sérica y urinaria de ácido metilmalónico (AMM)
La metilmalonil-CoA mutasa es una enzima intracelular que depende de cobalamina para catabolizar el paso de metilmalonil CoA a succinil CoA. Por lo tanto, en situaciones de baja disponibilidad de cobalamina intracelular se produce un descenso de la actividad de la metilmalonil-CoA mutasa y, consecuentemente, se produce un incremento de las concentraciones séricas del metabolito ácido metilmalónico (AMM) 28.
Los pacientes con hipocobalaminemia presentan mayores valores séricos de AMM que los que tienen normocobalaminemia. No obstante, un 12 % de los perros con valores normales de cobalamina presentan un aumento de la concentración de AMM y podrían beneficiarse de la suplementación de dicha vitamina, especialmente si los valores de cobalamina son subóptimos (inferiores a 400 ng/l)8,25. Por esta razón, la medición de AMM se considera un marcador útil para detectar déficits de cobalamina a nivel celular en pacientes con cobalamina sérica normal8.
Las concentraciones de AMM pueden determinarse a partir de muestras de suero u orina, ya que excesos séricos de AMM conllevan una mayor excreción urinaria del metabolito8,29. No obstante, la cuantificación del AMM no está actualmente extendida en la práctica clínica diaria debido al coste y dificultad técnica que supone su determinación tanto a nivel sérico como urinario. Los valores séricos de AMM pueden incrementarse en pacientes con insuficiencia renal debido a una reducción de su excreción8. Por este motivo, se recomienda interpretar los resultados juntamente con los valores de creatinina o dimetilarginina simétrica (SDMA). Adicionalmente, estados de deshidratación o disbiosis intestinal también pueden provocar elevaciones de los valores séricos8,30.
Concentración sérica de homocisteína
La homocisteína es un aminoácido sulfurado derivado de la metionina ingerida en la dieta a través de las proteínas de origen animal31. La cobalamina (vitamina B12), el ácido fólico (vitamina B9) y la piridoxina (vitamina B6) son cofactores esenciales para la metabolización de homocisteína a cisteína32.
Por esta razón, la determinación sérica de homocisteína se considera un marcador sensible para la detección de déficits intracelulares de vitamina B, ya que estados de hiperhomocisteinemia sugieren la disminución celular de alguno de estos tres cofactores.
La hiperhomocisteinemia sucede de forma temprana ante deficiencias de cobalamina. No obstante, la elevación sérica de homocisteína se considera menos específica para la detección del déficit intracelular de cobalamina que el incremento de las concentraciones séricas de AMM33. La homocisteína circula en sangre unida a la albúmina. Por este motivo, patologías que cursan con hipoalbuminemia (p. ej., enteropatías perdedoras de proteínas) pueden conllevar a mediciones falsamente bajas o normales de homocisteína34. Adicionalmente, elevaciones de la homocisteína sérica deben interpretarse con cautela ya que pueden ocurrir en casos de insuficiencia renal o hipotiroidismo34,35.
Concentración sérica de folato
El folato es una vitamina hidrosoluble (vitamina B9) que se encuentra en la mayoría de las dietas comerciales en forma de poliglutamato, el cual difícilmente se absorbe. En el duodeno proximal el poliglutamato es desconjugado a monoglutamato por la enzima folato desconjugasa, la cual se encuentra en el ribete estriado. Los transportadores específicos encargados de la absorción intestinal de monoglutamato se localizan exclusivamente en los enterocitos del duodeno y yeyuno proximal (Figura 3)7.
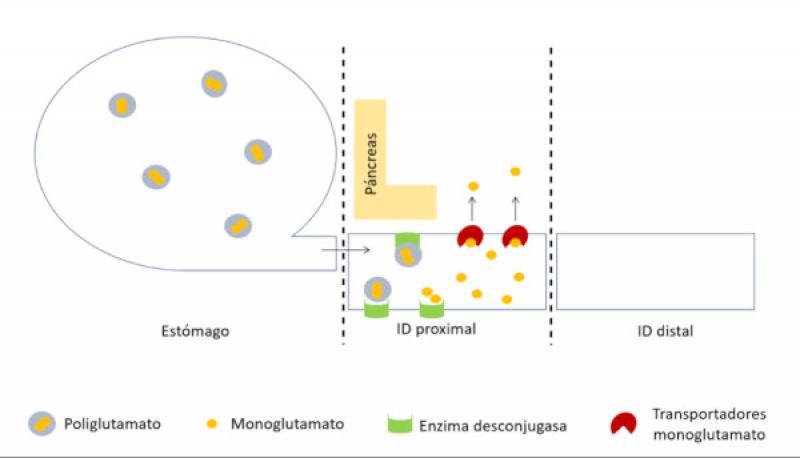
En pacientes con enfermedad intestinal proximal se produce una destrucción del folato desconjugasa y de los transportadores de folato, implicando de este modo una absorción deficiente de folato. Si dicha situación se cronifica, se produce una depleción sérica de los folatos37. Por otro lado, varias especies bacterianas son capaces de sintetizar folato. Por este motivo, aumentos significativos de los folatos séricos pueden ser secundarios a un sobrecimiento o disbiosis bacteriana38.
Se recomienda suplementar con ácido fólico los perros (100 μg/kg o 200-400 μg/perro/24 h 30 días) y gatos (200 μg/gato/24 h PO 30 días) con déficit moderado o grave. Posteriormente, una semana tras finalizar la suplementación, se aconseja volver a cuantificar los niveles séricos de folato para valorar la necesidad de mantener el tratamiento a largo plazo en caso de persistir el déficit.
Concentración fecal de alfa1-antitripsina (α1-AT)
La α1-AT es una proteína producida a nivel hepático, la cual está de manera fisiológica presente en el plasma, el líquido intersticial y la linfa. En condiciones normales no se detectan concentraciones elevadas a nivel fecal a no ser que haya una pérdida transmucosa de alguno de estos fluidos debido a una patología gastrointestinal. La α1-AT se caracteriza por tener un peso molecular similar a la albúmina, por lo que ambas suelen perderse en cantidades similares en situaciones de EPP39. No obstante, a diferencia de la albúmina, la α1-AT es resistente a la degradación proteolítica, haciendo posible su determinación y cuantificación en heces para estimar la pérdida proteica en heces40. Por este motivo, tiene especial interés clínico en pacientes con hipoalbuminemia sin signos gastrointestinales evidentes tras haber descartado otras patologías extra-gastrointestinales que justifiquen dicha alteración.
La concentración de α1-AT en heces puede anticiparse a la aparición de signos clínicos gastrointestinales y a la disminución sérica de albúmina o proteínas totales. Por lo tanto, se considera un biomarcador de detección temprana de pérdida de proteínas a nivel gastrointestinal41.
La pérdida gastrointestinal crónica de α1-AT causada por una EPP conlleva una disminución de las concentraciones séricas de α1-AT. Por lo tanto, la ratio de los valores séricos-fecales de α1-AT parece ofrecer una mayor precisión diagnóstica en pacientes con hipoalbuminemia y sospecha de enteropatía crónica42. Adicionalmente, se recomienda testar aquellas razas con alta prevalencia de EPP (p. ej., Yorkshire Terrier, Norwegian Lundehund, Soft Coated Wheaten Terrier) antes de emplearlos para cría43.
Finalmente, para la correcta cuantificación de α1-AT se recomienda emplear tres muestras fecales frescas de tres días consecutivos con el fin de reducir las posibles variaciones diarias40.
Concentración sérica de Proteína C reactiva (PCR)
La PCR es un reactante de fase aguda sintetizada en el hígado en respuesta a un proceso inflamatorio, infeccioso o neoplásico. Por esta razón, la medición de concentraciones séricas de PCR se considera un marcador de inflamación no específico en pacientes caninos y felinos44. Debido a la alta variabilidad fisiológica en sus valores séricos, la PCR tiene una utilidad limitada para el diagnóstico de EIC. No obstante, diversos estudios han observado una buena correlación de los valores séricos de PCR con los índices clínicos de actividad de IBD (Inflammatory Bowel Disease)45,46. Por este motivo, se considera una herramienta útil para monitorizar la progresión de estas enteropatías, así como la respuesta al tratamiento instaurado. De esto modo, descensos significativos de las concentraciones de PCR (como mínimo 2.7 veces menos respecto el valor inicial) se interpretan como una respuesta favorable47.
Adicionalmente, un estudio reciente observó que concentraciones séricas de PCR > 9.1 mg/l permitieron distinguir perros con EIC que requirieron tratamiento inmunosupresor (ERI) de los que respondieron a tratamiento dietético (ERD) o antimicrobiano (ERA) con una sensibilidad del 72 % y una especificidad del 100 %48.
Concentraciones séricas y fecales de calprotectina
La calprotectina (S100A8/A9) es una proteína expresada y liberada principalmente por macrófagos y neutrófilos activados y células epiteliales en respuesta a varios procesos inflamatorios agudos y crónicos49. Por ello, la concentración sérica de calprotectina también puede verse aumentada en pacientes con EIC46,50,51. No obstante, la calprotectina sérica no es específica del tracto gastrointestinal y puede incrementarse ante cualquier cuadro inflamatorio.
Alternativamente, se puede cuantificar la calprotectina fecal al tratarse de una proteína con una elevada estabilidad en heces48. Además, la medición de la calprotectina fecal ha demostrado ser un biomarcador útil de inflamación gastrointestinal y con buena correlación con la gravedad clínica en perros y gatos con enteropatía crónica52,53. Adicionalmente, parece ser de utilidad para predecir la respuesta al tratamiento de estos pacientes. En un estudio, valores ≥15.2 μg/g se relacionaron con pacientes caninos con una respuesta parcial o nula al tratamiento con una sensibilidad del 80 % y una especificidad del 75 %48.
Es importante tener en cuenta que la calprotectina fecal puede elevarse en otros procesos inflamatorios gastrointestinales agudos y puede disminuir en animales tratados con glucocorticoides54,55. Por ello, para poder interpretar adecuadamente los resultados, se debe realizar una correcta selección de los pacientes previamente a su medición. Actualmente se desconoce cómo puede influir la presencia de procesos neoplásicos gastrointestinales en los valores de la calprotectina fecal.
Concentraciones séricas y fecales de calgranulina C
La calgranulina C (S100A12) es una isoforma de la proteína de unión a calcio que interviene en procesos importantes de la inmunidad innata y adquirida56. Se considera un marcador muy sensible de procesos inflamatorios localizados, como es el caso de las EIC57. No obstante, de forma similar a la calprotectina, la calgranulina puede elevarse en diferentes patologías inflamatorias.
La calgranulina C es una proteína muy estable en heces, por lo que es un biomarcador útil de inflamación gastrointestinal que se puede cuantificar a partir de muestras fecales58. La calgranulina C fecal se correlaciona con la gravedad de los signos clínicos y de las lesiones endoscópicas, pero no con la gravedad de las lesiones histopatológicas59. Además, también se ha estudiado su utilidad como marcador predictor de la respuesta terapéutica. Un estudio observó que una concentración fecal >490 ng/g pudo distinguir perros con EIC que requirieron tratamiento inmunosupresor (ERI) de los respondedores a dieta (ERD) o a antimicrobianos (ERA) con una sensibilidad del 64 % y especificidad del 77 %. Por otro lado, una concentración fecal ≥2.700 ng/g identificó los perros que no respondieron al tratamiento (ENR) de los que, al menos, respondieron parcialmente con una sensibilidad del 100 % y una especificidad del 76 %60.
A diferencia de la calprotectina, el tratamiento concomitante con glucocorticoides no altera las concentraciones séricas de calgranulina C58. Sin embargo, los valores fecales también pueden incrementarse ante procesos inflamatorios gastrointestinales agudos, motivo por el cual es importante seleccionar previamente los pacientes que cumplan criterios de EIC54. Finalmente, tampoco se ha determinado el impacto que puede ejercer una neoplasia gastrointestinal en los valores fecales de calgranulina C.
Índice de disbiosis fecal
Estudios recientes han identificado diferencias en las poblaciones bacterianas intestinales de perros y gatos con EIC respecto al microbioma de animales sanos. El índice de disbiosis (ID) permite detectar estas alteraciones y distinguir entre normobiosis y disbiosis intestinal mediante la cuantificación fecal de los 7 grupos bacterianos más comúnmente alterados en casos de EIC (Blautia, Clostridium hiranonis, Escherichia coli, Faecalibacterium, Fusobacterium, Streptococcus y Turicibacter) y la comparación con el valor total de bacterias detectadas. La determinación de los distintos grupos bacterianos se realiza mediante detección de DNA fecal con el empleo de PCR cuantitativa (qPCR). Un valor de ID negativo es indicativo de normobiosis, mientras que un valor positivo es sugestivo de disbiosis intestinal. De este modo, permite distinguir pacientes con EIC de los animales sanos con una sensibilidad del 74 % y una especificidad del 95 %61-63.
Pruebas de permeabilidad gastrointestinal
Una de las propiedades de la pared gastrointestinal es actuar como barrera efectiva frente a la absorción no controlada de substancias peligrosas del lumen intestinal, así como evitar la pérdida de proteínas plasmáticas. Las pruebas de permeabilidad ofrecen la posibilidad de evaluar de forma no invasiva la funcionalidad de la barrera intestinal, la cual se puede ver alterada frente a múltiples patologías intestinales64-67. Diferentes substancias se han empleado como marcadores de permeabilidad, siendo el 51Cr-EDTA el gold standard. Sin embargo, al tratarse de una substancia radioactiva, su empleo no es clínicamente viable en medicina veterinaria68. Alternativamente, se pueden emplear distintos tipos de azúcares como la lactulosa, ramnosa y sucrosa69.
La cuantificación sérica de estos azúcares tras su administración oral permite estimar la permeabilidad intestinal de los pacientes. El efecto de una EIC sobre la permeabilidad de un compuesto va a depender de las características de la molécula como el tamaño, carga y capacidad de degradarse. Por ejemplo, la permeabilidad intestinal frente a moléculas grandes de azúcar como la lactulosa se ve incrementada si hay una lesión en el epitelio intestinal como una EIC. Sin embargo, las moléculas pequeñas como la ramnosa suelen cruzar el epitelio a través de poros de membrana en situaciones fisiológicas.
La determinación de azúcares en suero requiere de métodos de cuantificación complejos. Además, algunos azúcares se metabolizan rápidamente, dificultando su correcta medición en suero. Por estas razones, se suelen realizar cuantificaciones de estos azúcares en orina70. Sin embargo, su medición requiere de sondaje urinario por lo que también se considera una prueba laboriosa. Desafortunadamente, actualmente no hay métodos de valoración disponibles de la permeabilidad intestinal que puedan emplearse en la práctica clínica diaria de forma rutinaria.
Bibliografía
- Washabau RJ, Day MJ, Willard MD. WSAVA International Gastrointestinal Standardization Group. Endoscopic, biopsy, and histopathologic guidelines for the evaluation of gastrointestinal inflammation in companion animals. J Vet Intern Med. 2010;24:10-26.
- Day MJ, Bilzer T, Mansell J, et al. Histopathological standards for the diagnosis of gastrointestinal inflammation in endoscopic biopsy samples from the dog and cat: a report from the World Small Animal Veterinary Association Gastrointestinal Standardization Group. J Comp Pathol. 2008;138:S1-S43. 3.
- Dandrieux JR. Inflammatory bowel disease versus chronic enteropathy in dogs: are they one and the same? J Small Anim Pract. 2016;57: 589-599.
- Allenspach K, Culverwell C, Chan D. Long-term outcome in dogs with chronic enteropathies: 203 cases. Vet Rec. 2016;178:368.
- Volkmann M, Steiner JM, Fosgate GT, et al. Chronic diarrhea in dogs – retrospective study in 136 cases. J Vet Intern Med. 2017;31: 1043-1055.
- Erdmann C, Heilmann RM. Diagnostic and therapeutic approach to chronic inflammatory enteropathies in dogs. Tierärztl Prax (K). 2017;45:317-327.
- Suchodolski J, Steiner J. Laboratory assessment of gastrointestinal function. Clin Tech Small Anim Pract. 2003;18: 203-210.
- Berghoff N, Parnell NK, Hill SL, Suchodolski JS, Steiner JM. Serum cobalamin and methylmalonic acid concentrations in dogs with chronic gastrointestinal disease. Am J Vet Res. 2013;74(1):84-89.
- Simpson KW, Fyfe J, Cornetta A, et al. Subnormal concentrations of serum cobalamin (vitamin B12) in Cats with Gastrointestinal Disease. J Vet Intern Med. 2001;15(1):26-32.
- Trehy MR, German AJ, Silvestrini P, Serrano G, Batchelor DJ. Hypercobalaminemia is associated with hepatic and neoplastic disease in cats: a cross sectional study. BMC Vet Res. 2014;10:175.
- Fyfe JC, Giger U, Hall CA, et al. Inherited selective intestinal cobalamin malabsorption and cobalamin deficiency in dogs. Pediatr Res. 1991;29(1):24-31.
- Owczarek-Lipska M, Jagannathan V, Drögemüller C, et al. A Frameshift mutation in the cubilin gene (CUBN) in Border Collies with Imerslund-Gräsbeck syndrome (selective cobalamin malabsorption). PLoS One. 2013;8(4): e61144.
- Bishop MA, Xenoulis PA, Berghoff N, Grützner N, Suchodolski JS, Steiner JM. Partial characterization of cobalamin deficiency in Chinese Shar Peis. Vet J. 2012;191(1):41-45.
- Gold AJ, Scott MA, Fyfe JC. Failure to thrive and life-threatening complications due to inherited selective cobalamin malabsorption effectively managed in a juvenile Australian shepherd dog. Can Vet J. 2015;56(10):1029-1034.
- Kook PH, Reusch CE, Hersberger M. Prospective long-term evaluation of parenteral hydroxocobalamin supplementation in juvenile beagles with selective intestinal cobalamin malabsorption (Imerslund-Gräsbeck syndrome). J Vet Intern Med. 2018;32:10331040.
- McLauchlan G, McLaughlin A, Sewell AC, Bell R. Methylmalonic aciduria secondary to selective cobalamin malabsorption in a Yorkshire Terrier. J Am Anim Hosp Assoc. 2015;51(4):285-288.
- Batchelor DJ, Noble PJ, Taylor RH, Cripps PJ, German AJ. Prognostic factors in canine exocrine pancreatic insufficiency: prolonged survival is likely if clinical remission is achieved. J Vet Intern Med. 2007; 21(1):54-60.
- Suchodolski JS. Alterations in the small intestinal microflora (small intestinal bacterial overgrowth). In: Steiner JM, ed. Small Animal Gastroenterology. Hannover, Germany: Schlütersche; 2007:202-207.
- Geesaman, B., Whitehouse, W. and Viviano, K., 2016. Serum Cobalamin and Methylmalonic Acid Concentrations in Hyperthyroid Cats Before and After Radioiodine Treatment. Journal of Veterinary Internal Medicine, 30(2), pp.560-565.
- Reed, N., Gunn-Moore, D. and Simpson, K., 2007. Cobalamin, folate and inorganic phosphate abnormalities in ill cats. Journal of Feline Medicine and Surgery, 9(4), pp.278-288.
- Stanley E, Appleman E, Schlag A, Siegel A. Relationship between cobalamin and folate deficiencies and anemia in dogs. J Vet Intern Med. 2019;33(1):106-113.
- Weiss DJ. Congenital dyserythropiesis. In: Weiss JD, Wardrop KJ, eds. Schalm's Veterinary Hematology. Vol 6. Ames, Iowa: Wiley; 2010:196-197.
- Trehy MR, German AJ, Silvestrini P, Serrano G, Batchelor DJ. Hypercobalaminemia is associated with hepatic and neoplastic disease in cats: a cross sectional study. BMC Vet Res. 2014;10:175.
- Toresson L, Steiner JM, Razdan P, et al. Comparison of efficacy of oral and parenteral cobalamin supplementation in normalising low cobalamin concentrations in dogs: a randomised controlled study. Vet J. 2018;232:27-32.
- Toresson L, Steiner JM, Spodsberg E, et al. Effects of oral versus parenteral cobalamin supplementation on methylmalonic acid and homocysteine concentrations in dogs with chronic enteropathies and low cobalamin concentrations. Vet J. 2019;243:8-14.
- Toresson L, Steiner J, Olmedal G, Larsen M, Suchodolski J, Spillmann T. Oral cobalamin supplementation in cats with hypocobalaminaemia: a retrospective study. J Feline Med Surg. 2017;19(12):1302-1306.
- Ruaux CG. Cobalamin in companion animals: Diagnostic marker, deficiency states and therapeutic implications. Vet J 2013; 196: 145–152.
- Allen RH, Stabler SP, Savage DG, Lindenbaum J. Metabolic abnormalities in cobalamin (vitamin B12) and folate deficiency. FASEB J. 1993;7(14):1344-1353.
- Berghoff N, Suchodolski JS, Steiner JM. Association between serum cobalamin and methylmalonic acid concentrations in dogs. Vet J. 2012;191:306-311.
- Suchodolski JS. Diagnosis and interpretation of intestinal dysbiosis in dogs and cats. Vet J. 2016;215:30-37.
- Lippi G, Plebani M. Hyperhomocysteinemia in health and disease: where we are now, and where do we go from here? Clin Chem Lab Med. 2012;50(12):2075-2080.
- Stanger O, Herrmann W, Pietrizik K, et al. DACH-Liga homocysteine (german, austrian and swiss homocysteine society): consensus paper on the rational clinical use of homocysteine, folic acid an B-vitamins in cardiovascular and thrombotic diseases: guidelines and recommendations. Clin Chem Lab Med. 2003;41(11):1392-1403.
- Lutz S, Sewell AC, Bigler B, Riond B, Reusch CE, Kook PH. Serum cobalamin, urine methylmalonic acid, and plasma total homocysteine concentrations in Border Collies and dogs of other breeds. Am J Vet Res. 2012;73(8):1194-1199.
- Grützner N, Suchodolski JS, Steiner JM. Relationship between cobalamin-dependent metabolites and both serum albumin and alpha1-proteinase inhibitor concentrations in hypocobalaminemic dogs of 7 different breeds. Vet Clin Pathol. 2014;43(4):561-566.
- Amin HK, El-Sayed MI, Leheta OF. Homocysteine as a predictive biomarker in early diagnosis of renal failure susceptibility and prognostic diagnosis for end stages renal disease. Ren Fail. 2016;38(8): 1267-1275.
- Gołynski M, Lutnicki K, Krumrych W, et al. Relationship between total homocysteine, folic acid, and thyroid hormones in hypothyroid dogs. J Vet Intern Med. 2017;31(5):1403-1405.
- Yakut M, Ustün Y, Kabaçam G, Soykan I. Serum vitamin B12 and folate status in patients with inflammatory bowel diseases. Eur J Intern Med. 2010 Aug;21(4):320-3.
- Raux CG. Laboratory testing for the diagnosis of intestinal disorders. In: Steiner JM, ed. Small Animal Gastroenterology. Hannover. Germany: Schlütersche; 2008:50-55.
- Melgarejo T, Williams DA, Griffith G. Isolation and characterization of α1-protease inhibitor from canine plasma. Am J Vet Res. 1996;57:258-263.
- Heilmann RM, Paddock CG, Ruhnke I, et al. Development and analytical validation of a radioimmunoassay for the measurement of α1-proteinase inhibitor concentrations in feces from healthy puppies and adult dogs. J Vet Diagn Invest. 2011;23:476-485.
- Vaden SL, Vidaurri A, Levine JF, et al. Fecal α1-proteinase inhibitor activity in Soft Coated Wheaten Terriers. J Vet Intern Med. 2002;16:382.
- Heilmann RM, Parnell NK, Grützner N, et al. Serum and fecal canine alpha1-proteinase inhibitor concentrations reflect the severity of intestinal crypt abscesses and/or lacteal dilation in dogs. Vet J. 2016;207:131-139.
- Vaden SL, Sellon RK, Melgarejo LT, Williams DA, Trogdon MM, VanCamp SD, Argenzio RA. Evaluation of intestinal permeability and gluten sensitivity in Soft-Coated Wheaten Terriers with familial protein-losing enteropathy, protein-losing nephropathy, or both. Am J Vet Res. 2000;61(5):518-24.
- Nakamura M, Takahashi M, Ohno K, et al. C-reactive protein concentration in dogs with various diseases. J Vet Med Sci. 2008;70:127-13.
- Jergens AE, Schreiner CA, Frank DE, Niyo Y, Ahrens FE, Eckersall PD, Benson TJ, Evans R. A scoring index for disease activity in canine inflammatory bowel disease. J Vet Intern Med. 2003;17(3):291-7.
- McCann TM, Ridyard AE, Else RW, Simpson JW. Evaluation of disease activity markers in dogs with idiopathic inflammatory bowel disease. J Small Anim Pract. 2007;48(11):620-5.
- Carney PC, Ruaux CG, Suchodolski JS, Steiner JM. Biological variability of C-reactive protein and specific pancreatic lipase immunoreactivity (Spec cPL) in apparently healthy dogs. J Vet Intern Med. 2011;25:825-830.
- Heilmann RM, Berghoff N, Mansell J, et al. Association of fecal calprotectin concentrations with disease severity, response to treatment, and other biomarkers in dogs with chronic inflammatory enteropathies. J Vet Intern Med. 2018;32:679-692.
- Vogl T, Tenbrock K, Ludwig S, et al. Mrp8 and Mrp14 are endogenous activators of Toll-like receptor 4, promoting lethal, endotoxin-induced shock. Nat Med. 2007;13:1042-1049.
- Heilmann RM, Allenspach K, Procoli F, et al. Serum calgranulin concentrations in dogs with inflammatory bowel disease. J Vet Intern Med. 2011;25:1486.
- McCann TM, Ridyard AE, Else RW, Simpson JW. Evaluation of disease activity markers in dogs with idiopathic inflammatory bowel disease. J Small Anim Pract. 2007;48:620-625.
- Otoni CC, Heilmann RM, García-Sancho M, et al. Serologic and fecal markers to predict response to induction therapy in dogs with idiopathic inflammatory bowel disease. J Vet Intern Med. 2018;32:999-1008.
- Truar K, Nestler J, Schwarz J, et al. Feasibility of measuring fecal calprotectin concentrations in dogs and cats by the fCAL® turbo immunoassay. J Vet Intern Med. 2018;32:580.
- Heilmann RM, Guard MM, Steiner JM, et al. Fecal inflammatory biomarkers and microbial changes in dogs with acute hemorrhagic diarrhea syndrome (AHDS). J Vet Emerg Crit Care. 2017;27:586-589.
- Heilmann RM, Jergens AE, Ackermann MR, Barr JW, Suchodolski JS, Steiner JM. Serum calprotectin concentrations in dogs with idiopathic inflammatory bowel disease. Am J Vet Res. 2012;73(12):1900-7.
- Foell D, Wittkowski H, Vogl T, Roth J. S100 proteins expressed in phagocytes: a novel group of damage-associated molecular pattern molecules. J Leukoc Biol. 2007;81:28-37.
- Foell D, Wittkowski H, Roth J. Monitoring disease activity by stool analyses: from occult blood to molecular markers of intestinal inflammation and damage. Gut. 2009;58:859-868.
- Heilmann RM, Cranford SM, Ambrus A, et al. Methodological and preanalytical validation of an enzyme-linked immunosorbent assay for the measurement of canine S100A12. Vet Clin Pathol. 2016;45:135-147.
- Heilmann RM, Grellet A, Allenspach K, et al. Association between fecal S100A12 concentration and histologic, endoscopic, and clinical severity in dogs with idiopathic inflammatory bowel disease.Vet Immunol Immunopathol. 2014;158:156-166.
- Heilmann RM, Volkmann M, Otoni CC, et al. Fecal S100A12 concentration predicts a lack of response to treatment in dogs affected with chronic enteropathy. Vet J. 2016;215:96-100.
- AlShawaqfeh MK, Wajid B, Minamoto Y, Markel M, Lidbury JA, Steiner JM, Serpedin E, Suchodolski JS. A dysbiosis index to assess microbial changes in fecal samples of dogs with chronic inflammatory enteropathy. FEMS Microbiol Ecol. 2017;93(11).
- Kalenyak K, Isaiah A, Heilmann RM, et al. Comparison of the intestinal mucosal microbiota in dogs diagnosed with idiopathic inflammatory bowel disease and dogs with food-responsive diarrhea before and after treatment. FEMS Microbiol Ecol. 2018;94:173.
- Suchodolski JS. Diagnosis and interpretation of intestinal dysbiosis in dogs and cats. Vet J. 2016;215:30-37.
- Sorensen SH, Proud FJ, Rutgers HC. A blood test for intestinal permeability and function: a new tool for the diagnosis of chronic intestinal disease in dogs. Clin Chim Acta. 1997;264:103–115.
- Garden OA, Manners HK, Anners SH, et al. Intestinal permeability of Irish Setter puppies challenged with a controlled oral dose of gluten. Res Vet Sci. 1998;65:23–28.
- Rutgers HC, Batt RM, Hall EJ, Sørensen SH, Proud FJ. Intestinal permeability testing in dogs with diet responsive intestinal disease. J Small Anim Pract. 1995;36:295–301.
- Rutgers HC, Batt RM, Proud FJ, et al. Intestinal permeability and function in dogs with small intestinal bacterial overgrowth. J Small Anim Pract. 1996;37:428–434.
- Hall EJ, Batt RM. Enhanced intestinal permeability to 51Cr-labeled EDTA in dogs with small intestinal disease. J Am Vet Med Assoc. 1990;196:91–95.
- Allenspach K, Steiner JM, Shah BN, Berghoff N, Ruaux C, Williams DA, Blum JW, Gaschen F. Evaluation of gastrointestinal permeability and mucosal absorptive capacity in dogs with chronic enteropathy. Am J Vet Res. 2006;67(3):479-83.
- Hall EJ, Batt RM. Urinary excretion by dogs of intravenously administered simple sugars. Res Vet Sci.1996;60:280–282.
 by Multimédica
by Multimédica