Evaluación laboratorial del fallo renal en perros y gatos
Resumen breve
La enfermedad renal se refiere a la presencia de cambios estructurales o funcionales que afectan a uno o ambos riñones. El fallo renal es la enfermedad renal que va acompañada de una pérdida de la función de excreción de los productos de desecho proteicos, que se suele manifestar con la elevación plasmática de la urea y/o la creatinina junto a una amplia variedad de signos clínicos1.Índice de contenidos
Introducción
La enfermedad renal se refiere a la presencia de cambios estructurales o funcionales que afectan a uno o ambos riñones. El fallo renal es la enfermedad renal que va acompañada de una pérdida de la función de excreción de los productos de desecho proteicos, que se suele manifestar con la elevación plasmática de la urea y/o la creatinina junto a una amplia variedad de signos clínicos1.
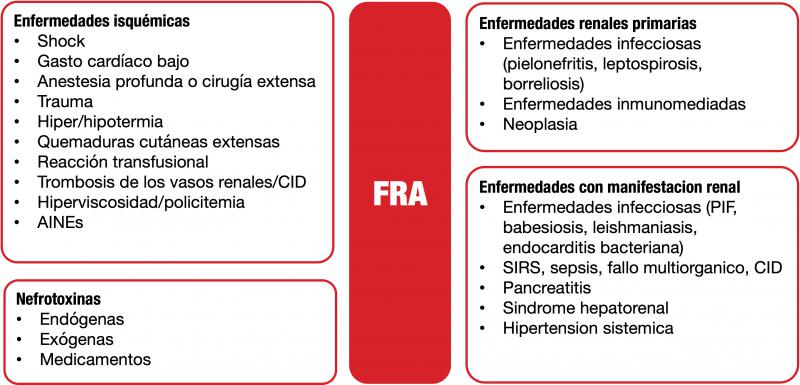
Cuando el fallo renal es agudo, hay cierta capacidad de recuperación de la función renal, considerándose potencialmente reversible, si bien esto dependerá de la capacidad de reserva funcional renal y de si la causa primaria es identificada (Figura 1) y tratada2. Sin embargo, algunos pacientes con fallo renal agudo progresan a fallo renal crónico3.
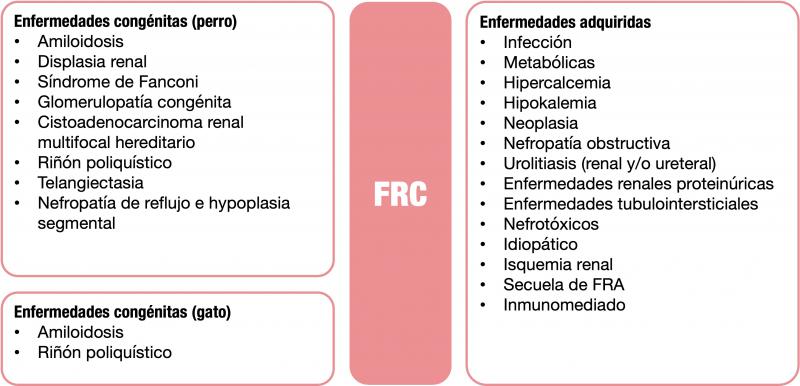
Son muchas las enfermedades, renales y no renales, que pueden dar lugar a fallo renal crónico (Figura 1). Éste se caracteriza por la pérdida irreversible de más del 75 % de las nefronas e hipertrofia de las nefronas restantes, lo que a su vez conlleva al desarrollo de hipertensión glomerular, posteriormente glomeruloesclerosis y finalmente la pérdida de más nefronas y fibrosis4. A pesar de que se trata de una enfermedad progresiva, suele presentar una evolución lenta a lo largo de meses o años, pudiendo los pacientes tener una buena calidad de vida sobre todo si se instauran medidas terapéuticas tempranas que enlentezcan la progresión.
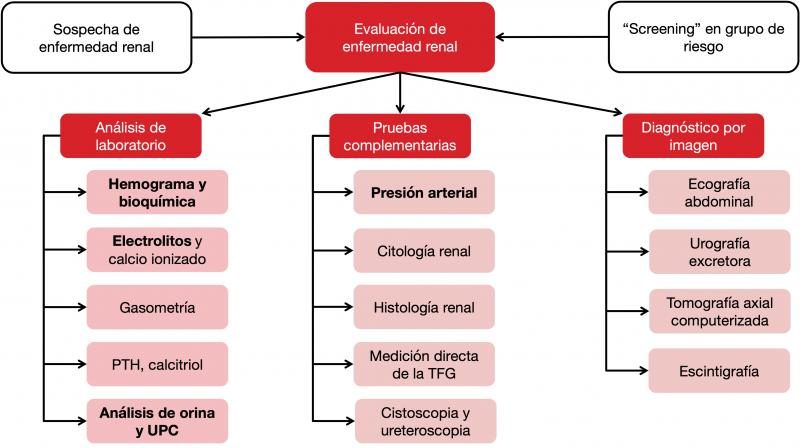
En muchas ocasiones la sintomatología que acompaña al fallo renal pasa desapercibida o es inespecífica. Algunas veces puede acompañar a otras enfermedades como el hipertiroidismo felino o la pancreatitis aguda. Aunque este artículo se centrará en pruebas analíticas, cabe destacar la importancia de otras pruebas diagnósticas como la medición de la presión arterial, diagnóstico por imagen5 y citología6,7 e histología renales8-10. En la Figura 2 se incluyen las pruebas diagnósticas que se pueden utilizar cuando se evalúa el fallo renal en perros y gatos.
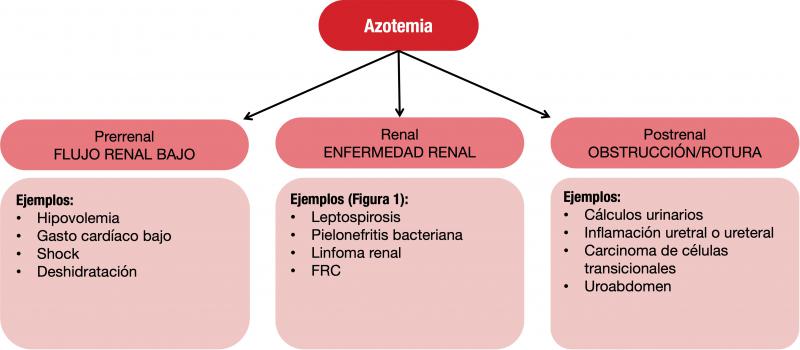
El hallazgo más común en el fallo renal es la elevación de urea y creatinina en sangre se conoce como azotemia, pudiendo tener un origen prerrenal, renal o postrenal (Figura 2) dependiendo del mecanismo que la cause.
Analítica sanguínea
Hemograma
En el hemograma se puede encontrar anemia. El fallo renal crónico puede cursar con un déficit en la producción de eritropoyetina dando lugar a una anemia no regenerativa, de leve a moderada, normocítica y normocrómica. En gatos, la presencia de anemia se considera un factor pronóstico negativo en el fallo renal crónico11. Además, en estadios avanzados de fallo renal crónico, los pacientes pueden desarrollar una gastropatía urémica (más común en perros que en gatos) que causaría sangrado gastrointestinal más o menos severo que, en ausencia de un déficit de eritropoyetina, podría dar lugar a una anemia regenerativa.
Ciertos tumores renales (linfoma, carcinoma), quistes renales, pielonefritis o hidronefrosis pueden provocar un aumento de la producción de eritropoyetina y por tanto eritrocitosis.
En casos de infecciones como pielonefritis bacterianas, borreliosis, leptospirosis o incluso cistitis bacterianas, puede observarse una neutrofilia (con o sin neutropenia previa) en el hemograma. Hay que tener en cuenta que un recuento absoluto de neutrófilos dentro del intervalo de referencia no excluye una infección urinaria o en otro sistema.
Bioquímica
En el perfil bioquímico se pueden encontrar varias anomalías dependiendo de la causa del fallo renal, siendo la más frecuente una elevación de la creatinina, urea y fósforo (ver tasa de filtración glomerular y metabolismo del calcio y fósforo).
La albúmina puede estar disminuida en enfermedades inflamatorias o infecciosas (estando acompañada en este caso de hiperglobulinemia), en enfermedades glomerulares (nefropatía perdedora de proteína) o en fallo renal crónico. El colesterol puede aparecer elevado en el síndrome nefrótico. Otras alteraciones en los parámetros bioquímicos no son típicas de la enfermedad renal, pero pueden ayudar a descartar otras causas de azotemia o diagnósticos diferenciales.
Electrolitos
La hipernatremia puede estar asociada a fallo renal debido a la pérdida de fluido hipotónico, como consecuencia por ejemplo de la poliuria, siendo sin embargo más frecuente en la diuresis postobstructiva. Dentro de las enfermedades renales que causan hiponatremia se incluyen el síndrome nefrótico y la enfermedad renal avanzada12.
Los niveles de potasio pueden aparecer elevados o disminuidos en el fallo renal. La hiperkalemia está causada por alteración de la excreción renal de potasio, el aumento del consumo de potasio y la redistribución del potasio del espacio intracelular al extracelular. En base a esto, dentro de las enfermedades renales que causan hiperkalemia nos encontramos todas aquellas patologías que cursen con fallo renal anúrico u oligúrico, obstrucción renal y uroabdomen. La presencia de acidosis metabólica por aniones inorgánicos puede causar también hiperkalemia. Por el contrario, dentro de las enfermedades renales que con mayor frecuencia causan hipokalemia son las que cursan con fallo renal crónico, diuresis post-obstructiva, así como la acidosis tubular renal y la miopatía hipokalémica del gato Burmés12. Debido a que no sólo las enfermedades renales o del tracto urinario pueden causar desequilibrios en los niveles de potasio, la ausencia de otros hallazgos que indiquen enfermedad renal, hace que debamos considerar también otros diagnósticos diferenciales.
Metabolismo mineral
Los riñones juegan un papel fundamental en la regulación del metabolismo del calcio y del fósforo por lo que el fallo renal, ya sea agudo o crónico, puede provocar desequilibrios del calcio y fósforo en sangre.
El fósforo es filtrado a nivel glomerular y posteriormente reabsorbido por los túbulos renales, por lo que cuando disminuye la TFG, se elevan los niveles de fósforo en sangre. Esto estimula la producción de PTH y FGF-23 (fibroblast growth factor-23), inhibiendo la reabsorción de fósforo por los túbulos renales. Según avanza la enfermedad renal, la cantidad de fósforo filtrada se reduce de manera proporcional a la bajada de la TFG. La hiperfosfatemia puede ocurrir tanto en el fallo renal crónico como agudo, pero en el crónico puede cursar con hipertrofia de las glándulas paratiroideas13 y desmineralización del hueso, especialmente en gatos14. La monitorización del nivel de fósforo en sangre es una parte esencial del manejo del fallo renal crónico, ya que varios estudios han confirmado que la hiperfosfatemia tiene un efecto negativo en la morbilidad y mortalidad de esta enfermedad tanto en la especie canina como felina11,15,16.
El calcio total (suma del calcio ionizado, complejos de calcio y el calcio unido a proteínas) suele estar elevado o normal en la enfermedad renal debido a la formación de complejos de calcio con los ácidos orgánicos e inorgánicos retenidos (citrato, fosfato y sulfato). Este parámetro puede usarse para estimar el riesgo de mineralización de los tejidos blandos usando la siguiente fórmula: Ca (mg/dL) x P (mg/dL)17. Cuando el producto es mayor o igual a 60, existe riesgo de mineralización de los tejidos blandos, debiendo instaurarse un tratamiento para ajustar este desequilibrio.
La determinación de calcio ionizado es el método de elección para determinar si la hipercalcemia es el problema principal o se debe a enfermedad renal intrínseca. En pacientes con enfermedad renal el calcio ionizado suele estar normal o disminuido, mientras que el aumento del calcio ionizado es más probable que se deba a otro proceso patológico simultáneo o primario. Si la hipercalcemia pasa inadvertida y se mantiene de manera prolongada, podría causar daño renal, por lo que es posible encontrar hipercalcemia y fallo renal crónico de manera simultánea. Un estudio reciente encontró que en gatos con FRC la hipercalcemia ionizada es más frecuente de lo que se pensaba18.
La hormona paratiroidea (PTH) se produce en las glándulas paratiroideas y su secreción está regulada por la concentración del calcio ionizado y la vitamina D. La medición de esta hormona es relevante cuando hay hipercalcemia ionizada para decidir si ésta se debe a fallo renal crónico o a otras patologías (Tabla 1). En el fallo renal crónico, la PTH puede estar normal o aumentada.
| Tabla 1. Parámetros bioquímicos en las enfermedades más comunes que afectan al metabolismo del calcio y fósforo (PTH:hormona paratiroidea, PTHrp: PTH related-protein, ↑: elevado, ↓: disminuido, N: normal). |
| Parámetro | Calcio total | Calcio ionizado | Fósforo | PTH | PTHrp | Calcitriol |
| FRC | ↑/N | ↑/N | ↑/N | ↑/N | ↓ | ↓ |
| Hiperparatiroidismo primario | ↑/N | ↑ | ↓/N | ↓ | ↑/N | N |
| Hipoparatiroidismo primario | ↓/N | ↓ | ↑/N | ↓/N | ↓ | N |
| Hipercalcemia idiopática | ↑/N | ↑ | N | ↓/N | ↓ | N |
| Neoplasia | ↑/N | ↑/N | ↓ | ↓/N | ↑/N | ↓/N |
| Hipervitaminosis D | ↑/N | ↑ | ↑/N | ↓/N | ↓ | ↑ |
| Hipovitaminosis D | ↓/N | ↓ | ↓ | ↑/N | ↓ | ↓ |
Gasometría
La gasometría venosa y arterial es una herramienta útil como apoyo en el diagnóstico de muchas enfermedades metabólicas y respiratorias. Hoy en día, estas pruebas se pueden realizan en la clínica siendo fácilmente accesibles. Respecto a la enfermedad renal, la gasometría venosa suele mostrar una acidosis metabólica. Algunos ejemplos de enfermedades renales que causan acidosis metabólica son la acidosis tubular renal, la intoxicación por etilenglicol y la acidosis urémica. Debido a que la acidosis metabólica es un hallazgo común a muchas otras patologías, los resultados de la gasometría deben interpretarse siempre en el contexto clínico del paciente19.
La alcalosis metabólica también se puede encontrar en la enfermedad renal, pero se trata de un desequilibrio menos común. Puede ocurrir con la administración de quelantes de fósforo, o con el empleo de bicarbonato oral para corregir la hiperfosfatemia y el déficit de bicarbonato, respectivamente19.
Esta prueba diagnóstica también se puede utilizar para monitorizar el tratamiento de algunas enfermedades renales19.
Tasa de filtración glomerular
Los riñones tienen varias funciones metabólicas importantes como la filtración glomerular, mantenimiento de la barrera glomerular, función tubular, equilibrio de fluidos corporales, producción y regulación de algunas hormonas como el calcitriol y la eritropoyetina y el control de la presión arterial. A pesar de la relevancia de todas estas funciones renales, la TFG se considera el mejor indicador de la función renal. Sin embargo, es posible tener enfermedad renal con una TFG normal20.
La TFG puede ser estimada de manera indirecta mediante varios biomarcadores renales: urea, creatinina, SDMA (symmetric dimethylarginine) o métodos directos (Tabla 2). Los indicadores indirectos de la TFG se acumulan en sangre cuando la TFG disminuye. La principal limitación de estos indicadores es que les lleva tiempo llegar a un equilibrio y pueden seguir aumentando durante unos días a pesar de una mejora de la TFG. También hay que considerar que hay una variabilidad diaria de los valores. Para evitar errores en la interpretación debido a la variabilidad entre laboratorios, se aconseja realizar las mediciones seriadas en la misma máquina20.
| Tabla 2. Limitaciones de los parámetros directos (tasa de aclaramiento urinario, tasa de aclaramiento en plasma, escintigrafía) e indirectos (urea, creatinina, SDMA) de medición de la tasa de filtración glomerular. |
| Parámetro | Limitaciones | Factores que afectan su valor |
| Urea | Variación diaria de los niveles Reabsorbida por los túbulos renales | Ayuno (disminuye) Contenido proteico de la dieta Hemorragia gastrointestinal (aumenta) Función hepática reducida (disminuye) Diuresis (disminuye) Hipertiroidismo (disminuye) |
| Creatinina | Variación diaria de los niveles (<0.4 mg/dL o 35 umol/L) Relación curvilínea con la TFG | Ingesta reciente de comida proteica (aumenta) Pérdida de masa muscular (disminuye) Hipertiroidismo (disminuye) |
| SDMA | Variación diaria de los niveles (<5.98ug/dL) No hay rangos de referencia en animales >1 año Muy alta sensibilidad a la detección de bajada de TFG | Galgos (aumenta, máximo 19.9 ug/dL21) Alta carga tumoral (aumenta) Gatos con diabetes mellitus (disminuye) Hipertiroidismo (disminuye22) |
| Tasa de aclaramiento urinario | Rangos de referencia muy amplios Toma de múltiples muestras de orina durante un periodo de tiempo prolongado | Estas pruebas diagnósticas estarán afectadas por la calidad de la técnica y laboratorio en el que se realicen las mediciones del marcador. |
| Tasa de aclaramiento en plasma | Rangos de referencia muy amplios | Estas pruebas diagnósticas estarán afectadas por la calidad de la técnica y laboratorio en el que se realicen las mediciones del marcador. |
| Escintigrafía | Rangos de referencia muy amplios Requiere instalaciones y equipamiento especializado Puede requerir sedación del paciente | Esta prueba puede verse afectada por la experiencia en la interpretación de las imágenes. |
Dentro de los marcadores directos de la TFG se incluyen la prueba de aclaramiento urinario, prueba de aclaramiento plasmático y la escintigrafía renal. Estas pruebas diagnósticas están indicadas en aquellos pacientes no azotémicos en los que se sospecha de enfermedad renal y para determinar la función renal antes de administrar medicamentos nefrotóxicos. La escintigrafía permite además predecir el riesgo de fallo renal después de la nefrectomía en pacientes con enfermedad renal unilateral ya que permite evaluar la TFG en cada riñón por separado. Sin embargo, una gran limitación a la hora de interpretar los resultados de este tipo de pruebas es que los rangos de referencia son muy amplios y dependen del peso del paciente. Es quizá de mayor valor diagnóstico evaluar los cambios en la TFG más que los valores absolutos. Estas pruebas diagnósticas no son aptas para la evaluación rutinaria de los pacientes con fallo renal20.
Urea
La urea se sintetiza en el hígado a partir del amonio, que es un producto de la desaminación del exceso de aminoácidos de la dieta. La urea se filtra libremente a través del glomérulo, pero una gran parte es reabsorbida a nivel tubular. La reabsorción tubular aumenta cuando el flujo tubular es bajo (p. ej., en la deshidratación). Por tanto, sus niveles en sangre no están limitados a la TFG sino que también a factores como el ayuno, ingesta de proteína, hemorragia gastrointestinal, función hepática, diuresis e hipertiroidismo por lo que su valor como marcador de la TFG es limitado. Sin embargo, hay una buena correlación entre los niveles de urea en sangre y los síntomas clínicos causados por la uremia que acompaña al fallo renal avanzado20.
Creatinina
La creatinina es un producto del catabolismo de la fosfocreatina, que es una molécula acumuladora de energía en el músculo esquelético y la creatina. Por tanto, los niveles de creatinina dependen de la masa muscular del individuo. Por ejemplo, razas de perro como los galgos, que naturalmente tienen una masa corporal elevada, suelen tener de manera fisiológica, unos niveles de creatinina más elevados que otros animales de un tamaño similar. En animales que, por diferentes razones, han sufrido una pérdida de masa muscular, la creatinina puede ser normal en presencia de fallo renal crónico menos avanzado. El ejemplo clásico de la situación de tener valores normales de la creatinina con FRC es un gato con hipertiroidismo. Esta enfermedad causa, entre otras cosas, un estado catabólico que disminuye la masa muscular y aumenta la TFG por efecto directo de las hormonas tiroideas y el resultado final puede ser un valor normal de la creatinina en presencia de FRC. Cuando se consigue alcanzar el eutiroidismo con el tratamiento adecuado, el gato recupera la masa muscular y se normaliza la TFG (disminuye) por lo que se pone de manifiesto el FRC que existía antes del tratamiento. La ingesta reciente de una comida cárnica puede también incrementar levemente los valores de la creatinina por lo que siempre se recomienda medir este parámetro en ayunas20.
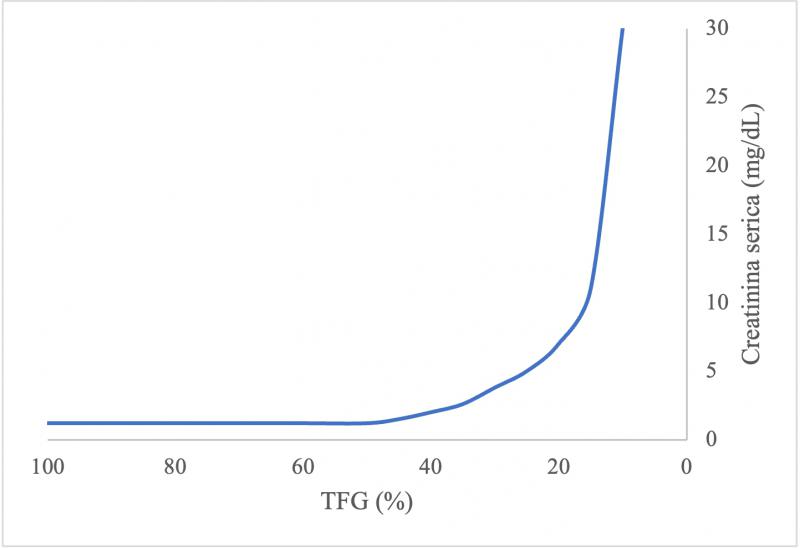
Otra limitación del uso de la creatinina como indicador de la TFG es su correlación curvilínea y acusada con la TFG (Figura 4) por lo que sólo cuando hay una pérdida de la TFG de más del 50 % o una pérdida de entre el 60-75 % de las nefronas, la creatinina empieza a elevarse21.
SDMA
La SDMA se produce en todas las células del cuerpo a partir de la metilación de residuos de arginina. Se considera un marcador más sensible y temprano de disminución de la tasa de filtración glomerular que la creatinina sérica (unos 10 meses antes en perros y unos 17 meses antes en gatos), ya que se excreta de forma exclusiva a través del riñón sin ser metabolizada. Además, la SDMA aumenta a partir de una reducción de aproximadamente del 25-30 % de la TFG, siendo independiente de la masa corporal21.
A pesar de no estar altamente influenciada por factores no relacionados con la TFG, varios estudios recientes han encontrado ciertas enfermedades no renales que pueden afectar el resultado de este parámetro (Tabla 3). Además, los rangos de referencia de los laboratorios sólo se han medido en perros y gatos mayores de un año de edad por lo que la interpretación de la SDMA en cachorros y gatitos es limitada. La SDMA también tiene utilidad diagnóstica en la enfermedad aguda renal21.
El principal problema de la SDMA es la alta sensibilidad a la hora de detectar bajadas de la TFG lo que conlleva la dificultad de decidir si tiene repercusiones clínicas y si hace falta tomar medidas o no ante esa bajada. Tampoco indica si la disminución de la TFG es o no irreversible, ni es específica de ninguna enfermedad renal. La SDMA puede estar aumentada en un momento determinado y no siempre culminar, por ejemplo, con fallo renal crónico. Es importante recalcar que la SDMA y la creatinina son parámetros que indican el estado de la filtración glomerular pero no dan información sobre el estatus del calcio y fósforo (CKD-mineral and bone disorder) ni sobre la etiología de la disminución de la TFG21.
Prueba de aclaramiento plasmático
La prueba de aclaramiento urinario ya no se utiliza a nivel clínico debido a la limitada practicidad del proceso (colocación de un catéter urinario, recogida de orina durante un periodo de 24 horas) y se ha reemplazado por la prueba de aclaramiento de determinadas substancias administradas parenteralmente. La técnica que está más disponible en la clínica es la prueba de aclaramiento plasmático. En esta prueba, se inyectan unos marcadores (creatinina exógena o el medio de contraste iohexol). En la Tabla 3 se resumen las principales ventajas y desventajas del uso de los marcadores más comúnmente utilizados. Hay otros marcadores con el gadolinium23,24 o el iodixanol25-27 que también se utilizan para la medición de la TFG y que parece que el riesgo de producir nefrotoxicidad es más bajo aunque la precisión del gadolinium para estimar la TFG en gatos parece que no es suficiente para usarlo clínicamente24. La mayor parte de los laboratorios ofrecen los resultados en ml/min/kg sin necesidad de realizar los cálculos pertinentes. También se puede el utilizar el iohexol para la determinación de la TFG por medio de la tomografía computerizada axial seriada28.
| Tabla 3. Ventajas y desventajas de cada uno de los marcadores para la medición de la tasa de filtración glomerular. |
| Marcador de TFG | Ventajas | Desventajas |
| Inulina | Gold-standard” para la TFG | Ni la inulina ni su análisis están disponibles comercialmente Caro |
| Creatinina exógena | Medición en todos los laboratorios | Las muestras se toman durante un periodo de tiempo más largo (toda la orina producida en 24 horas) No hay disponible creatinina exógena de grado médico |
| Iohexol | Duración más corta de la prueba Producto fácil de conseguir | Medición en laboratorios especializados Riesgo (bajo) de reacciones idiosincráticas (nefrotoxicidad, reacción anafiláctica) |
| Radiotrazadores | Evaluación de la TFG individual o global | Permisos e instalaciones especializadas Son necesarias 24 horas de aislamiento después de la prueba |
Escintigrafía
Otra técnica directa para medir la TFG es la escintigrafía. En esta técnica se inyecta una sustancia radiactiva y se mide su tasa de acumulación en el parénquima renal utilizando una cámara gamma. La ventaja de esta técnica es que permite valorar de manera individual la TFG en cada riñón. Esto puede ser relevante para aquellos pacientes en los que se planea realizar una nefrectomía y se quiere estimar la TFG de cada riñón de manera independiente. Las principales limitaciones de esta prueba son la utilización de material radioactivo y sus consiguientes regulaciones especiales, así como la necesidad de tener unas instalaciones y equipamiento especiales para su realización. El paciente debe a su vez permanecer en aislamiento durante 24 horas hasta que los niveles de radiación sean seguros para el ser humano29.
Análisis de orina
El análisis de orina es una herramienta indispensable y económica a la hora de evaluar el fallo renal en perros y gatos. Debe incluir la tira de orina, el examen del sedimento urinario, medición cuantitativa de la proteinuria y la medición de la densidad urinaria por medio del refractómetro. El cultivo de orina está indicado en aquellos casos en los que se sospecha una infección urinaria.
Las muestras de orina deben analizarse siempre a temperatura ambiente e inmediatamente tras su recolección, idealmente dentro de los primeros sesenta minutos tras la recogida. Si la muestra se analiza más tarde, se espera que se produzcan los siguientes cambios: las células y cilindros pueden degenerar, los cristales se pueden disolver o precipitar, los niveles de glucosa, cetonas y bilirrubina pueden disminuir y las bacterias se pueden multiplicar30.
A la hora de evaluar la tira de orina siempre se deben mirar los tiempos estipulados por el fabricante. El pH se debe medir en una muestra de orina fresca para evitar mediciones erróneas al cambiar el pH en muestras de orina más viejas. El valor del pH puede orientar a la hora de estimar el tipo de cálculo urinario si hubiera alguno en el sistema urinario. La densidad urinaria dada por la tira de orina no es fiable y se debe corroborar con un refractómetro. Es posible encontrar glucosuria en ausencia de hiperglucemia o diabetes mellitus en casos de disfunción tubular renal (p. ej., síndrome de Fanconi). El reactivo marcado como “LEU” no tiene valor diagnóstico en perros y gatos.
En la especie canina es importante destacar que si en la tira de orina hay un resultado de proteína 1+ y la densidad urinaria es ≤ 1.012, la proteinuria deberá ser evaluada por medio de un ratio urinario proteína:creatinina (ratio UPC) mientras que si hay 1+ de proteína pero la densidad urinaria es >1.012 es muy improbable que haya proteinuria31. En gatos, se debe realizar siempre UPC independientemente del valor de la tira de orina y la densidad32. El ratio UPC refleja de manera precisa la cantidad de proteína excretada durante 24 horas y es una herramienta imprescindible en el diagnóstico y monitorización de la enfermedad glomerular. El ratio UPC puede ser medido en una muestra tomada por cistocentesis pero también en una muestra recogida por micción espontánea descartando el primer chorro de orina33,34 o por compresión externa de la vejiga urinaria35.
Un ratio UPC elevado en ausencia de inflamación/infección sí requiere tratamiento específico para la proteinuria mientras que, si es normal, no estará indicado (Tabla 4).
| Tabla 4. Recomendaciones en función del valor del ratio UPC y de la presencia de FRC. |
| Ratio UPC | Recomendación |
| 2 | Investigar y tratar |
| 1-2 | Investigar |
| 0,5-1 (perros) 0,4–1 (gatos) | Sin FRC: Monitorizar Con FRC: investigar y tratar |
| < 0,5 (perros) < 0,4 (gatos) | Valor normal |
La densidad urinaria permite saber si los riñones siguen manteniendo la capacidad de concentración, aunque se debe evitar el concepto de “normal” o “anormal” al referirse a este parámetro. Un perro o gato sano puede tener una densidad urinaria desde 1.008 a más de 1.035 en gatos y 1.030 en perros si bien lo más frecuente es que se encuentre por encima de 1.008. En presencia de un valor elevado de SDMA o de creatinina séricas, un valor de densidad urinaria entre 1.008 y 1.034 en gatos y 1.029 en perros podría indicar fallo renal. Una densidad urinaria <1.008 (hipostenuria), casi excluye fallo renal ya que el riñón aún tiene capacidad de alterar la densidad urinaria30. En el hipoadrenocorticismo, puede haber azotemia con un valor entre 1.008 y 1.012 (isostenuria) y no existir una enfermedad renal primaria. Algunos gatos con fallo renal crónico pueden conservar la capacidad de concentración urinaria36.
Para realizar un cultivo en orina, la muestra ideal es la tomada por cistocentesis para evitar la contaminación con bacterias del tracto urinario inferior o genital. Un cultivo positivo en una muestra tomada por micción espontánea o recogida de un lecho no absorbente no se debe considerar como fiable. Es importante también, evaluar el sedimento urinario junto con el cultivo bacteriano cuantitativo a la hora de tomar decisiones terapéuticas. Las directrices más recientes en el tratamiento de las infecciones del tracto urinario recomiendan no tratar con antibióticos aquellos pacientes con bacteriuria (confirmado en cultivo bacteriano) pero sin síntomas de infección urinaria37.
Diferenciación entre fallo renal crónico y agudo
Todas las pruebas diagnósticas mencionadas tienen como objetivo identificar ciertos hallazgos que permitan discernir entre fallo renal agudo o crónico (Tabla 5) y también identificar enfermedades o alteraciones que hayan desencadenado el fallo renal. El tratamiento de algunas de estas enfermedades y alteraciones pueden potencialmente revertir el fallo renal agudo y mejorar el pronóstico de algunos pacientes con fallo renal crónico.
| Tabla 5. Hallazgos clínicos y laboratoriales que pueden ayudar a diferenciar entre fallo renal agudo y crónico, y algunos diagnósticos diferenciales más comunes (TFG: tasa de filtración glomerular; N: normal; ↑ elevado, ↓disminuido). |
| Parámetro | FRC | FRA | Comentarios/ Diagnóstico diferencial |
| Hallazgos clínicos | |||
| Apetito | ↓/N | ↓ | Algunos pacientes con FRC tienen una sintomatología que pasa desapercibida y pueden sufrir un deterioro agudo de la enfermedad, si por ejemplo, desarrollan una pielonefritis bacteriana u otras condiciones que desencadenan FRA. Además, en general, los pacientes con FRC toleran mejor niveles altos de creatinina comparados con pacientes con FRA. |
| Nivel de actividad | ↓/N | ↓ | (idem) |
| Fiebre | N | S/N | (idem) |
| Síntomas gastrointestinales | S/N | S/N | (idem) |
| Presión arterial | ↑/N | ↑/N/↓ | (idem) |
| Hallazgos laboratoriales | |||
| Hematocrito | ↓/N/↑ | N |
|
| Neutrófilos | N | ↑/N/↓ |
|
| Creatinina | ↑/N | ↑ |
|
| Urea | N/↑ | N/↑ |
|
| SDMA | ↑ | ↑ |
|
| Albúmina | N/↓ | N/↓ |
|
| Colesterol | ↑/N | N |
|
| Sodio | N/↑/↓ | N/↑ |
|
| Potasio | N/↓ | N/↑ |
|
| Fósforo | N/↑ | N/↑ |
|
| Calcio total | N/↑/↓ | N |
|
| Calcio ionizado | N/↓/↑ | N/↓ |
|
| PTH | N/↑ | N |
|
| Eritropoyetina | N/↓ | N |
|
| USG | Isotenuria | Hiperestenuria Isostenuria Hipostenuria |
|
| Proteinuria | N/↑ | N/↑ |
|
| Sedimento activo | N/S | N/S |
|
| Cultivo positivo | N/S | N/S |
|
Clasificación IRIS de la enfermedad renal crónica y aguda
El IRIS (International Renal Interest Society) clasifica el fallo renal crónico (Tabla 6) y agudo (Tabla 7) en diferentes estadios en función del nivel de creatinina, y más recientemente, de SDMA en el caso del fallo renal crónico. Esto permite definir los objetivos terapéuticos y de monitorización según el estadio. IRIS recomienda que la clasificación de FRC se haga en función del valor de la creatinina sérica o SDMA, ambas tomadas en al menos dos ocasiones con en el paciente en ayunas, hidratado y clínicamente estable. Después se valora el ratio UPC y la presión sistólica para definir el subestadio (Tabla 6).
Un paciente con una o más de las siguientes anomalías sería clasificado como estadío 1 o 2: una creatinina o SDMA que aumenta sin causa prerrenal, una SDMA persistentemente por encima de 14 ug/L, riñones anormales en el diagnóstico por imagen, proteinuria renal persistente.
| Tabla 6. Estadios del fallo renal crónico en perros y gatos38. |
| Estadio FRC | Creatinina (mg/dL) | SDMA (ug/dL) | |
| 1 | Perro: <1,4 Gato: <1,6 | < 18 | |
| 2 | Perro: 1,4-2,8 Gato: 1,6-2,8 | Perro: 18-35 Gato: 18-25 | |
| 3 | 2,8-5,0 | Perro: 36-54 Gato: 26-38 | |
| 4 | >5,0 | Perro: >54 Gato: >38 | |
| Subestadios de FRC | |||
| UPC | < 0,2 | No proteinúrico | |
| UPC | 0,2 - 0,5 (perro) 0,2 - 0,4 (gato) | Límite proteinúrico | |
| UPC | >0,5 (perro) >0,4 (gato) | Proteinúrico | |
| Presión sistólica (mmHg) | <140 | Normotenso; Mínimo | |
| Presión sistólica (mmHg) | 140-159 | Prehipertenso; Bajo | |
| Presión sistólica (mmHg) | 160-179 | Hipertenso; Moderado | |
| Presión sistólica (mmHg) | ≥180 | Hipertensión severa; Alto | |
| Tabla 7. Estadios del fallo renal agudo en perros y gatos39. AKI: acute kidney injury. |
| Estadio AKI | Creatinina (mg/dL) | |
| 1 | <1,6 | AKI no azotémico (p. ej. oliguria/anuria de más de 6 horas, aumento progresivo no azotémico de la creatinina ≥0.3mg/dL en 48 horas) |
| 2 | 1,7-2,5 | AKI leve (p. ej. oliguria/anuria de más de 6 horas, azotemia progresiva con aumento de la creatinina ≥0.3mg/ dL en 48 horas o aumento de la producción urinaria a > 1ml/kg/h durante 6 horas y/o disminución de la creatinina al valor de referencia en 48 horas) |
| 3 | 2,6-5,0 | AKI moderado a severo (aumento en la severidad de la azotemia y fallo renal funcional) |
| 4 | 5,1-10,0 | (idem) |
| 5 | >10,0 | (idem) |
Bibliografía
- Dibartola S. Clinical Approach and Laboratory Evaluation of Renal Disease. In: SJ E, EC F, editors. Textbook of Veterinary Internal Medicine. 7th ed. Saint Louis: Elsevier Saunders; 2010. p. 1955–69.
- Langston C. Acute Uremia. In: Ettinger SJ, Feldman EC, editors. Textbook of Veterinary Internal Medicine. 7th ed. Saint Louis: Elsevier Saunders; 2010. p. 1969–85.
- Cowgill LD, Polzin DJ, Elliott J, Nabity MB, Segev G, Grauer GF, et al. Is Progressive Chronic Kidney Disease a Slow Acute Kidney Injury? Vol. 46, Veterinary Clinics of North America - Small Animal Practice. W.B. Saunders; 2016. p. 995–1013.
- Polzin D. Chronic Kidney Disease. In: Ettinger SJ, Feldman EC, editors. Textbook of Veterinary Internal Medicine. 7th ed. Saint Louis: Elsevier Saunders; 2010. p. 1990–2021.
- Rademacher N. Diagnostic Imaging of the Urinary Tract. Vet Clin North Am - Small Anim Pract [Internet]. 2019;49(2):261–86. Available from: https://doi.org/10.1016/j.cvsm.2018.10.006
- Borjesson DL. Renal cytology. Vet Clin North Am Small Anim Pract. 2003 Jan;33(1):119–34.
- Wycislo KL, Piech TL. Urinary Tract Cytology. Vet Clin North Am - Small Anim Pract [Internet]. 2019;49(2):247–60. Available from: https://doi.org/10.1016/j.cvsm.2018.11.002
- Vaden SL. Renal biopsy: methods and interpretation. Vet Clin North Am Small Anim Pract [Internet]. 2004 Jul;34(4):887–908. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15223207
- Lees GE, Cianciolo RE, Clubb FJ. Renal Biopsy and Pathologic Evaluation of Glomerular Disease. Top Companion Anim Med [Internet]. 2011;26(3):143–53. Available from: http://dx.doi.org/10.1053/j.tcam.2011.04.006
- Subgroup ICGSGD, Littman MP, Daminet S, Grauer GF, Lees GE, Dongen AM van. Consensus Recommendations for the Diagnostic Investigation of Dogs with Suspected Glomerular Disease. J Vet Intern Med. 2013;27:19–26.
- Chakrabarti S, Syme HM, Elliott J. Clinicopathological Variables Predicting Progression of Azotemia in Cats with Chronic Kidney Disease. J Vet Intern Med. 2012;26(2):275–81.
- Skelly B. Electrolyte Imbalances. In: Villiers E, Ristic J, editors. BSAVA Manual of Canine and Feline Clinical Pathology. 3rd Ed. Quedgeley: British Small Animal Veterinary Association; 2016. p. 142–64.
- Wisner ER, Nyland TG. Ultrasonography of the Thyroid and Parathyroid Glands. Vet Clin North Am - Small Anim Pract. 1998 Jul 1;28(4):973–91.
- Segev G, Meltzer H, Shipov A. Does Secondary Renal Osteopathy Exist in Companion Animals? Vet Clin North Am - Small Anim Pract [Internet]. 2016;46(6):1151–62. Available from: http://dx.doi.org/10.1016/j.cvsm.2016.06.006
- Geddes RF, Finch NC, Syme HM, Elliott J. The role of phosphorus in the pathophysiology of chronic kidney disease. J Vet Emerg Crit Care. 2013;23(2):122–33.
- King JN, Tasker S, Gunn-Moore DA, Strehlau G. Prognostic factors in cats with chronic kidney disease. J Vet Intern Med. 2007;21(5):906–16.
- Peterson ME, Fluegeman K. Cholecalciferol. Top Companion Anim Med. 2013;28(1):24–7.
- Hendrik Nicolaas van den Broek D, Geddes RF, Lötter NS, Chang Y-M, Elliott J, Jepson RE, et al. Ionized hypercalcemia in cats with azotemic chronic kidney disease (2012-2018). J Vet Intern Med [Internet]. 2022; Available from: http://iris-kidney.com/guidelines/staging.html
- Flaherty D, Blackwood L. Blood gas analysis and acid-base disorders. In: Villiers E, Ristic J, editors. BSAVA Manual of Canine and Feline Clinical Pathology. 3rd Ed. Quedgeley: Elsevier Saunders; 2016. p. 165–82.
- Syme HM. Laboratory Evaluation of Renal Disorders. In: Villiers E, Ristic J, editors. BSAVA Manual of Canine and Feline Clinical Pathology2. 3rd ed. Quedgeley: Elsevier Saunders; 2016. p. 219–36.
- Sargent HJ, Elliott J, Jepson RE. The new age of renal biomarkers: does SDMA solve all of our problems? J Small Anim Pract. 2021;62(2):71–81.
- Peterson ME, Varela F V., Rishniw M, Polzin DJ. Evaluation of Serum Symmetric Dimethylarginine Concentration as a Marker for Masked Chronic Kidney Disease in Cats With Hyperthyroidism. J Vet Intern Med. 2018;32(1):295–304.
- Nolan BG, Ross LA, Vaccaro DE, Groman E V., Reinhardt CP. Estimation of glomerular filtration rate in dogs by plasma clearance of gadolinium diethylenetriamine pentaacetic acid as measured by use of an ELISA. Am J Vet Res. 2009;70(4):547–52.
- Sox EM, Chiotti R, Goldstein RE. Use of gadolinium diethylene triamine penta-acetic acid, as measured by ELISA, in the determination of glomerular filtration rates in cats. J Feline Med Surg [Internet]. 2010 Aug [cited 2010 Sep 6];12(10):738–45. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20724186
- Katayama R, Saito J, Katayama M, Yamagishi N, Yamashita T, Kato M, et al. Simplified procedure for the estimation of glomerular filtration rate following intravenous administration of iodixanol in cats. Am J Vet Res. 2012;73(9).
- Katayama M, Sasaki A, Takayasu M, Shimamura S, Uzuka Y, Murayama I, et al. Application of the single blood sample method to estimate feline glomerular filtration rate in a clinically relevant situation. J Feline Med Surg. 2013 Dec;15(12):1119–22.
- Sasaki Y, Iwama R, Shimamura S, Katayama M, Uzuka Y, Yabe K, et al. Estimation of glomerular filtration rate in dogs by a single-blood sample method involving iodixanol. Am J Vet Res. 2015;76(9):828–35.
- Jinhwa Chang, DVM, PhD; Sejoon Ahn, DVM, PhD; Sooyoung Choi, DVM, MS; Heechun Lee, DVM, PhD; Dongwoo Chang, DVM, PhD; Hojung Choi, DVM, PhD; Youngwon Lee D. Evaluation of glomerular filtration rate by use of dynamic computed tomography and Patlak analysis in clinically normal cats. Am J Vet Res. 2011;72.
- Kerl ME, Cook CR. Glomerular filtration rate and renal scintigraphy. Clin Tech Small Anim Pract. 2005;20(1 SPEC.ISS.):31–8.
- Skeldon N, Ristic J. Urinanalysis. In: Villiers E, Ristic J, editors. BSAVA Manual of Canine and Feline Clinical Pathology. 3rd Ed. Quedgeley: British Small Animal Veterinary Association; 2016. p. 183–218.
- Zatelli A, Paltrinieri S, Nizi F, Roura X, Zini E. Evaluation of a urine dipstick test for confirmation or exclusion of proteinuria in dogs. J Am Vet Med Assoc. 2010;236(4):439–439.
- Pérez-Accino J, Feo Bernabe L, Manzanilla EG, Puig J. The utility of combined urine dipstick analysis and specific gravity measurement to determine feline proteinuria. J Small Anim Pract. 2020;61(9):541–6.
- Beatrice L, Nizi F, Callegari D, Paltrinieri S, Zini E, Zatelli A. Comparison of urine protein- to-creatinine ratio in urine samples collected by cystocentesis versus free catch in dogs. J Am Vet Med Assoc. 2010;236(11):1221–4.
- Marynissen SJJ, Willems AL, Paepe D, Smets PMY, Picavet P, Duchateau L, et al. Proteinuria in Apparently Healthy Elderly Dogs: Persistency and Comparison Between Free Catch and Cystocentesis Urine. J Vet Intern Med. 2017;31(1):93–101.
- Vilhena HCR, Santos RR, Sargo TJ, Lima TB, Dias SS, Ramiro Pastorinho M, et al. Urine protein-to-creatinine concentration ratio in samples collected by means of cystocentesis versus manual compression in cats. J Am Vet Med Assoc. 2015;246(8):862–7.
- Skeldon N, Ristic J. Urinanalysis. In: Villiers E, Ristic J, editors. BSAVA Manual of Canine and Feline Clinical Pathology. 3rd Ed. Quedgeley: British Small Animal Veterinary Association; 2016. p. 183–218.
- Weese JS, Blondeau J, Boothe D, Guardabassi LG, Gumley N, Papich M, et al. International Society for Companion Animal Infectious Diseases (ISCAID) guidelines for the diagnosis and management of bacterial urinary tract infections in dogs and cats. Vet J [Internet]. 2019;247:8–25. Available from: https://doi.org/10.1016/j.tvjl.2019.02.008
- International Renal Interest Society. IRIS Staging of CKD [Internet]. IRIS Guidelines. 2019 [cited 2022 May 31]. Available from: http://www.iris-kidney.com/guidelines/index.html
- International Renal Interest Society. IRIS Grading of AKI. IRIS Guidel [Internet]. 2016; Available from: http://www.iris-kidney.com/guidelines/grading.html
 by Multimédica
by Multimédica