Evaluación laboratorial de hepatopatías en el perro y el gato
Resumen breve
Las enfermedades del parénquima hepático, la vascularización hepática y el tracto biliar son relativamente comunes en perros y gatos. Debido a que los signos clínicos que acompañan a la enfermedad hepática son bastante inespecíficos, y a que el hígado puede estar involucrado secundariamente a enfermedades de otros órganos, la enfermedad hepática puede pasar fácilmente desapercibida.Índice de contenidos
Resumen
Las enfermedades del parénquima hepático, la vascularización hepática y el tracto biliar son relativamente comunes en perros y gatos. Debido a que los signos clínicos que acompañan a la enfermedad hepática son bastante inespecíficos, y a que el hígado puede estar involucrado secundariamente a enfermedades de otros órganos, la enfermedad hepática puede pasar fácilmente desapercibida. Por lo tanto, después de realizar una anamnesis completa y un examen físico, es fundamental realizar pruebas laboratoriales adicionales. Si no se puede descartar una enfermedad hepática en base a estos exámenes, se necesitan pruebas adicionales para definir el tipo de patología hepática, como pruebas de imagen y el examen de muestras de tejido hepático. El diagnóstico definitivo generalmente depende del examen histopatológico, especialmente para las enfermedades del parénquima hepático. Este artículo revisa las pruebas de laboratorio comúnmente utilizadas para evaluar el sistema hepatobiliar y discute su utilidad, así como sus limitaciones.
Introducción
El hígado es el segundo órgano más grande del cuerpo y realiza aproximadamente 1500 funciones bioquímicas esenciales. Estas diversas funciones incluyen el metabolismo de fármacos; eliminación de toxinas exógenas y endógenas (p. ej., amoniaco); síntesis de sustancias vitales como albúmina y factores de coagulación; metabolismo de proteínas, grasas y carbohidratos; almacenamiento y activación de vitaminas; almacenamiento de glucógeno, triglicéridos y minerales (p. ej., cobre, hierro); activación, conversión, secreción, desactivación y excreción de diversas hormonas; síntesis de sales biliares; conjugación y excreción de bilirrubina en la bilis; entre otras1.
Las enfermedades hepáticas suponen un desafío diagnóstico importante para el clínico veterinario debido a la inespecificidad de los signos clínicos de estos pacientes en los estadios iniciales de la enfermedad. Además, la gran reserva funcional del hígado requiere una marcada pérdida de tejido hepático funcional antes de que se manifiesten los signos clínicos debidos a insuficiencia hepática. Por ello, la aparición de signos relativamente específicos de disfunción hepatobiliar, como ictericia, hipoglucemia, tendencias hemorrágicas, encefalopatía hepática y ascitis, ocurren sólo cuando la enfermedad progresiva agota las reservas hepáticas. Estas enfermedades a menudo permanecen subclínicas durante largos períodos de tiempo y los síntomas pueden ser relativamente leves e inespecíficos2. Rara vez es posible un diagnóstico específico sin la ayuda de una biopsia hepática3. A pesar de estos desafíos, las pruebas de laboratorio juegan un papel importante en el reconocimiento y diagnóstico de la enfermedad hepatobiliar canina y felina4.
Para alcanzar un diagnóstico de enfermedad hepática es necesario un enfoque lógico que tenga en cuenta las características del paciente, la historia clínica y antecedentes, los hallazgos del examen físico, las anomalías bioquímicas y hematológicas, las pruebas de imagen y el muestreo hepático. La evaluación laboratorial del sistema hepatobiliar tiene varios objetivos que incluyen determinar si existe enfermedad hepatobiliar, evaluar la función hepática, definir si la enfermedad hepática es primaria o secundaria, y monitorizar la respuesta a la terapia o la progresión de la enfermedad. La evaluación de la enfermedad hepática requiere la interpretación de datos de patología clínica que reflejen el estado del hígado. Estos datos provienen de los resultados de las pruebas bioquímicas, pero también de los resultados del hemograma y el análisis de orina. Cuando se investigan pacientes con actividad de enzimas hepáticas séricas aumentadas, deben descartarse las enfermedades extrahepáticas. Por otro lado, se debe tener en cuenta que pacientes con pruebas de laboratorio normales pueden tener una enfermedad hepatobiliar significativa. El conocimiento de las variaciones biológicas de los parámetros analizados es importante para la interpretación precisa de los resultados analíticos2,4.
Analítica sanguínea
Las pruebas de laboratorio específicas utilizadas para la evaluación de pacientes con enfermedad hepatobiliar se pueden clasificar en tres grupos: marcadores de daño hepatocelular, marcadores de colestasis y pruebas de diversas funciones hepáticas (captación, conjugación, secreción y síntesis). Otras pruebas complementarias como el hemograma y el urianálisis pueden aportar información sobre la enfermedad y el estado clínico del paciente, pero no aportan información específica de la enfermedad hepática5.
Enzimas hepáticas
Existen numerosas enzimas hepáticas, pero solo cuatro se utilizan habitualmente como biomarcadores de enfermedad hepatobiliar en perros y gatos: alanina aminotransferasa (ALT), aspartato aminotransferasa (AST), fosfatasa alcalina (ALP) y gamma-glutamil transferasa o transpeptidasa (GGT, GGTP). La actividad sérica de las enzimas hepáticas ayuda a identificar, diferenciar y controlar la enfermedad hepática, pero no permite valorar la función hepatocelular. Aunque se considera que el aumento de las actividades de las enzimas hepáticas séricas es sensible, no son específicas de la enfermedad hepática primaria dado que también son producidas por tejidos extrahepáticos. La importancia relativa de estas isoenzimas extrahepáticas varía, pero su liberación extrahepática puede conducir a un aumento de las actividades séricas. Además, la producción de algunas enzimas hepáticas puede ser inducida por ciertas hormonas y fármacos, lo que lleva a un aumento de sus actividades séricas en pacientes sin enfermedad hepática primaria1,2,5,6.
Es importante tener en cuenta que pacientes con enfermedad hepatobiliar significativa pueden tener resultados bioquímicos normales y pacientes sanos pueden tener resultados anormales. Es por esto por lo que, las actividades anormales de las enzimas hepáticas deben interpretarse en el contexto del paciente, los hallazgos del examen físico y el historial clínico, que debe incluir medicamentos anteriores y actuales, exposición ambiental a hepatotoxinas u organismos infecciosos y comorbilidades. Es necesaria la monitorización secuencial de las enzimas para mapear el curso de la enfermedad con especial atención a la duración de la elevación (aguda, crónica), la estabilidad (aumentando, disminuyendo) y el patrón (colestásico, necroinflamatorio, inducido)2. La magnitud de los aumentos de la actividad de las enzimas hepáticas puede ayudar en la evaluación de la gravedad o la extensión de la lesión hepática, pero no debe considerarse como un pronóstico1.
Enzimas hepáticas marcadoras de daño hepatocelular
Las enzimas de daño celular (ALT y AST) aumentan a las 24 - 48 horas tras daño hepatocelular agudo, y esto ocurre en mayor medida si se produce necrosis. Existe una relación directa entre el grado de aumento de las aminotransferasas con el grado de daño hepatocelular, sin embargo, este valor no proporciona un pronóstico preciso. Cuando el daño es agudo la actividad de las aminotransferasas disminuye pasados de 2 a 3 días del daño inicial y se normaliza entre las 2 y 3 semanas. Por el contrario, en las enfermedades crónicas la diminución de estas enzimas puede deberse a una mejoría de la enfermedad o a un empeoramiento con disminución significativa del número de hepatocitos1,2.
- Alanina aminotransferasa (ALT)2,5
La ALT se encuentra en altas concentraciones dentro del citoplasma y las mitocondrias de los hepatocitos caninos y felinos, aunque también está presente en cantidades intracelulares menores en el corazón, riñón y músculo esquelético. Se considera que la actividad de la ALT en suero o plasma es relativamente específica del hígado, pero ocasionalmente puede aumentar debido a una lesión muscular. La correlación con la actividad de la creatinina quinasa (CK) sérica es útil para diferenciar la actividad de ALT de origen muscular de la de origen hepático. La actividad sérica de esta enzima se utiliza como marcador de daño hepatocelular en perros y gatos, y se considera que es el gold standard para evaluar el daño hepatocelular. Los hepatocitos que se dañan rápida e irreversiblemente liberan su contenido citoplásmico, incluida la ALT, al espacio extracelular desde donde puede ingresar a la circulación. La liberación de ALT también puede ocurrir después de una lesión hepatocelular reversible. Sin embargo, no es posible distinguir entre un daño irreversible o reversible basándose únicamente en la evaluación de la actividad de la ALT. Si bien, la lesión reversible o menos extensa generalmente se asocia con cambios de menor magnitud que la lesión celular irreversible o generalizada.
Las posibles causas del daño de la membrana hepatocelular incluyen enfermedades inflamatorias, hipoxia, toxinas, fármacos y neoplasia. También existen varios trastornos extrahepáticos y fármacos que pueden dar lugar a una actividad elevada de la ALT en las primeras etapas del curso de la enfermedad y sin la presencia de una enfermedad hepatocelular primaria significativa (Tabla 1).
La actividad de la ALT sérica aumenta dentro de las 12 horas posteriores a la lesión hepatocelular y alcanzan niveles máximos después de aproximadamente 24 a 48 horas. Se ha informado que la actividad de la ALT en suero o plasma tiene una vida media aproximada de 40 a 61 horas en perros y 3,5 horas en gatos. Por lo tanto, incluso las elevaciones leves en la actividad sérica o plasmática de esta enzima a menudo se consideran clínicamente más relevantes en gatos que en perros. El tiempo que tarda una actividad aumentada de ALT en volver a la línea de base depende de la enfermedad subyacente.
Las pautas generales de los autores para los aumentos en la actividad de la ALT en suero o plasma son que los aumentos de hasta dos veces se pueden volver a controlar a intervalos de 2 semanas durante un máximo de 6 semanas y posiblemente tratarse con hepatoprotectores nutracéuticos. Los aumentos de dos a cinco veces requieren más de un estudio diagnóstico que puede incluir la medición de los ácidos biliares o el amoniaco, así como serología de leptospirosis y/o PCR. Para aumentos superiores a cinco veces, se recomienda un estudio de diagnóstico inmediato. Los aumentos más pequeños sostenidos también pueden requerir un estudio más completo.
| Tabla 1. Posibles causas de actividad sérica elevada de ALT y AST. |
| Origen | Causa |
| Hepático |
|
| Extrahepático |
|
- Aspartato aminotransferasa (AST)1,2
La AST es una enzima que está presente en cantidades marcadas en las mitocondrias de los hepatocitos. En comparación con la ALT, su elevación puede indicar un daño hepatocelular significativo, dado que las mitocondrias no se lesionan tan fácilmente como la membrana celular. La AST tiene una vida media de aproximadamente 12 horas en perros y 1,5 horas en gatos. En consecuencia, la determinación de AST en muestras seriadas a menudo se normalizará antes que la ALT con la resolución de la anomalía hepatocelular. Sin embargo, la AST no es específica del hígado dado que también está presente en cantidades significativas en los miocitos y los glóbulos rojos, así como en el cerebro, los riñones y el corazón. Por lo tanto, la AST se considera menos específica para el hígado que la ALT. Además, es importante tener en cuenta que otros procesos patológicos o fármacos pueden causar niveles elevados de AST sin la presencia de una enfermedad hepatocelular primaria significativa (Tabla 1). Las causas extrahepáticas, como el daño muscular y la hemólisis, pueden causar aumentos considerables en la actividad de AST. Si se observa una elevación de la AST, la CK, la ALT y el hematocrito pueden ser útiles para determinar si el origen es realmente hepático. Por el contrario, no hay causas significativas de una AST disminuida.
Enzimas hepáticas marcadoras de colestasis
La colestasis es una afección hepatobiliar aguda o crónica en la que se altera la formación, secreción o flujo de la bilis. La colestasis generalmente se clasifica como intrahepática o extrahepática, según la ubicación en la que se produce la alteración. Los marcadores bioquímicos de colestasis incluyen los niveles de fosfatasa alcalina (ALP) y gamma-glutamil transferasa (GGT).
- Fosfatasa alcalina (ALP)1,2,5
La ALP está asociada con la membrana celular en múltiples tejidos, incluidos los hepatocitos. Se han identificado varias isoenzimas de ALP en el hígado, los huesos, los intestinos, los riñones y la placenta. Es por ello que existen varios procesos hepáticos y no hepáticos que pueden conducir a una actividad elevada de ALP sérica. La colestasis, la necrosis de las células canaliculares y el aumento de la síntesis hepática pueden conducir a la liberación de esta enzima en la circulación. La vida media sérica de la ALP hepática es de aproximadamente 70 horas en el perro y de 6 horas en el gato. Esta vida media más corta en gatos significa que los aumentos en ALP generalmente no son tan altos como en los perros y, por lo tanto, esta enzima es un marcador menos sensible de colestasis en esta especie. En el perro la ALP se considera un marcador sensible (85 %) para la colestasis. Sin embargo, una actividad sérica elevada de ALP no distingue entre colestasis intrahepática y extrahepática. Una amplia variedad de enfermedades puede causar colestasis intrahepática a través de la inflamación de los hepatocitos, lo que conduce a la obstrucción de los pequeños canalículos biliares y colestasis extrahepática. El aumento de ALP después de la lesión hepática se retrasa en comparación con los aumentos de los marcadores de daño hepatocelular, debido a que se necesita tiempo para que las enzimas se sinteticen y se liberen a la circulación sistémica.
- Gamma-glutamil transferasa (GGT)2,5
La GGT es una enzima unida a las membranas de los hepatocitos que forman los canalículos biliares y a otros grupos celulares extrahepáticos como las células epiteliales de las glándulas mamarias, tubulares renales y pancreáticas. Sin embargo, se cree que la mayor parte de la actividad de la GGT en el suero es el resultado de la isoenzima hepática. El calostro también contiene GGT, lo que conduce a leves aumentos en la actividad de la GGT sérica en los animales lactantes. Las elevaciones de los niveles séricos de GGT se atribuyen a la colestasis o hiperplasia biliar, que resulta en la inducción enzimática. La GGT puede ser un indicador más sensible de enfermedad hepatobiliar en gatos que la ALP, debido a la vida media más corta de la ALP en esta especie. Una excepción importante es la lipidosis hepática, ya que pueden presentarse aumentos de moderados a marcados de ALP con aumentos mínimos o nulos de GGT. En los perros, la GGT suele considerarse más específica pero menos sensible que la ALP para la detección de enfermedades hepatobiliares. El efecto de los glucocorticoides exógenos o endógenos puede resultar en un aumento de la actividad de la GGT sérica en perros, probablemente debido a la inducción enzimática, pero la GGT sérica está menos influenciada que la ALP por enfermedades hepáticas secundarias o fármacos inductores de enzimas6.
Parámetros de funcionalidad hepática
Las pruebas de la función hepática evalúan la capacidad del hígado para eliminar sustancias de la sangre, incluido el amoniaco, producido diariamente a partir del metabolismo de los aminoácidos y que debe convertirse en urea, y los ácidos biliares, que se someten a la circulación enterohepática y se eliminan de la sangre mediante un funcionamiento normal del hígado. La capacidad de síntesis del hígado también se puede evaluar indirectamente mediante la medición de los niveles séricos de varias proteínas (p. ej., albúmina), sin embargo, existen otros procesos patológicos que pueden influir en estas proteínas2.
- Bilirrubina
La bilirrubina es el principal producto de la degradación de los compuestos que contienen grupo hemo de proteínas (p. ej., la hemoglobina y la mioglobina), por parte de las células del sistema mononuclear fagocitario (SMF). La mayor parte de la bilirrubina se genera durante la eliminación de los glóbulos rojos por la acción de la hemo oxigenasa microsomal intracelular. Esta enzima cataliza la degradación de la hemoglobina a hierro, monóxido de carbono, globina y biliverdina. A su vez, la biliverdina se reduce aún más a bilirrubina, que se libera de la célula y se transporta al hígado unida a la albúmina. La bilirrubina no conjugada se absorbe a través de las membranas celulares de los hepatocitos y se une al ácido glucurónico (conjugación). La bilirrubina conjugada es soluble en agua y se excreta activamente desde los hepatocitos hacia los canalículos biliares, y finalmente se excreta hacia los intestinos. Una vez en el intestino, las bacterias convierten parte de la bilirrubina en urobilinógeno7.
La hiperbilirrubinemia puede ser causada por enfermedad prehepática (hemolítica), enfermedad hepática primaria y enfermedad posthepática. La hiperbilirrubinemia hepática es causada por una disminución de la tasa de captación, conjugación o excreción de bilirrubina en los hepatocitos, como resultado de la colestasis intrahepática. Por lo general, la disfunción de los hepatocitos y la colestasis intrahepática ocurren al mismo tiempo. Las actividades de las enzimas hepáticas, tanto los marcadores de función hepatocelular como los marcadores colestásicos, a menudo aumentan, aunque también pueden aumentar con la hiperbilirrubinemia prehepática y posthepática. La hiperbilirrubinemia hepática generalmente se puede distinguir de la hiperbilirrubinemia prehepática mediante la evaluación del hematocrito del paciente y de la hiperbilirrubinemia posthepática mediante ecografía abdominal2.
La hiperbilirrubinemia posthepática es el resultado de la obstrucción del conducto biliar extrahepático. Esto a menudo es causado por una inflamación pancreática, colecistitis bacteriana, mucocele biliar o neoplasias. La principal herramienta diagnóstica para identificar la obstrucción de la vía biliar extrahepática es la ecografía abdominal. Por lo general, la obstrucción de los conductos biliares extrahepáticos conduce a aumentos drásticos en las actividades de las enzimas colestásicas e hipercolesterolemia. Cuando el conducto biliar está completamente obstruido, se pueden observar heces acólicas. Es posible medir la concentración de bilirrubina conjugada en suero, sin embargo, esta prueba no se considera clínicamente útil para distinguir entre hiperbilirrubinemia prehepática, hepática o posthepática2.
- Amonio
El amoniaco se produce en los enterocitos del intestino delgado a partir del catabolismo de la glutamina y en el colon como consecuencia de la desaminación bacteriana. El amoniaco en la luz intestinal se difunde a través de la mucosa, llega a la circulación esplénica y es transportado al hígado a través de la circulación portal hepática donde alcanza los hepatocitos en forma de amonio. Con una función hepática normal, el hígado metaboliza la mayor parte del amoniaco a urea. Se ha sugerido que se requiere una reducción superior al 70 % de la función hepática para que aumente la concentración sérica de amoniaco2,8.
Las concentraciones de amonio en plasma no están influenciadas por colestasis o trastornos hepáticos que no alteran la circulación portosistémica o reducen significativamente la masa funcional hepática. Es por esto por lo que la hiperamonemia generalmente se considera específica para la insuficiencia hepática o la derivación portosistémica. La sensibilidad del amoniaco plasmático para la detección de derivaciones portosistémicas congénitas es del 81-100 % en perros y del 83 % en gatos. Sin embargo, en ocasiones, las deficiencias de las enzimas del ciclo de la urea también pueden provocar un aumento de las concentraciones de amoniaco en la sangre. Estas deficiencias enzimáticas pueden ser hereditarias por la ausencia de una enzima en particular o secundarias a la deficiencia de cobalamina o arginina9.
Cabe señalar que los iones de amonio son lábiles en el plasma, por lo que las muestras deben recolectarse en tubos previamente enfriados y el plasma debe separarse lo antes posible, mantenerse refrigerado y analizarse dentro de los 30 minutos posteriores a la recolección2,9.
- Ácidos biliares
Los ácidos biliares se forman en el hígado a partir del colesterol y son el componente principal de la bilis. La medición de los ácidos biliares séricos (SBA) es una prueba útil de la función hepática en perros y gatos. Los SBA se miden a partir de una muestra en ayunas o recolectando muestras pareadas en ayunas (12 horas) y postprandiales de dos horas. Los pacientes con lipemia, hemólisis, colecistectomía previa o con enfermedad ileal pueden tener resultados poco fiables10.
Los aumentos en las concentraciones de ácidos biliares séricos en ayunas o postprandiales son consistentes con disfunción hepática, derivación portosistémica o colestasis. Para el diagnóstico de enfermedad hepatobiliar, la especificidad de las concentraciones de SBA es del 100 % para valores superiores a 20 mmol/L de los SBA preprandiales y 25 mmol/L de los SBA postprandiales. La sensibilidad de la concentración de SBA en ayunas para el diagnóstico de derivaciones portosistémicas es del 93 % en perros y del 100 % en gatos. La sensibilidad de las concentraciones de SBA para detectar insuficiencia hepática es menor que para detectar derivaciones portosistémicas9,11.
- Marcadores de la función de síntesis hepática
La enfermedad hepatobiliar puede provocar una disminución de la síntesis de proteínas, así como una alteración del metabolismo de la glucosa, la urea y los lípidos. Sin embargo, estas alteraciones no se consideran indicadores sensibles para el diagnóstico de enfermedad hepatobiliar ya que debe existir una reducción de aproximadamente el 70-80 % de la función hepática antes de que se detecten estas anomalías bioquímicas.
Además, también se producen cambios en estos analitos debido a otros procesos patológicos no hepáticos2.
- Glucosa1,2,3
El hígado juega un papel central en el metabolismo de los carbohidratos. El hígado es responsable del almacenamiento de glucógeno, la conversión de la galactosa y fructosa en glucosa, la gluconeogénesis y la síntesis de muchos compuestos utilizando carbohidratos como sustrato. No obstante, la medición de glucosa en sangre no es un marcador sensible o específico para la enfermedad hepática dado que existen diferentes condiciones extrahepáticas que también pueden conducir a una alteración en sus niveles.
La hipoglucemia puede ocurrir como resultado de la reducción de las reservas de glucógeno hepático, el retraso en la eliminación de la insulina o la disminución de la gluconeogénesis. Gracias a la gran capacidad de reserva hepática para la gluconeogénesis, la insuficiencia hepática debe ser grave para que curse con hipoglucemia. Además, la hipoglucemia también puede darse en pacientes con derivaciones portosistémicas congénitas. Por el contrario, la hiperglucemia puede ocurrir potencialmente como resultado de la disminución de la absorción de la circulación portal o hiperglucagonemia asociada con el síndrome hepatocutáneo.
- Colesterol2
El hígado participa en el metabolismo de los lípidos, incluida la síntesis de colesterol. Las concentraciones de colesterol sérico pueden estar aumentadas, normales o disminuidas en pacientes con enfermedad hepatobiliar. No obstante, las concentraciones anormales de colesterol también pueden darse en casos de endocrinopatías, obesidad, malnutrición, nefropatía o enteropatía con pérdida de proteínas, pancreatitis o hiperlipidemias primarias.
La hipocolesterolemia puede estar presente en pacientes con insuficiencia hepática grave y derivación portosistémica adquirida o congénita debido a una síntesis hepática alterada. La hipercolesterolemia puede o no observarse en pacientes con colestasis.
- Albúmina y globulinas1,2
El hígado desempeña un papel esencial en el metabolismo de las proteínas, siendo responsable de la síntesis de proteínas plasmáticas, la desaminación de aminoácidos, la conversión de amoniaco en urea y la síntesis de aminoácidos. Estas funciones pueden verse comprometidas en pacientes con enfermedad hepática.
La albúmina es una proteína plasmática sintetizada exclusivamente por el hígado. Las concentraciones de albúmina sérica se mantienen mediante una tasa igual de síntesis hepática y degradación de proteínas. Hay varios trastornos que pueden dar lugar a disminuciones leves de las concentraciones de albúmina sérica, pero los diagnósticos diferenciales de hipoalbuminemia grave (<2 g/dl) se limitan a insuficiencia hepática, enteropatía con pérdida de proteínas, nefropatía con pérdida de proteínas y enfermedad cutánea exudativa grave. Es posible determinar la causa de la hipoalbuminemia grave a partir de una combinación de hallazgos clínicos, medición de la concentración de globulina sérica, análisis de orina, pruebas de pérdida de proteína gastrointestinal y pruebas de función hepática. El hígado tiene una gran capacidad de reserva para la síntesis de albúmina y la albúmina tiene una vida media sérica de aproximadamente 7 días en perros. En consecuencia, la hipoalbuminemia es un marcador relativamente poco sensible de insuficiencia hepática y es probable que sólo se observe en pacientes con enfermedad hepática crónica avanzada o derivaciones portosistémicas (PSS).
Las α-globulinas y β-globulinas se producen en el hígado, mientras que las células linfoides producen inmunoglobulinas (γ -globulinas). La insuficiencia hepática rara vez conduce a una disminución de la concentración sérica de globulinas. Por el contrario, la enfermedad inflamatoria del hígado puede estar asociada con hiperglobulinemia debido a que la fracción no inmunoglobulínica producida por el hígado incluye varias proteínas de fase aguda.
- Proteínas de coagulación2,12
Los factores de coagulación (excepto el factor VIII), los factores de anticoagulación (antitrombina y proteína C) y la proteína fibrinolítica plasminógeno son sintetizados por el hígado. El hígado también es el sitio de activación de los factores de coagulación dependientes de la vitamina K: II, VII, IX, X y la proteína C. Además, los ácidos biliares son necesarios para emulsionar las grasas y ayudar en la absorción de la vitamina K en el intestino. La malabsorción de vitamina K puede desarrollarse secundariamente a la colestasis. En consecuencia, la enfermedad hepatobiliar puede afectar la hemostasia en más de una forma.
- Nitrógeno ureico en sangre (BUN)1,2,3
La urea se produce a partir del amoniaco en el hígado, se libera a la circulación sistémica y posteriormente se excreta por los riñones. La circulación alterada o la insuficiencia hepática pueden provocar una disminución del suministro de amoniaco desde la circulación portal para entrar en el ciclo de la urea, lo que produce hiperamonemia y disminución del BUN sérico. Sin embargo, la concentración de nitrógeno ureico sérico también puede disminuir debido al lavado de solutos de la médula renal causado por diuresis, desnutrición o una dieta restringida en proteínas, y es un hallazgo normal en los recién nacidos.
Hematología
Los pacientes con trastornos hepatobiliares pueden presentar anomalías morfológicas de los eritrocitos o anemia. Sin embargo, no hay anomalías hematológicas que sean específicas de la enfermedad hepatobiliar.
Los cambios morfológicos de los eritrocitos en pacientes con trastornos hepatobiliares se caracterizan por la presencia de poiquilocitosis (acantocitos, equinocitos, células diana, estomatocitos y formación de cuerpos de Heinz en el gato). Se cree que las anomalías del metabolismo de los fosfolípidos y la disminución de la tolerancia al estrés oxidativo son responsables de la mayoría de estos cambios. La presencia de esquistocitos en pacientes con enfermedad hepática puede resultar de cambios microangiopáticos que ocurren en presencia de coagulación intravascular diseminada o neoplasia hepática13. En los perros, las derivaciones hepáticas congénitas pueden producir microcitosis con o sin anemia, muy probablemente asociada a una alteración del metabolismo del hierro como resultado de una disfunción hepática11,14.
Los pacientes con enfermedad hepatobiliar pueden desarrollar una anemia aguda secundaria a la pérdida de sangre tras un procedimiento invasivo o debido a una hemorragia gastrointestinal. Además, estos pacientes también son susceptibles a padecer anemia normocítica normocrómica no regenerativa de enfermedad crónica debido a una disminución en la disponibilidad de hierro para la síntesis de hemoglobina a pesar de tener reservas adecuadas de hierro en los tejidos13. Por otro lado, la pérdida crónica de sangre o la presencia de anomalías vasculares portosistémicas puede resultar en una anemia por deficiencia de hierro caracterizada por microcitosis e hipocromía. La disminución de la concentración de hierro sérico limita la disponibilidad de hierro para la eritropoyesis, lo que genera la síntesis de eritrocitos hipocrómicos microcíticos15. El 63 % de los gatos con lipidosis hepatica presentan pioquilocitos y el 22 % anemia16.
Ocasionalmente se observan cambios en el trombograma de los pacientes con enfermedad hepatobiliar. La trombocitopenia puede ocurrir debido a insuficiencia hepática con disminución de la síntesis de trombopoyetina o bien debido a una coagulopatía de consumo17. Además, las enfermedades infecciosas que afectan al hígado, como la leptospirosis, pueden provocar trombocitopenia18.
Análisis de orina
Uno de los signos clínicos más comunes y tempranos de la enfermedad hepática es la poliuria y la polidipsia. Por lo tanto, la densidad específica de la orina en pacientes con enfermedad hepática suele disminuir notablemente. La bilirrubinuria y la urolitiasis o cristaluria de urato también son indicadores de posible enfermedad hepática1,3.
Para que la bilirrubina se excrete en la orina, debe estar conjugada. La bilirrubina se mide comúnmente de forma semicuantitativa en la orina canina y felina con una tira reactiva para orina. La bilirrubinuria superior a 2+ en una tira reactiva de orina en un perro y cualquier bilirrubinuria en gatos, deben aumentar la sospecha de una enfermedad hepática subyacente. La bilirrubinuria en perros sin enfermedad hemolítica o enfermedad hepatobiliar puede ocurrir como consecuencia de la pérdida de bilirrubina no conjugada que se une a la albúmina en pacientes proteinúricos, o la conjugación y producción de bilirrubina en las células tubulares renales.
Los gatos tienen un umbral renal mucho más alto para la bilirrubina que los perros, y cualquier grado de bilirrubinuria justifica la investigación de enfermedades hepáticas o hemolíticas en esta especie1,3.
La urolitiasis o cristaluria de biurato de amonio se puede detectar en el sedimento de orina de perros y gatos con enfermedad hepatobiliar, observándose en aproximadamente el 40-70 % de los pacientes con derivaciones portosistémicas, tanto intrahepáticas como extrahepáticas1,19.
Análisis de muestras hepáticas
Dada la presentación clínica inespecífica y el carácter común de las anomalías bioquímicas estándar, la evaluación diagnóstica avanzada de estos pacientes se vuelve fundamental para establecer un diagnóstico definitivo y un plan de tratamiento eficaz. Por lo tanto, cuando la evaluación estándar no logra caracterizar la enfermedad hepatobiliar, puede estar justificado obtener muestras de hígado y bilis.
Citología
Si bien la histopatología se considera el gold standard para llegar a un diagnóstico de enfermedad hepatobiliar, las biopsias hepáticas a menudo no se llevan a cabo debido a la falta de consentimiento del propietario o al riesgo para el paciente. Además, se debe evaluar el estado de coagulación del paciente antes de considerar la cirugía ya que estos animales pueden presentar coagulopatías20.
La citología ecoguiada del hígado por aspiración con aguja fina (FNA) puede brindar un diagnóstico preliminar. No obstante, el examen citológico del hígado tiene limitaciones como, por ejemplo, la incapacidad para proporcionar información sobre la arquitectura del parénquima. La obtención de un diagnóstico definitivo no siempre es posible ya que a menudo no se detectan correctamente los infiltrados inflamatorios, la extensión de la fibrosis o la acumulación anormal de cobre21. La precisión del examen citológico puede variar según el tipo de enfermedad hepática subyacente, siendo útil principalmente en casos de linfoma y lipidosis hepática.
La presencia de cambios vacuolares hepáticos en gatos con enfermedad hepática infiltrativa concurrente puede conducir a un diagnóstico de lipidosis hepática22.
Por otro lado, se recomienda la colecistocentesis ecoguiada y la toma de muestras para examen citológico y cultivo bacteriológico para detectar adecuadamente bactibilia en animales sometidos a evaluación de enfermedad hepatobiliar20,23,24. El examen citológico de la bilis brinda información relevante para el diagnóstico que precede y complementa el cultivo bacteriano. En ocasiones la correlación entre los resultadlos del cultivo y la citología biliar puede ser baja. Las posibles causas de un cultivo bacteriano negativo a pesar de la evidencia citológica de bactibilia incluyen la administración previa de un tratamiento antibiótico, un efecto bacteriostático de la bilis o la presencia de bacterias que son difíciles de cultivar. Por otro lado, la ausencia de evidencia citológica de bacterias con cultivo positivo puede deberse a un número insuficiente de microorganismos o bien a la contaminación de la muestra enviada para cultivo25. La evidencia citológica de bactibilia no se considera equivalente a un diagnóstico de colecistitis bacteriana, que requiere una evaluación histológica24. La bactibilia transitoria y autolimitada puede ocurrir en perros clínicamente sanos. Por otro lado, la falta de inflamación concurrente en la bilis o la pared de la vesícula biliar, a pesar de la bactibilia, también ocurre en animales clínicamente enfermos25.
Biopsia hepática
La biopsia hepática obtenida por laparotomía o laparoscopia sigue siendo el gold standard para el diagnóstico de enfermedades hepáticas. En general, las muestras de biopsia obtenidas durante la laparoscopia o laparotomía son de mejor calidad y se recomiendan para el diagnóstico. No obstante, si no se pueden obtener muestras mediante estas técnicas, las biopsias percutáneas ecoguiadas con aguja de 14 o 16 G, si se realizan correctamente, pueden proporcionar muestras adecuadas21.
El riesgo de morbilidad y mortalidad asociado con la biopsia hepática es bastante bajo. Sin embargo, la toma de una biopsia hepática está contraindicada en pacientes con alto riesgo de hemorragia por defectos de la hemostasia primaria o secundaria (p. ej., hemangiosarcoma) o aquellos con sospecha de lesiones infecciosas que podrían diseminarse. La biopsia hepática también debe evitarse en pacientes que no están lo suficientemente estables para la anestesia, lo que es más probable que ocurra en pacientes con insuficiencia hepática aguda.
La principal preocupación de cualquier técnica de muestreo hepático es la hemorragia posterior al procedimiento. Aunque existe el riesgo de hemorragia post biopsia en perros, la prevalencia está poco documentada.
La evaluación del riesgo de hemorragia en estos animales es un desafío debido al papel complejo y antagónico del hígado en la síntesis y degradación de proteínas pro y antitrombóticas y su papel en la fibrinólisis. La evaluación mediante la evaluación del tiempo de protrombina (PT), el tiempo de tromboplastina parcial activada (aPTT), la concentración de fibrinógeno en plasma, el recuento de plaquetas o el tiempo de sangrado de la mucosa bucal (BMBT) no predice de manera consistente el riesgo de sangrado después de la biopsia hepática. Hoy en día, están disponibles las pruebas de viscoelasticidad de la coagulación como son la tromboelastografía y la tromboelastometría, que permiten identificar estados de hiper e hipocoagulabilidad así como alteraciones en la fibrinólisis21,26,27. Los riesgos de la biopsia hepática además de la hemorragia incluyen complicaciones anestésicas, embolia gaseosa y neumotórax (con laparoscopia) e infección21.
La muestra debe tomarse de la región menos afectada, evitando los nódulos regenerativos y los lóbulos altamente fibróticos, los cuales pueden infravalorar la carga hepática de cobre. Se recomienda obtener un mínimo de cinco biopsias de al menos dos lóbulos hepáticos para histopatología (3), cultivo aeróbico/anaeróbico (1) y análisis cuantitativo de cobre (1). Si se obtienen muestras de biopsia con aguja, la recolección de múltiples muestras de biopsia con una aguja de 14 o 16 G reducirá el error de muestreo. Se requieren aproximadamente 20-40 mg de hígado (peso húmedo) para la cuantificación de cobre mediante espectrometría de absorción atómica. Esta cantidad equivale a una muestra completa de biopsia con aguja de 14 G (2 cm de largo) o la mitad de una muestra de biopsia laparoscópica de 5 mm (Figura 1). Algunos estudios sugieren que el riesgo de sangrado, independiente del calibre de la aguja, aumenta con el número de muestras de biopsia obtenidas3.
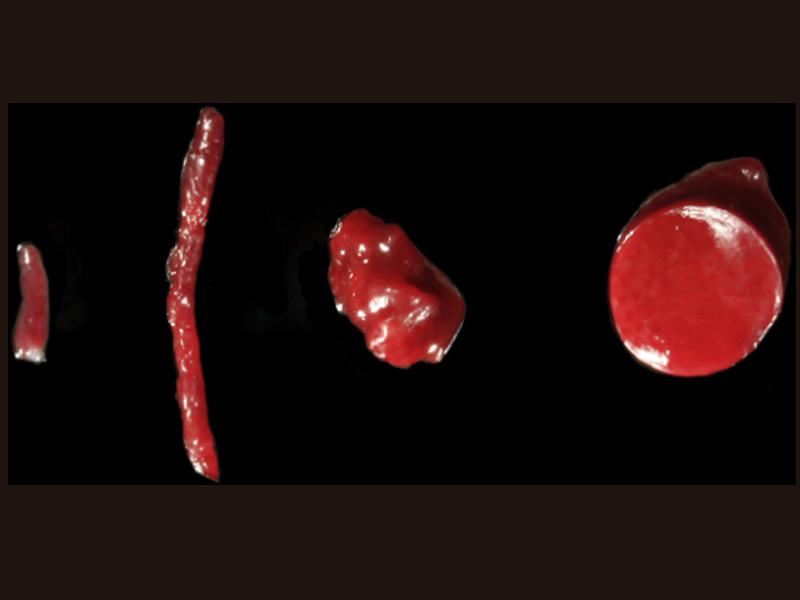
El tejido obtenido para el estudio histológico debe colocarse rápidamente en formalina tamponada neutra al 10 % en una proporción de 10:1. Las muestras de biopsia adicionales se deben colocar inmediatamente en medios de transporte adecuados para el cultivo de bacterias aeróbicas y anaeróbicas y en un tubo de vidrio vacío para la cuantificación de cobre. Al enviar muestras es fundamental proporcionar una historia clínica completa para que el patólogo pueda realizar la interpretación más detallada posible3.
La evaluación histopatológica conduce a un diagnóstico histomorfológico pero no siempre proporciona un diagnóstico causal. A menudo el clínico debe integrar estos hallazgos y otra información clínica para llegar a un diagnóstico definitivo. Además, la importancia e implicaciones clínicas de algunas lesiones no están bien definidas actualmente en el campo veterinario. Por ejemplo, en los perros no se conoce la etapa en la que la fibrosis hepática es irreversible3. Esta incertidumbre también se extiende al manejo de ciertas condiciones para las cuales, hasta la fecha, no se pueden hacer recomendaciones basadas en la evidencia (p. ej., existe cierta controversia sobre cuándo tratar la acumulación hepática de cobre con agentes quelantes de cobre28).
Bibliografía
- Lidbury, J. A. and Steiner, J.M. Liver-diagnostic evaluation. Canine & feline gastroenterology. 2013. St. Louis, Missouri: Elsevier Saunders; 840-939.
- Lawrence, Y. A. and Steiner, J. M. Laboratory evaluation of the liver. Vet Clin North Am Small Anim Pract. 2017; 47(3):539-553.
- Lidbury J.A. Getting the most out of liver biopsy. Vet Clin North Am Small Anim Pract. 2017 ;47(3):569-583.
- Chapman S.E. and Hostutler R.A. A laboratory diagnostic approach to hepatobiliary disease in small animals. Vet Clin North Am Small Anim Pract 2013;43(6): 1209–25.
- Center SA. Interpretation of liver enzymes. Vet Clin North Am Small Anim Pract. 2007; 37:297–333.
- Dillon AR, Spano JS, Powers RD. Prednisolone induced hematologic, biochemical, and histological changes in the dog. J Am Anim Hosp Assoc. 1980;16:831–837.
- Stockham S.L. and Scott M.A. Fundamentals of veterinary clinical pathology. 2002. Ames, Iowa: Blackwell Publishing; 681–690.
- Summerskill WH, Wolpert E. Ammonia metabolism in the gut. Am J Clin Nutr.1970;23(5):633–9.
- Ruland K, Fischer A, Hartmann K. Sensitivity and specificity of fasting ammonia and serum bile acids in the diagnosis of portosystemic shunts in dogs and cats. Vet Clin Pathol. 2010; 39:57–64.
- Center S.A., ManWarren T., Slater M.R., et al. Evaluation of twelve-hour preprandial and two-hour postprandial serum bile acids concentrations for diagnosis of hepatobiliary disease in dogs. J Am Vet Med Assoc.1991;15;199(2):217-26.
- Berent AC, Tobias KM. Portosystemic vascular anomalies. Vet Clin North Am Small Anim Pract. 2009;39(3):513–541.
- Kavanagh C, Shaw S, Webster CRL. Coagulation in hepatobiliary disease. J Vet Emerg Crit Care. 2011;21(6):589–604.
- Christopher M.M. and Lee S.E. Red cell morphologic alterations in cats with hepatic disease. Vet Clin Pathol. 1994;23(1):7–12.
- Martinez C. et al. Evaluation of red blood cell distribution width in dogs with various illnesses. Can Vet J. 2019; 60(9):964-971.
- Simpson K.W. et al. Iron status and erythrocyte volume in dogs with congenital portosystemic vascular anomalies. J Vet Intern Med.1997;11(1):14-9.
- Center S.A. Feline hepatic lipidosis. Vet Clin North Am Small Anim Pract. 2005; 35:225–269.
- Shih J.L. et al. Chronic hepatitis in labrador retrievers: clinical presentation and prognostic factors. J Vet Intern Med. 2007 ;21(1):33-9.
- Reagan K.L. and Sykes J.E. Diagnosis of canine leptospirosis. Vet Clin North Am Small Anim Pract. 2019;49(4):719-731.
- Rothuizen J. Important clinical syndromes associated with liver disease. Vet Clin North Am Small Anim Pract. 2009;39(3):419-37.
- Byfield V.L. et al. Percutaneous cholecystocentesis in cats with suspected hepatobiliary disease. J Feline Med Surg. 2017;19(12):1254-1260.
- Webster C.R.L. et al. ACVIM consensus statement on the diagnosis and treatment of chronic hepatitis in dogs. J Vet Intern Med. 2019;33(3):1173-1200.
- Willard MD, Weeks BR, Johnson M. Fine-needle aspirate cytology suggesting hepatic lipidosis in four cats with infiltrative hepatic disease. J Feline Med Surg 1999;1:215–220.
- Vörös K. et al. Percutaneous ultrasound-guided cholecystocentesis in dogs. Vet Hung. 2002;50(4):385-93.
- Lawrence, Y. A. et al. Characterization, treatment, and outcome of bacterial cholecystitis and bactibilia in dogs. J Am Vet Med Assoc. 2015 1;246(9):982-9.
- Peters L.M. et al. Cytological Findings of 140 Bile Samples from Dogs and Cats and Associated Clinical Pathological Data. J Vet Intern Med. 2016; 30(1):123-31.
- Kol A and Borjesson DL. Application of thrombelastography/ thromboelastometry to veterinary medicine. Vet Clin Pathol .2010; 39(4):405-1
- Badylak SF, Dodds WJ, Van Vleet JF. Plasma coagulation factor abnormalities in dogs with naturally occurring hepatic disease. Am J Vet Res. 1983;42(12):2336–2340.
- Dirksen K. and Fieten H. Canine Copper-Associated Hepatitis. Vet Clin North Am Small Anim Pract. 2017;47(3):631-644.
 by Multimédica
by Multimédica