Neoplasias de células plasmáticas en el perro y el gato
Resumen breve
Los tumores de células plasmáticas son neoplasias linfoides de células B que pueden clasificarse en mieloma múltiple, plasmocitoma óseo solitario cutáneo y no cutáneo, plasmocitoma extramedular, IgM macroglobulinemia (Waldeström) y el linfoma y la leucemia secretora de inmunoglobulinas (incluida la lecucemia de células plasmáticas). Estas neoplasias tienen una baja incidencia, son propias de la edad adulta y pueden aparecer como tumores diseminados de la médula ósea o, en menor medida,…Índice de contenidos
Resumen
Los tumores de células plasmáticas son neoplasias linfoides de células B que pueden clasificarse en mieloma múltiple, plasmocitoma óseo solitario cutáneo y no cutáneo, plasmocitoma extramedular, IgM macroglobulinemia (Waldeström) y el linfoma y la leucemia secretora de inmunoglobulinas (incluida la lecucemia de células plasmáticas). Estas neoplasias tienen una baja incidencia, son propias de la edad adulta y pueden aparecer como tumores diseminados de la médula ósea o, en menor medida, como tumores solitarios óseos o extramedulares. La mayoría de los plasmocitomas óseos solitarios acaban evolucionando a mieloma, mientras que sólo un 30% de los plamocitomas extramedulares lo hacen. Suelen presentar un comportamiento biológico variable que incluye amplios períodos asintomáticos y otros de rápido crecimiento de la lesión y tendencia a la diseminación de la neoplasia. El tratamiento de estas neoplasias varía dependiendo del tipo e incluye cirugía, radioterapia y quimioterapia, de forma única o en combinación.
El objetivo de este artículo es la valoración de los tumores de células plasmáticas en la especie canina y felina, basándonos en la bibliografía existente, para describir los distintos tipos de neoplasias en función de su localización anatómica y poder detallar sus principales características, las distintas pruebas de diagnóstico que tenemos actualmente a nuestra disposición en la medicina veterinaria, las opciones terapéuticas y el pronóstico de vida de cada una de ellas.
Introducción
Maduración de las células plasmáticas
Inicialmente, este es un proceso independiente de la exposición al antígeno, que abarca el desarrollo temprano y la determinación de la célula madre pluripotencial en la médula ósea hacia células del linaje B. Posteriormente, se produce el reordenamiento de los segmentos del gen de la cadena pesada de la inmunoglobulina (IgH) y de la cadena ligera (IgL).
Para pasar al segundo punto de control, se requiere la presencia de la inmunoglobulina de membrana, que permite que los linfocitos B vírgenes sobrevivan a la selección negativa y salgan de la médula ósea hacia el bazo y los ganglios linfáticos, dónde permanencen sin circular vía hematógena o linfática. Cuando se produce un estímulo antigénico, se inicia la diferenciación y proliferación clonal de los linfocitos B, que termina con la diferenciación en dos subplobaciones, una de células plasmáticas y otra de linfocitos B de memoria.
La vida media de una célula plasmática es de unos pocos días y, al ser células en fase de diferenciación terminal, no tienen capacidad mitótica y mueren por apoptosis. Su función es producir y secretar anticuerpos y, una vez se exponen al antígeno específico, dan una respuesta inmunitaria más rápida, más intensa y con mayor afinidad.
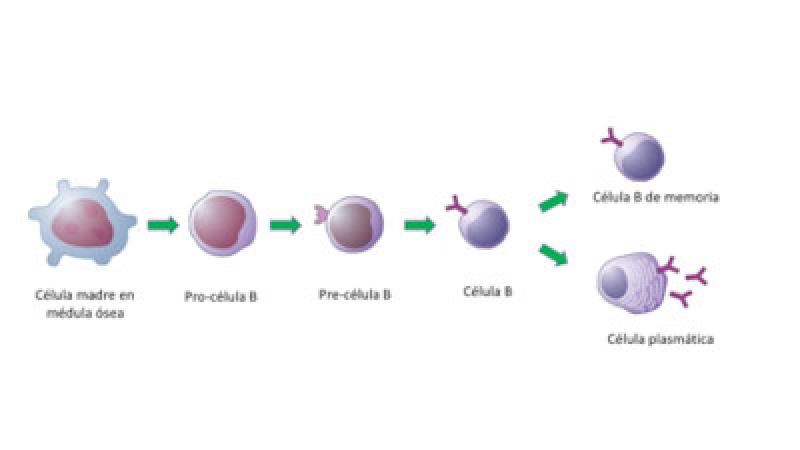
Características morfofuncionales de las células plasmáticas
Las células plasmáticas constituyen alrededor del 1% del total de las células presentes en la médula ósea. Su morfología es variable, normalmente redonda u ovalada, con un tamaño de 15 a 30μm de diámetro. Su citoplasma es abundante y basófilo, con una zona pálida alrededor del núcleo, también denominado halo perinuclear, que corresponde al aparato de Golgi. Tanto el retículo endoplásmico como el aparato de Golgi están muy desarrollados en esta célula, dando lugar a una gran producción de anticuerpos. El núcleo es de pequeño tamaño, redondo, excéntrico y con la cromatina condensada en “rueda de carro”.
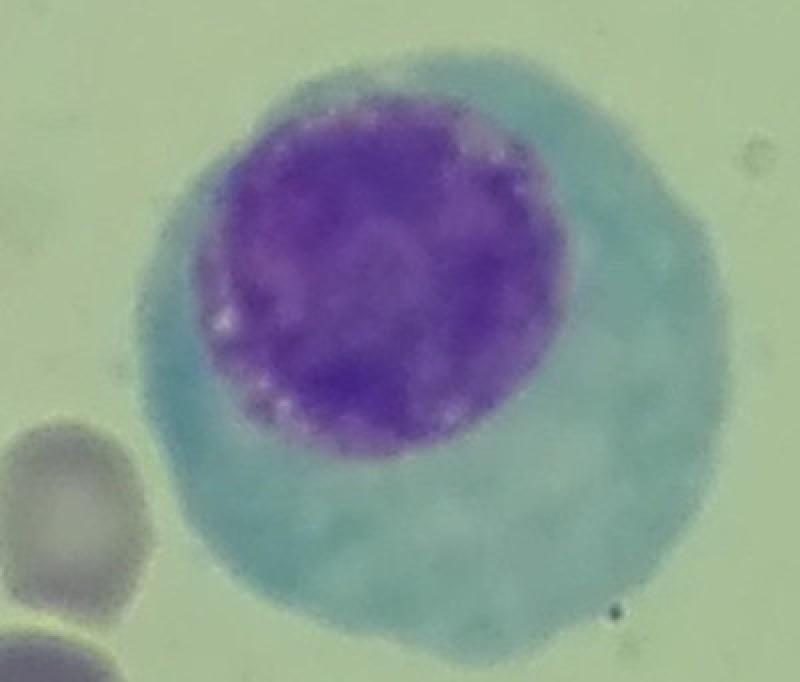
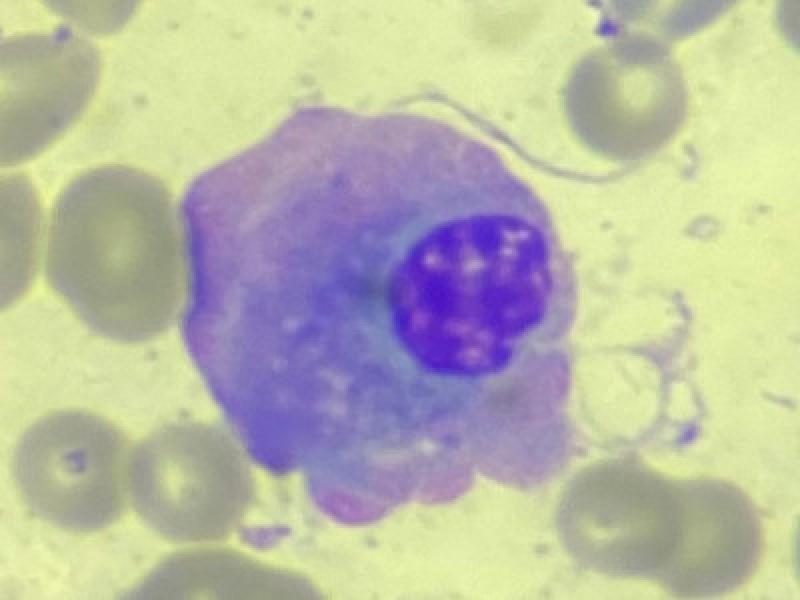
Según Withrow et al., podemos clasificar los desórdenes relacionados con mieloma (DRM) de la siguiente manera:
- MIELOMA MÚLTIPLE (MM)
- PLASMOCITOMA ÓSEO SOLITARIO CUTÁNEO Y NO CUTÁNEO (POS)
- PLASMOCITOMA EXTRAMEDULAR (PEM)
- IgM MACROGLOBULINEMIA (WALDESTRÖM)
- LINFOMA Y LEUCEMIA SECRETORAS DE INMUNOGLOBULINAS
Mieloma múltiple
Presentación
El mieloma múltiple (MM) es el más importante de los desórdenes relacionados con el mieloma (DRM) basándonos en la incidencia y la gravedad. Aunque representa menos del 1% de los tumores malignos en los animales, es responsable del 8% de las neoplasias hematopoyéticas y del 3,6% de las neoplasias primarias y secundarias que afectan al hueso.
En la especie canina, las publicaciones más recientes sugieren una mayor predisposición en los machos, pero todavía genera controversia. Afecta más a los animales mayores, con una edad media comprendida entre los 8 y 9 años. Y en cuanto a la raza, parece haber una mayor incidencia en el pastor alemán. Mientras que, en la especie felina, aunque hay menos estudios publicados, se puede estimar que representa el 0,9% de los tumores malignos y el 1,9% de las neoplasias hematopoyéticas.
La edad media de aparición se encuentra entre los 12 y 14 años, siendo la gran mayoría en el común europeo de pelo corto. No se han observado datos relevantes en cuanto a la predisposición del sexo, aunque hay indicios de que puede afectar en mayor medida a los machos.
No se ha asociado a otras patologías como son el coronavirus, la leucemia o la inmunodeficiencia felina. La etiología es desconocida en su gran mayoría. Se ha asociado a diversos factores como son la predisposición genética, las alteraciones moleculares aberrantes (p. ej. c-kit), otras infecciones víricas, estímulo crónico del sistema inmune y la exposición a carcinógenos.
Hay indicios de una asociación familiar debido a ciertos casos observados entre hermanos o evidencias de un mecanismo molecular de control celular, incluyendo la sobreexpresión de componentes del ciclo celular como son la ciclina D1 o la alteración del receptor tirosin kinasa que puede estar involucrado en los tumores de células plasmáticas, pero son necesarios más estudios para su confirmación.
Patología
El MM es una proliferación sistémica de células plasmáticas malignas o de sus precursores que surgen como clones a partir de una sola célula y que afecta a la médula ósea de distintas zonas en la especie canina. En los gatos, la dificultad en la diferenciación entre el MM y el PEM no cutáneo multicéntrico se debe a que pueden afectar a múltiples órganos abdominales sin infiltrar la médula ósea.
Las células del mieloma múltiple alteran la homeostasia de las células estromales y la interacción entre ésta, la matriz extracelular y factores líquidos (citoquinas y factores de crecimiento); como consecuencia, las células tumorales inducen señales directas e indirectas en la médula ósea que, a su vez, promueven la proliferación, supervivencia, migración y resistencia a medicamentos de las células de mieloma múltiple.
Debido a que el mieloma múltiple es originado a partir de la expansión monoclonal de células plasmáticas, generalmente se detecta la presencia en exceso de un solo tipo de inmunoglobulina (hiperglobulinemia monoclonal) o alguno de sus componentes, ya sea en la cadena ligera (proteína Bence-Jones) o en la cadena pesada. Esta es causada por la sobreproducción incontrolada de un componente de las inmunoglobulinas, que se conoce como componente M, por parte de las células neoplásicas.
En perros, es más común encontrar hiperglobulinemia tipo IgG o IgA (50% de cada tipo), mientras en gatos es más común encontrar gamopatías tipo IgG (80% de los casos) que de tipo IgA (20%). La producción anormal de inmunoglobulina puede llegar a darse de manera incompleta, con la formación de cadenas ligeras de la inmunoglobulina que son excretadas en la orina (proteínas de Bence Jones) y que no son detectadas en el examen general de orina de rutina.
Historia y signos clínicos
Las alteraciones que produce el MM se deben a la gran cantidad de componente M en circulación (hemorragia, hiperviscosidad o enfermedad renal) o a la infiltración de las células neoplásicas en los órganos o huesos (lesiones óseas, infecciones o anemia), o a ambas situaciones. En muchos pacientes, el curso insidioso de la enfermedad puede dar lugar a una sintomatología inespecífica (intolerancia al ejercicio, disminución de apetito o pérdida de peso) que puede enmascarar el proceso en un primer momento.
El MM felino suele cursar con un cuadro inespecífico de debilidad generalizada y anorexia, al igual que en el perro. Una característica que debe hacer sospechar de esta enfermedad es la presencia de hiperglobulinemia, acompañada en muchos casos de proteinuria. Así como en el perro es frecuente la afectación ósea y la consecuente cojera, en el gato la presentación más común incluye la infiltración neoplásica de órganos abdominales.Cuando la enfermedad se hace presente en el animal, los signos más frecuentes son:
Lesiones óseas
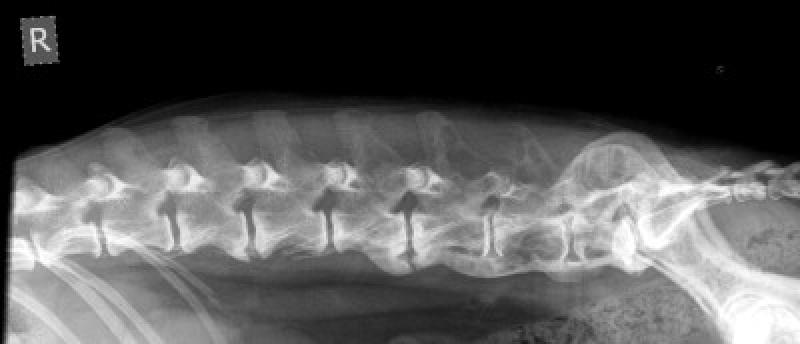
- Pueden ser lesiones osteolíticas aisladas (incluyendo fracturas patológicas) u osteopenias generalizadas o ambas.
- La incidencia de estas lesiones en la radiografía se presenta en un 25 o 30% de los perros, mientras que en los gatos varía de forma significativa según la zona geográfica, pasando de un 8% según los estudios realizados en la Unión Europea a un 65% en los Estados Unidos.
- Los huesos que se ven más afectados son las vertebras, las costillas, la pelvis, el cráneo y las regiones proximales o distales de los huesos largos.
- Clínicamente se presenta como claudicación, dolor o fracturas patológicas.
Diátesis hemorrágica
- Aproximadamente, se presenta en un 30% de los perros con MM y un 25% de los gatos.
- Puede haber uno o varios factores involucrados en esta alteración. Los componentes M pueden alterar la coagulación de varias formas:
- Inhibición de la agregación plaquetaria y liberación del factor plaquetario-3, que produce una alteración en la polimerización de la fibrina.
- Adsorción de las proteínas de la coagulación.
- Disminución de los niveles de calcio. - Pueden observarse alteraciones en los tiempos de coagulación (Tiempo de Protrombina y Tiempo de Tromboplastina Parcial) y trombocitopenia.
- Los signos clínicos están asociados a epistaxis, sangrando gingival, petequias, equimosis, melena y hematuria y, menos frecuente, efusión pleural y peritoneal hemorrágica.
Síndrome de hiperviscosidad
- El grado de afectación está relacionado con el tipo, el tamaño, la forma y la concentración del componente M en la sangre.
- Ocurre en un 20% de los perros, pudiendo causar diátesis hemorrágica, alteraciones neurológicas (tremor, convulsiones, síndrome vestibular central, cambios en el estado mental o mielopatias por infiltración vertebral), alteraciones oftalmológicas (vasos retinianos dilatados y tortuosos, hemorragia retiniana, hifema, desprendimiento de retina o ceguera) y aumenta el gasto cardíaco, que puede desencadenar una cardiomiopatía. Además, debido al espesamiento de la sangre a nivel de los capilares, se altera la coagulación y el intercambio de oxígeno y nutrientes en los tejidos.
Enfermedad renal
- Aparece en un tercio de los pacientes en la especie felina y en un tercio o la mitad en la especie canina.
- Se puede producir por diversos factores: proteinuria de Bence-Jones, infiltración tumoral en el riñón, hipercalcemia, amiloidosis, infecciones del tracto urinario o disminución de la perfusión por deshidratación o el síndrome de hiperviscosidad.
- Las cadenas ligeras, al tener un bajo peso molecular, son filtradas a través del glomérulo renal causando una precipitación de proteínas que dan lugar a un daño glomerular y a una obstrucción de los túbulos renales por la formación de formación de cilindros de proteína.
Hipercalcemia
- Se produce en 15-20% de los perros con MM y, en los gatos, al principio se creía que era un fenómeno poco habitual, aunque los últimos estudios han demostrado una incidencia entre el 10 y 25%.
- La principal causa es que las células neoplásicas aumentan la producción de factores activadores de los osteoclatos (linfotoxina, factor de necrosis tumoral alfa e interleuquinas 1, 3 y 6) que estimulan la resorción ósea, la liberación de calcio y la disminución de la formación de hueso por la inhibición osteoblástica. Las células plasmáticas malignas también pueden producir hipercalcemia paraneoplásica de malignidad por la producción del péptido relacionado a la hormona paratiroidea (PTHrP).
- Es importante recordar que la hiperglobulinemia causa la unión del calcio a ésta, por lo que la medición de calcio ionizado, y no de calcio total, es necesaria para confirmar la evidencia de hipercalcemia en pacientes con mieloma múltiple.
Alteraciones en el hemograma
- Se pueden presentar diversas citopenias asociadas a mieloptisis. Aproximadamente, un 65% de los perros con MM van a presentar alteraciones en la serie roja (anemia normocítica y normocrómica), y un 30%, leucopenia y trombocitopenia.
Enfermedad cardíaca
- Se produce por un aumento del gasto cardíaco y de la hipoxia en el miocardio debido a la hiperviscosidad. También puede deberse a la infiltración de la sustancia amiloide en el miocardio.
- Otros signos que pueden estar asociados son un fallo cardíaco congestivo o un soplo, sobre todo relacionados con la anemia.
Predisposición a infecciones
- Es una complicación frecuente como causa de muerte de un mieloma múltiple.
- Se han descrito tres razones principales: la primera es que los niveles normales de inmunoglobulinas están disminuidos debido a la proliferación de células tumorales en la médula ósea que sustituyen a las células normales, la segunda es por un factor que liberan estas células neoplásicas que induce a los macrófagos a suprimir la producción de anticuerpos y la tercera es cuando el paciente presenta neutropenia.
El MM se puede clasificar en función de la presentación clínica en:
- Agresivo: presencia de hipercalcemia, lesiones óseas líticas o fracturas patológicas, anemia, proteinuria de Bence Jones, azotemia, persistencia de hiperglobulinemia tras 8 semanas de tratamienton y ausencia o poca mejoría clínica.
- Poco agresivo: presencia de normocalcemia, lesiones óseas sin fractura patológica, ausencia de anemia, azotemia y proteinuria de Bence-Jones, y normalización de las proteínas totales tras 8 semanas de tratamiento.
Diagnóstico
El diagnóstico de mieloma múltiple generalmente requiere de la demostración de dos o más de los siguientes criterios:
- Infiltración de células plasmáticas malignas (plasmacitosis) en medula ósea
- Presencia de lesiones osteolíticas
- Demostración de una gammapatía monoclonal en suero u orina
- Demostración de proteinuria de Bence Jones
- Infiltración de células plasmáticas malignas (atípicas) en bazo y/o hígado
El porcentaje normal de células plasmáticas en medula ósea es generalmente menor al 5%, por lo que encontrar una infiltración de células plasmáticas mayor al 20% o encontrar células plasmáticas con características atípicas, generalmente es indicativo de mieloma múltiple. En ocasiones, el porcentaje puede ser menor (5 a 10%), por lo que la atipia celular es un factor importante para considerar esta enfermedad.
No siempre existe evidencia de lesiones osteolíticas, en perros, aproximadamente, un 50% de los casos las presentan, y en gatos, aunque no está bien determinado, probablemente sea menos frecuente. Debido a esto, la presencia de plasmacitosis en medula ósea en conjunto con una gammapatía monoclonal progresiva es indicativa del diagnóstico.
En muchos casos, especialmente en los gatos, la demostración de infiltrado de células plasmáticas con características atípicas (células neoplásicas) en bazo o en otros órganos como hígado o nódulos linfáticos, en conjunto con una gammapatía monoclonal es generalmente suficiente para determinar el diagnóstico. Para la toma de muestra se suele usar una punción con aguja fina al ser una técnica menos invasiva y, en los casos donde la citología no ha sido diagnóstica o se necesita un estudio más detallado, se realiza una biopsia de médula ósea.
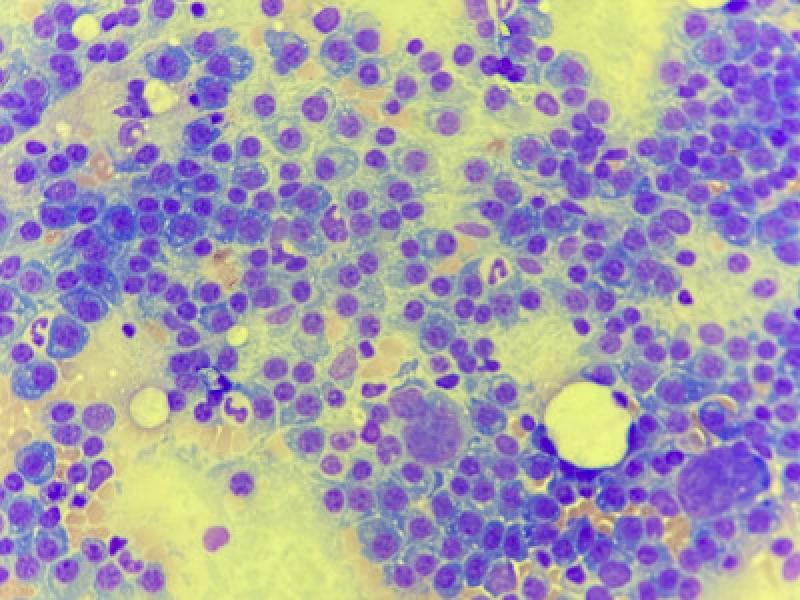
En todos los casos, se debe de realizar un hemograma, bioquímica sanguínea y examen general de orina. También es recomendado realizar un cultivo de orina, ya que la mayoría de los pacientes se encuentran inmunológicamente comprometidos. Es recomendable realizar pruebas de coagulación para medir el Tiempo de Protrombina (TP), el Tiempo de Tromboplastina Parcial (TTP) y la viscosidad sanguínea, sobre todo, cuando hay signos clínicos de hemorragia.
En medicina humana, también se mide el nivel de lactato deshidrogenasa (LDH), que ha demostrado ser un indicador útil del pronóstico del paciente. Un aumento en sus niveles indica que la enfermedad es más avanzada y que pueden tener un peor pronóstico. Aunque, de momento, en medicina veterinaria todavía no hay estudios que confirmen que la LDH sea un factor pronóstico.
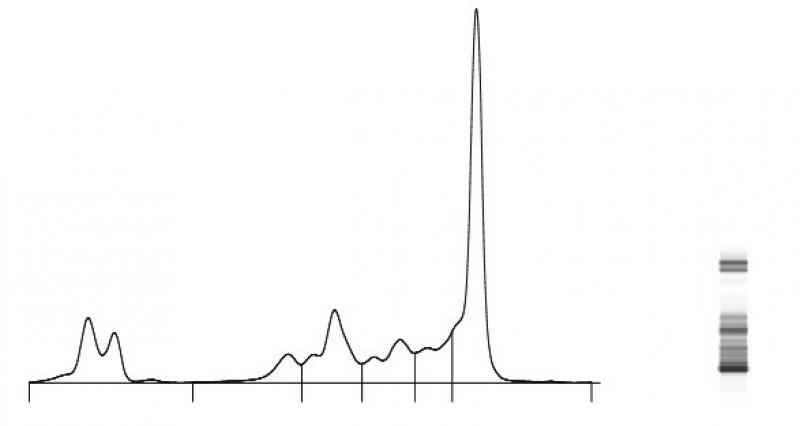
Es necesario realizar una electroforesis sérica para la demostración de una gammopatía monoclonal y, de ser posible, una inmunoelectroforesis para determinar el tipo de inmunoglobulina implicada. Para la detección de proteínas de Bence-Jones es necesario realizar una precipitación por calor y electroforesis en la orina.
Las radiografías torácicas y abdominales son recomendadas para la localización de lesiones líticas en los huesos presentes en estas áreas, sobre todo, la columna vertebral y el esqueleto apendicular, así como la detección de organomegalia. También es recomendado realizar radiografías de los sitios específicos donde previamente se ha detectado presencia de dolor.
Una tomografía computarizada o resonancia magnética puede ser de ayuda en la identificación de lesiones; mientras que una escintigrafía nuclear generalmente no es recomendada debido a que, al existir una disfunción osteoblástica, la captación del tecnecio-99 es inadecuada. También se debe realizar una ecografía abdominal, con aspirado de bazo y de otros órganos si presentan evidencia de infiltración, para la demostración de la presencia de células plasmáticas atípicas en estos órganos.
Para valorar la densidad mineral osea se puede realizar una absorciometría de rayos X de energía dual (DEXA o DXA). Esta técnica utiliza una pequeña dosis de radiación ionizante para producir imágenes que miden la pérdida de hueso. En medicina humana se usa de forma rutinaria para diagnosticar osteoporosis, evaluando el riego que tiene un individuo de desarrollar fracturas debidas a la osteoporosis.
En las muestras histológicas y citológicas se puede observar distintos grados de diferenciación que van desde células plasmáticas normales en las últimas fases del desarrollo hasta células redondas anaplásicas con un alto índice mitótico en los estadios iniciales (plasmablastos). Es frecuente encontrar células binucleadas o multinucleadas.
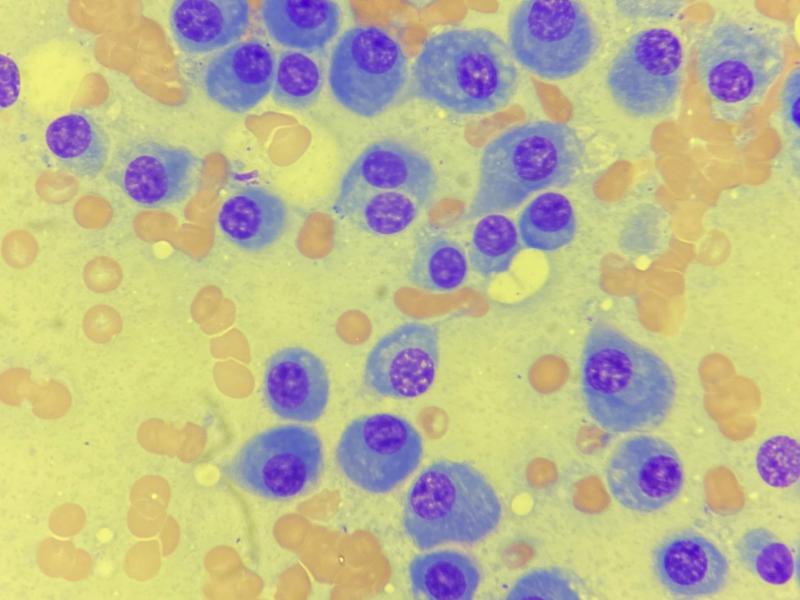
Otras técnicas que pueden complementar el diagnóstico para el MM son la citometría de flujo, la PCR para el Reordenamiento del Receptor de Antígeno (PCR for Antigen Receptor Rearrangement, PARR) y las técnicas inmunohistoquímicas.
CITOMETRÍA DE FLUJO
- La determinación del inmunofenotipo por citometría de flujo es útil para caracterizar fenotípicamente y distinguir las células plasmáticas neoplásicas de las sanas o reactivas, basándose en las diferencias en la expresión de los marcadores de superficie. Además, proporciona información de marcadores celulares para el pronóstico clínico.
- Las células plasmáticas exhiben una restricción isotípica, es decir, que cada una de ellas sólo puede producir un único tipo de inmunoglobulina, mientras que las células plasmáticas clonales malignas pueden expresar, además, de forma homogénea, cadenas ligeras kappa o lambda de las inmunoglobulinas, que pueden ser identificadas en muestras de plasma u orina con un patrón electroforético de pico anormal. Además, en médula ósea estas células clonales pueden mostrar diversos inmunofenotipos.
- En medicina humana, la Red Europea de Mieloma (European Myeloma Network, EMN) recomienda estudiar por citometría de flujo los antígenos CD19, CD56, CD117, CD20, CD28, CD27, CD81, CD200 para el diagnóstico del mieloma múltiple y los antígenos CD45, CD56, CD117, CD28 como marcadores pronósticos en el mieloma múltiple. Hay una gran variedad de combinaciones de patrones de expresión aberrantes, aunque en la mayoría de los casos, las células plasmáticas del MM expresan un fenotipo CD 38+, CD45-, CD138+, CD56+ y CD19+. Los anticuerpos de la mayoría de estas proteínas no son válidos en medicina veterinaria y el inmunofenotipo de las células plasmáticas normales y neoplásicas todavía no se ha publicado. En la práctica clínica, usando un panel estándar de anticuerpos para citometría de flujo, las células plasmáticas normales tienen una expresión de CD21 baja o ausente, de CD45 y CMH II alta, y de CD34 ausente.
PCR PARA LA DETECCIÓN DE REORDENAMIENTO DEL RECEPTOR DE ANTÍGENO (PCR for Antigen Receptor Rearrangements, PARR)
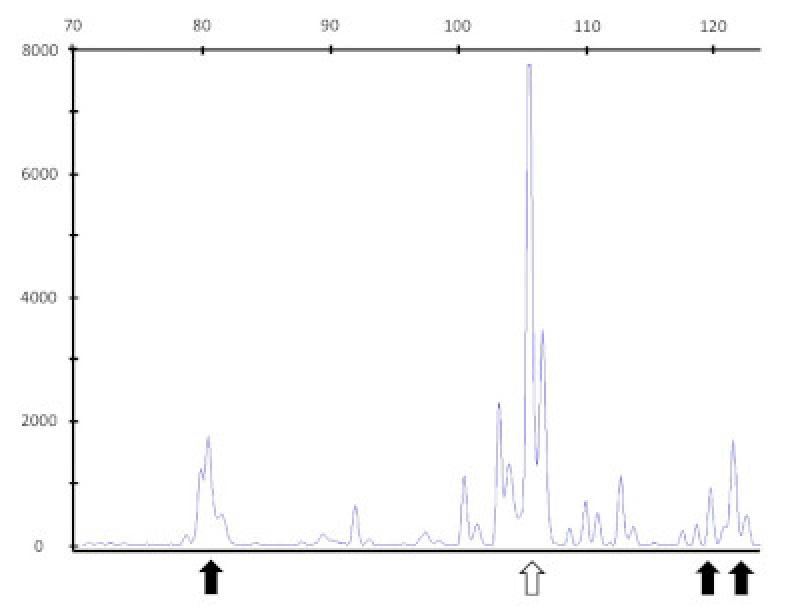
- Es una técnica molecular que se usa para detectar clonalidad en enfermedades linfoproliferativas. Esta técnica tiene una gran sensibilidad y especificidad tanto para diagnosticar linfomas o leucemias como para definir el inmunofenotipo (de células T o B). La detección de clonalidad se basa en el hecho de que los linfocitos contienen regiones de ADN que son únicas en longitud y secuencia. Se utiliza la reacción en cadena de la polimerasa (PCR) para detectar reordenamientos del receptor de antígeno (PARR), con las regiones conservadas de los genes V y J para amplificar la región deseada CDR3 que codifica la porción de unión al antígeno de la inmunoglobulina de cadena pesada o el receptor de células T gamma (TCRγ). En caso de clonalidad se obtienen siempre cadenas gemelas, mientras que en caso de policlonalidad se obtiene una mezcla heterogénea de cadenas de distinta longitud.
- Una de las grandes ventajas que ofrece es que puede hacerse a partir de preparaciones citológicas ya teñidas o de bloques de tejido fijado y en parafina que hayan sido remitidos para examen citológico o histológico, respectivamente.
- El objetivo es precisar el tamaño de la reordenación de las Inmunoglobulina H según el tipo de bases, lo que permite determinar si el tumor hematopoyético proviene del mismo clon. La reordenación de la Ig H es frecuente en los DRM en la especie canina y, en medicina humana, se usa para el diangóstico y monitorización de los pacientes.
- Se puede llevar a cabo antes del tratamiento para alcanzar el diagnóstico de la enfermedad y después de la remisión de las lesiones para valorar la evolución y el pronóstico.
INMUNOHISTOQUÍMICA (IHQ)
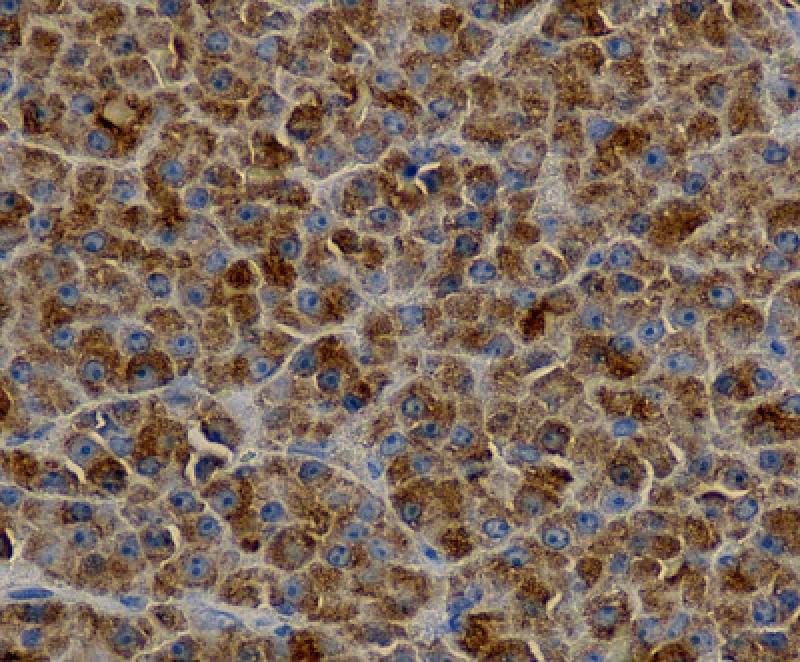
- Los cortes histológicos teñidos con Hematoxilina-Eosina no siempre identifican de forma clara las células plasmáticas, por lo que la inmunohistoquímica se utiliza en el MM para cuantificar las células plasmáticas de la biopsia, para confirmar proliferación por células plasmáticas monoclonales y para diferenciar de otros posibles diagnósticos. También es útil para determinar la expresión de marcadores específicos y aberrantes en las células plasmáticas malignas.
- En la práctica clínica, los marcadores que se usan con más frecuencia son MUM-1 (Multiple Myeloma oncogene 1), CD 138, CD79a, CD20, CD56 e IgG lambda o IgG-kappa.
Tratamiento
El objetivo del tratamiento consiste en controlar el avance de la neoplasia, así como tratar los posibles problemas secundarios relacionados con ésta, como son la hipovolemia, la deshidratación, las alteraciones cardiovasculares, la azotemia o la hipercalcemia. En la mayoría de los casos se deben enfocar los esfuerzos según los signos clínicos que aparecen en el paciente.
El tratamiento sistémico específico del mieloma múltiple consiste en la administración de quimioterapia. Uno de los protocolos de elección es el que contiene melfalán y prednisona. Otras opciones pueden incluir lomustina (CCNU) o clorambucilo. En gatos, el melfalán causa mayor mielosupresión, por lo que los fármacos de elección suelen ser la ciclofosfamida y el clorambucilo.
Existe poca información en medicina veterinaria sobre el uso de medicamentos como el bortezomib (inhibidor del proteosoma), que es utilizado como agente de rescate en humanos, y sobre el uso de inhibidores de los Inhibidores Tirosin Kinasa (ITK), como el toceranib fosafato y el masitinib, sin embargo, es posible que en un futuro este tipo de medicamentos pudieran ser incluidos como parte del tratamiento del mieloma múltiple en perros y gatos.
Pronóstico
En la especie canina, más del 90% de los pacientes responden al tratamiento quimioterápico y la media de supervivencia es, aproximadamente, de un año y medio. Mientras que en la especie felina, la respuesta suele ser parcial y menos duradera (4 meses), aunque publicaciones recientes sugieren un control de la enfermedad durante más tiempo (8-13 meses).
El factor principal depende de la forma de presentación en el paciente. Los pronósticos desfavorables incluyen hipercalcemia, insuficiencia renal, proteinuria de Bence-Jones y lesiones osteolíticas generalizadas o en sitios de gravedad.
Plasmocitoma óseo solitario (POS)
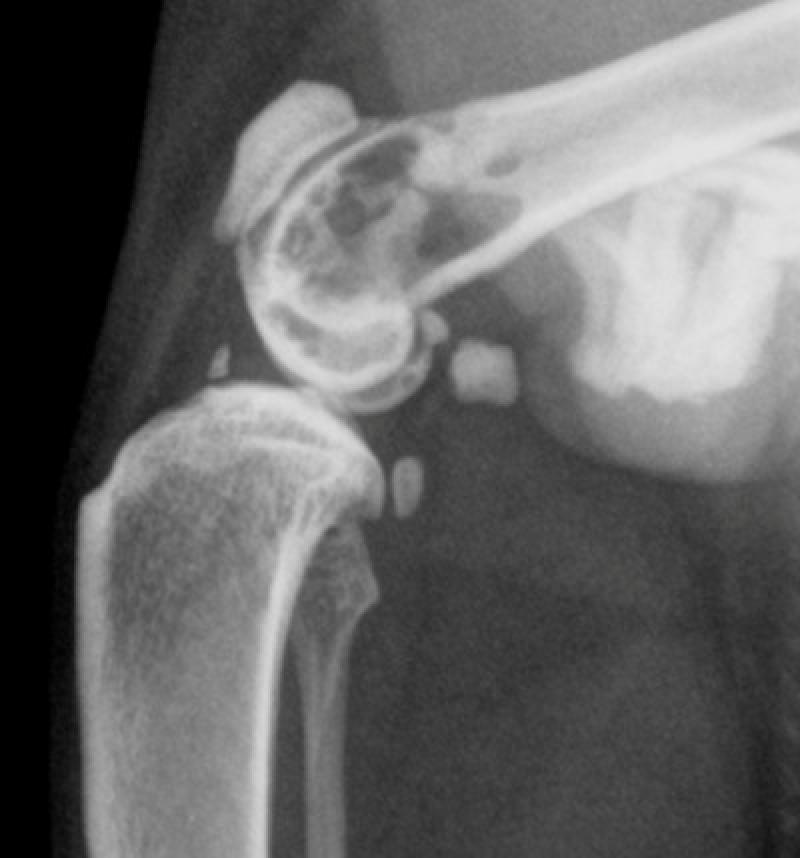
Se trata de un tumor de células plasmáticas que se manifiesta como una lesión osteolítica única, sin plasmocitosis medular y que puede secretar proteína M (Ig o fracción de esta monoclonal). La enfermedad puede afectar a cualquier parte del esqueleto, siendo su localización más habitual la columna vertebral, la cadera, los huesos largos y el cráneo. La apariencia radiológica puede mostrar un doble patrón, bien una imagen lítica ovalada con destrucción de la cortical ósea, bien una lesión que muestra un abombamiento bicortical. El 50 % de los casos de POS progresan hacia MM, por lo que son considerados por algunos autores como una manifestación temprana del MM.
El tratamiento de elección lo constituye la resección quirúrgica o la radioterapia, o la combinación de ambos. La radioterapia puede ser de gran utilidad en casos donde la cirugía no sea posible, sobre todo en casos de plasmacitomas solitarios de hueso, para el control local del dolor y del tumor. La quimioterapia está indicada en casos donde el tumor muestra signos de diseminación sistémica.
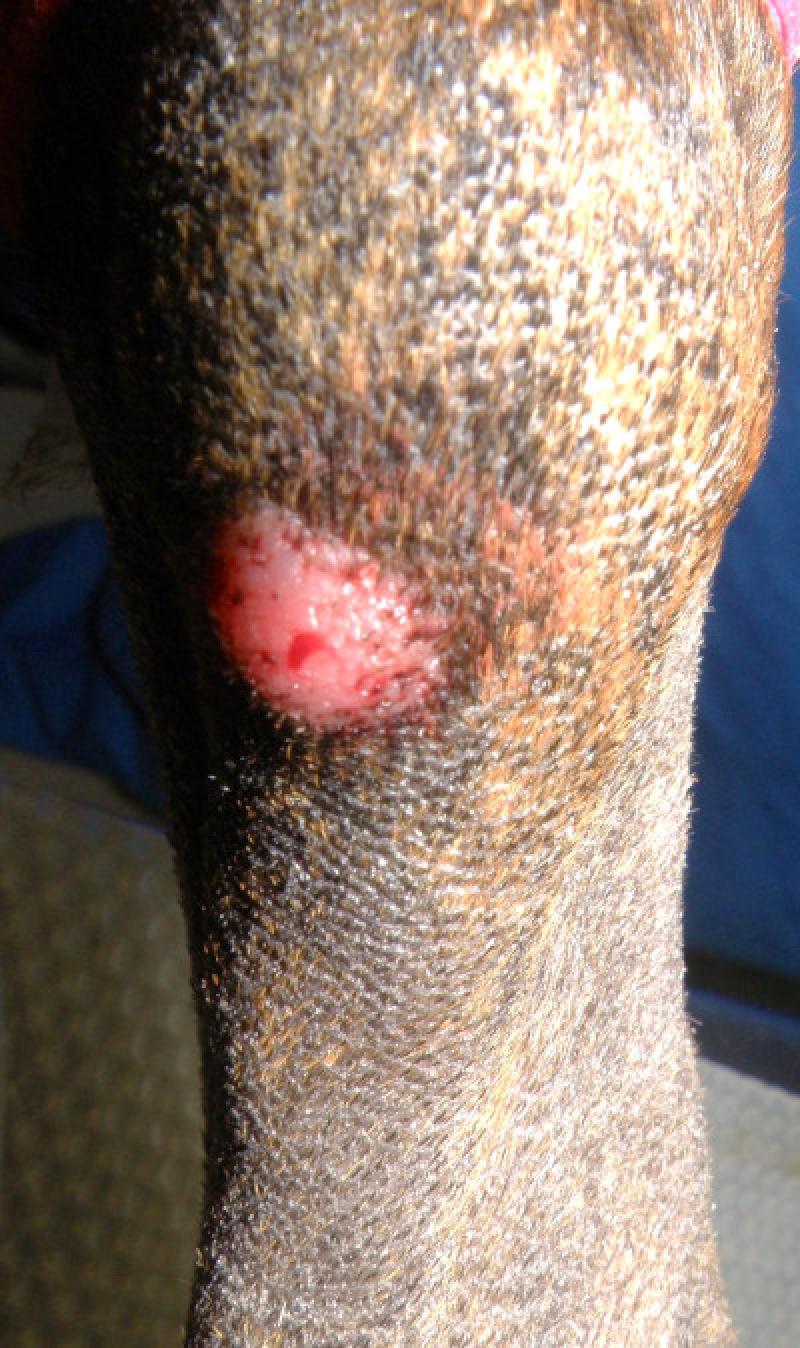
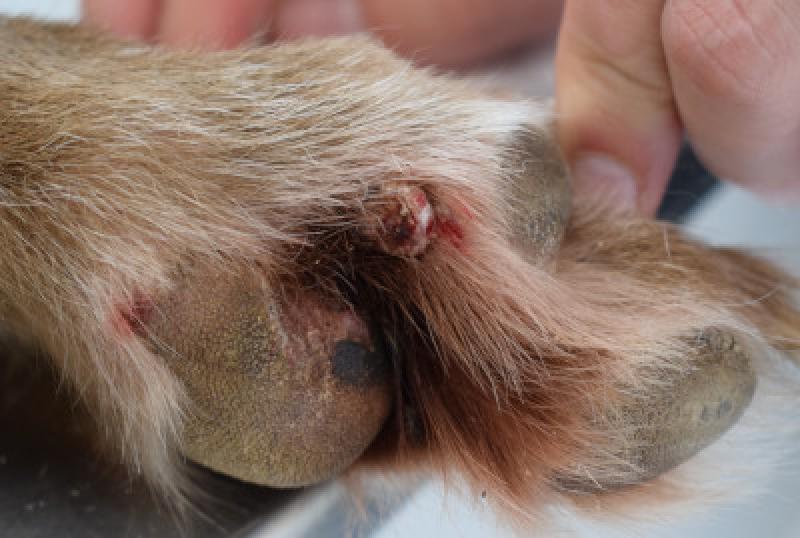
Plasmocitoma extramedular (PEM)
Se originan en los tejidos blandos. Las localizaciones mas comunes son la piel (mayor del 85% de los casos, sobre todo, en las extremidades, la cabeza y las orejas), mucosa oral y bordes mucocutáneos, y mucosa colorectal. Con menor frecuencia, llegan a presentarse en esófago, estómago, intestino, bazo, hígado, genitales, útero, conjuntiva, globo ocular, cavidad nasal, laringe, tráquea y localización intracraneal.
La edad media de aparición suele ser a partir de los 9 años. Respecto a la predisposición racial, se ha observado mayor incidencia en el Cocker Spaniel inglés y americano, y en el West Highland white terrier.
El comportamiento biológico suele ser benigno y la mayoría no recidivan después de la resección quirúrgica completa. De manera ocasional, pueden llegar a presentar metástasis a nódulos linfáticos regionales, siendo más frecuente en plasmacitomas localizados en esófago, estómago e intestino.
La mayoría de los plasmacitomas cutáneos aparecen como nódulos solitarios, elevados, homogéneos, de color rosado o grisáceo y, normalmente, miden de 1 a 2 cm de diámetro. Los plasmacitomas colorrectales generalmente cursan con hematoquecia, tenesmo y/o prolapso rectal.
El diagnóstico de plasmacitomas solitarios suele realizarse mediante la citología, mientras que el estudio histopatológico y la inminohistoquímica son necesaria para confirmar el diagnóstico. Los marcadores utilizados en inmunohistoquímica incluyen cadena ligera y pesada de inmonoglobulina (Ig), MUM-1/IRF4 y tioflavina T. También se puede utilizar la técnica de PARR.
El tratamiento de elección es la intervención quirúrgica, aunque se aconseja excluir la posibilidad de presentación sistémica antes de decidir el tipo de tratamiento, sobre todo en caso de plasmacitomas solitarios localizados en otros sitios que la piel, mucosa oral o colorrectal, y deben incluirse hemograma, química sanguínea, radiografías y considerar, de ser indicado, una electroforesis sérica.
El pronóstico de plasmocitomas solitarios extramedulares localizados en piel, mucosa oral o colorrectal es excelente después de la remoción completa de la lesión. La utilización de quimioterapia adyuvante, con melfalán y prednisona, está indicada en caso de que la biopsia revele una remoción incompleta o un bajo grado de diferenciación, y cuando se detecta metástasis. La radioterapia puede ser de gran utilidad si la cirugía no se puede llevar a cabo.
Inmunoglobulina M macroglobulinemia (WALDESTRÖM)
La Macroglobulinema de Waldenström (WM), también conocida en medicina humana como linfoma linfoplasmocítico, es un linfoma de bajo grado relacionado con una paraproteinemia monoclonal de tipo IgM. La mayoría de los pacientes con esta patología presentan síntomas relacionados con un síndrome de hiperviscosidad sanguínea. Este proceso presenta una baja incidencia en perros, mientras que en gatos es muy poco frecuente.
Muchos animales con macroglobulinemia no presentan síntomas y el trastorno se descubre por casualidad cuando se encuentra hiperglobulinemia en un examen de sangre control. Sin embargo, en otras ocasiones se presentan síntomas cuando la gran cantidad de macroglobulinas produce un síndrome de hiperviscosidad. Estos síntomas incluyen hemorragia en la piel y en las membranas mucosas (como las de la boca, la nariz y el tracto digestivo), intolerancia al ejercicio, debilidad o alteración del estado mental. La viscosidad de la sangre también puede producir alteraciones cardíacas, oftalmológicas y neurológicas.
El diagnóstico de la Macroglobulinemia de Waldenström se basa en una biopsia ósea para demostrar la infiltración linfocítica y en la demostración del componente monoclonal IgM en el proteinograma. El estudio requerirá además de una analítica completa con hemograma, bioquímica y estudio de coagulación.El tratamiento se basa en la administración de melfalán, o clorambucilo, combinado con prednisona.
El pronóstico para los pacientes con Macroglobulinemia de Waldenström depende de varios factores, entre ellos la edad del paciente, la velocidad de la progresión de la enfermedad y la respuesta al tratamiento. Algunos pacientes pueden tener una enfermedad estable o de progresión lenta, y pueden vivir por muchos años. Otros pacientes pueden tener una forma de Macroglobulinemia de Waldenström de progresión rápida.
Linfoma y leucemia segretoras de inmunoglobulinas
En medicina veternaria, el linfoma plasmoblástico es una variante poco frecuente del linfoma B y la leucemia de células plasmáticas también tiene una baja incidencia, habiéndo sólo dos casos documentados en la literatura, uno con una presentación similar a la que se da con la producción de IgG y otro del que se sospecha de un plasmocitoma cutáneo como origen. En medicina humana, la leucemia de células plasmáticas es la presentación más agresiva dentro de las neoplasias de este tipo celular.La edad media de presentación es menor que en el Mieloma Múltiple, estando por debajo de los 8 años en el perro.
En la leucemia de células plasmáticas la médula ósea suele estar infiltrada de forma extensa y difusa, y las células plasmáticas malignas pueden aparecer en órganos aumentados de tamaño fuera de la médula (hígado, bazo o ganglio linfático). Las lesiones óseas líticas son menos frecuentes en comparación con el MM, al igual que una menor respuesta al tratamiento y esperanza de vida.
Esta leucemia se caracteriza por la presencia mayor del 20% de células plasmáticas en sangre periférica y puede ser primaria, en pacientes sin evidencias de mieloma, o secundaria, en animales con estadios avanzados de MM que afectan a la médula ósea.
Aunque es difícil realizar una clasificación certera en los animales, extrapolando de la literatura de la medicina humana y basándonos en los pocos casos documentados en veterinaria, podemos valorar que en la forma primaria hay una menor prevalencia de lesiones ósea y cojeras, mientras que se observa una mayor afectación de los ganglios linfáticos, hígado y bazo, así como alteraciones pulmonares y neurológicas y presencia de plasmocitomas extramedulares; también hay una mayor prevalencia en las alteraciones del hemograma (anemia y trombocitopenia) al haber una mayor infiltración de la médula ósea, que finalmente da lugar a curso más agresivo de la enfermedad y una menor esperanza de vida en comparación con la forma secundaria.
El inmunofenotipaje se basa en que las células plasmáticas normales tienen una expresión baja o ausente del antígeno CD21, aumento del CD45 y CMH II, y ausencia del CD34, aunque es necesario realizar más investigaciones para mejorar la fiabilidad de esta técnica en los animales.
Respecto a la inmuhistoquímica hay que destacar los marcadores MUM-1, Pax5 y CD3 para confirmar el origen de células plasmáticas. El MUM-1 tiene una gran especificidad en la especie canina, el Pax5 debe ser negativo ya que sólo se expresa en las células B y se inhibe para su diferenciación en célula plasmática, y el CD3 es un marcador de las células T, por lo que también debe ser negativo. El uso del PARR cada vez es más útil para el diagnóstico y monitorización de los DRM, incluido en la leucemia.
Bibliografía
- Boucher K, Parquet N, Widen R, et al. Stemness of Bcell progenitors in multiple myeloma bone marrow. Clin Cancer Res. 2012;18:6155–6168.
- Burnett, R.C., W. Vernau, J.F. Modiano, C.S. Olver, P.F. Moore and A.C. Avery, Diagnosis of canine lymphoid neoplasia using clonal rearrangements of antigen receptor genes. Veterinary Pathology, 2003. 40: p. 32-41.
- Cowgill ES, Neel JA, Ruslander D. Light-chain myeloma in a dog. J Vet Intern Med. 2004;1:119–121.
- Emily DR, Alba María MS, Angharad HKW, et al. Progression of cutaneous plasmacytoma to plasma cell leukemia in a dog. Vet Clin Pat. 2017. 0/0: 1-8.
- Flores-Montero J, de Tute R, Paiva B, et al. Immunophenotype of normal vs. myeloma plasma cells: toward antibody panel specifications for MRD detection in multiple myeloma. Cytometry B Clin Cytom. 2016;90:61–72.
- Geigy C, Riond B, Bley CR, et al. Multiple myeloma in a dog with multiple concurrent infectious diseases and persistent polyclona gammopathy. Vet Clin Path. 2013; 42-1: 47-54.
- Gorczyca W. Plasma cell neoplasms. Atlas of Differential Diagnosis in Neoplastic Hematopathology (ed 3a). Boca Ratón, Florida, Estados Unidos: CRC Press; 2014: 359-382.
- International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol. 2003;5:749–757.
- Kyle RA. Diagnostic criteria of multiple myeloma. Hematol Oncol Clin North Am. 1992;2:347–358.
- Muccio VE, Saraci E, Gilestro M, et al. Multiple myeloma: new surface antigens for the characterization of plasma cells in the era of novel agents. Cytom Part B Clin Cytom. 2016;90:81–90.
- Ramos-Vara JA, Miller MA, Valli VEO. Immunohistochemical detection of multiple myeloma 1/interferon regulatory factor 4 (MUM1/IRF-4) in canine plasmacytoma: comparison with CD79a and CD20. Vet Pathol. 2007;44:875–884.
- Rao S, Lana S, Eickhoff J, et al. Class II major histocompatibility complex expression and cell size independently predict survival in canine B-cell lymphoma. J Vet Intern Med. 2011;25:1097–1105.
- Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues (ed 4a). Lyon, Francia: International Agency for Research on Cancer; 2008.
- Szczepek AJ, Bergsagel PL, Axelsson L, Brown CB, Belch AR, Pilarski LM. CD34+ cells in the blood of patients with multiple myeloma express CD19 and IgH mRNA and have patient-specific IgH VDJ gene rearrangements. Blood. 1997;89:1824–1833.
- Vail DM. Myeloma-related Disorders. In: Vail DM, Thamn DH, Liptak JM eds. Withrow and MacEwen´s Small Animal Oncology. 6th ed. St. Louis, MO: Elsevier Inc.; 2020: 739-772.
- World Health Organization, International Agency for Research of Cancer . Globocan 2012: estimated cancer incidence, mortality and prevalence worldwide in 2012.
 by Multimédica
by Multimédica