Citología de la glándula adrenal en el perro y el gato
Resumen breve
Las glándulas adrenales son dos estructuras de pequeño tamaño que se localizan próximas a ambos riñones, adyacentes a la vena cava caudal y a la aorta abdominal. La citología de este órgano está indicada cuando mediante técnicas de imagen se detectan nódulos o masas adrenales, así como un incremento generalizado del tamaño (adrenomegalia). Debido a la continua expansión de las pruebas de imagen como la ecografía (Figura 1), la tomografía computerizada (TC) o la resonancia magnética,…Índice de contenidos
Introducción
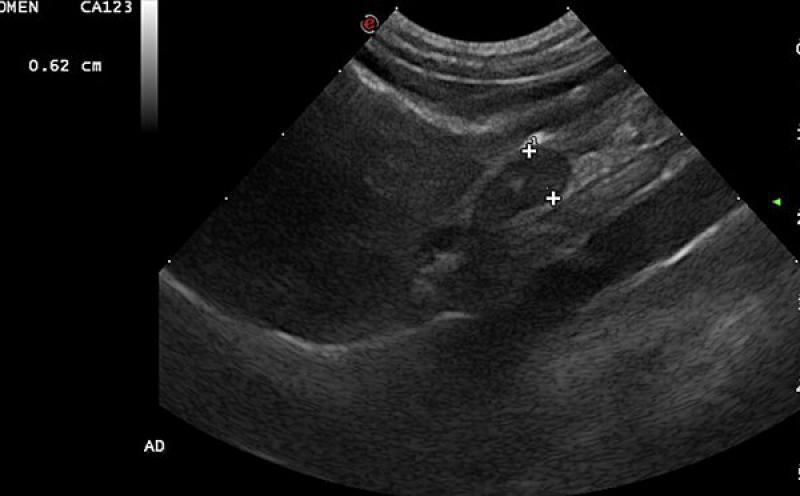
Las glándulas adrenales son dos estructuras de pequeño tamaño que se localizan próximas a ambos riñones, adyacentes a la vena cava caudal y a la aorta abdominal. La citología de este órgano está indicada cuando mediante técnicas de imagen se detectan nódulos o masas adrenales, así como un incremento generalizado del tamaño (adrenomegalia). Debido a la continua expansión de las pruebas de imagen como la ecografía (Figura 1), la tomografía computerizada (TC) o la resonancia magnética, cada vez es más frecuente la detección de tumores adrenales u otras alteraciones de las glándulas1,2.
Algunos tumores se asocian a disfuncionalidades hormonales (hiper- o hiposecreción hormonal), efecto masa, invasión local (p. ej. invasión de la vena cava) o metástasis distantes. Sin embargo, muchas de las masas adrenales no se asocian con ningún síntoma y, en estos casos, es apropiado utilizar el término “incidentaloma adrenal”1.
Son diferentes las patologías que pueden afectar a las glándulas adrenales, incluyendo inflamación (adrenalitis), infección, hiperplasia, hipoplasia, quistes, neoplasia primaria o neoplasia metastática. No obstante, tan solo se ha demostrado una utilidad clara de la citología en los casos de adrenalitis por causas infecciosas o en neoplasia (primaria o metastática)1,2.
Toma de muestras
La citología de glándulas adrenales mayoritariamente se realiza mediante punción o punción y aspirado con aguja fina guiado por pruebas de imagen, generalmente ecografía o en su defecto TC. Se recomiendan tamaños de aguja de entre 21 y 25 G, si bien no existe bibliografía al respecto en medicina veterinaria1. También se pueden realizar preparaciones citológicas mediante la técnica de impronta, utilizando glándulas adrenales extirpadas quirúrgicamente2.
El porcentaje de citologías concluyentes supera el 70 % en algunos estudios utilizando punción con aguja fina guiada por ecografía3. En medicina humana se han descrito abordajes de punción endoscópica (en lugar de percutánea) guiada por ecografía, con unas tasas de precisión cercana al 100 %1,4, que en algunos estudios muestran precisiones similares a las biopsias tipo Tru-Cut de 19G5. Sin embargo, en veterinaria estas técnicas no se realizan con frecuencia y no hay material publicado al respecto1.
En veterinaria, existe controversia respecto a la punción ecoguiada de lesiones adrenales. Muchos autores recomiendan evitarlo por la potencial complicación grave e incluso fatal que podría ocurrir en caso de muestrear tumores productores de catecolaminas (feocromocitomas), incluyendo dolor, hemorragia incontrolada, crisis hipertensiva marcada, etc.)1. Sin embargo, estas contundentes medidas disuasorias carecen de una evidencia sólida y parecen basarse principalmente en apreciaciones personales6.
En una publicación en la que se incluyeron 6 casos de punción adrenal en perros y gatos (ecoguiada o intraoperatoria), dos de los casos eran feocromocitomas y no se reportó ninguna complicación7. Por otra parte, en una encuesta realizada a especialistas de diagnóstico por imagen en la que se recabó un total de 50 perros, incluyendo 23 feocromocitomas, únicamente se reportaron complicaciones en 4 pacientes, mayoritariamente por hemorragias y ninguno sufrió una crisis hipertensiva.
La tasa de mortalidad se estimó en aproximadamente un 1 %3.
Sumner y colaboradores (2018)6 investigaron la seguridad de la punción y aspirado de lesiones de la glándula adrenal, incluyeron 23 lesiones de un total de 19 perros.
En 9 pacientes se diagnosticaron feocromocitomas y tan solo uno de ellos sufrió una complicación, que consistió en taquicardia ventricular. Por lo tanto, la evidencia actual indica que se trata de un procedimiento relativamente seguro con una tasa de complicaciones estimada del 5 %, incluyendo en los casos de feocromocitoma.
Las principales limitaciones son el bajo número de casos y la naturaleza retrospectiva del trabajo. En este aspecto, se podría haber infravalorado el porcentaje de complicaciones del procedimiento al no incluir aquellos casos en los que no se realizó punción por percibir un elevado riesgo clínico6.
Los tumores adrenales en medicina humana se clasifican principalmente por las características que muestran en las pruebas de imagen avanzada, el crecimiento y la actividad hormonal. Únicamente se realiza citología si se sospecha de neoplasia maligna, especialmente en casos de evaluación o sospecha de metástasis, y siempre y cuando se ha descartado la presencia de feocromocitoma (p. ej., medición de metabolitos de las catecolaminas en orina)1.
El principal punto a favor de la citología en masas adrenales es la posible ayuda en el manejo perioperatorio de los pacientes, ya que se ha demostrado que la fenoxibenzamina reduce el riesgo de mortalidad en perros con feocromocitoma. Además, como se establece a continuación, la diferenciación entre tumor cortical y medular generalmente se puede realizar de forma rápida y sencilla, pudiendo ayudar a determinar si es necesario la administración de fenoxibenzamina durante la cirugía en aquellos casos en los que se diagnostica un feocromocitoma mediante citología intraquirúrgica o preoperatoria1.
Estructura de la glándula adrenal
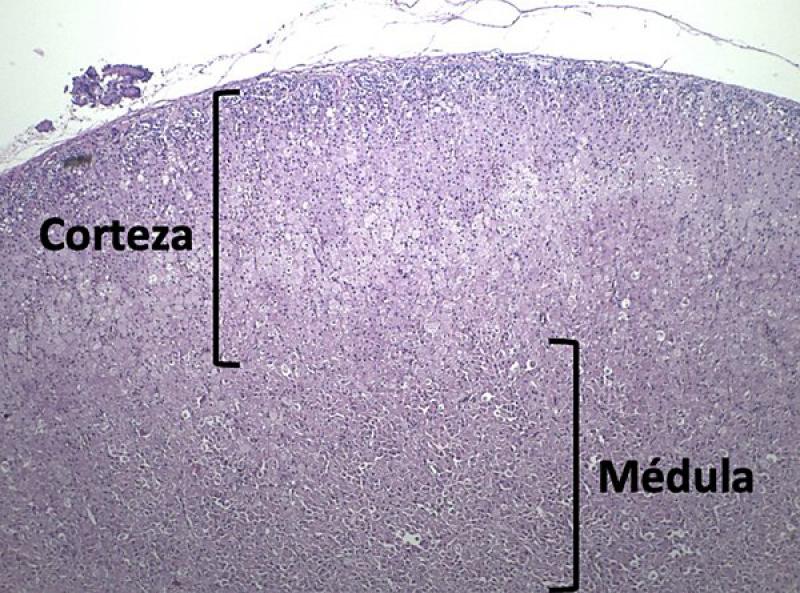
La glándula adrenal está formada por dos partes principales: corteza y médula (Figura 2). La primera tiene origen en el epitelio celómico del mesodermo y a su vez se divide en 3 zonas con diferente funcionalidad y estructura histológica. La más externa es la zona glomerular, donde se producen y secretan los mineralocorticoides, principalmente la aldosterona. A continuación, se encuentra la zona fascicular, en la que se producen los glucocorticoides, principalmente el cortisol. Entre la zona fascicular y la médula adrenal se encuentra la zona reticular, en la que se producen hormonas sexuales (andrógenos)1,2,8. De las tres zonas, la más gruesa es la zona fascicular (80 %), seguido de la zona glomerular (15 %) y únicamente un 5 % de zona reticular. Las células de la corteza, principalmente en la zona fascicular y reticular se encuentran bajo influencia del eje hipotálamo-hipófisis, a través de la hormona adrenocorticotropa (ACTH)1.
La médula adrenal es la región interna y deriva del neuroectodermo de la cresta neural. Contiene mayoritariamente células paraganglionares o células cromafines (feocromocitos). En esta región se producen las catecolaminas (adrenalina y noradrenalina). Estas células funcionan como neuronas postganglionares modificadas liberando catecolaminas en respuesta a estimulación simpática1,2,8. Aunque en muy bajo número, también se encuentran células cromafines en la corteza y en la cápsula adrenal, aunque estas últimas, con la edad sufren apoptosis, resultando en una disminución gradual de las mismas5.
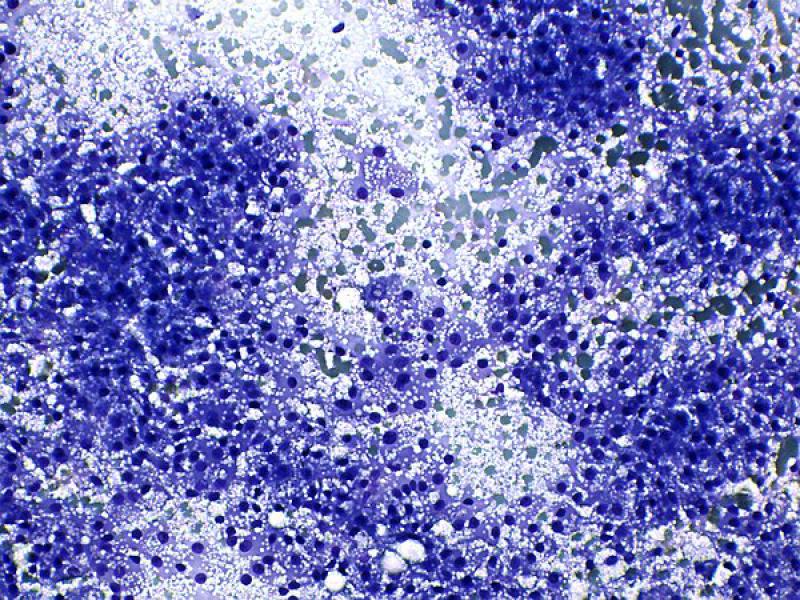
Aunque las características citológicas de la glándula adrenal normal (Figura 3) no se han descrito de forma detallada, estas pueden extrapolarse de las observadas en los procesos de hiperplasia o en los tumores bien diferenciados de cada una de las regiones descritas. Las células corticales tienen la apariencia típica de células endocrinas productoras de esteroides, con apariencia similar a la de células intersticiales o de Leydig en testículo (Figura 4), con una baja relación núcleo:citoplasma y numerosas vacuolas claras bien delimitadas de pequeño tamaño. Por el contrario, las células de la médula adrenal tienen la apariencia neuroendocrina típica, con una relación núcleo:citoplasma elevada1.
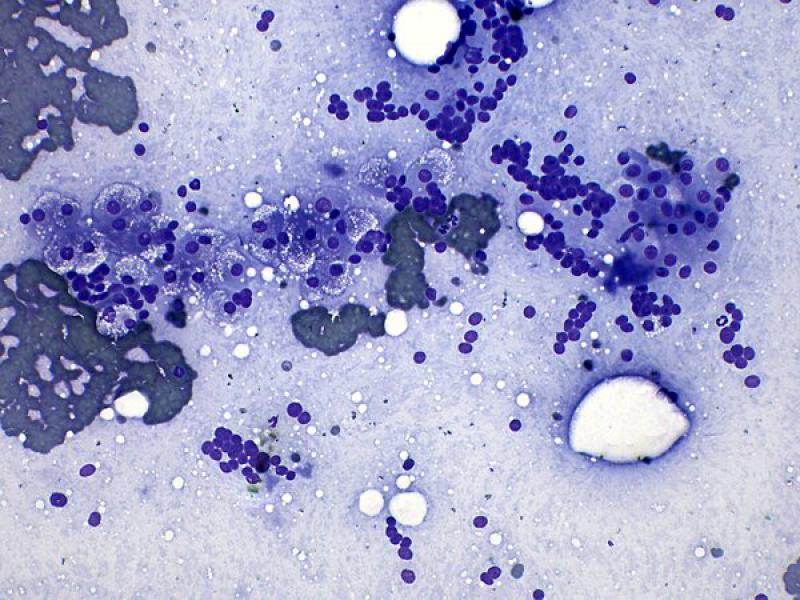
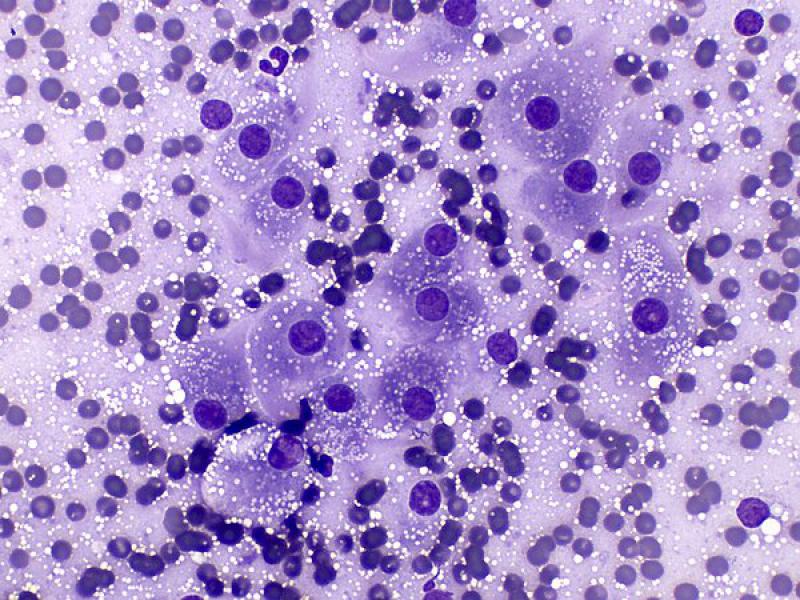
Inflamación
La inflamación de la glándula adrenal (adrenalitis) puede tener varios motivos, incluyendo infección (p. ej., bacteriana, fúngica o protozoaria), procesos inmunomediados o secundario a neoplasia, entre otros. El diagnóstico de adrenalitis puede realizarse al encontrar un número significativo de células inflamatorias (Figura 5) y, en algunos casos, se identifican agentes infecciosos, para lo cual puede resultar de ayuda otras técnicas (PCR y cultivo bacteriano o fúngico)8. La inflamación de la glándula adrenal es menos frecuente que otras patologías y no siempre causa incremento de tamaño de esta2.
Los microorganismos (bacterias, hongos o protozoos) principalmente llegan a la glándula adrenal por vía hematógena, causando generalmente inflamación supurativa (neutrofílica) y/o macrofágica. En medicina humana se describen casos de infección por bacterias (p. ej., Mycobacterium) y hongos, en especial Blastomyces, Cryptococcus, Histoplasma, Paracoccidioides y Pneumocystis carinii que, en algunos casos, fueron evidenciados mediante citología1.
Sin embargo, en veterinaria las descripciones son más escasas. Se han reportado adrenalitis e infección por diferentes agentes, entre los que se incluyen bacterias generalmente durante el curso de una septicemia (Clostridium perfringens tipo A, Escherichia coli)9, protozoos (Leishmania infantum10 o Toxoplasma gondii8), hongos (Histoplasma capsulatum, Coccidioides immitis, y Cryptococcus neoformans)8,9 y virus (circovirus del perro [DogCV])11. Si bien reconocer algunos de estos agentes causales es teóricamente posible mediante citología, en conocimiento de los autores, no existen publicaciones al respecto
Hiperplasia adrenocortical
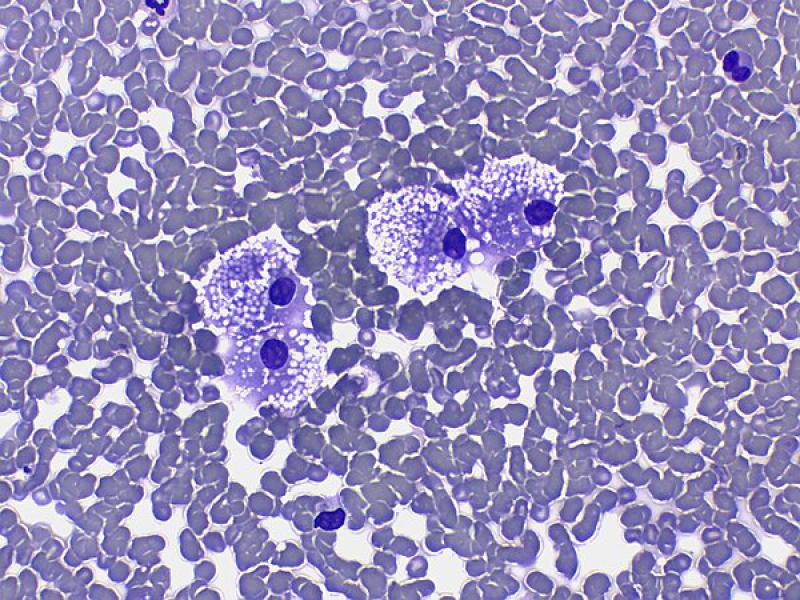
La hiperplasia adrenocortical puede ocurrir de forma nodular o difusa y es más frecuente encontrarla en perros y gatos mayores. La hiperplasia adrenocortical difusa causa un aumento del grosor de la corteza adrenal, bilateral y puede provocar adrenomegalia. Típicamente está causada por una sobre-secreción autónoma de ACTH por la hipófisis, por un adenoma (80 % de los casos de Síndrome de Cushing). La hiperplasia nodular también suele ocurrir de forma bilateral e histológicamente se caracteriza por la presencia de varios nódulos, no encapsulados, con origen en cualquiera de las zonas de la corteza, aunque principalmente afectan a las zonas reticular y fascicular.
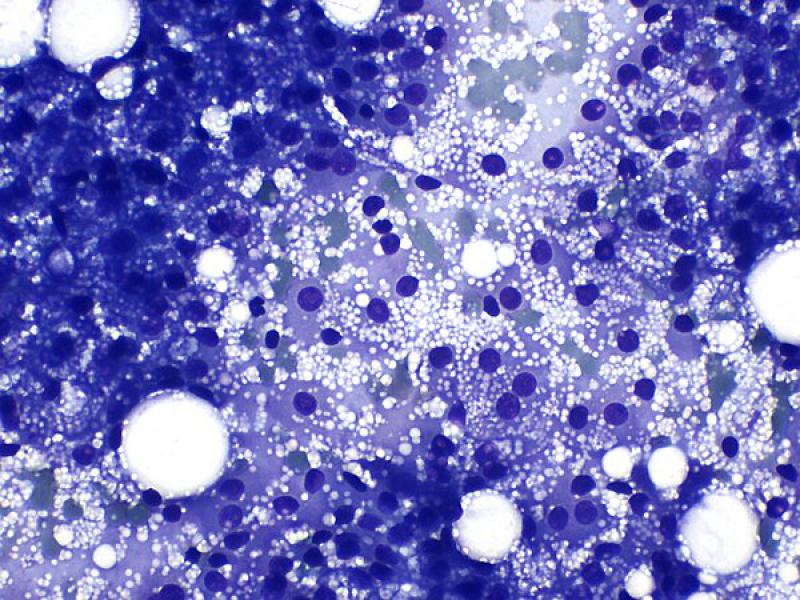
Las preparaciones citológicas generalmente son moderadamente celulares, con abundantes núcleos desnudos y células intactas con características corticales (moderada a abundante cantidad de citoplasma con frecuentes vacuolas claras bien definidas) (Figura 6)2,8. Las células pueden encontrarse con una organización ligeramente más cohesiva que en los aspirados de glándula adrenal normal. En medicina humana se han reportado células binucleadas en casos de hiperplasia adrenocortical2.
Hay que tener en cuenta que mediante citología la diferenciación entre hiperplasia, adenoma y adenocarcinoma bien diferenciado no es posible, incluso mediante histopatología es complicada en algunos casos2,8. La demostración funcional de hiperplasia puede realizarse mediante pruebas hormonales, incluyendo el test de estimulación con ACTH y el test de supresión con dexametasona8.
Quistes
Los quistes adrenales no son raros en humanos. Pueden tener un origen endotelial, epitelial, parasitario o ser pseudoquistes. De ellos, hasta el 7 % tienen un comportamiento maligno. Aunque se han descrito quistes en este órgano en hurones1, no se conocen casos publicados en perros o gatos.
Neoplasia
Los tumores adrenales son relativamente frecuentes en perros y en menor medida en gatos. Las neoplasias primarias de la glándula adrenal pueden dividirse en función de si tienen origen en la corteza o en la médula. En el primer caso, se hallan los adenomas y adenocarcinomas de corteza adrenal. También se han descrito mielolipomas con origen en esta región, aunque parecen ser mucho menos comunes y no son secretores de hormonas. Por otra parte, la mayoría de los tumores de médula adrenal son feocromocitomas1.
Muchos de los tumores adrenales primarios son funcionalmente activos y secretan una cantidad inapropiada de una o varias hormonas, causando signos clínicos (Tabla 1). Los tumores adrenocorticales en perros suelen provocar hiperadrenocorticismo. Para demostrar un hiperadrenocorticismo adrenal dependiente se emplean técnicas de imagen y pruebas hormonales, como el test de supresión con dexametasona a dosis bajas o altas, el ratio cortisol:creatinina en orina, el test de estimulación con ACTH y/o la medición de la concentración endógena de ACTH1.
| Tabla 1. Resumen de las características clínicas y pruebas laboratoriales diferenciales entre los principales tumores medulares y corticales de la glándula adrenal1,8,14,15. . |
| Médula adrenal | Corteza adrenal |
| Tipo de neoplasia: | Feocromocitoma (común) Neuroblastoma y ganglioneuroma (muy poco frecuentes). | Adenoma/adenocarcinoma. |
| Test adicionales (útiles en tumores funcionalmente activos): | • Supresión con dexametasona (a dosis bajas o altas): normal • Estimulación con ACTH: normal • Concentración de ACTH endógena: normal • Ratio cortisol:cratinina en orina: normal • Ratio aldosterona:renina en plasma: normal • (Gatos) concentración plasmática de aldosterona: normal • Ratio normetanerfinas y metanerfinas: creatinina en orina: elevado • Concentración plasmática de metanerfinas y normetanefrinas: elevado • Concentración de inhibina sérica: muy baja o indetectable. *Variación en función de estado reproductivo (fértil versus castrado) | • Supresión con dexametasona (a dosis bajas o altas): cortisol incrementado • Estimulación con ACTH: cortisol incrementado • Concentración de ACTH endógena: disminuida • Ratio cortisol:cratinina en orina: incrementado • Ratio aldosterona:renina en plasma: elevado • (Gatos) concentración plasmática de aldosterona: elevada • Ratio normetanerfinas y metanerfinas:creatinina en orina: normal • Concentración plasmática de metanerfinas y normetanefrinas: normal • Concentración de inhibina sérica: elevada. |
| Comentarios clínicos | Signos clínicos asociados con la secreción de catecolaminas (hipertensión, taquicardia o taquipnea). | Hiperadrenocorticismo, hiperaldosteronismo. |
En gatos los tumores de corteza adrenal pueden provocar hiperadrenocorticismo o hiperaldoteronismo (Síndrome de Conn). En este último caso, los gatos suelen presentar hipertensión sistémica, hipokalemia severa y debilidad muscular, y puede confirmarse al detectar una alta concentración plasmática de aldosterona y un alto ratio aldosterona:renina en plasma1.
Los feocromocitomas pueden secretar catecolaminas por lo que los signos clínicos incluyen hipertensión, taquicardia o taquipnea entre otros. Sin embargo, la mitad de los feocromocitomas se encuentran de forma incidental y no provocan signos clínicos. Ante una sospecha clínica de feocromocitoma, la medición de catecolaminas y sus metabolitos puede ayudara al diagnostico1. El ratio normetanefrina:creatinina en orina es significativamente más alto en perros con feocromocitoma que en animales con hiperadrenocorticismo o sanos12.
En otro estudio se concluye que la concentración plasmática de normetanefrinas libres tiene una sensibilidad y especificidad excelentes, mientras que la concentración plasmática de la fracción libre de metanefrinas tiene una sensibilidad moderada y una especificidad excelente13.
Por ultimo, Salesov y colaboradores (2015) compararon perros con feocromocitoma, hiperadrenocorticismo, enfermedad no adrenal y perros sanos, observaron que los pacientes con feocromocitoma tenían valores más altos de los siguiente parámetros: ratios normetanefrinas y metanefrinas:creatinina en orina, concentración plasmáticas de metanefrinas (fracción total y libre) y fracción libre de normeanefrinas. Concluyeron que la medición de normetanefrinas debería ser el método bioquímico de elección para confirmar un feocromocitoma cuando esté disponible y que la medición en orina es superior a la plasmática14.
También se ha descrito el uso de la concentración de inhibina en suero como marcador para diferenciar tumores adrenocorticales de feocromocitomas. Los pacientes con feocromocitoma tienen una concentración de esta hormona mucho más baja (indetectable en perros que además estaban castrados) comparado con perros con tumores de la corteza adrenal o con hiperadrenocorticismo hipofisario dependiente. En animales enteros la interpretación de este parámetro es complicada. Se estimó una sensibilidad, especificidad y precisión del 100, 88.9 y 93.6 % respectivamente al utilizar la concentración sérica de inhibina para identificar un tumor adrenal como feocromocitoma15.
Tumores primarios de la corteza adrenal
Adenoma y adenocarcinoma adrenal
Los principales tumores con origen en corteza adrenal son los adenomas y adenocarcinomas corticoadrenales. Un 10-20 % de los perros con hiperadrenocorticismo tienen un tumor adrenal. Probablemente no hay un predominio de las formas malignas ni de las benignas, ya que algunos autores describen con mayor frecuencia adenocarcinomas8, mientras que otros describen adenomas como más prevalentes2.
Los adenomas adrenocorticales son comunes en perros mayores y se reportan de forma aislada en gatos. Histológicamente están rodeados por una cápsula y comprimen el resto del la corteza adyacente normal. Los adenocarcinomas suelen tener un mayor tamaño y se caracterizan por invasión de tejidos adyacentes, incluyendo la vena cava caudal o presencia de metástasis2.
Las características citomorfológicas (Tabla 2) se describen de forma conjunta para ambos (adenomas y adenocarcinomas) por sus similitudes y por existir un solapamiento morfológico en ambas condiciones. Las células son similares a las descritas previamente (en la glándula adrenal normal y en la hiperplasia adrenocortical).
| Tabla 2. Principales características citomorfológicas diferenciales de tumores adrenocorticales y feocromocitomas en perros y gatos7 . |
| Tumores adrenocorticales | Feocromocitomas |
| Arquitectura general | Abundantes células intactas, aisladas o en grupos cohesivos, con bordes celulares bien definidos. Puede haber disposición perivascular. | Abundantes núcleos desnudos homogéneos, con un patrón de cromatina finamente granular, sobre un fondo azulado. A menudo se encuentran células distribuidas en hileras o en rosetas. Puede haber disposición perivascular. |
| Células intactas | Frecuentes. | Raras. |
| Ratio núcleo:citoplasma | Bajo. | Alto. |
| Citoplasma | Azulado, marcadamente vacuolado (frecuentes vacuolas claras/lipoides de pequeño a mediano tamaño). | Azul claro, finamente granulado. |
| Núcleo | Redondo a ovalado, central a periférico, con patrón de cromatina grueso a condensado. | Redondo a ovalado con cromatina finamente punteada. |
| Nucleolo | No visible a prominente. | Generalmente no visible. |
| Otras características | Puede haber precursores hematopoyéticos (hematopoyesis extramedular). | |
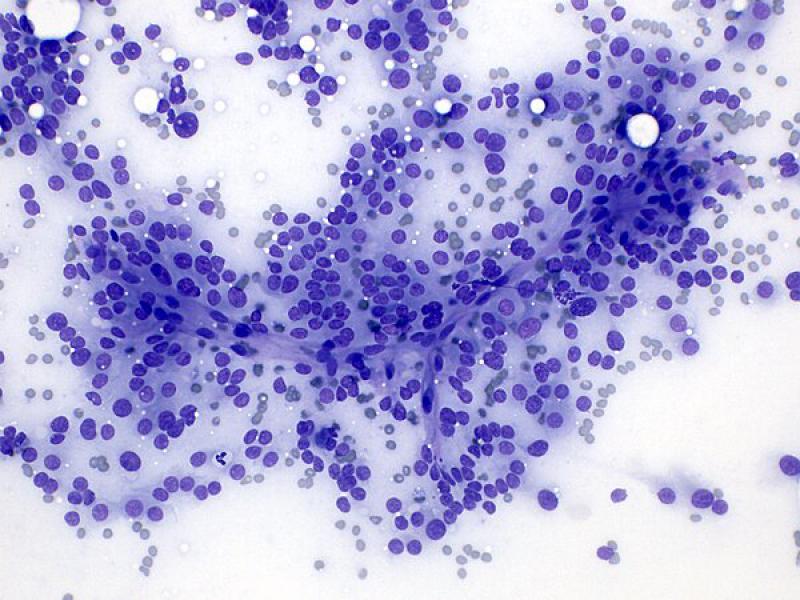
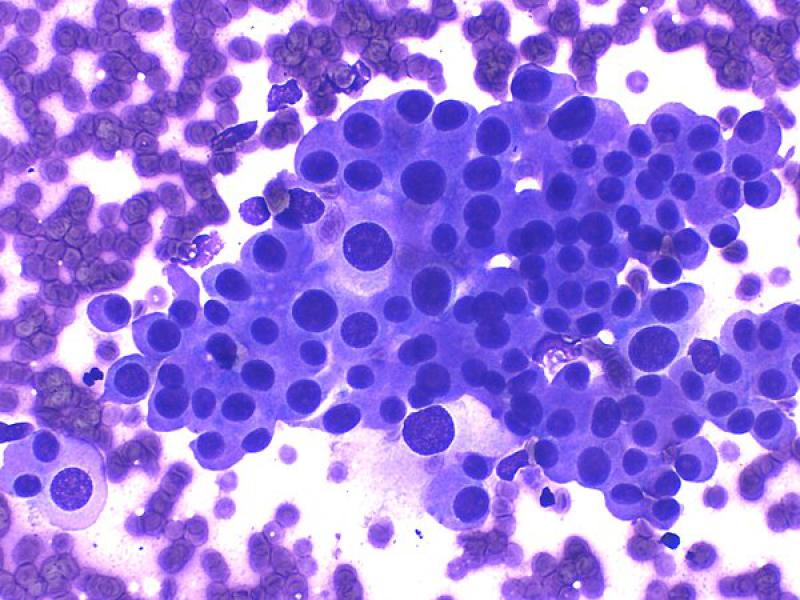
Aunque se ha descrito que la apariencia general puede ser la de otros tumores endocrinos con numerosos núcleos desnudos sobre una abundante cantidad de citoplasma de células rotas8, normalmente suelen encontrarse células intactas en número moderado a elevado, formando agregados de tamaño variable7. Estas tienen morfología redondeada a poligonal, una moderada cantidad de citoplasma azul medio con frecuentes vacuolas claras puntiformes y un bajo ratio núcleo:citoplasma (Figura 7A y B). Los núcleos son redondeados, en posición paracentral a excéntrica, de tamaño uniforme, con cromatina firmemente punteada a heterogénea y generalmente contienen un único nucleolo visible a prominente1,7,8.
La disposición perivascular (Figura 8A) puede encontrarse tanto en neoplasias adrenocorticales como en feocromocitomas, por lo que no debe utilizarse como característica diferenciadora entre ambos1,7.
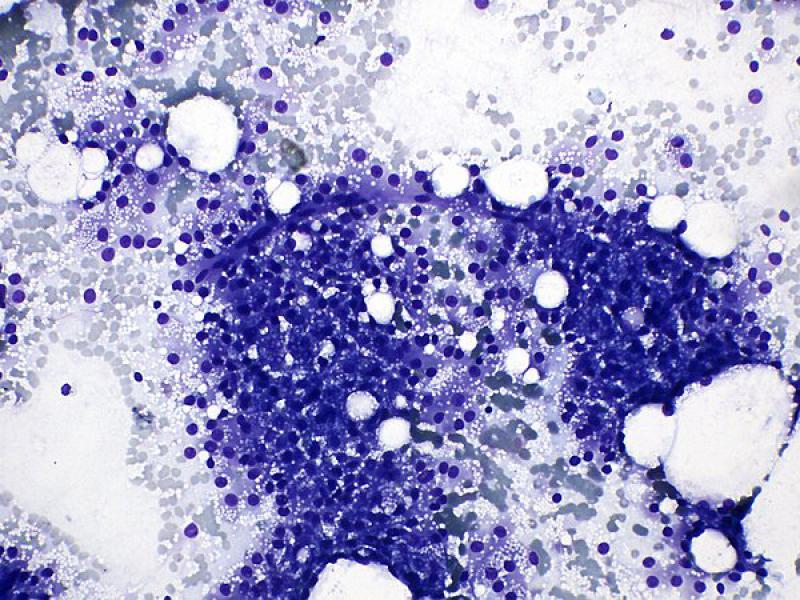
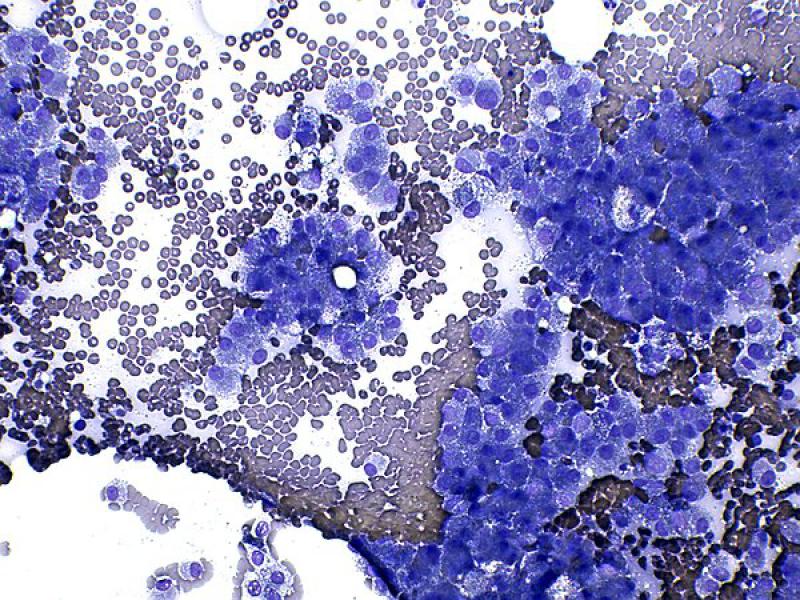
En los tumores adrenales pueden observarse evidencias de hematopoyesis extramedular (Figura 9), incluyendo la presencia de megacariocitos, precursores mieloides y eritroides. Este fenómeno se describe con mayor frecuencia en adenomas (83 %) que en carcinomas (12 %)16. También puede encontrarse adipocitos y depósitos minerales8.
Mediante citología no se puede diferenciar entre hiperplasia adrenocortical (p. ej., en hiperadrencorticismo hipofisario dependiente) de adenomas, por lo que se deberán utilizar otras técnicas como pruebas laboratoriales (p. ej., medición de ACTH endógena), de imagen e histopatología8. Normalmente se observa un incremento bilateral en los casos de hiperadrenocorticismo hipofisario dependiente, mientras que en casos de tumor adrenocortical únicamente una de las glándulas adrenales está incrementada de tamaño y generalmente la glándula contralateral se encuentra atrofiada.
Las células de los adenocarcinomas pueden ser más pleomórficas que las de los adenomas, incluyendo un mayor tamaño celular, anisocariosis y nucleolos múltiples y prominentes. Sin embargo, debido al solapamiento en las características de ambas entidades, no se puede realizar una distinción clara entre adenomas y adenocarcinomas bien diferenciados. Cuando existen criterios de malignidad suficientes (Figura 7C y D) se puede emitir un diagnostico de adenocarcinoma con suficiente certeza, pero en ausencia de estos, un adenocarcinoma no se puede descartar y se requerirán pruebas complementarias1,8.
Para confirmar malignidad es necesario evidenciar otros criterios de agresividad, tanto macroscópicos (en pruebas de imagen o examen visual [p. ej., en laparotomía exploratoria]) como microscópicos (p. ej., histopatología para detectar invasión vascular) o evidencia de metástasis distantes.
En un estudio que evaluó diferentes características histológicas de malignidad en tumores corticoadrenales caninos, encontraron varios criterios útiles en la diferenciación entre adenomas y adenocarcinomas: tamaño, fibrosis periférica, invasión capsular, patrón de crecimiento trabecular, hemorragia, necrosis, hematopoyesis, trombos de fibrina y vacuolización citoplasmática16.
En este mismo estudio evaluaron el marcador de proliferación celular Ki-67, observando una expresión significativamente más alta en adenocarcinomas comparado con adenomas o glándulas adrenales normales. Establecieron como punto de corte la expresión de este antígeno en el 2.4 % de las células, diferenciando adenomas de carcinomas en el 96 % de los perros16.
Mielolipoma
En perros y gatos los mielolipomas son tumores benignos2, poco frecuentes, que suponen un 3.8 % de los tumores adrenales17. Se originan en la corteza y en ocasiones se extienden hacia la médula. Existen varias hipótesis respecto a la etiología de los mielolipomas que incluyen: un desarrollo a partir de restos embrionarios, una metaplasia de la corteza adrenal o por embolismo de células de la médula ósea18.
En citología se observan adipocitos maduros, vacuolas lipídicas y precursores hematopoyéticos, incluyendo megacariocitos, precursores eritroides y mieloides/granulocíticos que teóricamente muestran una maduración completa y ordenada19.
Ante la presencia de precursores hematopoyéticos se debe establecer un diagnóstico diferencial entre mielolipoma y hematopoyesis extramedular. Como se ha mencionado, en los mielolipomas además del componente hematopoyético se observa tejido adiposo y generalmente se trata de una lesión encapsulada, si bien este último aspecto no puede evaluarse mediante citología. Por el contrario, la hematopoyesis extramedular carece de adipocitos y no está encapsulada/circunscrita18.
Tumores primarios de la médula adrenal
Feocromocitoma
Los feocromocitomas son los tumores más frecuentes de la médula adrenal en perros y gatos, aunque en estos últimos son mucho menos comunes. Ocurren principalmente en pacientes de edad media a avanzada. Esta neoplasia tiene origen en las células cromafines o feocromocitos, englobando tanto tumores benignos como malignos. En general suelen ser neoplasias invasivas localmente y pueden metastatizar a diferentes órganos (pulmón, hígado, riñón, bazo, páncreas, etc.)1,2.
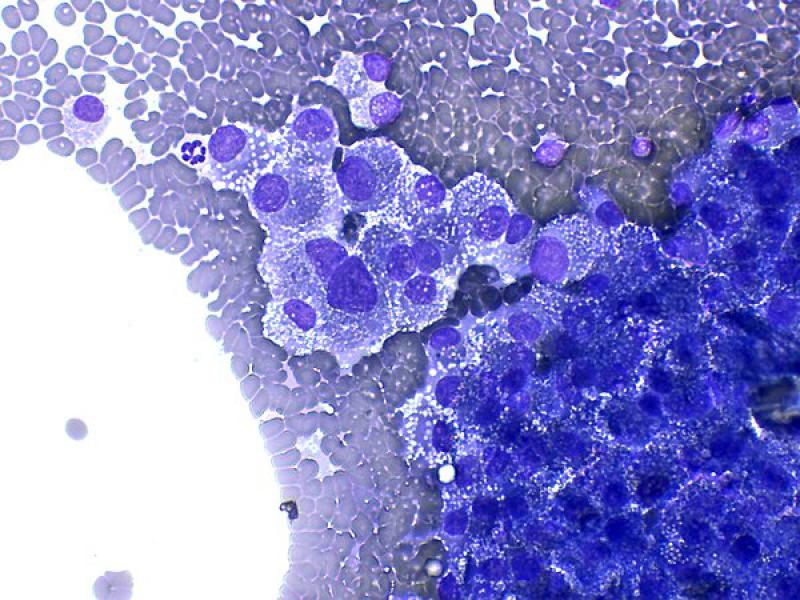
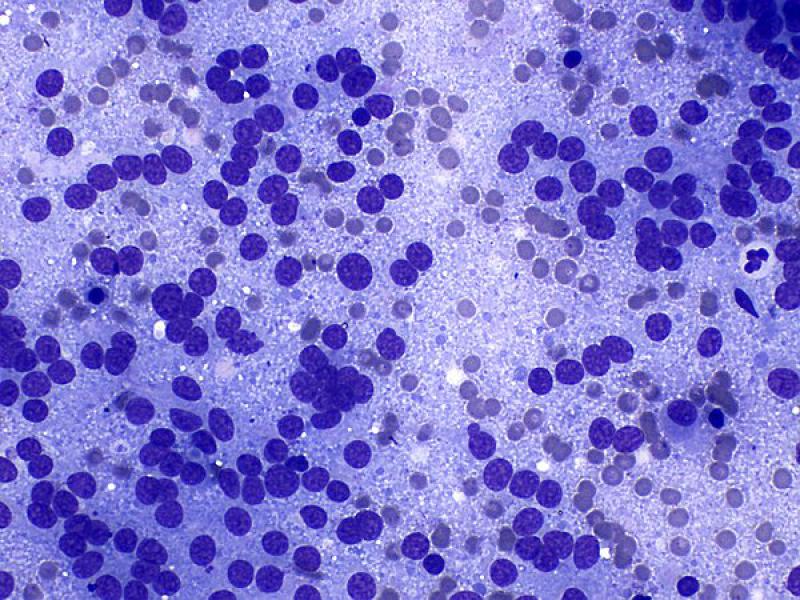
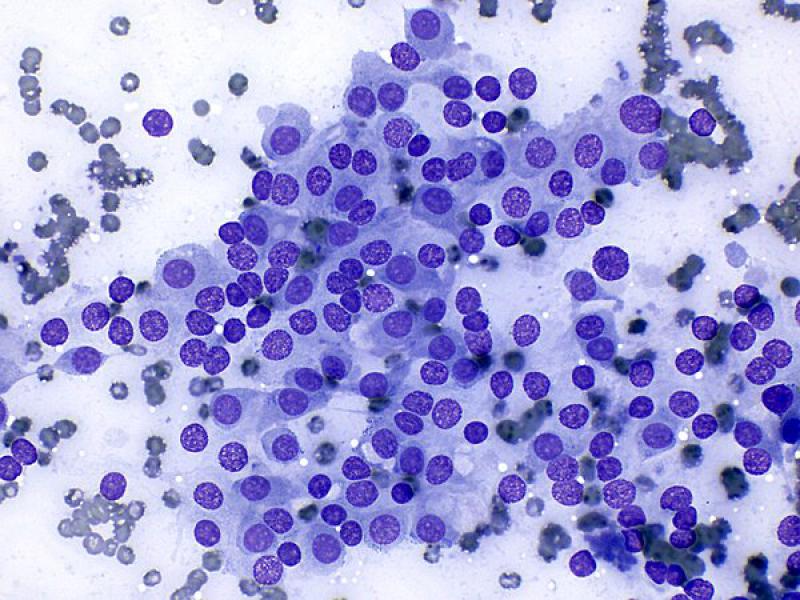
Las citologías (Tabla 2) de los feocromocitomas suelen ser de elevada celularidad1,2 y con una apariencia similar a la descrita en otras lesiones de tipo neuroendocrino, como los tumores endocrinos del páncreas, los carcinomas tiroideos con origen en las células C, tumores paratiroideos y quemodectomas. Suele observarse un número elevado de núcleos desnudos sobre un fondo azulado formado por el citoplasma de las células rotas sin bordes celulares definidos (Figura 10A). Una posible explicación a este fenómeno podría ser la suma de un incremento de la fragilidad de la membrana celular junto con una mayor resistencia de la membrana nuclear1,8.
Las células se pueden distribuir de forma aislada o formando pequeños grupos moderadamente cohesivos. Tanto los núcleos desnudos como las células intactas pueden adquirir una disposición en empalizada o formando estructuras de tipo “roseta” o “pseudo-acinares”. La disposición perivascular (Figura 8B), como se ha descrito previamente, puede observarse tanto en feocromocitomas como en tumores corticoadrenales1,7.
Utilizando tinciones de tipo Romanowsky, el citoplasma de las células intactas es azul claro y con frecuencia tiene una fina granulación rosada dando apariencia anfófila (azul y rosa). Los núcleos se encuentran en posición paracentral a excéntrica, son redondos a ovalados y en ocasiones contienen un pequeño nucleolo visible (Figura 10B, C y D). El ratio núcleo citoplasma es elevado. Las atipias celulares no se asocian con el comportamiento clínico1,7,8.
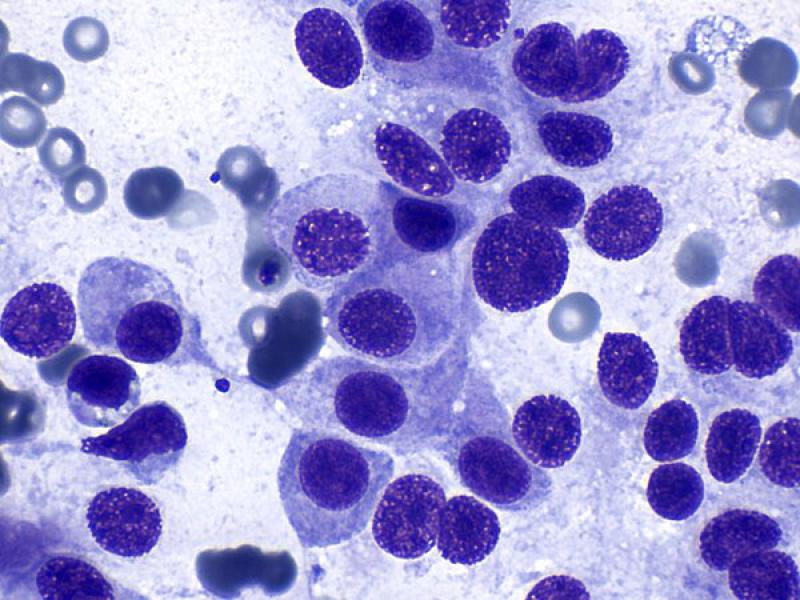
Pueden utilizarse algunas tinciones inmunocitoquímicas como la cromogranina A y la sinaptofisina en especímenes citológicos para apoyar el diagnóstico. De igual modo, aunque no se utiliza de forma rutinaria, mediante microscopia electrónica puede ser de ayuda par la demostración de los gránulos citoplasmáticos neurosecretores8.
En caso de obtener un fragmento de tejido, se puede aplicar la solución de Zenker (dicromato potásico) sobre un corte del tejido y, pasados unos minutos, en caso de tratarse de un feocromocitoma se forma un pigmento marrón oscuro por la oxidación de las catecolaminas2.
La citología no es capaz de predecir el comportamiento biológico de los tumores de médula adrenal. En su lugar deben utilizarse otros criterios, principalmente la evaluación microscópica y macroscópica (por histología, visualización directa post-mortem o mediante pruebas de imagen) de los tejidos adyacentes y la presencia de metástasis1. No se observa correlación entre el grado de atipias celulares (que suelen ser leves) y el comportamiento biológico. Incluso los tumores de pequeño tamaño y sin atipias celulares pueden mostrar invasión local y causar metástasis lejanas8.
En general, el pronóstico de los pacientes con feocromocitoma es malo porque en el momento del diagnóstico, el 50 % o más de estos tumores no son resecables debido a invasión temprana del sistema venoso o por metástasis lejana a través de la vena cava caudal8.
Neuroblastoma
Son tumores muy poco frecuentes que se describen en perros jóvenes, típicamente de menos de 3 años. Esta entidad puede ocurrir en diferentes localizaciones anatómicas, entre las que se incluye la glándula adrenal (médula). En la citología se observa una población de células redondeadas, con una escasa cantidad de citoplasma azulado, núcleos redondos e hipercromáticos que recuerdan a linfocitos, y pleomorfismo celular leve. Estas células también se disponen formando grupos con apariencia epitelial y, en ocasiones, formando “pseudorosetas” rodeando un material rosa y fibrilar. Para el diagnóstico definitivo se requiere de examen histopatológico con inmunohistoquímica1,2.
Ganglioneuroma
Al igual que los neuroblastomas, son tumores muy poco frecuentes con origen en la médula. Los ganglioneuromas suelen ser benignos de pequeño tamaño8. En veterinaria, este tumor únicamente ha sido descrito histológicamente. En medicina humana, la citología de ganglioneuromas contiene células ganglionares y células con morfología fusiforme. Las células ganglionares son grandes (hasta 40 μm de diámetro), redondas a poligonales, con una abundante cantidad de citoplasma azulado a rosado que, en ocasiones, tienen prolongaciones citoplasmáticas. Los núcleos miden hasta 18 μm y tienen morfología redondeada, con un nucleolo prominente1,2.
Neoplasia metastática
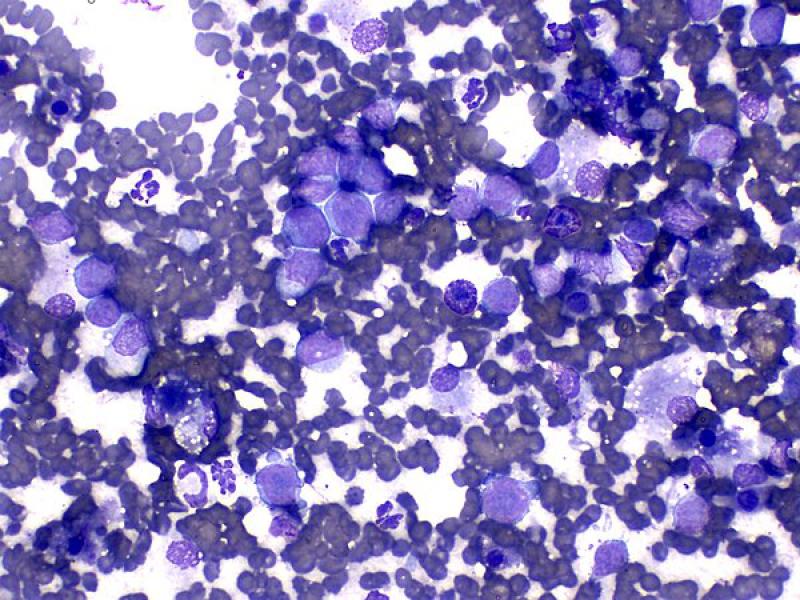
En medicina humana es frecuente el uso de la citología para el diagnóstico de metástasis en glándula adrenal. En algunos casos, el crecimiento tumoral metastático puede desplazar la población adrenal normal y causar insuficiencia adrenal. En personas, se han descrito metástasis por melanoma, sarcoma histiocítico, carcinoma, liposarcoma, neoplasia maligna de origen desconocido y diferentes subtipos de linfoma1.
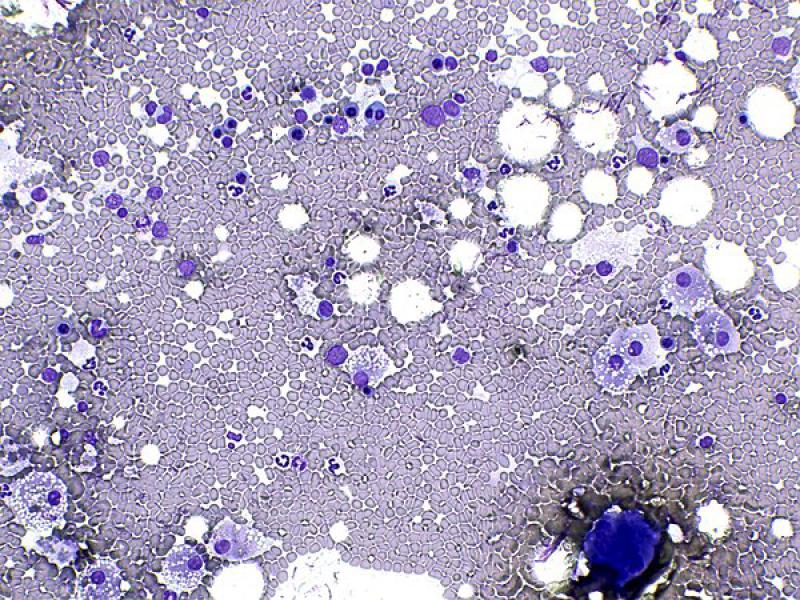
Aunque en veterinaria la prevalencia de metástasis en glándula adrenal (Figura 11) parece ser elevada, en conocimiento de los autores, no existen publicaciones que utilicen la citología para realizar el diagnóstico. Los principales tumores que metastatizan a glándula adrenal en animales son los carcinomas, hemangiosarcomas o melanomas entre otros16.
Conclusión
La citología de las glándulas adrenales puede ser útil en diferentes patologías, si bien su principal utilidad es la de diferenciar un origen adrenocortical de un origen medular en las masas adrenales. Sin embargo, existen importantes limitaciones de esta técnica, principalmente a la hora de evaluar la malignidad de estas neoplasias o al examinar glándulas afectadas por procesos inflamatorios o hiperplásicos.
Bibliografía
- Bertazzolo W. Adrenal Gland. In: Sharkey LC, Radin MJ, Seelig D, eds. Veterinary Cytology. 1st ed. WILEY Blackwell; 2020:608-615.
- Little EK, Wills TB, Haldorson TG. The adrenal gland. In: Valenciano AC, Cowell RL, eds. Cowell and Tyler’s Diagnostic Cytology and Hematology of the Dog and Cat. 5th ed. ELSEVIER; 2019:507-511.
- Pey P, Diana A, Rossi F, et al. Safety of percutaneous ultrasound-guided fine-needle aspiration of adrenal lesions in dogs: Perception of the procedure by radiologists and presentation of 50 cases. Journal of Veterinary Internal Medicine. 2020;34(2):626-635.
- Jhala NC, Jhala D, Eloubeidi MA, et al. Endoscopic ultrasound-guided fine-needle aspiration biopsy of the adrenal glands: Analysis of 24 patients. Cancer. 2004;102(5):308-314.
- Varadarajulu S, Fraig M, Schmulewitz N, et al. Comparison of EUS-guided 19-gauge Trucut needle biopsy with EUS-guided fine-needle aspiration. Endoscopy. 2004;36(5):397-401.
- Sumner JA, Lacorcia L, Rose AM, Woodward AP, Carter JE. Clinical safety of percutaneous ultrasound-guided fine-needle aspiration of adrenal gland lesions in 19 dogs. Journal of Small Animal Practice. 2018;59(6):357-363.
- Bertazzolo W, Didier M, Gelain ME, et al. Accuracy of cytology in distinguishing adrenocortical tumors from pheochromocytoma in companion animals. Veterinary Clinical Pathology. 2014;43(3):453-459.
- Choi US, Arndt T. Endocrine/Neuroendocrine system. In: Raskin RE, Meyer DJ, eds. Canine and Feline Cytology: A Color Atlas and Interpretation Guide. 3rd ed. ELSEVIER; 2015:430-452.
- Frank C, Valentin S, Scott-Moncrieff J, Miller M. Correlation of inflammation with adrenocortical atrophy in canine adrenalitis. Journal of Comparative Pathology. 2013;149(2-3):268-279.
- Momo C, Alves De Souza Rocha N, Rodrigues Reina Moreira P, et al. Morphological changes and parasite load of the adrenal from dogs with visceral leishmaniasis. Revista Brasileira de Parasitologia Veterinária. 2014;23(1):30-35.
- Li L, McGraw S, Zhu K, et al. Circovirus in tissues of dogs with vasculitis and hemorrhage. Emerging Infectious Diseases. 2013;19(4):534-541.
- Quante S, Boretti FS, Kook PH, et al. Urinary catecholamine and metanephrine to creatinine ratios in dogs with hyperadrenocorticism or pheochromocytoma, and in healthy dogs. Journal of Veterinary Internal Medicine. 2010;24(5):1093-1097.
- Gostelow R, Bridger N, Syme HM. Plasma-free metanephrine and free normetanephrine measurement for the diagnosis of pheochromocytoma in dogs. Journal of Veterinary Internal Medicine. 2013;27(1):83-90.
- Salesov E, Boretti FS, Sieber-Ruckstuhl NS, et al. Urinary and plasma catecholamines and metanephrines in dogs with pheochromocytoma, hypercortisolism, nonadrenal disease and in healthy dogs. Journal of Veterinary Internal Medicine. 2015;29(2):597-602.
- Brömel C, Nelson RW, Feldman EC, et al. Serum inhibin concentration in dogs with adrenal gland disease and in healthy dogs. Journal of Veterinary Internal Medicine. 2013;27(1):76-82.
- Labelle P, Kyles AE, Farver TB, de Cock HE v. Indicators of malignancy of canine adrenocortical tumors: histopathology and proliferation index. Vet Pathol. 2004;41(5):490-497.
- Massari F, Nicoli S, Romanelli G, Buracco P, Zini E. Adrenalectomy in dogs with adrenal gland tumors- 52 cases (2002–2008). Journal of the American Veterinary Medical Association. 2011;239(2):216-221.
- Osborn M, Smith M, Senbanjo T, Crofton M, Robinson S, Rajan P. Adrenal myelolipoma-clinical, radiological and cytological findings: a case report. Cytopathology. 2002;13(4):242-246.
- Tursi M, Iussich S, Prunotto M, Buracco P. Adrenal Myelolipoma in a Dog. Veterinary Pathology. 2005;42(2):232-235.
 by Multimédica
by Multimédica