Encephalitozoonosis en conejos domésticos (Oryctolagus cuniculus)
Resumen breve
Encephalitozoon cuniculi es un parásito microsporidio, siendo el conejo doméstico (Oryctolagus cuniculus) el principal hospedador, aunque también lo pueden presentar otras especies, incluidas las personas, considerándose una zoonosis.Índice de contenidos
Resumen
Encephalitozoo cuniculi es un parásito microsporidio, siendo el conejo doméstico (Oryctolagus cuniculus) el principal hospedador, aunque también lo pueden presentar otras especies, incluidas las personas, considerándose una zoonosis. En los conejos, la transmisión se produce por vía horizontal, a través del agua y los alimentos contaminados por la orina y también por inhalación de esporas, aunque de forma esporádica, o por vía vertical, de la madre al feto, a través de la placenta afectando a las estructuras oculares. Los signos clínicos son principalmente neurológicos, renales y oculares, pero la enfermedad también puede ser subclínica, habiendo bastantes conejos asintomáticos. El diagnóstico post mortem se realiza mediante histopatología observando lesiones de meningoencefalitis granulomatosa y nefritis intersticial crónica junto con esporas en los órganos diana. Las pruebas serológicas sirven de diagnóstico ante mortem, donde se detectan títulos específicos de IgM e IgG. El tratamiento de la infección incluye fenbendazol, antibioterapia sistémica, terapia de apoyo y el tratamiento de las lesiones oculares con antiinflamatorios o incluso intervención quirúrgica, pero con una tasa de éxito variable. La administración profiláctica de fenbendazol en los conejos, las pruebas serológicas periódicas de las poblaciones de conejos y el mantenimiento de un entorno limpio son las mejores formas de reducir la transmisión de este patógeno, no sólo entre las poblaciones de conejos sino, lo que es más importante, en los seres humanos, en quienes la zoonosis puede causar resultados graves en individuos inmunodeprimidos.
Introducción
Encephalitozoon cuniculi es un parásito intracelular obligado perteneciente al filo Microsporidia causante de la encefalitozoonosis en conejos domésticos (Oryctolagus cuniculus), pudiendo afectar a otras especies domésticas como cobayas (Cavia porcellus), gatos (Felis silvestris catus), perros (Canis familiaris), aunque de forma esporádica e incluso puede infectar a las personas, considerándose una zoonosis de bajo riesgo debido a que los casos implicados son de personas inmunodeprimidas o trabajadores de animalarios y granjas de conejos1,2.
Actualmente, se considera que este microsporidio es más un hongo que un protozoo. E. cuniculi presenta un ciclo de vida directo con transmisión horizontal como vertical (transplacentaria)1. La transmisión horizontal se produce en el intestino delgado a través de la ingesta de alimento contaminado por la orina de conejos infectados, así como en el tracto respiratorio inhalando las esporas del parásito1,2. Esta vía horizontal digestiva es la más habitual y de esta forma, los conejos se pueden infectar tanto en edades tempranas, siendo la fase de lactancia la de mayor riesgo, como en edades adultas. Asimismo, la vía vertical también es importante para el contagio ya que los gazapos nacen con el parásito tras haberse transmitido a través de la placenta1,2,3.
Una vez el conejo está infectado, los lugares de predilección del parásito son el sistema nervioso central, los riñones, el cristalino, los pulmones y el miocardio. Las esporas son eliminadas a través de la orina de manera intermitente para continuar el ciclo de infección. Estas esporas pueden sobrevivir en el medio hasta 4 semanas aproximadamente a temperatura ambiente1,4.
Signos clínicos
El cuadro clínico de un conejo infectado por E. cuniculi puede variar desde una forma subclínica hasta producir una muerte súbita. La enfermedad se puede presentar de distintas formas y afectar a distintos órganos4.
Los signos neurológicos constituyen la mayoría de las presentaciones en relación con un supuesto caso de encefalitozoonosis y pueden aparecer a cualquier edad. El síndrome vestibular es el signo más evidente que puede observar el tutor del animal (Figura 1), al ver en una inclinación clara de la cabeza o andar en círculos, por ejemplo1,4.

Figura 1. Conejo con síndrome vestibular hacia el lado izquierdo.
Los signos vestibulares varían en gravedad, desde una leve inclinación de la cabeza (head tilt) hasta ser incapaz de incoporarse por sí mismo, rodar sobre sí mismo y presentar nistagmos en el ojo del lado afectado y ataxia1,2. La aparición de estos signos suele ser repentina. Otros signos neurológicos que pueden presentar son convulsiones y comportamientos agresivos repentinos, aunque no son tan habituales como los anteriores. Estos signos no son patognomónicos de la enfermedad y hay que hacer diagnóstico diferencial con trauma, otitis medias y/o internas por Pasteurella multocida, neoplasias3.
Las manifestaciones renales provocadas por esta enfermedad suelen ser pérdida de peso causada por una insuficiencia renal crónica, incontinencia urinaria, polidipsia y poliuria, siendo posible que la incontinencia urinaria sea debido a un problema neurológico provocada por el parásito. Aun así, hay bastantes diagnósticos diferenciales con respecto a la incontinencia urinaria y la insuficiencia renal crónica como pueden ser la urolitiasis, infección del tracto urinario, obesidad, artritis3,4.
Los signos oftalmológicos incluyen las cataratas, uveítis e hipopion. Estos signos se deben a la rotura del cristalino. La cápsula anterior del cristalino se rompe espontáneamente y provoca una uveítis facoclástica (Figura 2).
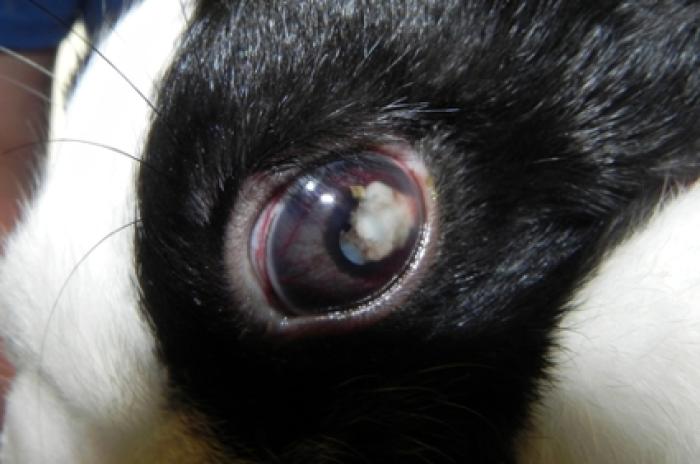
Figura 2. Uveítis facoclástica en un conejo doméstico.
Se cree que la transmisión vertical de E. cuniculi invade el cristalino en desarrollo de los conejos en el útero cuando la cápsula del cristalino es muy fina o está ausente. Después, el parásito produce la rotura del cristalino en su punto más delgado de la superficie anterior, liberando material del cristalino en la cámara anterior y provocando una uveítis facoclástica. La afección suele ser unilateral1,2,3.
Otros signos que pueden aparecer en esta enfermedad son pérdida de peso de origen desconocido, anorexia y diarrea. El diagnóstico de E. cuniculi en estos casos pueden identificar al parásito como un factor en estos procesos de enfermedad inespecíficos, pero no deben excluir un examen completo1,3.
Diagnóstico
El método de diagnóstico más común es la serología mediante la detección de anticuerpos IgG e IgM. La titulación de anticuerpos frente a E. cuniculi se realiza generalmente con un ELISA, pudiéndose utilizar tanto suero como plasma, sin necesidad de emplear un gran volumen para ello. La interpretación de esta serología se tiene que realizar según la sintomatología y el historial clínico del conejo y en la mayoría de los casos, esta técnica confirma la exposición, pero no la enfermedad1,2.
Un animal seropositivo puede indicar que sea portador (IgG positivo/IgM negativo), que presente una infección reciente o aguda (IgG negativo/IgM positivo) o que se haya reinfectado o reactivado de una infección latente (IgG positivo/IgM positivo) (Tabla 1).
| IgG | IgM | |
|---|---|---|
| Portador | + | - |
| Infección reciente/aguda | - | + |
| Reinfección/reactivación | + | + |
| No infección | - | - |
Tabla 1. Interpretación serología E. cuniculi.
La hematología de conejos infectados con E. cuniculi que mostraban signos de enfermedad renal mostraron cambios como el aumento del recuento absoluto de neutrófilos y un hematocrito bajo (<33 %), aunque pueden pasar desapercibidos. La bioquímica es una herramienta bastante más útil, donde se han observado cambios en los valores renales, especialmente en infecciones agudas por encefalitozoonosis. En un estudio, los valores de nitrógeno ureico en sangre (BUN), creatinina, fosfatasa alcalina (ALP), colesterol, fósforo y glucosa eran significativamente más elevados en los conejos seropositivos que en los seronegativos. En otro estudio también se señalaron valores más elevados de concentración de urea y ALP en animales seropositivos, pero también se ha informado de una disminución de los niveles de fósforo y potasio en conejos afectados con signos de enfermedad renal3.
El empleo del proteinograma junto con la serología puede ser de ayuda en el diagnóstico de esta enfermedad. La elevación de las β-globulina y las γ-globulina pueden ser debido a procesos inflamatorios crónicos como la encefalitozoonosis, infecciones bacterianas, víricas o fúngicas, enfermedades inmunomediadas o procesos tumorales, así como un ratio bajo de albúmina/globulina puede ayudar al diagnóstico de una encefalitozoonosis3,5.
La técnica de PCR no es muy útil en los casos de animales vivos debido a la escasa detección del parásito por este método en distintos tipos de muestras, así como depender del estadío de la enfermedad (aguda, latente o reinfección) ya que la carga del parásito es distinta y aunque la vía de excreción del parásito es a través de la orina, la cantidad de esporas que se eliminan es intermitente y es complicado detectar el momento adecuado de excreción para la toma de muestras y realizar la PCR de esa orina1,2.
En histopatología, los órganos más afectados son los riñones y el cerebro, presentando una inflamación granulomatosa en estos tejidos, así como en otros como el hígado o el corazón, además de observarse esporas en ellos2.
Tratamiento
Los objetivos del tratamiento deben incluir la reducción de la proliferación y migración de las esporas del parásito, la reducción de la inflamación, el tratamiento de la enfermedad concurrente y el tratamiento de los signos clínicos neurológicos graves1,3.
Actualmente, no hay ningún tratamiento que elimine por completo el parásito, pero sí existen tratamientos que resuelven el cuadro clínico y suelen tener un buen pronóstico siempre y cuando no haya un daño renal grave ni otras enfermedades que agraven el cuadro3.
Según la experiencia del autor, el protocolo de tratamiento frente a un caso de E. cuniculi sistémico se puede realizar de la siguiente forma.
Se pauta fenbendazol, un antiparasitario frente a helmintos que en casos de encefalitozoonosis tiene gran efectividad a dosis de 20-25 mg/kg por vía oral, una vez al día, durante al menos 28 días. En algunos casos en los que el fenbendazol no dé los resultados deseados, se puede cambiar por albendazol a 25 mg/kg por vía oral, una vez al día durante 30 días. Si la sintomatología persiste, se puede repetir este ciclo de nuevo, aunque el uso prolongado de estos antiparasitarios puede causar leucopenias2,3.
Además de ello, si presenta signos neurológicos tales como ladeo de cabeza, andar en círculos sobre sí mismo, nistagmos, en la experiencia del autor, se recomienda el uso de corticoides frente a antiinflamatorios no esteroideos, como la dexametasona (0.1-0.2 mg/kg por vía subcutánea o intramuscular, dos veces al día), debido a que puede atravesar la barrera hematoencefálica y reducir la inflamación en esa zona aunque su uso es controvertido debido a que si se utilizan durante un tiempo prolongado pueden causar inmunosupresión en los conejos, por lo que deben usarse con precaución y retirarlos una vez resueltos los signos neurológicos. También se pueden emplear la hidroxicina (2 mg/kg por vía oral, dos veces al día) y cianocobalamina (0.5 mg/kg por vía oral, una vez al día), en los casos de síndrome vestibular con rolling (pérdida de equilibrio y caídas laterales con giro sobre su propio eje). Asimismo, el uso de benzodiacepinas como el diazepam (1-2 mg/kg por vía subcutánea o intravenosa) o midazolam (0.5-2 mg/kg por vía subcutánea o intravenosa) se puede emplear para controlar la actividad convulsiva y para actuar como un sedante suave en animales con síndrome vestibular grave1,2. Aunque los conejos no son capaces de vomitar y carecen del centro del vómito en el bulbo raquídeo, los fármacos antieméticos como la metoclopramida (0.5 mg/kg por vía oral o subcutánea, tres veces al día) y el maropitant (1 mg/kg por vía subcutánea) pueden disminuir los signos vestibulares2,3.
En las manifestaciones agudas de encefalitozoonosis en conejos, además de la administración de fenbendazol, se recomienda una antibioterapia sistémica de amplio espectro para cualquier infección bacteriana concurrente o secundaria. Los más empleados son el trimetoprim-sulfametoxazol (40 mg/kg por vía oral, dos veces al día) o enrofloxacino (10 mg/kg por vía oral, dos veces al día) durante 7-10 días3.
En los casos que hay daño ocular por el continuo roce de la mucosa conjuntival sobre el suelo al tener la cabeza ladeada, se deben aplicar antiinflamatorios tópicos y comprobar que no hay úlceras corneales, mediante el uso de tinciones de fluoresceína. Además, para evitar este tipo de daños y que se golpee contra el suelo u objetos durante los ataques de rolling, es conveniente acolchar la instalación del animal con mantas o toallas, por ejemplo2,3.
En los casos que haya únicamente signos oftalmológicos como la uveítis, se puede instaurar un tratamiento conservador con fenbendazol y el uso de corticoesteroides y antibióticos tópicos de dos a tres veces al día (dexametasona y oxitetraciclina, respectivamente) aunque en ocasiones suelen derivar a glaucomas y cataratas que terminan con la enucleación del ojo sin que esto impida realizar una vida adecuada para el animal2,3.
Respecto a la encefalitozoonosis renal, el tratamiento que se pauta es el mismo que el realizado en un caso sistémico evitando el uso de antiinflamatorios no esteroideos ya que puede provocar más daño renal y empeorar el cuadro. En estos casos, es importante asegurar una ingesta adecuada de agua y ser necesaria la aplicación de fluidoterapia intravenosa. Está indicada una dieta baja en calcio debido al deterioro de la excreción renal de calcio y al riesgo de mineralización de los tejidos blandos. El heno contiene niveles de calcio óptimo, pero no es excesivo y debe evitarse el consumo de la alfalfa por tener un alto contenido en calcio, así como espinacas, acelgas, hojas de zanahoria2,3.
Prevención y control
E. cuniculi es resistente al medio ambiente, pero las esporas pueden eliminarse eficazmente utilizando varios protocolos de desinfección. Las esporas son sensibles a la lejía al 0.1 % con un tiempo de contacto de 10 minutos, y el etanol (70 %) mata eficazmente las esporas con un tiempo de contacto de 30 segundos. El hidróxido de sodio (1 %), el formaldehido (0.3 %) y el peróxido de hidrógeno (1 %) matan eficazmente las esporas con un tiempo de contacto de 30 minutos2,3.
La prevención de la infección por E. cuniculi tanto en conejos como en otras especies susceptibles, especialmente en humanos, es de suma importancia. Debido a la amplia propagación del organismo y a todas sus características, no es lo más sencillo de conseguir. El primer paso, y el más esencial, sería establecer colonias de cría de conejos libres de E. cuniculi, lo que, por desgracia para los criadores, puede requerir mucho tiempo y un elevado coste. Esto debe lograrse mediante pruebas serológicas periódicas de las poblaciones de conejos, con el aislamiento de los individuos sanos seronegativos de los demás en jaulas separadas. Especialmente en las instalaciones de cría, el análisis de los niveles de anticuerpos debe realizarse en conejos jóvenes cada 2 semanas durante 2 meses, con la eliminación de todos los animales seropositivos. Sólo los conejos que muestren resultados negativos durante todo un mes deben utilizarse para la futura cría, y a continuación deben someterse a pruebas serológicas mensuales para confirmar que están libres de la enfermedad. Es posible que, una vez que el parásito entre en una colonia, sea necesario utilizar el sistema de "todo dentro y todo fuera" para eliminar toda la población y realizar una desinfección a fondo del entorno antes de introducir nuevos conejos. Además, utilizar razas de conejos procedentes de cuniculturas libres de encefalitozoonosis, como los conejos de orejas caídas y los conejos Rex, que se cree que son más resistentes a la enfermedad. En estos lugares de cría, se deben desinfectar habitualmente los comederos y bebederos y que estos estén separados de la zona de excreción de orina para evitar la contaminación de las esporas en el alimento y el agua2,3.
En el caso de los conejos que no se tenga la seguridad de que procedan de colonias libres de E. cuniculi, la mejor forma de reducir la propagación de la infección sería la administración profiláctica de fenbendazol por vía oral, utilizando el mismo protocolo de 28 días mencionado anteriormente. Esto también debería aplicarse a los animales recién adquiridos antes de ponerlos en contacto con otros conejos. Lo que hay que tener en cuenta es que este método no garantiza que no puedan aparecer futuras infecciones2,3.
Otras medidas profilácticas que pueden aplicarse son la reducción del contacto de los conejos con otros conejos o incluso con la fauna salvaje, la desinfección exhaustiva del entorno utilizando sustancias como las mencionadas anteriormente, una higiene adecuada mediante el lavado y desinfección de las manos después de manipular a los conejos2,3.
Conclusiones
E. cuniculi es un organismo parásito eucariota, unicelular, intracelular obligado y ubicuo del filo Microsporidia, siendo el conejo doméstico (O. cuniculus) su principal hospedador, pero también transmisible a otras especies, así como en humanos, considerándose una zoonosis potencial. En los conejos, la transmisión se produce por vía horizontal, a través del agua y los alimentos contaminados por la orina o, en raras ocasiones, por inhalación de esporas, o por vía vertical, de la madre al gazapo, a través de la placenta afectando a las estructuras oculares. Los signos clínicos en los conejos infectados son principalmente de neurológicos, renales y oculares, pero la enfermedad también puede ser subclínica, con un número significativo de portadores asintomáticos. El diagnóstico post mortem de la encefalitozoonosis se realiza mediante histopatología revelando lesiones de meningoencefalitis granulomatosa y nefritis intersticial crónica junto con esporas en los órganos diana. Las pruebas serológicas son la herramienta de diagnóstico ante mortem más utilizada, donde se detectan títulos específicos de IgM e IgG. El tratamiento de la infección suele incluir fenbendazol, antibioterapia sistémica, terapia de apoyo y el tratamiento de las lesiones oculares con antiinflamatorios o incluso intervención quirúrgica, pero con una tasa de éxito variable. La administración profiláctica de fenbendazol en los conejos, las pruebas serológicas periódicas de las poblaciones de conejos y el mantenimiento de un entorno limpio son las mejores formas de reducir la transmisión de este patógeno, no sólo entre las poblaciones de conejos sino, lo que es más importante, en los seres humanos, en quienes la zoonosis puede causar resultados graves en individuos inmunodeprimidos.
Bibliografía
1. Harcourt-Brown FM. Encephalitozoon cuniculi infection in rabbits. Semin Avian Exot Pet Med. 2004; 13 (2):86-93.
2. Latney LV, Bradley CW, Wyre NR. Encephalitozoon cuniculi in pet rabbits: diagnosis and optimal management. Vet Med Res Rep. 2014; 5:169-80.
3. Doboși AA, Bel LV, Paștiu AI, Pusta DL. A Review of Encephalitozoon cuniculi in Domestic Rabbits (Oryctolagus cuniculus). Biology, Clinical Signs, Diagnostic Techniques, Treatment, and Prevention. Pathogens. 2022;11(12):1486.
4. Meredith A, Lord B. BSAVA Manual of Rabbit Medicine. 2014. First Edition, British Small Animal Veterinary Association.
5. Melillo A. Applications of Serum Protein Electrophoresis in Exotic Pet Medicine. Veterinary Clin North Am Exot Anim Pract. 2013; 16 (1): 211-25.
 by Multimédica
by Multimédica