Enfermedad de Cushing en cobayas
Resumen breve
En esta publicación se presenta un estudio retrospectivo de todos los casos de cobayas (Cavia porcellus) diagnosticadas con enfermedad de Cushing o hiperadrenocorticismo en la clínica veterinaria Macaronesia, en Las Palmas de Gran Canaria, en los últimos 10 años. En este se presentan cuadros de estadística en los que se analizan el sexo, la edad, los síntomas clínicos y los hallazgos analíticos que se apreciaron en estos 19 casos. Posteriormente se comparan los resultados obtenidos…Índice de contenidos
Resumen
En esta publicación se presenta un estudio retrospectivo de todos los casos de cobayas (Cavia porcellus) diagnosticadas con enfermedad de Cushing o hiperadrenocorticismo en la clínica veterinaria Macaronesia, en Las Palmas de Gran Canaria, en los últimos 10 años. En este se presentan cuadros de estadística en los que se analizan el sexo, la edad, los síntomas clínicos y los hallazgos analíticos que se apreciaron en estos 19 casos. Posteriormente se comparan los resultados obtenidos con estudios publicados anteriormente, viéndose algunas similitudes con estos, como por ejemplo, los síntomas más comúnmente observados, los cuales incluyen la alopecia y la piel fina. También se han hallado muchas discrepancias entre las que se destaca el daño hepático, del tracto urinario, algunos valores analíticos y muy importante la consideración de esta enfermedad como rara o poco común, que en este estudio se considera que realmente no es tan rara si no que está infradiagnosticada y que es necesario realizar más estudios para llegar a diagnósticos más tempranos.
Introducción
La glándula adrenal en cobayas se encuentra, al igual que en el resto de mamíferos, en la superficie craneomedial de cada riñón. La glándula adrenal derecha tiene una morfología triangular mientras que la izquierda es más alargada. Además se ha visto que existe una diferencia significativa entre ambas glándulas en cuanto a peso, longitud, grosor, anchura y volumen. Ambas son bilobuladas siendo el lóbulo lateral de mayor tamaño que el medial. La superficie caudal es levemente cóncava para adaptarse a la superficie del riñón (Figura 1). Las 2 glándulas están compuestas por la corteza que cuenta con 3 zonas: la zona glomerulosa, la zona fasciculada y la zona reticular, y la médula, estando todo ello rodeado por una cápsula, aunque la composición es la misma en las 2 glándulas se ha descrito que hay una diferencia reseñable en el grosor de las zonas1,2.
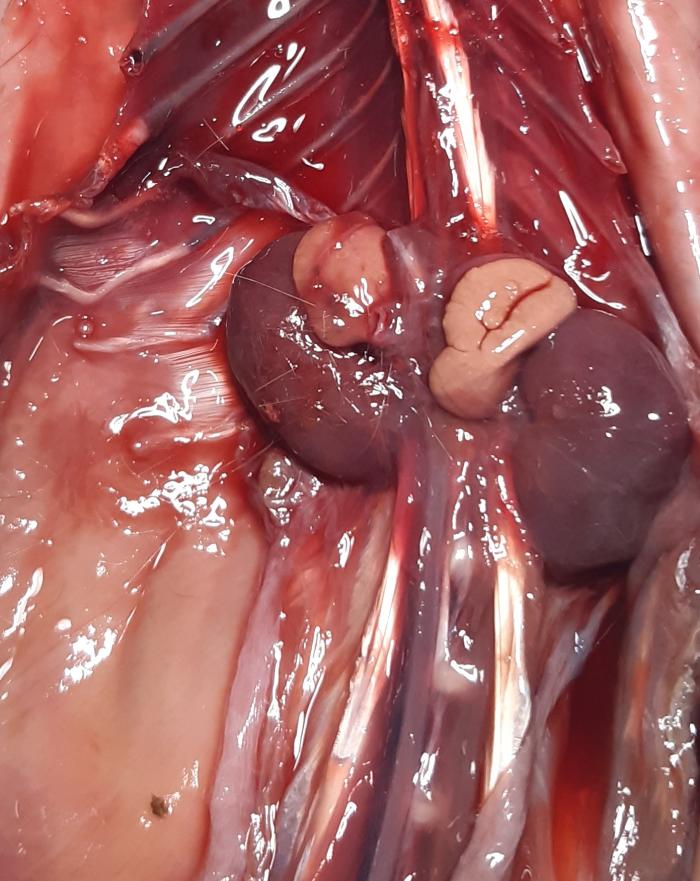
Se han realizado varios estudios desde 1940 hasta, el más reciente en 2024, en los cuales se ha estudiado el tamaño y peso de estas glándulas. En el último estudio publicado en 2014, en el que se valoraba el peso de estas glándulas en 3 cobayas hembras sanas, se obtuvieron unos resultados de 0.35 ± 0.05 g para la derecha y 0.4 ± 0.05 g para la izquierda3. En cuanto al tamaño, el último estudio realizado en 2024, aporta mediciones mediante el estudio ecográfico en 20 cobayas sanas, dando como resultado para la glándula suprarrenal derecha un largo medio de 11.55 ± 1.52 mm, un ancho medio del polo craneal de 4.69 ± 1.34 mm y para el polo caudal de 4.04 ± 0.75 mm; y en el caso de la glándula suprarrenal izquierda un largo medio de 12.64 ± 2.11 mm, un ancho medio del polo craneal de 4.83 ± 1.03 mm y para el polo caudal de 4.8 ± 1.23 mm4. Teniendo en cuenta estos parámetros y que el peso de las cobayas oscila entre 500 y 1500 g, si se compara con el perro (en el cual se han reportado dimensiones normales de entre 10 y 50 mm de longitud y 2 y 12 mm de grosor), o con gatos de menos de 4 kg (en los cuales se ha visto una longitud de 7.3 ± 2.1 mm y un ancho de 3.1 ± 0.6 mm para la adrenal izquierda; y una longitud de 7.7 ± 1.7 mm y un ancho de 3.2 ± 0.4 mm), se observa que el tamaño de las adrenales en cobayas es proporcionalmente más grande que en perros y gatos. Esto quizá podría explicar porque esta especie es probablemente de las más estresables de las que acuden a consulta de los denominados nuevos animales de compañía5,6. Las glándulas adrenales de cobayas tiene una baja eficacia, pero compensan muy bien gracias a su gran tamaño, llegando incluso a presentar concentraciones basales de cortisol basal varias veces superiores a las observadas en el gato y en el perro, lo cual también se asocia a la mayor frecuencia de liberación pulsátil de ACTH11,12.
La enfermedad de Cushing o hiperadrenocorticismo se produce por la presencia de un cortisol persistentemente elevado debido a la sobresecreción de la hormona adrenocorticotrópica (ACTH) dependiente de la hipófisis o a la sobreproducción de cortisol dependiente de las glándulas suprarrenales. El hiperadrenocorticismo se ha descrito en muchas especies, incluyendo cobayas, en las cuales se considera una afección endocrina rara. El primer caso de neoplasia adrenal se describió en 1930 y desde entonces son pocos los estudios que se han realizado al respecto, pero se ve que van aumentando los casos y estudios al respecto en los últimos años14. Entre los síntomas descritos destacan la alopecia bilateral simétrica no pruriginosa, poliuria-polidipsia y otros signos más inespecíficos como atrofia muscular, exoftalmo bilateral, piel con pérdida de elasticidad y más delgada, pérdida de peso, distensión abdominal, obesidad y letargo. El diagnóstico se basa en distintas pruebas dependiendo del tipo de muestra. En el caso de muestras de orina se puede realizar el ratio cortisol/creatinina. A pesar de considerarse la prueba menos fiable, es la menos invasiva. Puede realizarse con muestras de orina recogidas en casa mediante micción espontánea para que los resultados no se vean tan afectados por el estrés del paciente. También pueden utilizarse muestras de sangre, realizándose en este caso la medición de cortisol basal, post-estimulación por ACTH o post-depresión con dexamentasona. Esta muestra es la más extendida en otras especies como el perro y el gato, siendo más fiables, pero en cobayas puede suponer un desafío, no solo el obtener el volumen y calidad de muestra suficiente si no porque la carga de estrés puede interferir en la interpretación del resultado obtenido. Finalmente, en esta especie se ha introducido el uso de la saliva para medir el cortisol basal y post-estimulación con ACTH. Este es un método más o menos invasivo pues va a depender de si el animal requiere o no sedación para su recolección o si el tutor es capaz de tomar la muestra desde casa, pero es muy fiable y el que más se está extendiendo en medicina humana pues en la saliva, el cortisol obtenido es equivalente al cortisol libre y este está menos influenciado por interferencias que el cortisol total. Además, evita problemas debidos a la gran cantidad de cortisol basal en sangre que pueden tener las cobayas de forma normal y evita las fluctuaciones de concentración relacionadas con el estrés. Todo esto hace que esta sea la muestra de elección, aunque quizá el mayor hándicap de este método sea el valor económico7,12. Tambien en estos casos es recomendable realizar estudios ecográficos con mediciones de las glándulas y estudios del aspecto en busca de posibles neoplasias (Figura 2).
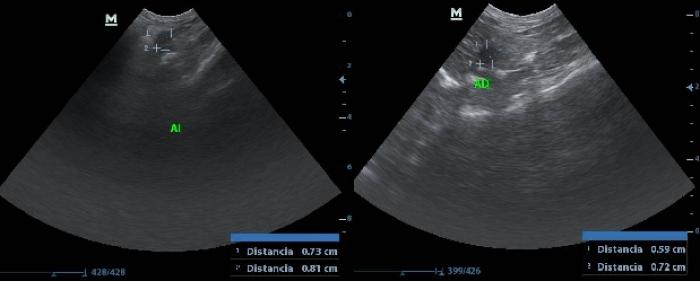
En este estudio se quiere hacer una revisión de los casos diagnosticados con síndrome de Cushing en cobayas en los últimos 10 años en una misma clínica veterinaria exclusiva para animales exóticos de Gran Canaria. Estudiando la prevalencia en cuanto a edad y sexo, los síntomas clínicos observados con mayor frecuencia y los hallazgos analíticos más comunes.
Material y método
Se han revisado 19 casos de cobayas diagnosticadas de enfermedad de Cushing en los últimos 10 años en una clínica veterinaria de Gran Canaria. El método de diagnóstico ha estado condicionado por los recursos o limitaciones del tutor, así como las pruebas asociadas como bioquímicas, urianálisis y hemogramas y el seguimiento que, en algunos casos, no se ha podido llevar a cabo.
De estos casos, el 15.79 % se diagnosticaron usando el ratio cortisol/creatinina en orina, el 36.84 % usando la medición de cortisol basal en saliva y el 47.37 % mediante la medición del cortisol basal en sangre.
De los 19 casos solo a 9 se les pudo realizar bioquímica, a 6 se les realizó examen de orina y únicamente 4 cuentan con hemograma.
Cabe destacar que de estos animales se apreció un caso de una hembra entera con hipotiroidismo y tumor ovárico y un caso en un macho entero con hiperplasia prostática coadyuvante al hiperadrenocorticismo.
Resultados
Si se tiene en cuenta el sexo de los animales estudiados se observa que el 44.44 % de los animales eran machos y el 55.56 % eran hembras, lo cual indica que no hay un predominio en cuanto al sexo (Tabla 1).
El rango de edades entre los que se encontraban los pacientes es de 1 a 7 años, siendo la media 3.9 años y la moda 5 años, por lo que es una enfermedad que se diagnostica más en animales mayores, pero se observa que puede presentarse también en animales jóvenes (ver Tabla 1).
Tabla 1. Datos del estudio ...
| Casos clínicos | Sexo / Macho | Sexo / Hembra | Edad de diagnóstico 1 año | Edad de diagnóstico 2 años | Edad de diagnóstico 3 años | Edad de diagnóstico 4 años |
|---|---|---|---|---|---|---|
| N1 | 1 | |||||
| N2 | 1 | |||||
| N3 | 1 | |||||
| N4 | 1 | |||||
| N5 | 1 | 1 | ||||
| N6 | 1 | |||||
| N7 | 1 | 1 | ||||
| N8 | 1 | 1 | ||||
| N9 | 1 | Desconocido | Desconocido | Desconocido | Desconocido | Desconocido |
| N10 | 1 | |||||
| N11 | 1 | |||||
| N12 | 1 | 1 | ||||
| N13 | 1 | 1 | ||||
| N14 | 1 | 1 | ||||
| N15 | 1 | 1 | ||||
| N16 | Desconocido | Desconocido | ||||
| N17 | 1 | 1 | ||||
| N18 | 1 | 1 | ||||
| N19 | 1 | |||||
| Total | 8 | 10 | 2 | 3 | 3 |
Tabla 1. ... Continuación
| Casos clínicos | Sexo / Macho | Sexo / Hembra | Edad de diagnóstico 5 años | Edad de diagnóstico 6 años | Edad de diagnóstico 7 años |
|---|---|---|---|---|---|
| N1 | 1 | 1 | |||
| N2 | 1 | ||||
| N3 | 1 | 1 | |||
| N4 | 1 | 1 | |||
| N5 | 1 | ||||
| N6 | 1 | 1 | |||
| N7 | 1 | 1 | |||
| N8 | 1 | ||||
| N9 | 1 | Desconocido | Desconocido | Desconocido | |
| N10 | 1 | 1 | |||
| N11 | 1 | 1 | |||
| N12 | 1 | ||||
| N13 | 1 | ||||
| N14 | 1 | ||||
| N15 | 1 | ||||
| N16 | Desconocido | Desconocido | 1 | ||
| N17 | 1 | ||||
| N18 | 1 | ||||
| N19 | 1 | 1 | |||
| Total | 8 | 10 | 5 | 3 | 1 |
En cuanto a la sintomatología se observa un amplio abanico de síntomas y enfermedades secundarias en estos animales. El principal síntoma que se aprecia es la poliuria-polidipsia, presente en el 63.16 % de los casos, al igual que la alopecia, que se observa en el mismo número de casos, siendo la mitad de ellas con prurito y la otra mitad sin prurito (Tabla2).
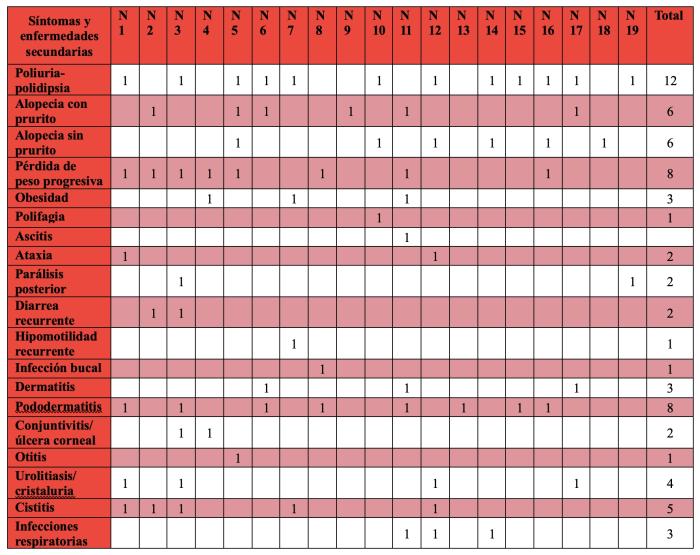
Sin embargo, en los casos con prurito se observó que aproximadamente la mitad estaban asociados a dermatitis infecciosas secundarias. Al excluir estos casos, se evidencia que las alopecias no pruriginosas fueron más frecuentes, representando el 31.58 % de los casos, en comparación con las alopecias pruriginosas, que correspondieron al 15.79 %. En cuanto al peso, al contrario de lo que ocurre en perros, que en la mayoría de casos se aprecia obesidad, en este estudio se aprecia que solo el 15.79 % de los casos presentaban esta condición. Por el contrario, el 42.11 % de los animales presentaba una bajada progresiva de peso. Entre los procesos inflamatorios-infecciosos secundarios más comunes en estos animales destaca la pododermatitis, en muchas ocasiones severa, la cual se observa en un 42.11 % de los casos, seguida por la cistitis en un 26.32 % de los casos. Posteriormente las dermatitis e infecciones respiratorias se aprecian en el 15.79 % de los casos; en menor medida se encuentran las conjuntivitis y úlceras corneales en un 10.53 % de los pacientes y finalmente las otitis y estomatitis e infecciones dentales, observados en un 5.26 % de los animales. Otra enfermedad secundaria que se aprecia en un número reseñable de casos es la cristaluria o cálculos urinarios de calcio asociado a un 21.05 % de los casos. Las patologías digestivas eran menos comunes, pero se han observado diarreas recurrentes en el 10.53 % de los animales y aún menos frecuente los casos de estasis que eran solo el 5.26 %. Otros síntomas que se han apreciado son manifestaciones neurológicas con ataxia y parálisis posterior en un 10.53 % de los casos cada una. Finalmente se ha apreciado en baja proporción síntomas como ascitis y polifagia en un 5.26 % de los animales cada uno.
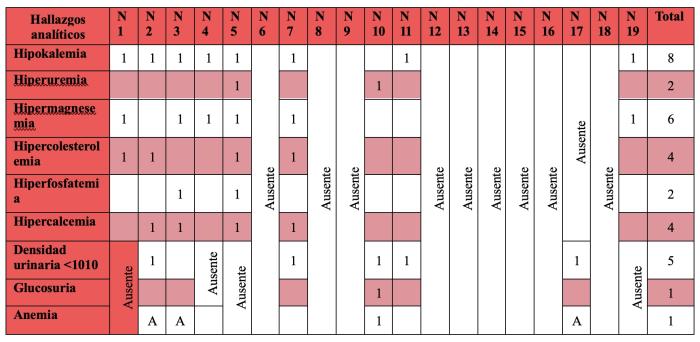
Analizando los animales con pruebas bioquímicas (Tabla 3), se puede observar que un 88.88 % de los animales presentaban hipokalemia, la cual en muchos casos se encontraba en valores inferiores a 5 y en ocasiones se asociaban con la aparición de ataxia y parálisis posterior. La hipercolesterolemia, también asociada con esta enfermedad en otras especies, se observó en el 44.44 % de los casos siendo igual que la hipercalcemia, la cual no se asocia con esta enfermedad en otras especies. En cuanto a los parámetros que se pueden relacionar con daño renal secundario, la hipermagnesemia fue el hallazgo más frecuente, presente en un 66.66 % de los pacientes, seguido por la hiperfosfatemia y la hiperuricemia, ambas detectadas en el 22.22 % de los casos. En ningún paciente con hiperuricemia se observó un aumento concomitante de creatinina. En comparación con los perros cabe destacar que no hubo ningún caso con fosfatasa alcalina elevada.
En los casos que contaban con examen de orina, el parámetro alterado mayoritariamente es la densidad, que se apreciaba por debajo del 1010 en el 83.33 % de los casos y tan solo el 16.66 % de los casos presentaban glucosuria.
En el hemograma solo el 25 % de los casos presentaban anemia, estando el resto de parámetros dentro del rango normal (ver Tabla 3).
Discusión
En la mayoría de estudios de Cushing en cobayas se reporta que se trata de una enfermedad rara o poco común. Según la experiencia del equipo, se trata de una enfermedad infradiagnosticada en esta especie, pues en ocasiones los síntomas pueden ser muy inespecíficos o que se presenten con enfermedades secundarias y sin ninguno de los síntomas considerados los más comunes de la enfermedad, como la alopecia y la poliuria-polidipsia. Este hecho coincide con lo descrito por diversos autores.
La mayoría de los casos publicados en cobayas son de animales de edad adulta entre los 3 y 6 años, rango en el cual se encuentra comprendida la edad media de este estudio.
En su tesis Nowotny I.describía 4 casos de enfermedad de Cushing en el cual observó que todos sus casos de hiperadrenocorticismo en hembras estaban asociados a ovario poliquístico. En la casuística analizada, solo una hembra tuvo patologías coadyuvantes con hipotiroidismo y tumor ovárico y en un macho entero se apreció hiperplasia prostática por lo que se cree que es posible que estos casos se asocien con lesiones a nivel hipofisario10. Hay varios artículos que describen el hiperadrenocorticismo hipofisario en cobayas. Aunque en la mayoría de los casos analizados no se ha podido confirmar este diagnóstico, se considera la etiología más probable en la mayoría de los pacientes evaluados. En el presente estudio solo hubo sospecha de un caso de neoplasia adrenal con ascitis por metástasis, pero que no se pudo confirmar. Esta es una de las principales causas descritas en la mayoría de los artículos, siendo los más comunes el adenoma o carcinoma.
Tanto en el estudio anteriormente citado como en otros de casos clínicos se han reportado daños hepáticos con aumentos de la ALT (alanina aminotransferasa) solo o en combinación con otras transaminasas, lo cual no se ha encontrado en ninguno de los casos analizados10,13.
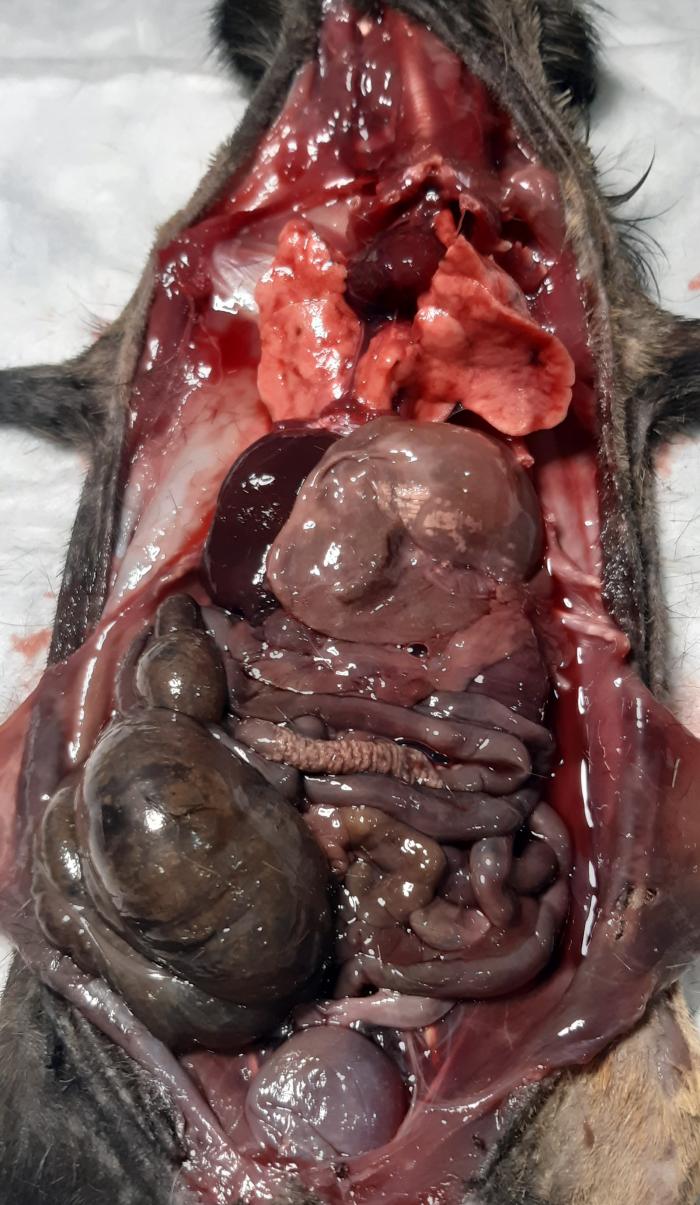
Son pocos los autores que hablan de daño renal asociado. Sin embargo, este sí fue observado en el presente estudio, con aumentos en electrolitos como el magnesio y valores menores a 1010 en la densidad urinaria. En el caso de Nowotny I., sus animales presentaban signos de fallo renal, pero las densidades urinarias se encontraban entre 1012 y 103310. Solo en un artículo que describe un caso clínico se observó un urolito de carbonato cálcico obstruyendo un uréter, lo cual también ha sido observado por el equipo en varios casos, de forma recurrente en algunos. Esto también se considera importante a la hora de tener esta patología en cuenta en el diagnóstico diferencial, sobre todo si la dieta del animal es correcta y sin excesos de calcio o vitamina D. En estos casos es probable que se encuentren hallazgos de hipercalcemia, pero también se ha visto en animales con daño renal secundario al hiperadrenocorticismo. En un caso, además, se evidenciaron calcificaciones ectópicas en órganos digestivos durante la necropsia (ver Figura 3)9.
Los hallazgos de hipokalemia, observados en muchos animales diagnosticados con esta enfermedad en el presente estudio, son considerados por el equipo como un dato relevante en la sospecha clínica. Sin embargo, en la literatura consultada, solo se ha reportado en un caso14. Se considera que la hipokalemia puede estar directamente relacionada con el hiperadrenocorticismo, pero en los casos con daño renal secundario puede ser más acusado llegando a producir síntomas como debilidad muscular con ataxia y paresia del tercio posterior, síntomas que sí reportan algunos autores como Laboklin12.
La hipercolesterolemia, que también se reporta en perros en esta enfermedad, es un hallazgo analítico del que no se ha reportado en otros artículos. Sin embargo, en esta serie de casos, sí se ha observado este parámetro elevado, y en muchos casos sin obesidad asociada como sí ocurre en perros. En este estudio se considera que se asocia al síndrome nefrótico, pues los casos con esta elevación presentaban un posible daño renal asociado.
En cuanto al peso, tanto en el presente estudio como en los artículos de Nowotny I. y Laboklin se ha observado que hay una pérdida de peso progresiva10,12. Aunque no es frecuente, sí hay algunos con obesidad; esto también se reporta en estudios como el de Gaschen L. et al y Laboklin9,12.
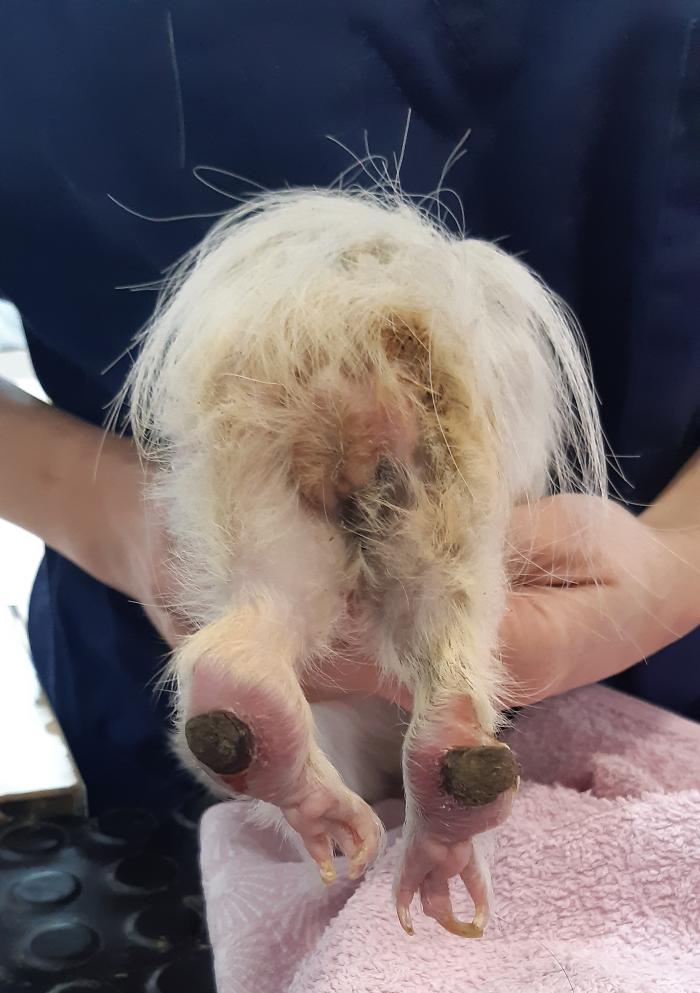
El síntoma que reportan todos los autores es la alopecia, la cual también fue observada en muchos de los casos del presente estudio, siendo más común sin prurito que con prurito. La piel fina también es un síntoma que reportan muchos autores, pero en este estudio es un síntoma del que no se habla directamente, aunque se considera que puede ser, en parte, la causa de la gran cantidad de pododermatitis observada. Esta enfermedad secundaria se considera de gran importancia y debe ser considerada a la hora de sospechar de esta patología (Figura 4).
Aunque no hay evidencias de inmunodeficiencias en los análisis realizados, la gran cantidad de infecciones secundarias reportadas en estos animales, en ocasiones de forma simultánea, hace sospechar que esto es posible debido al exceso de cortisol en sangre.
Se considera necesario realizar más estudios para poder llegar a diagnósticos más tempranos, ya que muchos de los casos de hiperadrenocorticismo hipofisario podrían encontrarse en etapas iniciales pero que comienzan a manifestar síntomas evidentes en edades más avanzadas. Además, estos casos suelen verse enmascarados por enfermedades concomitantes o que no se considera que puedan ser una consecuencia de patologías relativamente comunes, como la hipovitaminosis C15.
Bibliografía
- Wagner JE,Manning PJ.Biología del conejillo de indias.1.ª ed. Academic Press;1976.
- Batah AL,Mirhish SM.Histomorphological and histochemical study of adrenal gland in adult male of guinea pigs (Cavia porcellus).Iraqi J Vet Med.2019;43(1):59-66. doi:10.30539/iraqijvm.v43i1.475.
- Sheikhian A,Saadatfar Z,Mohammadpour A.A histological study of adrenal gland in guinea pig and hamster.Comp Clin Path.2014;24(5):1-6. doi:10.1007/s00580-014-2034-3
- Sainato D, Pelligra T, Puccinelli C, Petrini D, Citi S. Ultrasonographic measurements of the normal adrenal glands in guinea pigs (Cavia Porcellus). Vet Radiol Ultrasound. 2024 Jul;65(4):385-391. doi: 10.1111/vru.13367. Epub 2024 Apr 13. PMID: 38613764
- Michael E. Herrtage. Ultrasonography of the Endocrine Glands. WSAVA 2002 Congress.
- Pérez-López L, Wägner AM, Saavedra P, Jaber JR, Melián C. Ultrasonographic evaluation of adrenal gland size in two body weight categories of healthy adult cats.Journal of Feline Medicine and Surgery. 2020;23(8):804-808. doi:10.1177/1098612X20974962
- Zaheer OA,Beaufrère H.Treatment of hyperadrenocorticism in a guinea pig (Cavia porcellus).J Exot Pet Med.2020;34:57-61. doi:10.1053/j.jepm.2020.03.010
- Künzel F,Mayer J.Endocrine tumours in the guinea pig.Vet J.2015;206(3):268-274. doi:10.1016/j.tvjl.2015.08.016
- Gaschen L,Ketz C,Lang J,Weber U,Bacciarini L,Kohler I.Ultrasonographic detection of adrenal gland tumor and ureterolithiasis in a guinea pig.Vet Radiol Ultrasound.1998;39(1):43-46. doi:10.1111/j.1740-8261.1998.tb00323.x
- Nowotny I.Hyperadrenokortizismus beim Meerschweinchen. (Thesis). University of Veterinary Medicine Vienna;2010. Accessed July 3, 2023.https://www.vetmeduni.ac.at/hochschulschriften/diplomarbeiten/AC08858327.pdf. Diploma of Veterinary Medicine
- Fajer AB,Vogt M.Adrenocortical secretion in the guinea-pig.J Physiol.1963;169(2):373-385. doi:10.1113/jphysiol.1963.sp007262
- https://laboklin.com/en/neither-fungus-nor-parasite-endocrine-causes-of-dermatological-signs-in-small-mammals/
- https://lafeber.com/vet/hyperadrenocorticism-gpig/
- Zeugswetter, Florian Karl, M. Fenske, Jasmin Hassan and Frank Künzel. “Cushing's syndrome in a guinea pig.”Veterinary Record160 (2007): 878 - 880.
- Enwonwu CO, Sawiris P, Chanaud N. Effect of marginal ascorbic acid deficiency on saliva level of cortisol in the guinea pig. Arch Oral Biol. 1995 Aug;40(8):737-42. doi: 10.1016/0003-9969(95)00030-s. PMID: 7487575.
 by Multimédica
by Multimédica