Hemangiosarcoma canino: presente y futuro
Resumen breve
El hemangiosarcoma (HSA) es un tumor de gran malignidad que se origina a partir de las células endoteliales de los vasos sanguíneos y, según los últimos estudios, de precursores circulantes derivados de la médula ósea1, lo que le otorga un elevado potencial de implantación y diseminación.Índice de contenidos
Introducción
El hemangiosarcoma (HSA) es un tumor de gran malignidad que se origina a partir de las células endoteliales de los vasos sanguíneos y, según los últimos estudios, de precursores circulantes derivados de la médula ósea1, lo que le otorga un elevado potencial de implantación y diseminación.
Es muy común en perros, se calcula que representa entre el 5-7 % de todos los tumores caninos, y el 12-21 % de las neoplasias mesenquimales en esta especie2. La edad media de presentación es de 8 años, con predisposición en el Pastor alemán, el Golden retriever, el Labrador retriever y el Bóxer, entre otros2. El Whippet y el Pitbull están sobrerrepresentadas en el HSA cutáneo.
A diferencia de otros tumores, el HSA es una enfermedad que afecta casi en exclusiva a animales de compañía, se ha descrito en perros, gatos, hurones, ratas, erizos, vacas, ovejas y caballos3. En personas, lo más similar es el angiosarcoma, un tumor raro que representa menos del 1 % de todos los tumores en medicina humana, y se asocia a oficios con exposición al cloruro de vinilo y los bifenilos policlorados (PCB) que se encuentran en gomas y plantas de neumáticos, así como a altas dosis de radioterapia (principalmente en el tratamiento de cáncer de mama)2. La forma benigna, el hemangioma, es frecuente en la piel de personas y animales expuestos de manera continuada al sol.
En medicina veterinaria, se han identificado alteraciones en la transcripción de genes asociadas al desarrollo de tumores y mutaciones de secuencias génicas inactivadoras de vías asociadas con la angiogénesis en perros. Lo que junto con la predisposición racial expone un componente genético en el desarrollo de algunos de los HSA. Por otro lado, factores ambientales, como la radiación ultravioleta y la ionizante predisponen al desarrollo de HSA cutáneo, y la exposición a radionucleótidos a HSA primario de pulmón, hueso e hígado; sin embargo, no se han identificado condiciones ambientales específicas que contribuyan al desarrollo del HSA esplénico3.
Presentación
No se termina de comprender la forma en la que se desarrolla el HSA.
En relación con su comportamiento biológico, el HSA se caracteriza por su curso agresivo. Las principales localizaciones son: bazo (se estima que dos tercios de las masas en bazo son de origen tumoral, y, de ellas, dos tercios son HSA), corazón (aurícula derecha), hígado, piel y músculo. Aproximadamente en el 8,7 % de los perros están involucrados bazo y corazón de forma simultánea4.
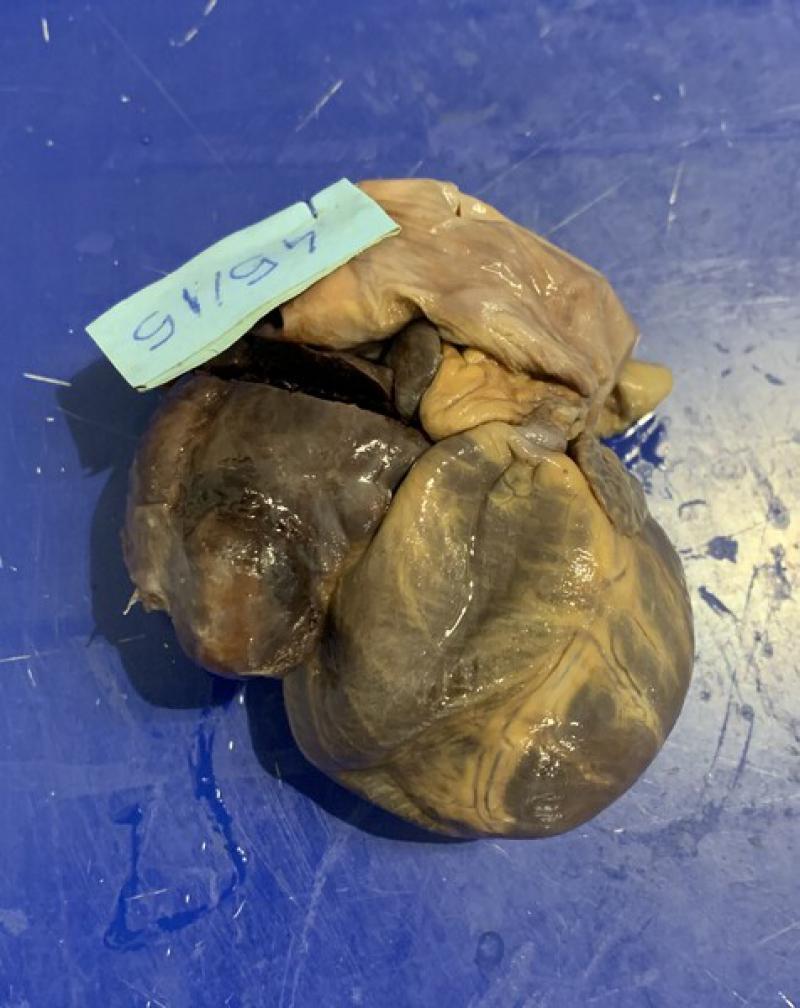
Las localizaciones de las metástasis se relacionan con el origen del tumor primario. En el caso del HSA esplénico (Figura 1), los puntos más afectados son el hígado, el omento y el pulmón5. El desarrollo de metástasis puede ser tanto por diseminación hematógena como por implantación tras un sangrado. En cambio, en el HSA cardíaco (Figura 2), los principales puntos de metástasis son el pulmón, el bazo, el pericardio, el tejido subcutáneo, el riñón, el mesenterio, el omento y el cerebro3,6. Cabe destacar, además, que la mayoría de los tumores secundarios intracraneales son como consecuencia de una metástasis de HSA, el 85 % afecta a la materia gris del cerebro3,6.
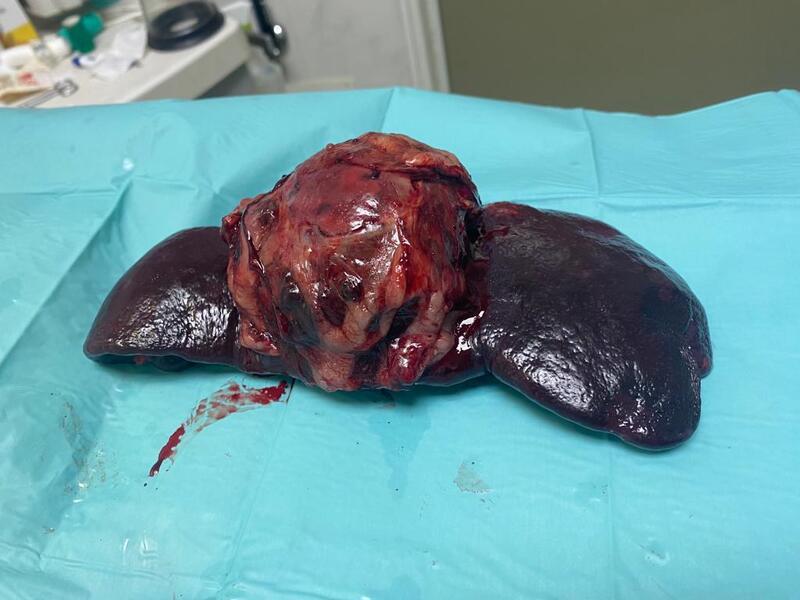
Dada su morfología extremadamente friable, la mayoría de los pacientes acuden al veterinario por signos compatibles con hemorragia por rotura del HSA, de hecho, el 75 % de los perros con hemoabdomen presentan un HSA7. Como se ha comentado anteriormente, ya que una de las vías de diseminación es la implantación, en estos pacientes, el riesgo de metástasis es mayor que en aquellos que no cursan con hemorragia.
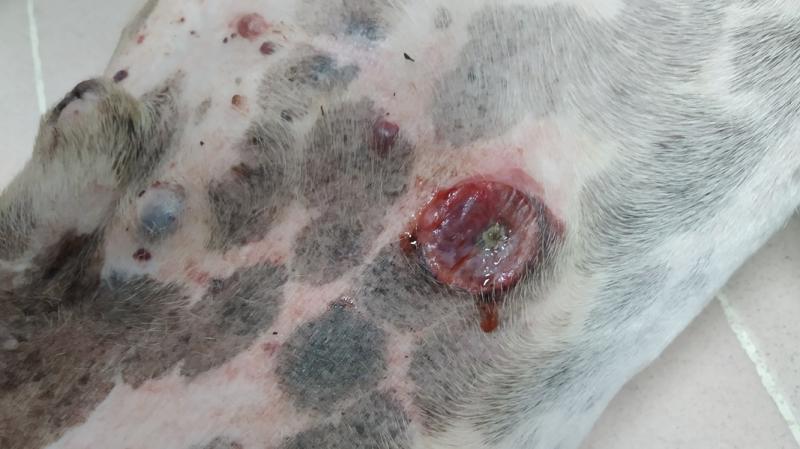
En el caso del HSA cutáneo (Figura 3), engloba tres presentaciones: cutáneo propiamente dicho (dérmico), subcutáneo y muscular. El comportamiento biológico del primero es mucho menos agresivo (a diferencia de la presentación visceral, que se acaba de comentar, y la muscular y subcutánea, cuyo comportamiento es similar). Dentro de los HSA cutáneos hay presentaciones asociadas a la exposición solar y otra que son independientes de la misma. Los HSA cutáneos asociados a la exposición solar son más frecuentes en animales de capa clara y zonas de poco pelo (abdomen ventral, cara interna de los muslos y cara). En la mayoría de los casos, en particular si está confinado a la epidermis, el tratamiento quirúrgico, sin terapia adyuvante, puede aportar supervivencias de hasta 2 años8,9.
Diagnóstico y estadificación
En razas predispuestas se propone la realización de revisiones geriátricas y ecografía de abdomen a partir de los 8 años con el fin de detectar la masa antes de que se produzcan sangrados/metástasis.
El cuadro clínico varía en función de la localización y tamaño del tumor primario, yendo desde sintomatología inespecífica (decaimiento, debilidad, pérdida de peso, distensión abdominal, entre otros) hasta situaciones de urgencia, como un shock hipovolémico por sangrado o taponamiento cardiaco por hemopericardio. Las hemorragias pueden ser leves, y se resuelven por sí solas en 12-36 horas, o graves, requiriendo tratamiento de urgencia, quirúrgico y médico.
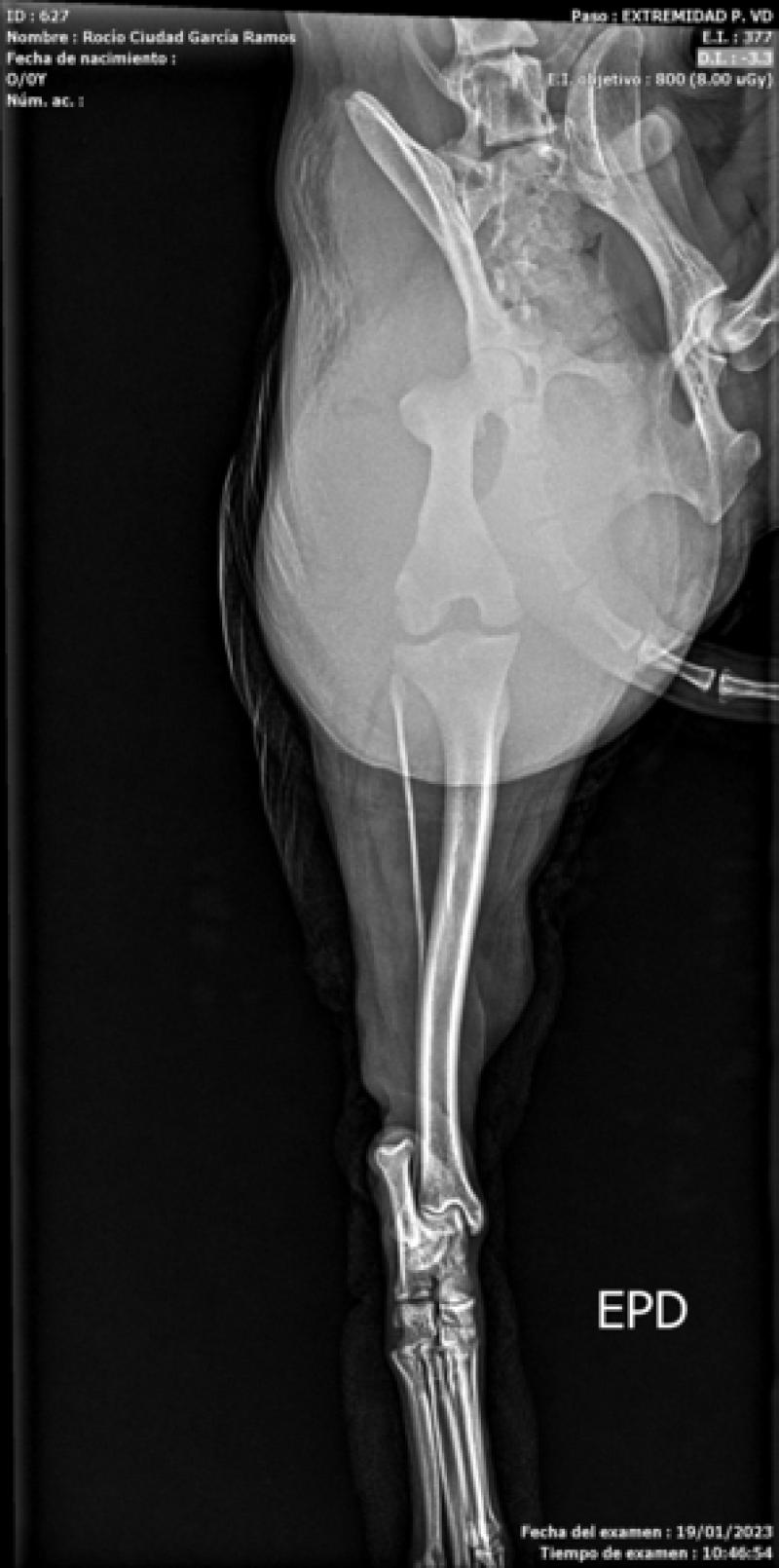
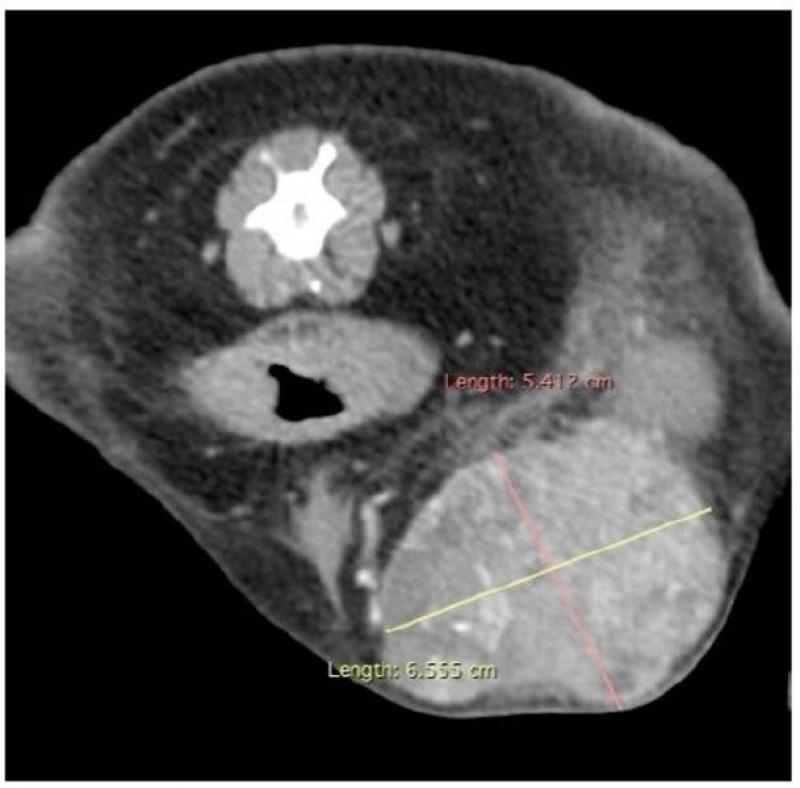
El estadio clínico, dada su gran capacidad de diseminación, incluye radiografías de tórax (tres proyecciones) (Figuras 4 y 5), ecografía de abdomen (Figura 6), ecocardiografía (Figura 7), analítica sanguínea completa y urianálisis completo.
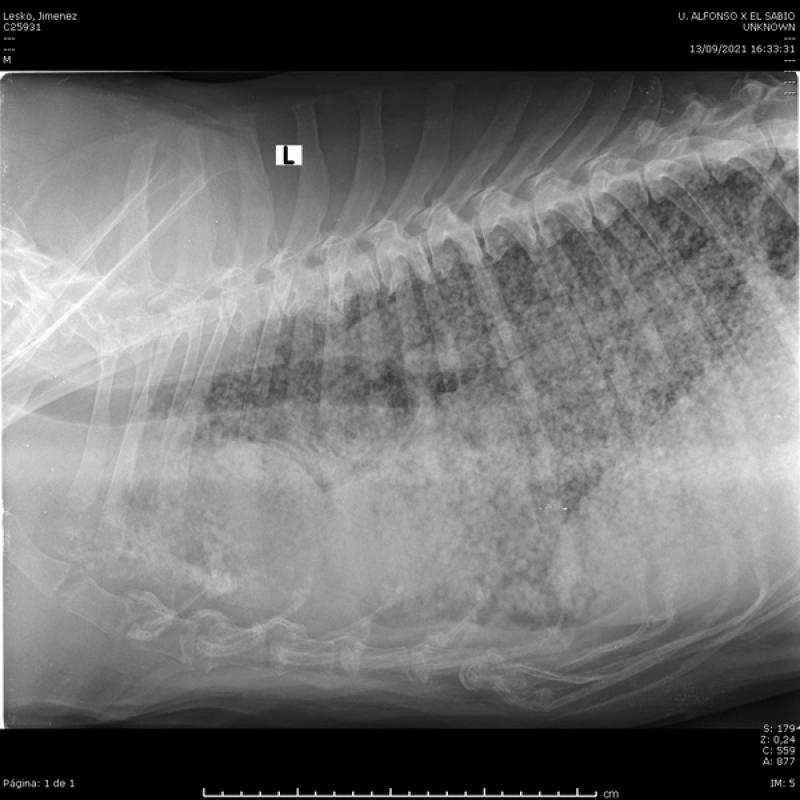
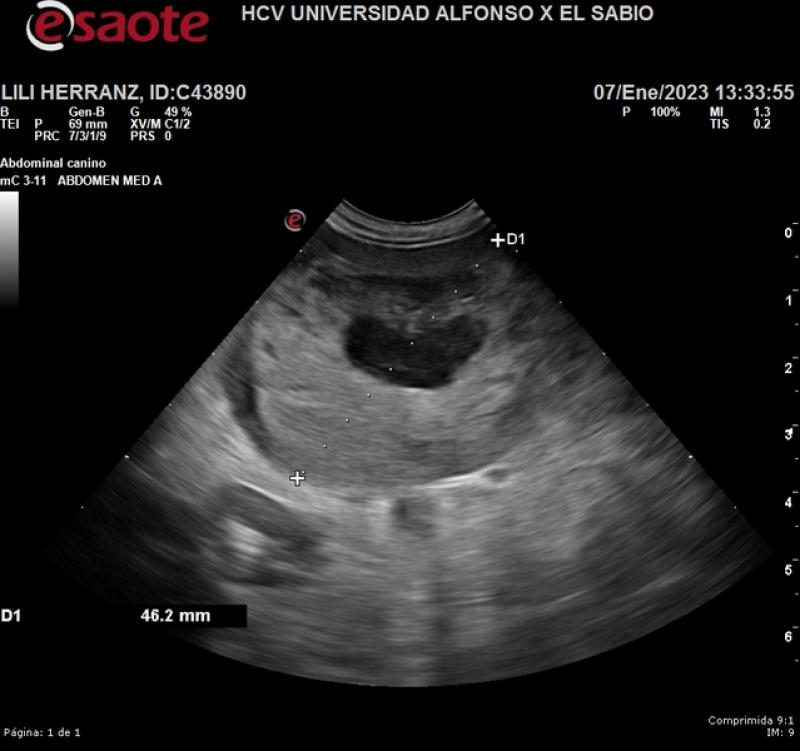
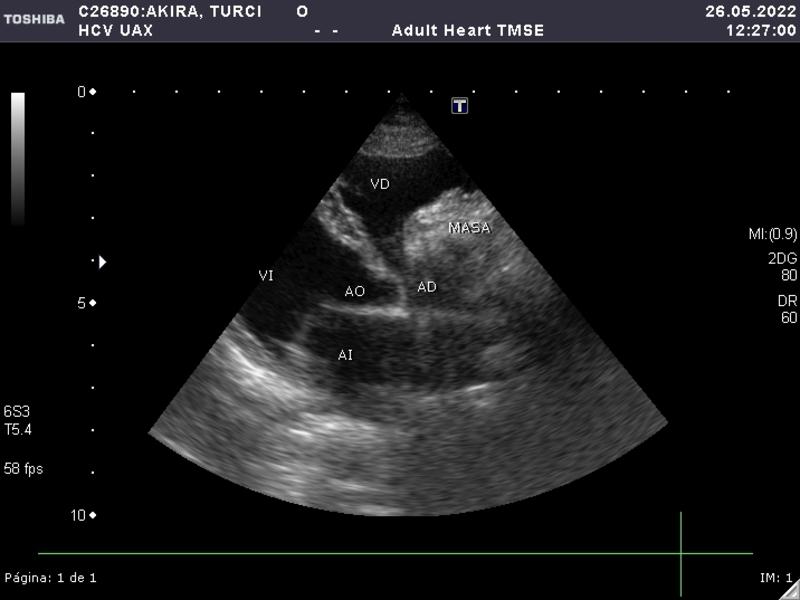
Los hallazgos laboratoriales más comunes incluyen anemia (regenerativa o no, en función de la gravedad del sangrado y el momento de realización del hemograma), trombocitopenia (75-97 % de los casos) y neutrofilia. En el frotis pueden observarse esquistocitos y acantocitos. La bioquímica suele ser inespecífica y algunos de los pacientes pueden presentar alteraciones en los tiempos de coagulación2,3.
En el HSA cardíaco, la sintomatología se relaciona con la efusión pericárdica, taponamiento cardíaco o fallo cardíaco derecho; colapso, distensión abdominal, disnea, tos y debilidad. En la exploración física destacan: disminución de los sonidos cardiacos, taquipnea, taquicardia, mucosas pálidas y pulso femoral débil. En la ecocardiografía se aprecia derrame pericárdico, con o sin efusión pleural, y puede observarse o no un efecto masa en la aurícula/atrio derecho6.
La troponina cardiaca tipo I (cTnI, por sus siglas en inglés) es una isoforma única implicada en la contractilidad cardíaca, de forma que la elevación de sus niveles en sangre circulante, implican la muerte de miocitos. Se ha evaluado su fiabilidad para el diagnóstico de HSA cardíaco, y concentraciones mayores de 0,25 ng/ml tienen una especificidad del 100 % y sensibilidad del 81 %, de forma que permite diferenciar entre derrame pericárdico secundario a HSA de derrame pericárdico idiopático10.
La timidina quinasa tipo 1 (TK1) es un marcador soluble de proliferación que se encuentra aumentado en perros con HSA y con hemoperitoneo. Aún está por determinar su utilidad diagnóstica2.
Ante la sospecha de posible HSA muscular lo ideal es realizar pruebas de imagen avanzadas, como la tomografía computarizada (TC) (Figuras 8 y 9) o la resonancia magnética, con el fin de delimitar la extensión de la lesión, y, si es posible, tomar una muestra para citología o biopsia de una zona sólida de la lesión, ya que las muestras de las zonas con acúmulo de sangre o efusiones rara vez son diagnósticas.
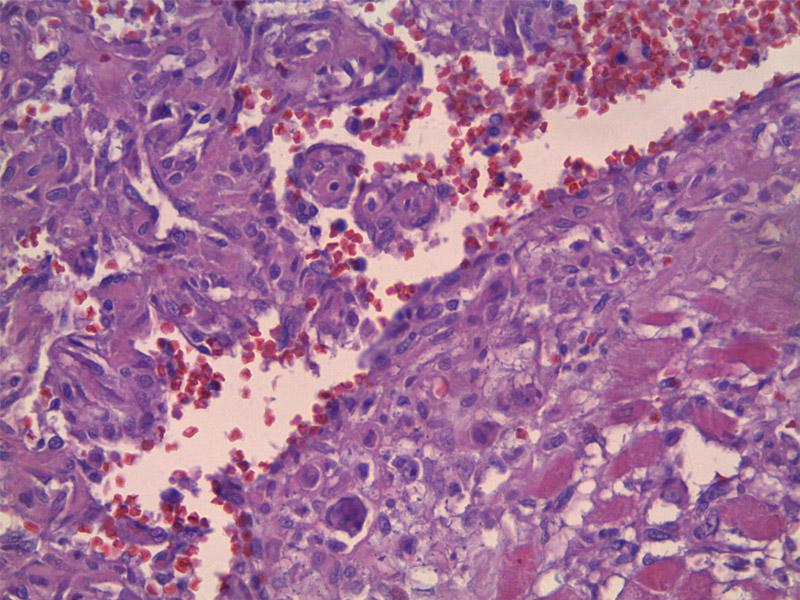
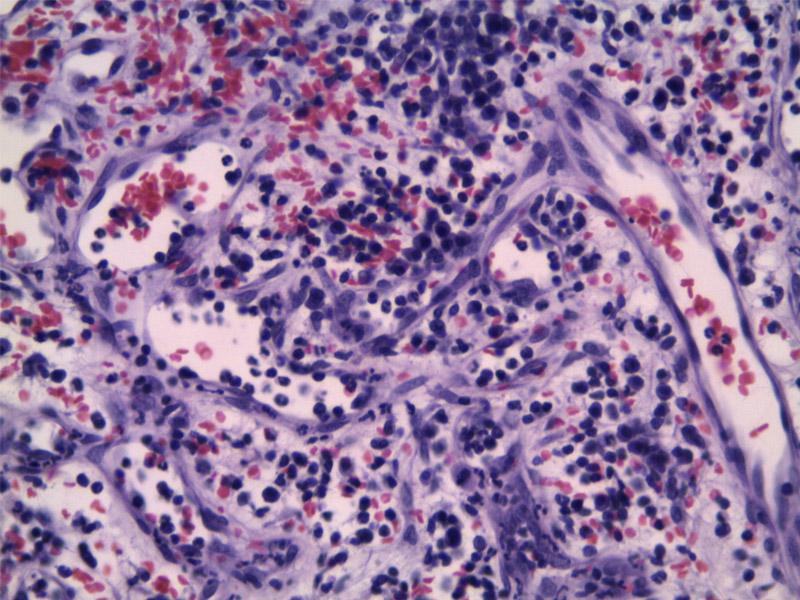
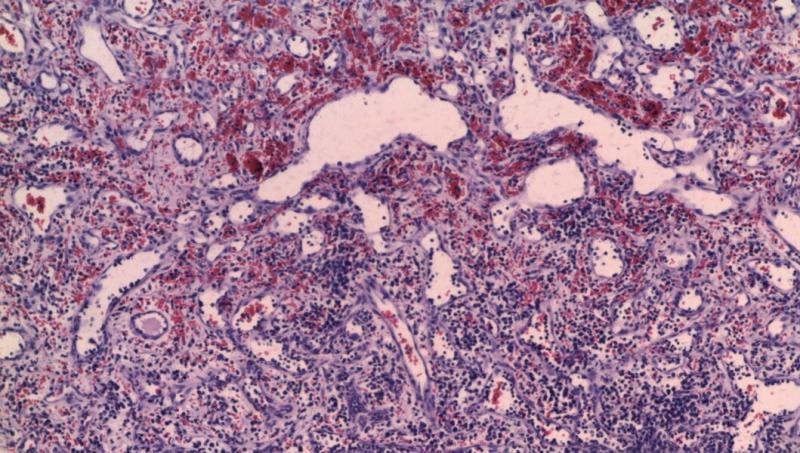
El diagnóstico definitivo lo emite la biopsia. Se describen tres patrones de crecimiento: capilar (Figura 10), cavernoso (Figura 11) y sólido (Figura 12). El tipo cavernoso y sólido se asocian a peor pronóstico, el primero por su mayor facilidad de rotura y el segundo por una mayor indiferenciación asociada a un comportamiento más agresivo. Además, en el HSA subcutáneo, muscular y pulmonar se ha descrito una presentación “epitelioide”11. Por otro lado, hay autores que defienden las diferencias pronósticas en función del grado de malignidad del HSA, pero no se ha llegado a un consenso para su estandarización1,2,3. Las autoras presentan especial atención al grado de diferenciación y el número de mitosis.
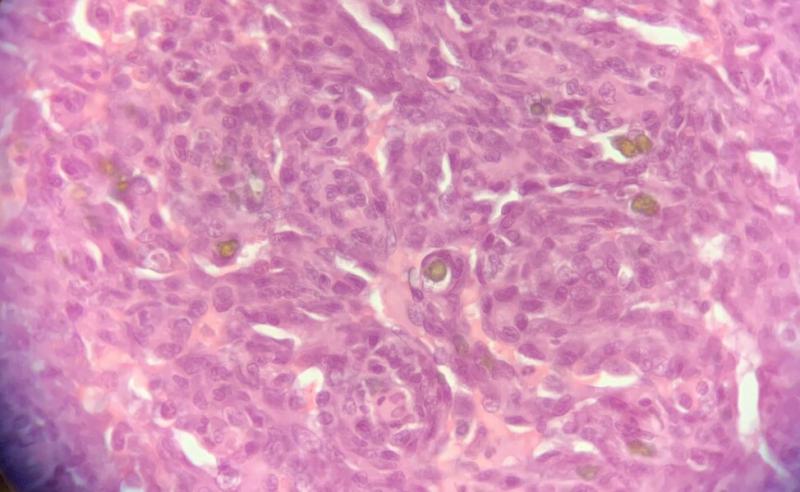
Cuando el estudio histopatológico no permite identificar el sarcoma son necesarias pruebas de inmunohistoquímica (IHQ) con el fin de confirmar la presencia de un HSA. El anticuerpo de elección es el marcador endotelial del factor de von Willebrand (vWF). Otras opciones son el factor de crecimiento endotelial vascular (VEGF A, por sus silgas en inglés) y su receptor (VEGFR-R2), y Ang-23.
El estadio clínico del HSA depende del origen del mismo, en función de si es un HSA visceral o un HSA cutáneo o muscular.
El estadio clínico del HSA visceral se realiza en base al sistema TNM (Tabla 1), mientras el estadio clínico del HSA cutáneo y del muscular depende del grado de infiltración a nivel histológico (Tabla 2).
| Tabla 1. Estadios clínicos HSA visceral. |
| T | 0 | No evidencia del tumor |
| 1 | Tumor < 5 cm | |
| 2 | Tumor > 5cm o roto | |
| 3 | Tumor infiltración estructuras adyacentes | |
| N | 0 | Sin afectación de ganglios linfáticos regionales |
| 1 | Afectación de ganglios linfáticos regionales | |
| 2 | Afectación de ganglios linfáticos a distancia | |
| M | 0 | Sin evidencia de metástasis a distancia |
| 2 | Metástasis a distancia |
Estadio I: T0/T1, N0, M0
Estadio II: T1/T2, N0/N1, M0
Estadio III: Cualquier T, cualquier N y M1
| Tabla 2. Estadios clínicos para HSA cutáneo y muscular. |
| Estadio | Afectación |
| I | El tumor afecta a la dermis |
| II | El tumor se extiende al tejido subcutáneo |
| III | El tumor afecta al músculo |
Tratamiento y pronóstico en el presente
El tratamiento de elección es la terapia multimodal con cirugía, siempre que sea posible, y quimioterapia neo y/o adyuvante, con protocolos basados en doxorrubicina.
La cirugía como tratamiento único no mejora la supervivencia total (30-90 días), a excepción del HSA cutáneo en estadio I (puede llegar a considerarse curativa). Menos del 10 % de los perros con HSA no cutáneo estadio I alcanzan el año de supervivencia con cirugía como único tratamiento3. Cuando se combinan cirugía y quimioterapia se alcanzan supervivencias de 6-8 meses2,3,5.
En relación con el estadio clínico, los estadios I sin hemoperitoneo alcanzan supervivencias de 239-255 días, mientras que en los estadios II la esperanza de vida es de 120-148 días2,5.
En el HSA cardíaco por un lado debe manejarse la enfermedad cardiaca como consecuencia del tumor (si existe), junto con la realización de una pericardiectomía subtotal para prevenir el taponamiento cardíaco, así como quimioterapia. Los perros que no reciben quimioterapia tienen una supervivencia media de unos 16-42 días, frente a los 164-183 días de los que reciben tratamiento multimodal6.
Los HSA cutáneos y subcutáneos requieren las mismas consideraciones quirúrgicas que cualquier sarcoma de tejidos blandos, con 2-3 cm de márgenes. En los estadios I la supervivencia media es de 780 días solo con cirugía, alcanzando supervivencias aún mayores en los HSA inducidos por radiación solar (1549 días frente a 545 días). En los estadios II (subcutáneo) y III (muscular) el manejo es similar al del HSA visceral, con supervivencias de 172-307 días cuando se realiza cirugía (con o sin RT) y de 1553-1189 días y de 266-273 días en el HSA subcutáneo y muscular, respectivamente, cuando se combina cirugía y quimioterapia8,9,12. En los últimos años se ha comenzado a utilizar la electroquimioterapia como una alternativa de tratamiento local para HSA cutáneos (estadios I y II) múltiples y/o no operables.
En la actualidad, sigue siendo un reto encontrar alternativas médicas adyuvantes a la cirugía que permitan mejorar la supervivencia. El fármaco más efectivo, hasta el momento, es la doxorrubicina (en monoterapia o politerapia). Otros fármacos alternativos son el carboplatino, la epirrubicina y la mitoxantrona (Tabla 3).
| Tabla 3. Protocolos convencionales de quimioterapia en el HSA canino. |
| Protocolo | Administración |
| Doxorrubicina | 25-30 mg/m2 cada 2-3 semanas y en animales de menos de 15 kilos 1 mg/kg |
| VAC modificado | Día 1: doxorrubicina Día 7: ciclofosfamida (250-300 mg/m2) Día 15: vincristina (0,5-0,7 mg/m2) Día 21 = fin del ciclo |
| AC | Día 1: doxorrubicina Día 10: ciclofosfamida Día 21 = fin del ciclo |
| Carboplatino | D250-300 mg/m2 cada 3 semanas, una media de 5-6 dosis |
Existen publicaciones sobre el uso de quimioterapia metronómica para el HSA visceral, pero no existen evidencias suficientes que avalen su eficacia13,14,15.
La radioterapia (RT) está descrita como tratamiento para el control local del HSA2.
Existen publicaciones sobre el uso de Yunnan Bai Yao para control del sangrado16,17. Estudios in vitro describen la muerte celular dosis dependiente en tres líneas celulares del HSA canino.18 El polisacaropéptido (PSP), un agente bioactivo del hongo Coriolus versicolor, podría mejorar la supervivencia a dosis altas, pero se requieren más estudios19. Este polisacaropéptido (PSP) presente en el hongo ha demostrado actividad antitumoral e inhibición del crecimiento tumoral en modelos animales. Otro estudio reciente de la Universidad de Pensilvania demostró que I'm-Yunity® mejoró significativamente los tiempos de supervivencia en perros con HSA esplénico en comparación con perros que solo se sometieron a esplenectomía (199 días frente a 86 días, respectivamente)20.
Nuevas posibilidades de tratamiento en un futuro no tan lejano
Se ha demostrado la expresión de PDGFR-β (receptor de factor de crecimiento derivado de las plaquetas), VEGF- y c-kit en el HSA. El inhibidor de tirosina cinasa, masitinib, mostró una inhibición de la proliferación en líneas celulares de HSA a dosis dependiente21.
Las concentraciones bajas de vitamina D (25 hidroxivitamina D) se asocian con inflamación y se han detectado bajas concentraciones en gran parte de los pacientes oncológicos22,23. Se desconoce el posible beneficio de la suplementación con vitamina D para disminuir el riesgo de cáncer o mejorar la respuesta a las terapias estándar, pero el riesgo es relativamente bajo y merece la pena investigarlo.
Recientemente se están publicando y desarrollando algunas terapias novedosas para el HSA:
- Terapia con anticuerpos: en la Universidad de Pensilvania se está investigando la eficacia y seguridad del tratamiento con un vector viral recombinante (AAV8) que codifica un anticuerpo para inhibir la actividad del VEGF.
- Copanlisib: se ha descubierto que el desarrollo de un HSA depende, entre otras cosas, de la mutación en un gen llamado PI3K. Copanlisib inhibe de manera específica las células con la mutación PI3K, bloqueando su capacidad de crecer y dividirse24.
- eBAT: la Universidad de Minnesota publicó un artículo sobre los efectos de un nuevo fármaco llamado eBAT utilizado en perros con HSA esplénico. Este nuevo fármaco mejoró la tasa de supervivencia a los 6 meses en, aproximadamente, un 70 % de los pacientes y, además, el 21 % vivió más de 450 días25.
- Propanolol: estudios publicados recientemente mostraron que el propranolol aumenta sustancialmente el tiempo de supervivencia de los pacientes con angiosarcoma humano cuando se usa en combinación con los tratamientos estándar, además se ha demostrado que el propranolol sensibiliza las células del HSA a la doxorrubicina26. Las universidades de Minesota y Pensilvania están realizando un estudio para comprobar su eficacia, en combinación con doxorrubicina y cirugía, en el tratamiento del HSA esplénico.
Todas estas nuevas terapias abren la puerta a nuevas esperanzas en el manejo del HSA.
Bibliografía
- Kim JH, Graef AJ, Dickerson EB, Modiano JF. Pathobiology of Hemangiosarcoma in Dogs: Research Advances and Future Perspectives. Vet Sci. 2015 Nov 6;2(4):388-405
- Withrow SJ, Vail DM. Withrow & MacEwen's Small Animal Clinical Oncology, 6th Edition, St. Louis, Mo.:Saunders Elsevier, 2019; 773-778.
- Meuten, D.J. Tumors in domestic animals. Ames, Iowa: Wiley Blackwell, 2017 pp. 309–313;626–627.
- Boston SE, Higginson G, Monteith G: Concurrent splenic and right atrial mass at presentation in dogs with HSA: a retrospective study, J Am Anim Hosp Assoc 47:336–341, 2011.
- Göritz, M., Müller, K., Krastel, D., et al. Canine splenic haemangiosarcoma: influence of metastases, chemotherapy and growth pattern on post‐splenectomy survival and expression of angiogenic factors. J Comp Pathol (2013) 149:30–39.
- Yamamoto S, Hoshi K, Hirakawa A: Epidemiological, clinical and pathological features of primary cardiac hemangiosarcoma in dogs: a review of 51 cases, J Vet Med Sci 2013 75:1433–1441.
- Hammond TN, Pesillo-Crosby SA: Prevalence of hemangiosarcoma in anemic dogs with a splenic mass and hemoperitoneum requiring a transfusion: 71 cases (2003-2005), J Am Vet Med Assoc. 2008, 232:553–558.
- Bulakowski EJ, Philibert JC, Siegel S, Clifford CA, Risbon R, Zivin K, Cronin KL. Evaluation of outcome associated with subcutaneous and intramuscular hemangiosarcoma treated with adjuvant doxorubicin in dogs: 21 cases (2001-2006). J Am Vet Med Assoc. 2008 Jul 1;233(1):122-8.
- Shiu KB, Flory AB, Anderson CL, et al.: Predictors of outcome in dogs with subcutaneous or intramuscular hemangiosarcoma, J Am Vet Med Assoc 2011, 238:472–479.
- Chun R, Kellihan HB, Henik RA, Stepien RL. Comparison of plasma cardiac troponin I concentrations among dogs with cardiac hemangiosarcoma, noncardiac hemangiosarcoma, other neoplasms, and pericardial effusion of nonhemangiosarcoma origin. J Am Vet Med Assoc. 2010 Oct 1;237(7):806-11.
- Warren, A.L. and Summers, B.A. (2007) Epithelioid variant of hemangioma and hemangiosarcoma in the dog, horse, and cow. Vet Pathol (2007) 44:15–24.
- Wiley JL, Rook KA, Clifford CA, Gregor TP, Sorenmo KU. Efficacy of doxorubicin-based chemotherapy for non-resectable canine subcutaneous hemangiosarcoma. Vet Comp Oncol. 2010 Sep;8(3):221-33
- Marconato L, Chalfon C, Finotello R, Polton G, Vasconi ME, Annoni M, Stefanello D, Mesto P, Capitani O, Agnoli C, Amati M, Sabattini S. Adjuvant anthracycline-based vs metronomic chemotherapy vs no medical treatment for dogs with metastatic splenic hemangiosarcoma: A multi-institutional retrospective study of the Italian Society of Veterinary Oncology. Vet Comp Oncol. 2019 Dec;17(4):537-544.
- Alexander CK, Cronin KL, Silver M, Gardner HL, London C. The addition of metronomic chemotherapy does not improve outcome for canine splenic haemangiosarcoma. J Small Anim Pract. 2019 Jan;60(1):32-37.
- Gaspar TB, Henriques J, Marconato L, Queiroga FL. The use of low-dose metronomic chemotherapy in dogs-insight into a modern cancer field. Vet Comp Oncol. 2018 Mar;16(1):2-11.
- Frederick J, Boysen S, Wagg C, Chalhoub S: The effects of oral administration of Yunnan Baiyao on blood coagulation in Beagle dogs as measured by kaolin-activated thromboelastography and buccal mucosal bleeding times, Can J Vet Res 2017,81:41–45, 2017.
- Murphy LA, Panek CM, Bianco D, Nakamura RK: Use of Yunnan baiyao and epsilon aminocaproic acid in dogs with right atrial masses and pericardial effusion, J Vet Emerg Crit Care 2017, 27:121–126.
- Wirth KA, Kow K, Salute ME, et al.: In vitro effects of Yunnan Baiyao on canine hemangiosarcoma cell lines, Vet Comp Oncol 2016, 14:281–294.
- Brown DC, Reetz J: Single agent polysaccharopeptide delays metastases and improves survival in naturally occurring hemangiosarcoma, Evid Based Comp Alt Med 2012. 3284301.
- Gedney A, Salah P, Mahoney JA, Krick E, Martins R, Scavello H, Lenz JA, Atherton MJ. Evaluation of the anti-tumour activity of Coriolus versicolor polysaccharopeptide (I'm-Yunity) alone or in combination with doxorubicin for canine splenic hemangiosarcoma. Vet Comp Oncol. 2022 Sep;20(3):688-696.
- Lyles SE, Milner RJ, Kow K, Salute ME. In vitro effects of the tyrosine kinase inhibitor, masitinib mesylate, on canine hemangiosarcoma cell lines. Vet Comp Oncol. 2012 Sep;10(3):223-35.
- Weidner N, Woods JP, Conlon P, Meckling KA, Atkinson JL, Bayle J, Makowski AJ, Horst RL, Verbrugghe A. Influence of Various Factors on Circulating 25(OH) Vitamin D Concentrations in Dogs with Cancer and Healthy Dogs. J Vet Intern Med. 2017 Nov;31(6):1796-1803.
- Selting KA, Sharp CR, Ringold R, Thamm DH, Backus R. Serum 25-hydroxyvitamin D concentrations in dogs - correlation with health and cancer risk. Vet Comp Oncol. 2016 Sep;14(3):295-305.
- Le T, Jerel D, Bryan LJ. Update on the role of copanlisib in hematologic malignancies. Ther Adv Hematol. 2021 Apr 9;12:20406207211006027.
- Borgatti, A., Fieberg, A., Winter, A. L., Stuebner, K., Taras, E., Todhunter, D., Masyr, A., Rendhal, A., Vallera, D. A., Koopmeiners, J. S., & Modiano, J. F. Impact of Repeated Cycles of EGF Bispecific Angiotoxin (eBAT) Administered at a Reduced Interval from Doxorubicin Chemotherapy in Dogs with Splenic Hemangiosarcoma. Veterinary and Comparative Oncology, 2020.
- Saha J, Kim JH, Amaya CN, Witcher C, Khammanivong A, Korpela DM, Brown DR, Taylor J, Bryan BA, Dickerson EB. Propranolol Sensitizes Vascular Sarcoma Cells to Doxorubicin by Altering Lysosomal Drug Sequestration and Drug Efflux. Front Oncol. 2021 Feb 1;10:614288.
 by Multimédica
by Multimédica