Hematología en animales exóticos (III): interpretación del frotis sanguíneo en animales exóticos
Resumen breve
La evaluación del frotis sanguíneo es una parte fundamental de la hematología, aunque la gran variación morfológica entre especies y la falta de bibliografía al respecto puede dificultar su interpretación en animales exóticos. Del mismo modo las condiciones fisiológicas y adaptaciones al medio pueden variar considerablemente los parámetros hematológicos, dificultando establecer la importancia clínica de las variaciones de los escasos intervalos de referencia de los que disponemos. La…Índice de contenidos
Resumen
La evaluación del frotis sanguíneo es una parte fundamental de la hematología, aunque la gran variación morfológica entre especies y la falta de bibliografía al respecto puede dificultar su interpretación en animales exóticos. Del mismo modo las condiciones fisiológicas y adaptaciones al medio pueden variar considerablemente los parámetros hematológicos, dificultando establecer la importancia clínica de las variaciones de los escasos intervalos de referencia de los que disponemos. La mayoría de bibliografía referente a la interpretación del frotis sanguíneo en animales exóticos, principalmente en aves y reptiles, es anecdótica y frecuentemente basada sobre principios en mamíferos, los cuales no tienen por qué cumplirse en todas las especies. En el presente artículo se realizará una revisión sobre la interpretación del frotis sanguíneo en animales exóticos.
Introducción
Las pruebas laboratoriales en animales exóticos, del mismo modo que en otros animales, se emplean de forma conjunta con otras pruebas complementarias para poder establecer un diagnóstico definitivo. Siendo la hematología una de las pruebas laboratoriales que se incluye en prácticamente todos los protocolos diagnósticos.
Sin embargo, la interpretación de los resultados hematológicos sigue siendo un desafío en animales exóticos en comparación con perros y gatos, debido al menor número de estudios realizados y la falta de intervalos de referencia1. La diversidad y cantidad de especies, más de 9000 en el caso de aves o 7600 en reptiles, sin duda es uno de los principales desafíos, agravado por la escasez de información científica sobre estas2. Aunque estas no son las únicas limitaciones, la escasez de reactivos específicos, la terminología inconsistente, la falta de investigaciones científicas sobre muchos de las enfermedades o problemas médicos que acompañan a muchos cambios hematológicos, o la falta de formación en esta aérea son otras razones que dificultan el conocimiento veterinario. La disciplina de medicina zoológica necesita una mejor comprensión de la anemia en animales exóticos, patrones inflamatorios asociados a infecciones, neoplasias hematopoyéticas o cambios morfológicos de las células sanguíneas2.
En el presente artículo “Hematología en animales exóticos. Parte III: interpretación del frotis sanguíneo en animales exóticos” nos centraremos en la interpretación del frotis sanguíneo en animales exóticos y en las principales enfermedades asociadas a las alteraciones que podemos detectar en este. Las generalidades de la hematología en animales exóticos, métodos de extracción, accesos vasculares, técnicas de realización de frotis y descripción de la morfología celular se han abordado en la primera y segunda parte.
Interpretación del frotis sanguíneo
ANEMIA
La anemia es una condición, no un diagnóstico. Se define como la reducción del número de eritrocitos que produce una deficiencia en el transporte de oxígeno y se produce por pérdida de sangre, aumento de la destrucción de los eritrocitos o disminución de la producción de los eritrocitos3,4.
En reptiles el diagnóstico de anemia puede ser difícil y siempre debe ser considerado después de descartar una posible causa artefactual (dilución) o factores fisiológicos (por ejemplo, Pyton regious tiene un hematocrito de 16-21 %)1. Los vasos/senos linfáticos en reptiles discurren de forma paralela a los venosos, por lo que la dilución con linfa puede ocurrir en cualquier muestra, inclusive en muestras obtenidas por cardiocentesis se puede producir contaminación o dilución con líquido pericárdico. Aunque se considera que las muestras obtenidas por esta vía o de la vena yugular la dilución es menos frecuente6,7. En general si el hematocrito es bajo (especialmente en valores < 15 %), no hay evidencia de regeneración (no policromasia), y hay un aumento de linfocitos de pequeño tamaño, el grado de contaminación linfática se considera alto y es probable que los resultados de la hematología no sean válidos. Una vez descartadas las causas artefactuales, las anemias en este grupo de animales pueden ser debidas a las mismas causas que en pequeños mamíferos o aves6.
Existen diferentes clasificaciones:
Tipo de anemia en función del grado de regeneración
- Anemias regenerativas
- Hemólisis (intravascular y extravascular), por un aumento en la destrucción de los eritrocitos.
Pequeños mamíferos. Las causas más frecuentes incluyen parásitos hemáticos y daños oxidativos (formación de cuerpos de Heinz)3.
Aves. Hay pocas causas descritas, entre ellas las parasitosis (Plasmodium spp, Aegyptianella sp), septicemias bacterianas (Salmonella spp. o espiroquetas), toxicosis agudas (aflatoxinas) o causas inmunomediadas2.
Reptiles. Las causas descritas son septicemia, parasitemia, toxicosis. Aunque la mayoría de hemoparásitos no tienen poder patogénico, en infestaciones graves pueden cursar con anemia (Plasmodium, Haemoproteus, Saurocytozoon)1. - Hemorragia (interna y externa) por pérdida de sangre.
Pequeños mamíferos. Las causas descritas son trauma, pérdida de sangre en procedimientos quirúrgicos, úlceras gastrointestinales (Helicobacter mustelae en hurones), neoplasias, coagulopatías3. En conejos también se describen hemorragias uterinas (adenocarcinoma, aneurismas o hiperplasia endometrial quística), hemorragias gástricas y urolitiasis8.
Aves. La pérdida de sangre aguda es la causa más frecuente, secundaria a trauma, parasitosis gastrointestinales, úlceras gástricas, neoplasias ulceradas, alteraciones de la coagulación (intoxicaciones por rodenticidas) o algunas enfermedades víricas2.
Reptiles. Principalmente asociadas a trauma (internos y externos), otras causas descritas son úlceras gástricas y roturas asociadas a neoplasias1.
Las anemias regenerativas se caracterizan por la presencia de policromasia, reticulocitosis, macrocitosis en mamíferos, en cambio en aves y reptiles el tamaño de los eritrocitos es ligeramente menor, y anisocitosis. En reptiles generalmente la historia clínica evidencia una pérdida de sangre aguda como trauma, es importante recordar la menor respuesta regenerativa que tienen los reptiles por la larga vida de sus eritrocitos (600-800 días)6.
- Hemólisis (intravascular y extravascular), por un aumento en la destrucción de los eritrocitos.
- Anemia no regenerativa por una disminución en la producción de eritrocitos.
- Eritropoyesis inefectiva (semirregenerativas)
- Defecto en la síntesis de nucleótidos (deficiencias de vitamina B12, Co, folato o mielodisplasia).
- Defecto en la síntesis de hemoglobina: deficiencias de Fe, Cu, vitaminas E, B6, intoxicación por plomo/zinc, porfiria.
- Producción reducida de glóbulos rojos (anemia moderada/grave: aplasia, mieloptisis, mielofibrosis).
- Reducción de factores estimulantes (anemia leve/moderada: enfermedad renal crónica, endocrinopatías, anemia de enfermedad crónica).
- Eritropoyesis inefectiva (semirregenerativas)
Pequeños mamíferos. Por defectos extrínsecos: fallo renal crónico, enfermedades endocrinas, enfermedades inflamatorias, neoplásicas (linfoma) o deficiencias nutricionales; o por defectos intrínsecos: defectos en la médula ósea que causan hipoplasia, aplasia o defectos en la maduración en médula ósea3. Siendo la anemia por enfermedad crónica la causa más frecuente de anemia no regenerativa en mamíferos exóticos3. La toxicidad por estrógenos es una de las principales causas de anemia aplásica (pancitopenia aplásica) en mamíferos exóticos, especialmente en hurones. Los hurones son animales de ovulación inducida, si la monta no se produce, las hembras permanecen en estro continuo, produciéndose una supresión de la médula ósea por estrógenos endógenos3. En hurones también se ha descrito aplasia pura de glóbulos rojos9. En conejos se describen pérdidas de sangre agudas (estadios iniciales, por ejemplo, en aneurismas), linfoma, enfermedades crónicas: enfermedad renal crónica, pasteurelosis, traqueobronquitis, pododermatitis, mastitis, osteomielitis, enfermedad dental8.
Aves. Son el tipo más común. Las etiologías incluyen: inflamación crónica, infecciones crónicas (tuberculosis, colibacilosis, salmonelosis, aspergilosis), algunas enfermedades víricas (West Nile virus), infecciones por clamidia (agudas o crónicas), toxicosis (plomo o aflatoxicosis), deficiencia de hierro, endocrinopatías (hipotiroidismo) o leucemia2,4. Las aves parecen desarrollar de forma más rápida anemia por falta de eritropoyesis que los mamíferos, tal vez debido a la corta vida media de sus eritrocitos3.
Reptiles. La anemia por enfermedad crónica es la causa más descrita en reptiles, ya que a menudo estos animales “se debilitan durante un tiempo prolongado” antes de que se observen signos clínicos y se busque atención veterinaria. Las causas más frecuentes de anemia crónica incluyen: infección, dieta y/o ambiente inadecuado de forma crónica, enfermedad crónica (enfermedad renal/hepática), enfermedades infecciosas (Herpesvirus, Micobacteria, Mycoplasma, Chlamidia, Salmonella, entre otras), exposición a tóxicos o fármacos, hipotiroidismo o neoplasias1,6.
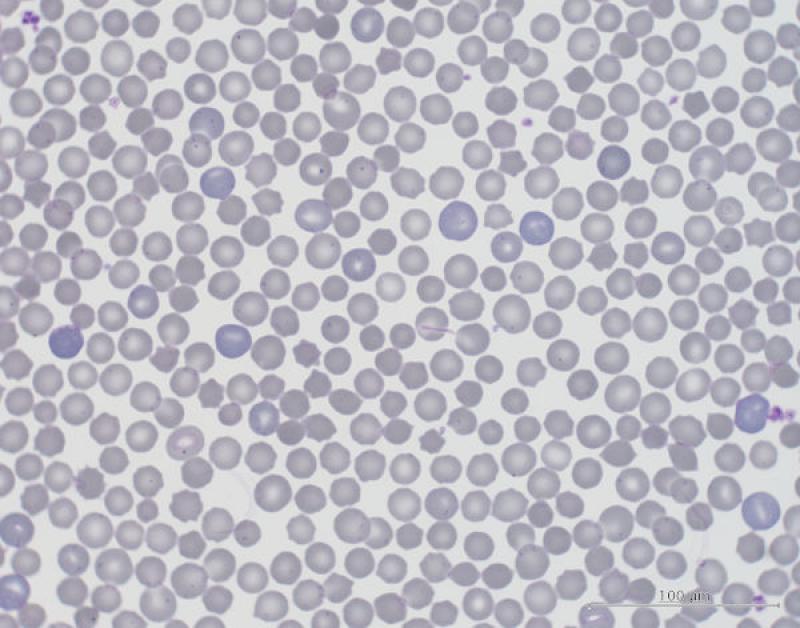
Para diferenciar las anemias regenerativas de las no regenerativas se debe valor la presencia de signos de regeneración en el frotis. Los signos típicos de regeneración son: policromasia, mitosis, anisocitosis, presencia de eritrocitos inmaduros (Figura 1). Además, las anemias regenerativas se caracterizan por una reducción en la concentración de hemoglobina corpuscular, por la cantidad más reducida que tienen los policromatófilos (se está produciendo de forma activa). En reptiles y aves el volumen celular medio de los eritrocitos (MCV) es menor, a diferencia de mamíferos donde el MCV es mayor durante la regeneración1,4. En reptiles la regeneración es particularmente lenta, a los 30 días podemos empezar a observar signos de regeneración llegando a su máximo a las 8 semanas. Este retraso puede estar relacionado con el largo tiempo de desarrollo de los rubriblastos en médula ósea y la larga vida útil de los eritrocitos. La anemia se considera no regenerativa si no se observan signos de regeneración después de un mes1.
Tipo de anemia en función del MCV (“Mean Cell Volume”, Volumen Celular Medio de los eritrocitos):
- Microcítica: MCV < al intervalo de referencia
- Normocítica: MCV dentro del intervalo de referencia
- Macrocítica: MCV ˃ al intervalo de referencia
Tipo de anemia en función del MCHC (“Mean Cell Hemoglobin Concentration”, Concentración Media de Hemoglobina en cada eritrocito):
- Hipocrómica: MCHC < al intervalo de referencia
- Normocrómica: MCHC dentro del intervalo de referencia
- Hipercrómica: MCHC ˃ al intervalo de referencia
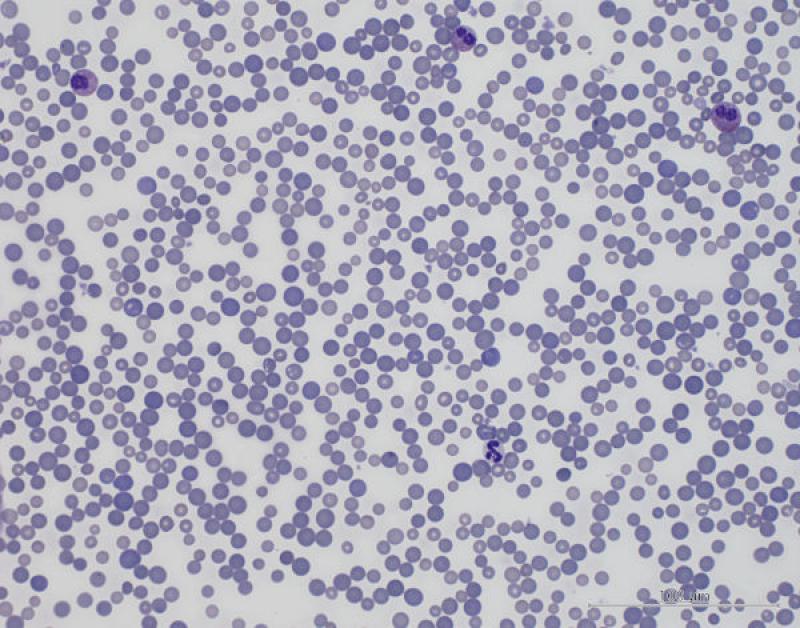
Anormalidades morfológicas de los eritocitos (2,3,10,11)
Pilas de moneda o Rouleaux.
Su formación depende de componentes de los eritrocitos y del plasma. El principal componente del plasma que induce la formación de estas estructuras son las globulinas y el fibrinógeno. Se pueden observar de manera normal en frotis de cerdos sanos, no se suele observar en aves.
Aglutinación.
Agregación de los eritrocitos en “clusters”, no en pilas de moneda. Se debe a la presencia de inmunoglobulinas en las superficies de los eritrocitos. En caso de anemia es bastante sugerente de destrucción inmunomediada de los eritrocitos.
Policromasia.
Presencia de eritrocitos policromatófilos en el frotis sanguíneo. Los policromatófilos son eritrocitos que se ven de color rojo-azulado. Su presencia en el frotis es indicativa de una adecuada respuesta de la médula ósea en caso de anemia (regeneración). Es importante conocer el porcentaje de policromatófilos normal en las diferentes especies.
Anisocitosis.
Variación del diámetro de los eritrocitos en el frotis sanguíneo. Aumenta cuando hay diferentes poblaciones celulares como ocurre tras una transfusión de sangre. Puede ocurrir porque haya un gran número de células pequeñas (microcíticas) por deficiencia de hierro, o cuando hay un gran número de reticulocitos en una respuesta regenerativa (macrocíticas vs microcíticas en función de la especie).
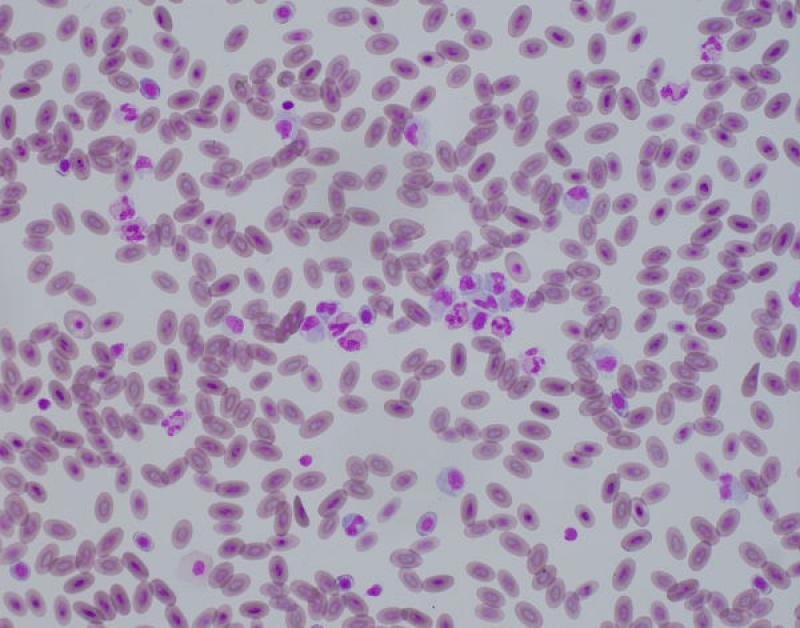
Hipocromasia (Figura 2).
Presencia de eritrocitos con una palidez central aumentada y zona periférica disminuida. Importante diferenciar de los torocitos, que son un artefacto en el que los eritrocitos se observan con una zona central incolora como si hubiera sido extraída. La presencia de hipocromasia indica anemia por deficiencia de hierro. La media de hemoglobina de los eritrocitos se ve reflejada en el parámetro MCHC o concentración de hemoglobina media de los eritrocitos.
Poiquilocitosis.
Presencia de anormalidades morfológicas de los eritrocitos. Es importante determinar las posibles causas para las alteraciones observadas. Estas células son más susceptibles a daño celular por lo que tienen una vida media inferior a los eritrocitos. Pueden tener una forma más redondeada, elongada o irregular. El núcleo también puede variar en apariencia, localización y número (eritrocitos binucleados: eritropoyesis anormal secundaria a inflamación crónica o neoplasia, en reptiles indica regeneración), y en algunos casos puede estar ausente (eritroplástidos).
- Equinocitos (Figura 3): eritrocitos espiculados en los que las espículas están distribuidas de forma uniforme por la superficie y son de tamaños similares. Los podemos observar en hipofosfatemia, uremia, asociado a algunas quimioterapias, artefactuales (crenación), etc.
- Esferocitos: eritrocitos en los que no se observa la palidez central por estar hinchados o faltarles parte de la membrana celular. Se observan en anemias hemolíticas inmunomediadas, o anemia por cuerpos de Heinz, intoxicación por zinc, hipofosfatemia, intoxicaciones por veneno de serpiente, coagulación intravascular diseminada, etc.
- Acantocitos: eritrocitos con espículas distribuidas de forma irregular por la superficie celular. Suelen aparecer por alteraciones de la composición lipídica de la membrana. Los podemos observar en enfermedad hepática, anemia ferropénica, hemangiosarcomas, coagulación intravascular diseminada, etc.
- Excentrocitos: son eritrocitos en los que la hemoglobina se localiza en una parte de la célula mientras que otra parte aparece incolora por adhesión de las dos partes de la membrana del eritrocito. Se pueden observar por fármacos (paracetamol, propofol, vitamina K, azatioprina, ciclofosfamida), ingestión de cebolla o ajo o infecciones graves.
- Queratinocito: eritrocitos que tienen un “agujero” en la membrana que resulta en una o dos proyecciones en la misma.
- Esquistocitos: fragmentos de eritrocitos con extremos puntiagudos. Posibles causas: coagulación intravascular diseminada, hemangiosarcoma, dirofilariosis, anemia ferropénica, enfermedad hepática.
- Codocitos: eritrocitos con un pequeño círculo de hemoglobina en la palidez central.
- Eliptocitos: eritrocitos elípticos/ovales. Causas: mielofibrosis, síndromes mielodisplásicos, enfermedad hepática, leucemia, quimioterapia o artefacto entre otras.
- Estomacitos: eritrocitos con palidez central de forma oval. Causas: anemia regenerativa, enfermedad hepática, intoxicación por plomo.
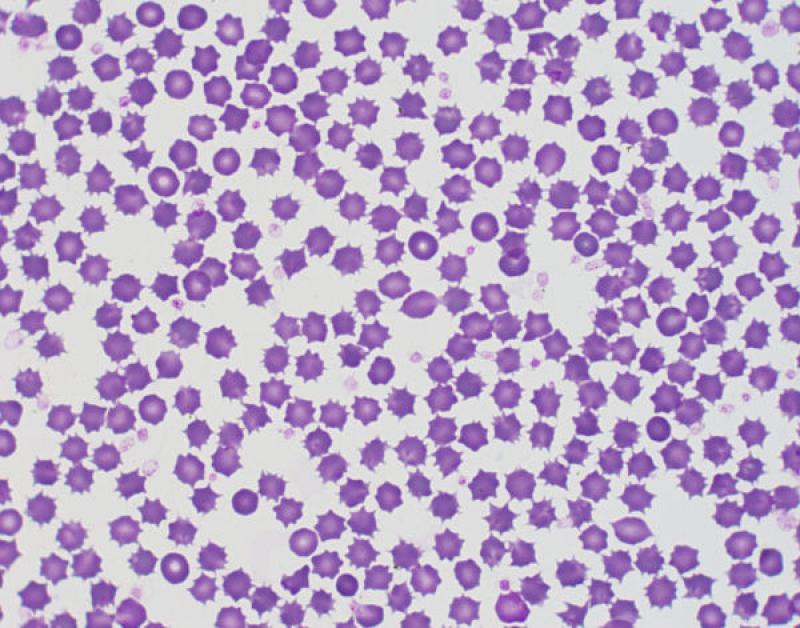
Eritrocitos nucleados.
Pueden observarse en bajo número en la sangre de animales adultos sanos. Se puede ver en animales intoxicados por plomo, septicemia, shock endotóxico o por fármacos. También se han visto en animales con golpe de calor. En reptiles indican regeneración.
Inclusiones de los eritrocitos:
- Cuerpos de Howell-Jolly. Son restos pequeños y esféricos de núcleo que se forman en médula ósea por fragmentación o rotura de la membrana nuclear. Se pueden observar en bajo número en roedores de forma normal. También pueden verse asociados a respuesta regenerativa o en animales sometidos a quimioterapia.
- Cuerpos de Heinz: son inclusiones de hemoglobina agregada, oxidada y precipitada en la superficie de las membranas de los eritrocitos. Al contrario de los cuerpos de Howell-Jolly, que se tiñen de color azul oscuro, los cuerpos de Heinz se tiñen rosa pálido con las tinciones Diff-Quick® habituales, y en ocasiones se les puede ver protruir de la superficie de la membrana formando la típica “nariz de payaso”. La principal causa de la aparición de anemia por cuerpos de Heinz es la oxidación de la hemoglobina por alimentos (ajos, cebolla) o fármacos (paracetamol).
Policitemia
La policitemia se puede categorizar en absoluta o relativa (por redistribución de los eritrocitos, hemoconcentración o pérdida de plasma por deshidratación)2. La policitemia absoluta se subcategoriza en primaria (policitemia vera, producción autónoma) o secundaria (por un incremento de eritropoyetina en respuesta a la hipoxia)2,3,11.
Pequeños mamíferos. Los efectos de la contracción esplénica (policitemia relativa) se suele observar clínicamente en animales con un elevado hematocrito, como los hurones, asociado a excitación (liberación de epinefrina)3.
Aves. Los mecanismos por los cuales se producen no están tan descritos como en pequeños mamíferos11. La policitemia absoluta primaria es rara, como causas de policitemia secundaria se describen enfermedad pulmonar crónica, enfermedad cardíaca, enfermedad de almacenaje del hierro, enfermedad renal, neoplasia renal o como una respuesta fisiología a elevadas altitudes2,11. Las aves no almacenan eritrocitos de reserva en el bazo, por lo que la policitemia relativa por redistribución de los eritrocitos (en respuesta al ejercicio, excitación, miedo o dolor) no se observa2,4,11.
Reptiles. Hablamos de policitemia cuando el hematocrito es superior a 40 %1,2. La causa principal es la deshidratación (también observaremos un aumento de las proteínas totales), es frecuente en hibernación o periodos secos (el reptil puede no haber bebido durante meses)1,2. También se ha descrito en iguanas hembras activas sanas1.
Trombocitopatías
Trombocitosis
Pequeños mamíferos. Raramente se observa. Asociada a anemia por deficiencia de hierro, enfermedades inflamatorias y efectos de la adrenalina3.
Aves. No bien documentada, pero puede ocurrir como una respuesta apropiada a trombocitopenias o a enfermedades crónicas2.
Reptiles. Poco descritas.
Trombocitopenia
Se produce como resultado a una disminución en la producción, un aumento en la destrucción o un aumento en la utilización (consumo)3.
Pequeños mamíferos. Disminución en el número de megacariocitos en la médula ósea, tóxicos, irradiación, agentes infecciosos, enfermedades inmunomediadas. Las causas descritas en conejos son: infecciones agudas, hemorragias, artefactual (coágulos), coagulación intravascular diseminada8.
Aves. Puede ser secundario a un incremento en su destrucción o a una demanda excesiva, como en septicemia o coagulación intravascular diseminada, supresión de la médula ósea (pancitopenia), o en algunas infecciones víricas (circovirus, reovirus, o poliomavirus)2. Descrito en toxicidad por fenbendazol (columbiformes, psitaciformes, entre otras, y asociada a heteropenia y anemia)4,11.
Reptiles. Generalmente es por un uso periférico excesivo o una disminución en la producción por una patología como septicemia o coagulación intravascular diseminada1.
Interpretación de leucogramas
Leucocitosis fisiológica
- Por miedo, excitación, ejercicio extenuante.
- Neutrofilia/heterofilia madura leve y linfocitosis.
- Monocitos y eosinófilos sin cambios o ligero aumento.
- Aparece en pocos minutos y resuelve en unos 30 minutos (perros y gatos).
- Mediado por la epinefrina.
En reptiles otras causas de leucocitosis fisiológicas incluyen: edad (tortuga Caretta caretta), o estacional (durante el invierno en víboras africanas).
Leucocitosis inducida por corticosteroides (Leucograma de estrés)
- Por estrés severo, Cushing o aporte exógeno de corticosteroides.
- Neutrofilia/heterofilia madura, linfopenia, monocitosis y eosinopenia.
- Aparece a las 4-8 h y se resuelve en 24 h (en tratamientos con cortisona de más de 10 días puede tardar en resolver 2-3 días) (perros y gatos).
En aves se puede observar una leucocitosis de leve a moderada por estrés ambiental, no se conoce el mecanismo exacto por el que se produce, pero se cree que puede ir relacionado con cambios endógenos de cortisol4. Se han descrito en guacamayos, loros grises, cacatúas y ratites, durante captura, restricción manual durante el examen físico, ejercicio o trauma2,4. Los niveles de corticoides cambian rápidamente durante el estrés, aunque el número total de leucocitos cambian más lentamente (30 minutos - 2 horas) en respuesta al estrés, siendo menos variables, pero más duraderos4. En aves la extracción de sangre tiene que ser rápida con un estrés mínimo para evitar el leucograma de estrés asociado al manejo. El ratio H/L es un indicador más fiable de las alteraciones asociadas al estrés, ya que varía menos que el número de heterófilos o linfocitos por separado4.
Leucogramas inflamatorios
- Inflamación hiperaguda
- Leucopenia con neutropenia/heteropenia
- Neutropenia/heteropenia por marginación vascular, acortamiento de la vida media, aumento de migración a los tejidos.
- Se establece a las 1-3 h y persiste 2-3 h (perros y gatos).
- Infecciones uterinas, pulmonares, celómicas (sobre todo por bacterias G -).
- Leucopenia con neutropenia/heteropenia
- Inflamación aguda
- Leucocitosis por neutrofilia/heterofilia (desviación a la izquierda).
- Aparece a las 6-8 h del estímulo inflamatorio inicial (perros y gatos).
- La demanda en tejidos supera la producción por parte de la médula ósea.
- Cambios tóxicos en neutrófilos/heterófilos.
- A veces junto a leucograma de estrés (linfopenia, monocitosis, eosinopenia).
- Inflamación crónica
- Inflamación de días o semanas.
- Alteraciones en la médula ósea.
- Leucocitosis con neutrofilia/heterofilia (desviación a la izquierda ligera o ausente).
- Reacción leucemoide: leucograma que parece una leucemia granulocítica en recuento y diferencial de WBC pero que está causada por procesos “benignos”
- Marcada leucocitosis neutrofílica/heterofílica.
- Desviación a la izquierda.
- Pueden o no existir cambios tóxicos.
- Neutrofilia/heterofilia extrema. Leucograma caracterizado por leucocitosis neutrofílica/heterofílica con desviación a la izquierda y sin evidencias de neoplasia hematopoyética.
Pequeños mamíferos. Los conejos con enfermedades infecciosas típicamente no muestran un aumento del recuento de leucocitos, sino que en vez de tener un recuento predominante linfocítico tienen un recuento principalmente neutrofílico8.
Aves. Asociado a enfermedades graves, las causas descritas incluyen Chlamydophila, Aspergillus, Salmonella o Mycobacterium (especialmente si observamos una leucocitosis marcada, WBC>30.000 103/µL), procesos inmunomediados, cuerpos extraños gastrointestinales, necrosis tisular, enfermedades inflamatorias (gota, celomitis por huevo, enfermedades articulares degenerativas o alergias), neoplasias o toxicosis (plomo)2,4.
Reptiles. Un recuento elevado de leucocitos puede ser debido a una respuesta inflamatoria/inflamatoria, infección y/o estrés6. A menudo los parámetros más importantes para interpretar el leucograma es el diferencial de leucocitos y la morfología de estos, en vez de un recuento total6. Un estudio en tortugas (C. mydas) con dermatitis ulcerativa demostró que no había diferencias en el número total de leucocitos, en cambio la ratio heterófilos/linfocitos era significativamente menor6.
Alteraciones del número de leucocitos
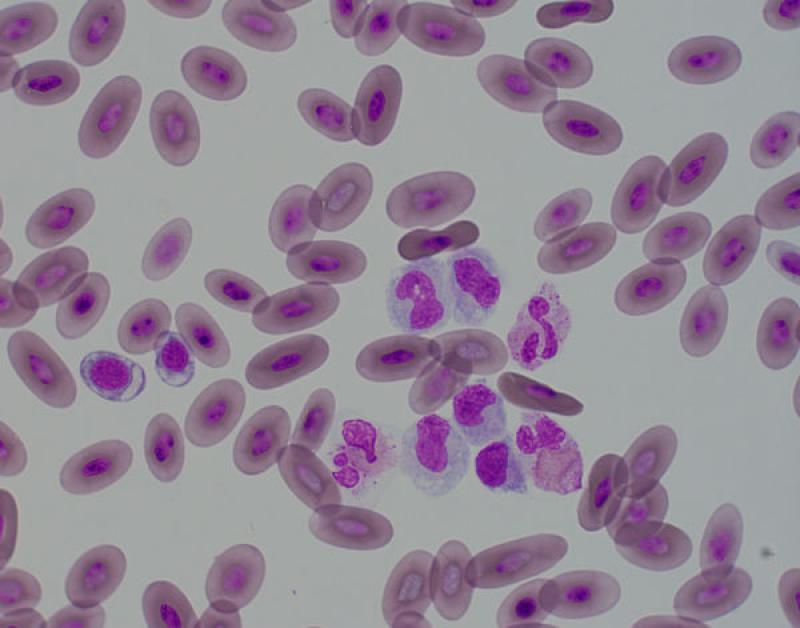
Linfocitosis (Figura 4)
- En leucocitosis fisiológica, en reptiles variaciones fisiológicas en función de sexo, especie y edad.
- Estímulo antigénico persistente: infección o inflamación crónica (infecciones bacterianas, fúngicas, víricas, protozoarias...).
- Neoplasias linfoproliferativas: linfoma, leucemias, timoma.
- Hipoadrenocorticismo.
Pequeños mamíferos. Generalmente asociada a excitación o leucemia linfocítica. En conejos se ha descrito en casos de linfomas e infecciones víricas3,8.
Aves. La presencia de linfocitos reactivos puede indicar estimulación antigénica secundaria a enfermedades infecciosas, como enfermedades víricas (Herpesvirus, Circovirus), Chlamydophila, aspergilosis, tuberculosis o salmonelosis.
Reptiles. El número de leucocitos es variable en reptiles y pueden representar el 80 % de las células circulantes. Muchos reptiles tienen un recuento mayor de linfocitos que de heterófilos5. El número de linfocitos están influenciados por diferentes factores intrínsecos y extrínsecos. Factores ambientales y fisiológicos como la época del año o la hibernación afectan al recuento de linfocitos. El número de linfocitos es más bajo en invierno y más alto en verano. Los reptiles de climas temperados que no hibernan tienen menos linfocitos circulantes en invierno. También están afectados por el sexo, siendo las hembras las que tienen un número más elevado de linfocitos5. Las linfocitosis en reptiles se asocian a la cicatrización o curación de heridas, enfermedades inflamatorias, infecciones parasitarias o víricas y durante la ecdisis5. La presencia de linfocitos reactivos, y menos frecuentemente de células plasmáticas, indican una estimulación de sistema inmune. Se han descrito leucemias linfoides y otras neoplasias hematopoyéticas5.
Linfopenia
- Estrés, administración de glucocorticoides (predecible). Causa más común en aves4.
- Infecciones agudas (por estrés y redistribución)
- Atrapamiento en órganos/tejidos linfoides
- Destrucción de linfocitos y atrofia de tejido linfoides (virus)
- Pérdidas intestinales
- Infecciones virales
- Quilotórax-quiloabdomen: centesis continuadas
- Malnutrición en reptiles5
Pequeños mamíferos. Indicativa de un exceso de corticoides. Se observa frecuentemente en infecciones agudas3. En conejos se ha descrito asociada a infecciones agudas, estrés, administración exógena de esteroides de forma crónica8. Aunque los conejos generalmente no desarrollan leucocitosis en infecciones bacterianas, la concentración absoluta de heterófilos aumenta mientras que la concentración absoluta de linfocitos disminuye, por lo que la evaluación del ratio heterófilos/linfocitos es un indicador más fiable de desórdenes inflamatorios (recordar que los conejos son especies linfocíticas, aunque se observa una variación de su concentración en función de la edad)3. En hurones en cambio la concentración de neutrófilos es superior a la concentración de linfocitos. La concentración total de leucocitos en hurones sanos puede tener un límite inferior de 3000/µL, y no suelen desarrollar linfocitosis marcadas en enfermedades inflamatorias, siendo raro observar valores superiores de 20000/µL y desviación a la izquierda3.
Aves. Las causas más descritas incluyen un exceso de corticosteroides endógenos o exógenos, infecciones víricas o supresiones de médula ósea, enfermedades víricas (aunque poco descritas) o quimioterápicos2,4,11.
Reptiles. Ocurre secundariamente a enfermedades asociadas a inmunosupresión, estrés o malnutrición crónicos5.
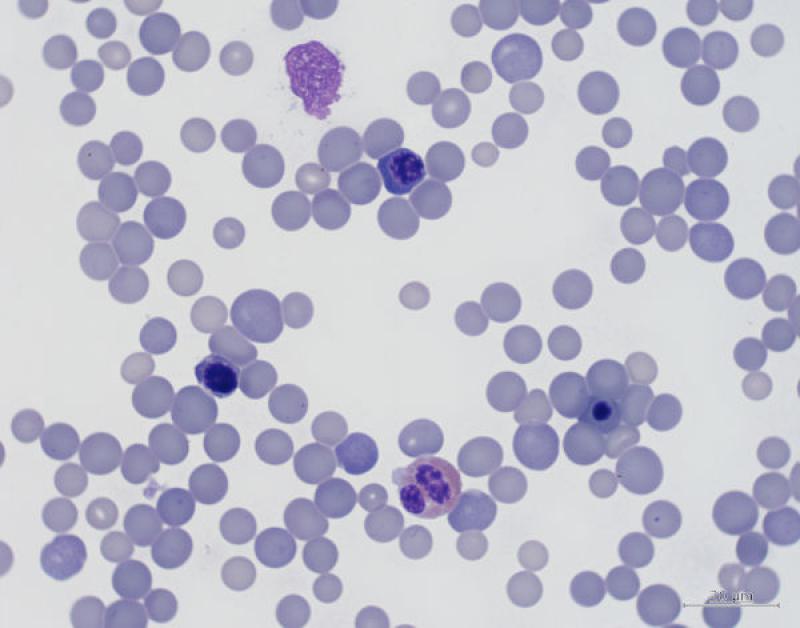
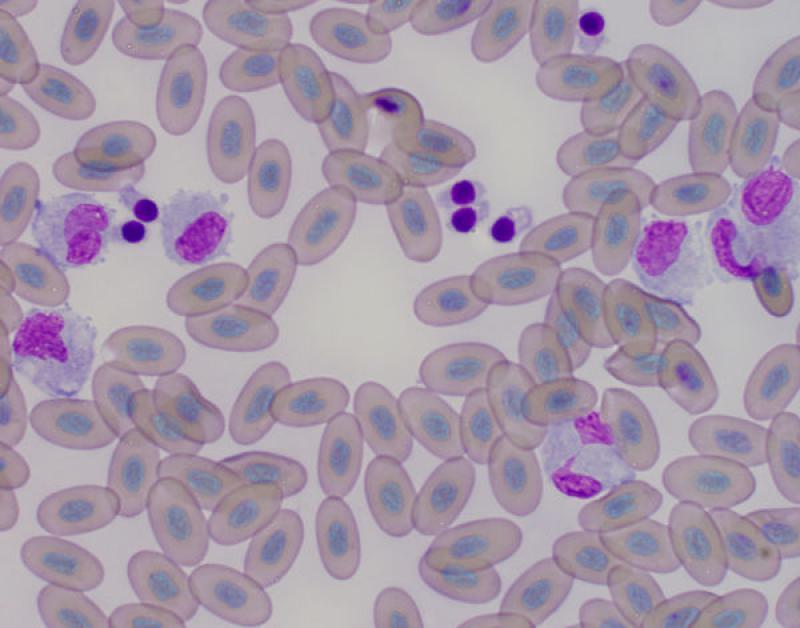
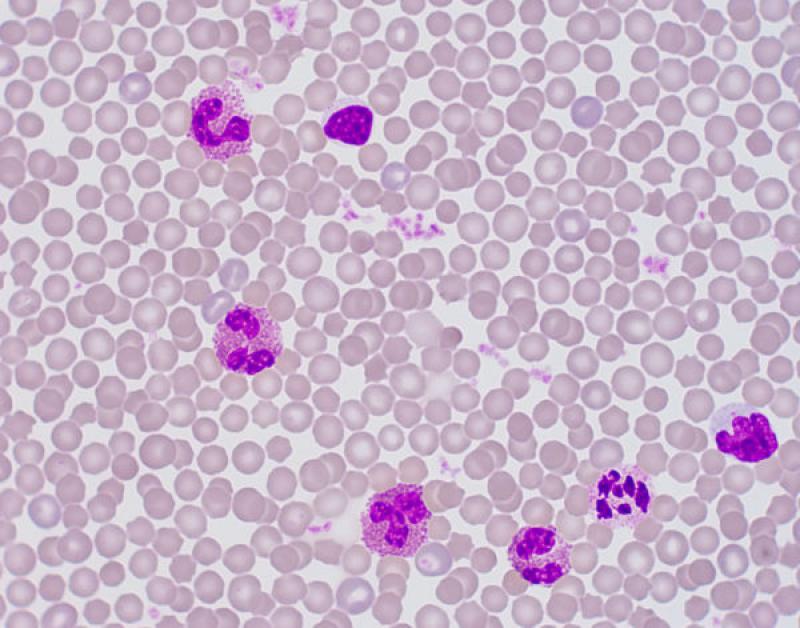
Monocitosis (Figura 5)
- Normalmente + neutrofilia/heterofilia.
- Se asocia a necrosis, supuración, neoplasias malignas, lesiones piogranulomatosas, hemorragia interna, hemólisis, trauma, endocarditis bacteriana.
Pequeños mamíferos. Inflamaciones crónicas, típicamente asociada a neutrofilia/heterofilia (necrosis, neoplasia maligna, lesiones piogranulomatosas, trauma, hemólisis o causas inflamatorias)3,8.
Aves. Se puede observar tanto en inflamaciones agudas, como crónicas. (ejemplos: Mycoplasma, Mycobacterium, Chlamydophila o Aspergillus) o enfermedades bacterianas granulomatosas2. Otras causas son inflamaciones granulomatosas, reacciones de cuerpo extraño, deficiencias nutricionales (deficiencias en zinc)4.
Reptiles. Fisiológico, se observa un incremento durante el invierno (Boa constrictor) y en edad avanzada (Caretta caretta) y también se asocia a infecciones bacterianas y parasitarias, enfermedades inflamatorias, especialmente en inflamaciones granulomatosas6.
Monocitopenia
- Sin valor clínico
Aves. Los monocitos no son comunes en sangre periférica, valores bajos o cero no son infrecuentes, también se ha asociado a deficiencias nutricionales2.
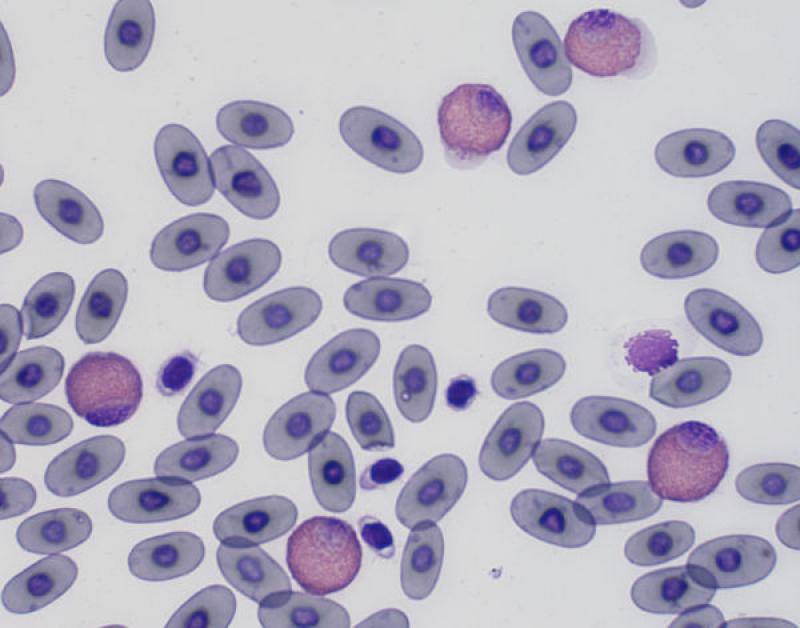
Neutrofilia / Heterofilia (Figura 6)
- Leucocitosis fisiológica
- Leucocitosis inducida por corticosteroides
- Inflamación:
- Lesiones purulentas locales (abscesos) producen mayor neutrofilia/heterofilia que procesos generalizados (septicemia).
- Grado de neutrofilia/heterofilia y de desviación a la izquierda indicadores de severidad.
- Hemólisis
- Hemorragia
- Enfermedades inmunomediadas
- Síndromes paraneoplásicos
- Trombosis, infartos, quemaduras, trauma, uremia...
Pequeños mamíferos. Los neutrófilos/heterófilos de los mamíferos son la principal línea de defensa contra cualquier estímulo inflamatorio, como la invasión de microorganismos o trauma tisular. El balance entre el consumo y liberación de neutrófilos/heterófilos por la médula ósea está afectado por el número de células de reserva y la capacidad de regeneración de cada especie. Estas diferencias se traducen en la magnitud de la neutrofilia/heterofilia que puede ocurrir en la respuesta inflamatoria en cada especie. Especies con una gran reserva puede liberar un mayor número a sangre periférica y así observar neutrofilia o heterofilia durante una inflamación aguda. Especies con una reserva menor puede exhibir una neutropenia/heteropenia inicial hasta que la médula ósea pueda responder. Por ejemplo, los conejos sanos que son primariamente linfocíticos, raramente se observa una leucocitosis significante en infecciones o inflamaciones agudas3.
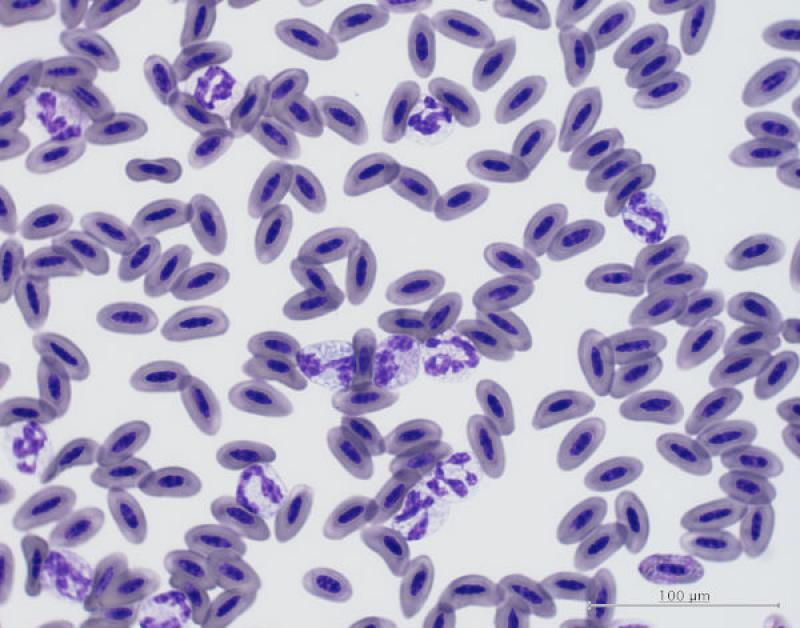
Aves. Descrito en intoxicaciones con organofosforados o zinc/plomo2. También se asocia a inflamaciones agudas o crónicas, enfermedades infecciosas (Chlamydophila sp., Mycoplasma sp., aspergillosis), neumonía, celomitis, neoplasia, estrés o fisiológico en animales jóvenes2,4. Los heterófilos inmaduros (en banda) raramente se observan en frotis de aves, aunque, cuando están presentes, pueden indicar una inflamación aguda y grave (la demanda de heterófilos es mayor que su liberación por la médula ósea)2,4.
Los heterófilos en banda se observan durante las 12-24 h del inicio de la enfermedad inflamatoria2. Un incremento marcado puede ser debido a una leucemia granulocítica (rara en aves)4. Los heterófilos tóxicos se observan con frecuencia en enfermedades graves que afectan a la producción y liberación en la médula ósea, como por ejemplo en septicemia, viremia, clamidia, infecciones fúngicas o necrosis tisular severa2,4. El grado de toxicidad indica la gravedad de la enfermedad4. Las especies predominantemente linfocíticas (p. ej., anseriformes) responden con heterofilia en inflamaciones agudas, inicialmente se suele observar leucopenia (hasta las 12 h) mostrando después la típica leucocitosis, con heterofilia y linfopenia4. Las especies predominantemente heterofílicas (p. ej., psitacidas, ratites y rapaces) típicamente muestran menos cambios en el leucograma de estrés4.
Reptiles. Generalmente asociado a infecciones bacterianas y parasitarias, estrés, neoplasia o leucemia heterofílica. Los reptiles desarrollan una marcada leucocitosis con heterofilia, con abundantes heterófilos inmaduros en enfermedades inflamatorias graves, especialmente si la etiología es bacteriana5.
Neutropenia / Heteropenia
- Menos frecuente
- Supone un mayor riesgo de infección
Mecanismos:
- Menor producción en médula ósea:
- Irradiación/radioterapia: severa neutropenia.
- Quimioterapia: predecible según el fármaco. Suele ocurrir a los 7 días de la administración.
- Estrógenos (administración exógena o neoplasias productoras de estrógenos).
- Infecciones víricas (por diferentes mecanismos).
- En hurones con moquillo o tortugas con Herpesvirus.
- Reacciones idiosincrásicas a fármacos: cefalosporinas, trimetoprimsulfa, fenobarbital, administración de fenbendazol (tortuga Testudo hermanni).
- Desviación del pool circulante al marginal:
- Anafilaxis, endotoxemia.
- Mayor migración a tejidos:
- Infección por bacterias piógenas.
Pequeños mamíferos. Se describen en infecciones virales agudas o daño en la médula ósea aguda. En conejos se describe asociada a infecciones bacterianas hiperagudas o infecciones crónicas, infecciones virales, hiperesplenismo, shock endotóxico/séptico/anafiláctico, tumores productores de estrógenos (p. ej., tumor de células de Sertoli), toxemia y neoplasia8.
Aves. En aves está asociada a enfermedades infecciosas severas, septicemias bacterianas e infecciones víricas (Circovirus, principalmente en loros grises). Aunque la heteropenia es rara y generalmente asociada a leucopenia. Es importante descartar causas artefactuales (si se observan un gran número de células rotas en el frotis). Hay que recordar que algunas especies de aves, como canarios o loros amazonas, los linfocitos son el leucocito predominante en sangre periférica2.
Reptiles. Descrito en tortugas con herpesvirus6.
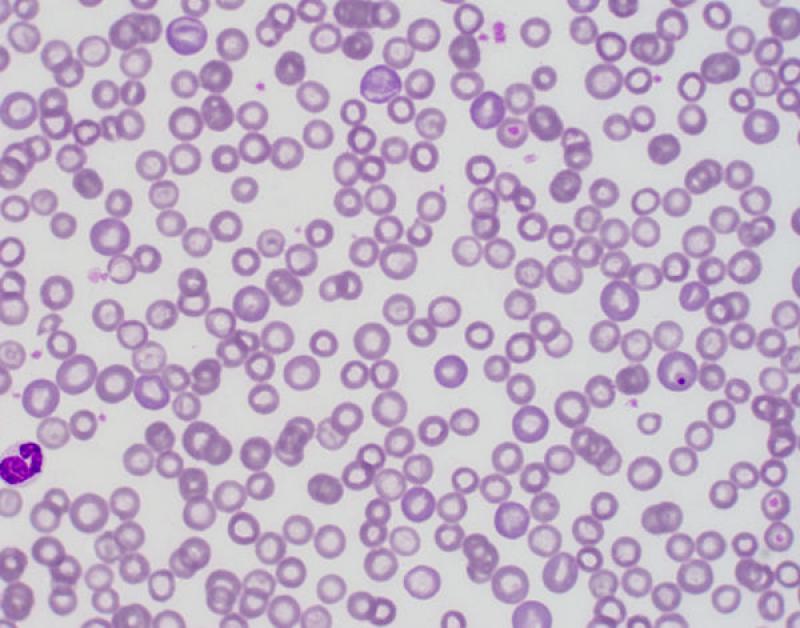
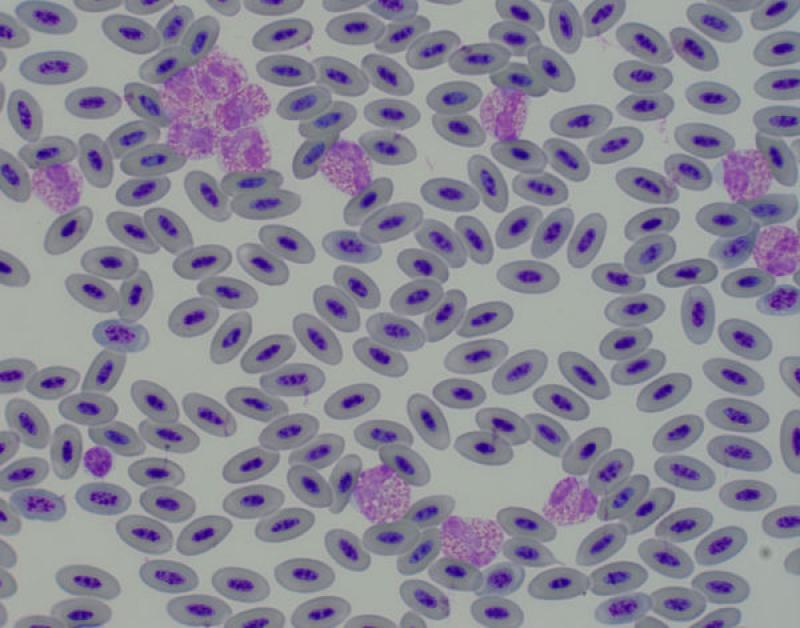
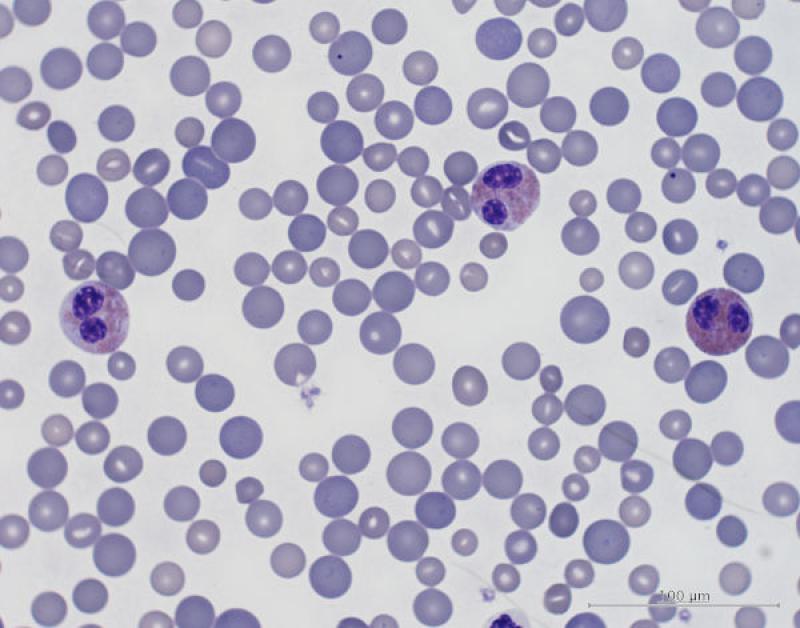
Eosinofília (Figura 7)
- Endo y ectoparásitos
- Inflamación o reacciones de hipersensibilidad local
- Síndrome paraneoplásico
- Síndrome hipereosinofílico vs leucemia eosinofílica
- Algunos fármacos: tetraciclinas
Pequeños mamíferos. Asociada a parasitismo crónico, enfermedad crónica dermatológicas (reacciones de hipersensibilidad o atopia, asociada a basofilia)3,8. En hurones está asociada a gastroenteritis eosinofílica.
Aves. En aves difícil de interpretar, ya que no se conoce su función exacta. Asociada a parásitos externos e internos o a respuestas de hipersensibilidad2,4,11.
Reptiles. Asociado a infecciones parasitarias6. Fisiológico en algunas especies de reptiles, el recuento de eosinófilos es más elevado durante la hibernación. El número de eosinófilos circulantes normales en reptiles es variable. En general, los lagartos tienen un número inferior de eosinófilos comparado con algunas especies de tortugas, que pueden llegar a significar el 20 % de las células circulantes (en Trachemys el recuente es alto). Los valores están influenciados por factores intrínsecos y extrínsecos, por ejemplo, el número es menor en verano y mayor en hibernación en algunas especies5.
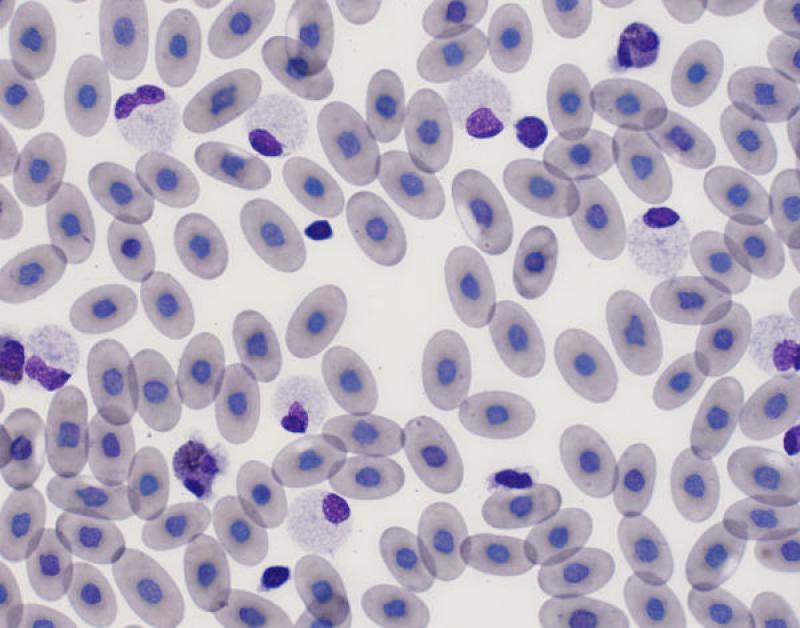
Eosinopenia
- Poco interés clínico. En leucograma de estrés, por administración exógena de glucocorticoides o en Cushing.
Pequeños mamíferos. En conejos asociado a estrés crónico8.
Aves. Raramente descrito en aves2.
Reptiles. Fisiológico en algunas especies de reptiles, por ejemplo, como respuesta fisiológica a la migración (Caretta caretta)6.
Basofilia
- No siempre se produce con eosinofilia
- Dirofilariosis
- Parásitos y otros agentes infecciosos
- Estados de hipersensibilidad
- Enfermedades inflamatorias
- Neoplasias
- Algunos fármacos
Pequeños mamíferos. Significancia limitada. Los conejos típicamente tienen más basófilos que otras especies8.
Aves. Función no muy conocida en aves. Se observa en enfermedades respiratorias o daño tisular, en infecciones activas por clamidia (particularmente en periquitos y loros amazonas). Es normal no encontrar basófilos en el frotis de aves2.
Reptiles. Fisiológico, es normal encontrar valores altos en tortugas Trachemys sp. o Chelidra serpentina. El número de basófilos en los reptiles no parece variar con los cambios estacionales, como ocurre con otros granulocitos. Sin embargo, se ha descrito un incremento significativo durante el invierno en los viperinos africano (Cerastes cerastes y Cerastes vipera). El porcentaje de basófilos en el recuento diferencial de reptiles puede variar de 0 a 40 %, las tortugas de climas áridos como Gopherus agassizii suelen tener un número de basófilos circulantes elevados5.
Basopenia
- Sin valor clínico
Bibliografía
- Nardini G, Leopardi S, Bielli M. Clinical hematology in reptilian species. Vet Clin North Am Exot Anim Pract; 2013; 16:1-30.
- Jones MP. Avian hematology. Vet Clin North Am Exot Anim Pract; 2015; 18:51-61.
- Campbell TW. Peripheral blood of mammals; En: Campbell TW. Exotic animal hematology and cytology. Fourth edition. Oxford: Wiley Blackwell; 2015; 3-36.
- Campbell TW. Peripheral blood of birds; En: Campbell TW. Exotic animal hematology and cytology. Fourth edition. Oxford: Wiley Blackwell; 2015; 37-66.
- Campbell TW. Peripheral blood of reptiles; En: Campbell TW. Exotic animal hematology and cytology. Fourth edition. Oxford: Wiley Blackwell; 2015; 67-88.
- Sykes JM, Klaphake E. Reptile hematology. Vet Clin Exot Anim; 2015; 63–82.
- Healtley JJ, Rusell KE. Box turtle (Terrapene spp.) hematology. J Exot Pet Med; 2010; 19:160-164.
- Moore DM, Zimmerman K. Hematological assessment in pet rabbits. Vet Clin Exot Anim; 2015; 9–19.
- Malka s, Hawkings MG, Zabolotzky SM, Mitchell EB, Ownes SD. Immune-mediated pure red cell aplasia in a domestic ferret. J Am Vet Med Assoc; 2010; 695-700.
- Zabolotzky SM, Walker DB. Peripheral blood smears; En: Cowell RL, Valenciano AC. Diagnostic cytology and hematology of the dog and cat. Fourth edition. Missouri: Elsevier; 2014; 457-488.
- Clark P, Boardman WSJ, Raidal SR. Physiological and pathological influences on the hematological characteristics of birds. En: Atlas of clinical avian hematology. Wiley-Blackwell. First edition 2009: 97-124.
 by Multimédica
by Multimédica