Hematología en animales exóticos. Parte II: frotis sanguíneo en aves y reptiles
Resumen breve
En la clínica de animales exóticos, del mismo modo que en perros y gatos, se realizan pruebas laboratoriales como parte del abordaje diagnóstico para establecer un diagnóstico definitivo. La hematología es una herramienta fundamental en el diagnóstico laboratorial, siendo el frotis sanguíneo de especial interés en aves y reptiles, por la morfología característica de sus células sanguíneas (particularmente eritrocitos y trombocitos nucleados) que impide el uso de contadores automatizados…Índice de contenidos
Resumen
En la clínica de animales exóticos, del mismo modo que en perros y gatos, se realizan pruebas laboratoriales como parte del abordaje diagnóstico para establecer un diagnóstico definitivo. La hematología es una herramienta fundamental en el diagnóstico laboratorial, siendo el frotis sanguíneo de especial interés en aves y reptiles, por la morfología característica de sus células sanguíneas (particularmente eritrocitos y trombocitos nucleados) que impide el uso de contadores automatizados programados para realizar recuentos sanguíneos en mamíferos.
La gran variación morfológica entre especies y la falta de bibliografía al respecto dificulta la identificación celular y la interpretación del frotis sanguíneo en este grupo de animales, por lo que se requiere un buen conocimiento y mucha práctica, ya que la diferenciación celular no es tan obvia como en otras especies. Además, las condiciones fisiológicas y adaptaciones al medio ambiente, especialmente importantes en reptiles, pueden hacer variar considerablemente los parámetros hematológicos. Hecho que dificulta establecer la importancia clínica de las variaciones de los escasos intervalos de referencia que tenemos. En el presente artículo se realizará una revisión de morfología de las células sanguíneas en aves y reptiles, y de los factores que pueden interferir en la variabilidad de los intervalos de referencia.
Introducción
Las pruebas laboratoriales en aves y reptiles, del mismo modo que en otros animales, se emplean de forma conjunta con otras pruebas complementarias para poder establecer un diagnóstico definitivo. Siendo la hematología uno prueba fundamental para conocer el estado de salud del paciente
Sin embargo, la interpretación de los resultados hematológicos sigue siendo un desafío en la mayoría de los animales exóticos en comparación con perros y gatos, debido al menor número de estudios realizados y la falta de intervalos de referencia en las especies que conforman este grupo de animales1. La diversidad y cantidad de especies, más de 9000 en el caso de aves o 7600 en reptiles, sin duda es uno de los principales problemas, agravado por la escasez de información científica, de reactivos específicos, terminología inconsistente o falta de investigaciones sobre las enfermedades o problemas médicos que acompañan a muchos cambios hematológicos2.
La morfología característica de las células sanguíneas, con variaciones interespecíficas marcadas, dificulta la interpretación del frotis sanguíneo por veterinarios poco habituados en esta área.
En el presente artículo “Hematología en animales exóticos. Parte II: frotis sanguíneo en aves y reptiles” nos centraremos en los factores que afectan a la interpretación de la hematología en aves y reptiles y en la descripción de la morfología celular en estas especies, ejemplarizando las diferencias morfológicas con diferentes imágenes. Las generalidades de la hematología en animales exóticos, métodos de extracción, accesos vasculares, y técnicas de realización de frotis se ha abordado en la primera parte de este artículo “Hematología en animales exóticos.
Parte I: introducción y frotis sanguíneo en pequeños mamíferos”, y la interpretación de los resultados que nos proporciona el frotis sanguíneo se abordará en una tercera parte.
Hematología clínica
Los problemas que nos encontraremos al interpretar la hematología en aves y reptiles es la falta de intervalos de referencia para la mayoría de especies, el bajo tamaño muestral de algunos de los artículos publicados o la dificultad de interpretación de los resultados disponibles por la simplicidad de categorizar a los individuos como sanos (únicamente por la no detección de alteraciones en el examen físico) o la falta de datos sobre el momento, método o lugar de extracción de sangre, entre otros muchos factores. Otro problema importante es la variabilidad de estos intervalos por factores como1,3:
- Factores intrínsecos: especie, sexo (los reptiles machos típicamente tienen valores eritrocitarios mayores, aunque hay varias excepciones4. En Testudos hermanni spp, Kinixys Erosa y Elseya novaeguineae machos se observa un mayor HTC y concentración de HGB que en hembras5. En cambio, en Iguana iguana hembras (grávidas o no) se observa un mayor HTC y concentración de HCB que en machos4. En tortugas Hieremys annandalii machos se observa un mayor número de leucocitos que en hembras, en cambio las cobras Naja naja el total de leucocitos es mayor en hembras3. En tortugas caja, Cuora flavomarginata, machos el recuento de eosinófilos y monocitos es mayor que en hembras)3, edad (En muchas especies de aves el HTC y la concentración de HGB aumenta con la edad6. En tortugas marinas, Caretta careta, el HTC, el recuento total de leucocitos y de monocitos son inferiores en animales jóvenes, contrariamente el número de granulocitos es mayor en animales adultos.3 En águila calva, Haliaeetus leucocephalus, se observa una disminución de los leucocitos totales a medida que aumenta la edad)7, y estado fisiológico (Las tortugas Dermochelys coriacea en puesta tienen valores inferiores de eosinófilos, y los camaleones tienen valores más elevados de heterófilos después de la puesta3. En palomas en época no reproductiva se observa un aumento en el HTC)6.
- Factores extrínsecos: estación (se han detectado cambios en el HTC en tortugas según la época del año, disminuyendo en meses secos en tortugas Gopherus agassizii, y aumentando en los meses de verano en tortugas C flavomarginata)3, hora del día (Las cotorras de Kramer, Psittacula krameri, muestran un ritmo circadiano con un recuento de heterófilos y eosinófilos mayores de las 6:00 am – 24:00 pm, y una proporción de linfocitos inferiores de las 6:00 am – 24:00 pm)6, temperatura, hábitat (cautividad: indoor/outdoor. Las tortugas Mauremys leprosa tienen valores mayores de linfocitos en cautividad)3, efecto de la migración6, dieta, enfermedad, estrés asociado a la captura (Los cocodrilos, Crocodylus porosus, tienen un mayor HTC y concentración de HGB asociado a la captura. Las pitones, Morelia spilota imbricata, tienen un mayor número de basófilos bajo anestesia que en restricción manual)3, transporte, punto de extracción de sangre (efecto de hemodilución especialmente importante en reptiles, disminuye el HTC, concentración de hemoglobina, y leucocitos)4,8, o hibernación (los índices eritrocitarios son más altos antes de la hibernación y más bajos inmediatamente después)8.
Para interpretar resultados laboratoriales en animales enfermos, es fundamental disponer de intervalos de referencia adecuados. Éstos tienen que ser establecidos a partir de animales sanos de la misma especie que examinamos. Muchos de los intervalos disponibles hoy en día deberían ser considerados como guías y no aceptados de forma absoluta por la influencia de los factores que acabamos de exponer, de la técnica empleada y del procesamiento de la muestra.
De especial importancia en reptiles y otros animales ectodermos, en los que las adaptaciones fisiológicas a factores intrínsecos o extrínsecos pueden provocar mayores variaciones9.
Recientemente se han descrito técnicas de contaje automatizado en aves utilizando una citometría de flujo o citometría de imagen de alto rendimiento10. Hasta la fecha no existe una técnica estándar para el recuento y diferenciación de células sanguíneas aviares, pero estos parecen métodos prometedores, aunque con resultados inconsistentes con las técnicas de contaje manual tradicional10. El coste económico y la gran variación de morfología y tamaño entre las diferentes especies puede dificultar su uso rutinario en laboratorios7.
Frotis sanguíneo
La evaluación de un frotis sanguíneo es una parte esencial del hemograma en aves y reptiles, al igual que en mamíferos. Generalmente el frotis sanguíneo se utiliza para realizar un diferencial de leucocitos, evaluar la morfología celular y la presencia de parásitos hemáticos. Aunque también puede ser útil para realizar un recuento estimado del total de leucocitos.
El frotis sanguíneo debe realizarse con sangre entera inmediatamente después de tomar la muestra sanguínea, sin anticoagulantes, para evitar los artefactos, y debe ser uniforme, con el objetivo de crear una monocapa de células.
Las características especiales que presentan las células hemáticas en este grupo de animales, como por ejemplo la presencia de núcleo en todas las líneas celulares, y la gran variación morfológica entre especies hace indispensable un buen conocimiento sobre la morfología celular y práctica para una correcta evaluación del frotis sanguíneo.
Eritrocitos
Las funciones de los glóbulos rojos en aves y reptiles son similares a la de los mamíferos1: transporte de oxígeno a los tejidos, transporte de CO2 a los pulmones, y el tamponamiento de iones hidrógeno. La principal diferencia con los eritrocitos de los mamíferos es la presencia de núcleo1.
En reptiles los eritrocitos se producen en la médula ósea (mayoritariamente) y a nivel extramedular en hígado, en bazo y por división de células maduras circulantes en sangre periférica1,3.
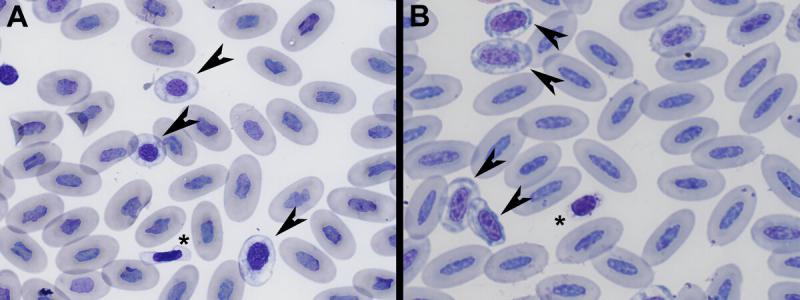
Vida media:
- Aves: muy corta (28-45 días), aunque existe una gran variabilidad entre especies11,12. Por ejemplo, en gallinas es de 28-35 días y en palomas 35-45 días12.
- Reptiles: muy larga (600-800 días)4.
La vida media de los eritrocitos, generalmente, se relaciona con el peso corporal y la tasa metabólica, por lo que, en animales de pequeño tamaño, con mayor tasa metabólica, tienen una menor vida media.
Morfología:
- Aves: los eritrocitos tienen una forma elíptica, con un núcleo también elíptico y centralmente posicionado, y orientado al eje largo celular11-13.
- Reptiles: tienen una forma elíptica y alargada, con los extremos más redondeados que los eritrocitos de las aves. El núcleo es de oval a redondo, orientado al eje largo celular y, al igual que en aves, posicionado centralmente. El núcleo posee unos márgenes irregulares. El citoplasma tiene una textura uniforme. Es frecuente observar unas inclusiones redondeadas o irregulares basofílicas en el citoplasma (artefacto), también podemos observar vacuolas o áreas de refracción1,3,4,14.
Tamaño:
- Aves: generalmente más grandes que los eritrocitos de los mamíferos13, pero más pequeños que en reptiles (rango: 10,7 x 6,1 / 15,8 x 10,2 µm). Tamaño variable en función de la especie11,12.
- Reptiles: más grandes que los eritrocitos de aves y mamíferos (14-23 µm de largo, 8-14 µm de ancho)1,4.
Anormalidades morfológicas de los eritrocitos: se pueden encontrar las mismas que las descritas en pequeños mamíferos: pilas de monedas, aglutinación, policromasia, anisocitosis, hipocromasia, poquilocitosis, eritrocitos nucleados e inclusiones eritrocitarias12.
Eritrocitos policromatófilos vs reticulocitos: “Todos los policromatófilos son reticulocitos. No todos los reticulocitos son policromatófilos”.
Los eritrocitos policromatófilos son el penúltimo estadio de desarrollo de los eritrocitos, los cuales han sido liberados de forma temprana a la circulación. Si los comparamos con los eritrocitos maduros, tiene un citoplasma más azulado y un patrón de cromatina menos denso12.
Los retículos son aquellos eritrocitos que cuando se tiñen con tinciones supravitales, como por ejemplo el azul de metileno o el azul cresil brillante, se observa en su citoplasma agregaciones de RNA. El número de reticulocitos se suele correlacionar con el número de eritrocitos policromatófilos en frotis sanguíneos teñidos con tinciones Romanowsky13. También se pueden observar en frotis sanguíneo eritrocitos en estadios más inmaduros, como por ejemplo los rubricitos13.
- En aves, es frecuente observar entre 1-5 % de eritrocitos policromatófilos en animales sanos11. Estos tienen un tamaño similar o un poco más pequeño que los eritrocitos maduros, y son más redondeados11. El citoplasma tiene una coloración más azulada y el núcleo es más redondeado, con una cromatina menos laxa12. Eritrocitos binucleados, indican una eritropoyesis anormal, generalmente asociada a inflamación crónica y severa o neoplasia11, aunque esta descrito que de forma ocasional se pueden observar en animales sanos13.
- En reptiles, los eritrocitos inmaduros son más redondeados que los maduros, y poseen un núcleo redondo y grande, con cromatina laxa, y un escaso citoplasma azul oscuro. Parecen de menor tamaño que los eritrocitos maduros, debido probablemente a su forma esférica3,4. Estos eritrocitos son capaces de duplicarse; la presencia de células binucleadas o de células con mitosis en sangre periférica es una respuesta fisiológica apropiada a una anemia y no se debe asociar con un proceso neoplásico. El grado de policromasia en reptiles sanos es generalmente bajo y representa menos del 1% del total de eritrocitos1. La razón puede ser un recambio eritrocitario más lento de debido a su larga vida media1.
El número de eritrocitos en sangre periférica de reptiles es inferior al de mamíferos y aves. En general, oscilan entre 300.000 y 2.500.000 células /μL, dependiendo de la especie y del lugar de punción.
Leucocitos
Podemos distinguir 2 grupos de leucocitos: granulocitos o polimorfonucleares (heterófilos, basófilos y esosinófilos) y los agranulocitos o mononucleares (monocitos, linfocitos, y en menor medida las células plasmáticas).
La clasificación de los leucocitos en los reptiles puede ser problemática debido a la variación morfológica entre especies. En general se dividen en dos grupos: granulocitos y leucocitos mononucleares1. Los granulocitos se subdivididen en acidófilos (heterófilos y eosinófilos, por su diferenciación en forma y color de los gránulos intracitoplasmáticos) y basófilos4.
Las células mononucleares incluyen los linfocitos, monocitos y células plasmáticas1. En reptiles se describe otro tipo celular, los azurófilos, aunque algunos autores los consideran monocitos con gránulos y no como un grupo celular diferente1. En cuanto a su recuento hay autores que los contabilizan en el número total de monocitos, diferenciado entre monocitos azurofílicos y monocitos no azurofílicos15, y otros autores hacen su recuento como una célula diferente16.
Linfocitos
Producción: órganos linfoides y otros tejidos linfoides (linfonodos, timo, bazo y médula ósea)
Vida media: larga (no descrita en aves/reptiles)
Distribución: órganos linfoides y sangre; y tejidos
Tipos de linfocitos:
- Linfocitos B: células plasmáticas (producen anticuerpos).
- Linfocitos T (CD4, CD8, Natural Killer): regulan respuesta inmune, destrucción células tumorales o infectadas por virus.
En reptiles, a diferencia de mamíferos y aves la respuesta inmunológica está muy influida por el ambiente. Las bajas temperaturas pueden suprimir o inhibir la respuesta inmune3.
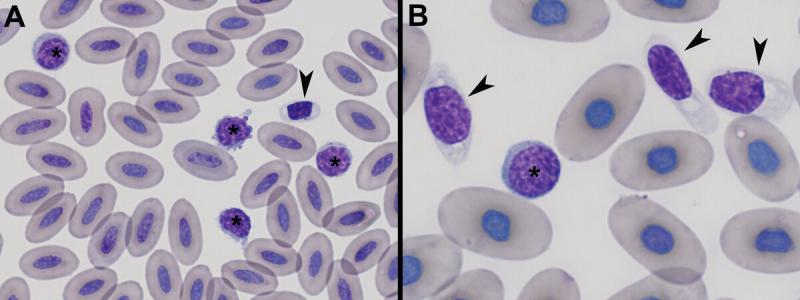
Los linfocitos reactivos: suelen observarse en sangre periférica como respuesta a un estímulo antigénico. Generalmente son de tamaño pequeño a mediano, y pueden presentar cambios como: citoplasma más basófilo, citoplasma más abundante, vacuolas intracitoplasmáticas, proyecciones en la membrana (pseudópodos), patrón de cromatina densa y también pueden observarse nucléolos en el núcleo4,11,12.
Morfología:
- En aves tienen una forma similar a los linfocitos de mamíferos, son células redondas, con un núcleo redondo o ligeramente indentado, posicionado central o ligeramente excéntrico. La cromatina es compacta en los linfocitos maduros, el citoplasma es escaso (elevado ratio N:C), claro o ligeramente azulado y no contiene vacuolas11-13. Podemos observar gránulos puntiformes en su citoplasma13.
- En reptiles, también tienen una forma similar a los de los mamíferos. El núcleo es redondeado y posicionado central o ligeramente excéntrico, con una cromatina compacta. El citoplasma carece de vacuolas y gránulos, con una coloración azul pálida y un elevado radio N:C1,3.
Las características citoplasmáticas son importantes para diferenciar linfocitos de pequeño tamaño y trombocitos. Los trombocitos tienen un citoplasma claro o transparente y frecuentemente contienen vacuolas y algunos gránulos puntiformes eosinófilos11,12.
Tamaño:
Los linfocitos se dividen en pequeños, medianos o grandes, siendo los pequeños y medianos los más frecuente en sangre periférica13.
- Aves: tamaño variable.
- Reptiles: linfocitos pequeños 5-10 μm, linfocitos grandes ≥ 15 µm1.
En aves los linfocitos son la célula mononuclear más frecuente y en algunas especies el leucocito más frecuente en sangre periférica13, (excepción loros amazonas y algunas especies de paseriformes como los canarios)12. En reptiles su número varía, llegando a superar el 80 % del recuento diferencial en algunas especies, muchos reptiles sanos tienen un recuento mayor de linfocitos que de heterófilos3, como por ejemplo las cobras reales16. En serpientes de las especies Boa constrictor, Bothrops jararaca y Crotalus durissus los linfocitos también el leucocito predominante, seguido por los azurófilos y los heterófilos17.
Se pueden observar células plasmáticas en los frotis de aves y reptiles. Generalmente son más grandes que los linfocitos, tienen el núcleo posicionado excéntricamente, de redondo a oval, con cromatina compacta. El citoplasma de las células plasmáticas, a diferencia de los linfocitos, es azulado intenso y contiene un halo perinuclear (Golgi) más claro1,12.
Monocitos
Los monocitos en sangre periférica se corresponden con los macrófagos en los tejidos.
Producción: médula ósea (1-3 días). No se almacenan, son liberados a medida que se producen.
Vida media: (perros/gatos: 18-23 h), no descrita en aves y reptiles.
Distribución: no está claro que exista un pool marginal, pero existen macrófagos propios de determinados tejidos.
Funciones: fagocitar y digerir partículas extrañas o material de desecho de células muertas, producen sustancias que regulan hematopoyesis y modulan respuesta inflamatoria (citoquinas), presentan antígenos a linfocitos T, citotoxicidad: eliminan células infectadas con virus o células tumorales.
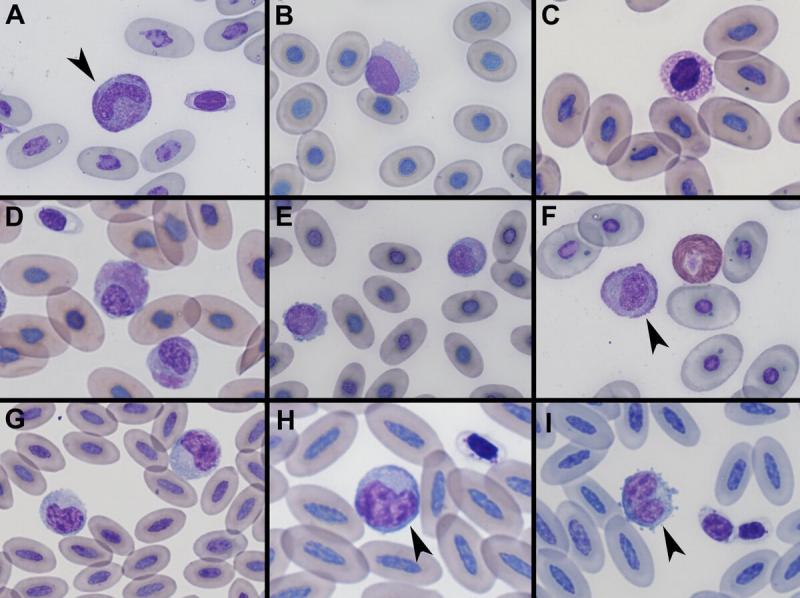
Tamaño:
- Aves. son los leucocitos más grandes en sangre periférica12.
- Reptiles: su tamaño varía entre 8 y 20 μm vs 8 y 25 μm1,4, son los leucocitos de mayor tamaño en la mayoría de especies11. Aunque, por ejemplo, en la cobra real y tortugas Testudo hermani los heterófilos son los leucocitos más grandes5,16.
Morfología:
- En aves tienen una forma variable de redondeada o ameboide11,12. La forma nuclear también varía entre redondeada a lobulada y se localiza de forma excéntrica. El patrón de cromatina es menos denso, en comparación con los linfocitos. Tienen un abundante citoplasma, azul-gris y en ocasiones vacuolado11,12. Frecuentemente podremos diferenciar dos áreas en el citoplasma, una más clara perinuclear, y otra más oscura alrededor12.
- En reptiles la morfología celular varía de redondeada a ameboide y su núcleo es pleomórfico (redondo, oval, lobulado) y normalmente indentado. Con un patrón de cromatina menos compacta que los linfocitos4. El citoplasma es abundante, se tiñe de color azul-grisáceo y puede contener vacuolas, material fagocitado o gránulos eosinofílicos/azurófilos1,4.
Azurófilos
Su clasificación no está clara y se cree que son únicos de los reptiles. Se han descrito más frecuentemente en iguanas y algunas serpientes. Algunos autores consideran que los azurófilos deberían ser considerados como monocitos, ya que comparten características citoquímicas en la mayoría de las especies y porque la utilidad de contarlos separadamente es mínima. Se cree que podrían ser una forma inmadura de monocitos4.
Algunos autores los describen como “monocitos azurófilos”, una variación de los monocitos normales, y no como un tipo celular distinto3. En serpientes muchos autores si los consideran como un tipo celular diferente, con una función similar a los heterófilos3.
Morfología: forma irregular, ligeramente más pequeños que los monocitos (en la mayoría de los casos), con un núcleo no segmentado, redondeado, oval o bilobulado4.Citoplasma basófilo, más oscuro que los monocitos, con un bajo número de gránulos azurofilicos de tamaño variable, vacuolas intracitoplasmáticas y material fagocitado1,3,4.
Tamaño: más pequeños o tamaño similar a los monocitos1,14.
Se identifican frecuentemente en serpientes, pudiendo llegar a ser el 65 % del total de leucocitos14.
Heterófilos
Producción: médula ósea
Vida media: (perro/gatos: unas 10 h en sangre), no descrita en aves y reptiles
Destrucción: macrófagos en bazo, hígado, médula ósea u otros tejidos. También excreciones y secreciones.
Distribución: los heterófilos se distribuyen entre el pool circulante (circulando en sangre periférica), pool marginal (adheridos a las paredes de los vasos) y en los tejidos inflamados. Los heterófilos son capaces de abandonar los vasos sanguíneos para acudir a los lugares atraídos por mediadores inflamatorios.
Funciones: fagocitosis y acción antimicrobiana; adherencia y migración a través de vasos sanguíneos; quimiotaxis: ingestión y degranulación. Los heterófilos funcionalmente equivalen a los neutrófilos de los mamíferos. En aves y reptiles tienen una elevada capacidad fagocítica1,4,14.
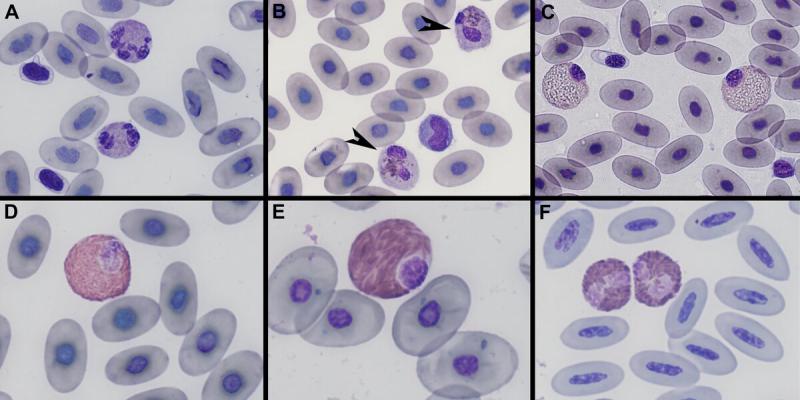
- Desviación a la izquierda: es la presencia de heterófilos inmaduros en sangre periférica, con núcleos en banda o células más inmaduras (metamielocitos o mielocitos). La desviación a la izquierda suele asociarse a procesos inflamatorios infecciosos o no infecciosos. Los heterófilos inmaduros presentan basofília citoplasmática aumentada, núcleo no segmentado, gránulos citoplasmáticos inmaduros, con una disminución del número de los gránulos3,11-13.
En aves es poco frecuente observar heterófilos inmaduros en sangre periférica, cuando lo observamos puede indicar una inflamación aguda y severa, generalmente se observan a las 12-24h del inicio de la enfermedad inflamatoria11. - Hipersegmentación o desviación a la derecha: se define como la presencia de 5 o más lobulaciones nucleares en los heterófilos. Es un proceso normal de envejecimiento de los heterófilos en sangre periférica y puede reflejar un incremento de su tiempo en circulación que puede ocurrir en inflamación crónica en resolución, administración de glucocorticoides o hiperadrenocorticismo12.
- Cambios tóxicos: son aquellos cambios morfológicos asociados a enfermedades que alteran la producción de estas células en la medula ósea. Estos cambios incluyen: basofília citoplasmática aumentada, vacuolización y/o cuerpos de Döhle. Alteraciones nucleares: cariolisis, cariorrexis, hiposegmentación, núcleos en anillos y binucleación3,12. En el caso de los heterófilos de aves y reptiles también observaremos granulación anómala (degranulación, gránulos basofílicos, gránulos agrupados, disminución del número de gránulos). Estas alteraciones morfológicas se producen en la médula ósea antes de su liberación al torrente sanguíneo. Los heterófilos tóxicos se ven principalmente asociados a condiciones inflamatorias graves11,12.
Tamaño:
- Aves: 8.8 µm12
- Reptiles: 10-23 μm1
Morfología:
- En aves son células redondeadas con un citoplasma incoloro, que contiene gránulos eosinofílicos, de naranja oscuro a rojo, y refráctiles. La forma y tamaño de los gránulos varían en función de las especies, pero típicamente son alargados u ovales11,12. Funcionalmente estos gránulos contienen enzimas lisosomales y no lisosomales con actividad bactericida (3 tipos de gránulos). El núcleo es lobulado (2-3 lóbulos), con un patrón de cromatina densa14. En muchas células los lóbulos pueden aparecer no conectados por la presencia de los gránulos sobrepuestos en este14. El núcleo de los heterófilos es menos basofílico que el de los eosinófilos14.
- En reptiles tienen una enorme variación morfológica en las distintas especies. Por lo general son células redondeadas grandes, con un citoplasma incoloro y gránulos citoplasmáticos refringentes fusiformes, que se tiñen de color naranja brillante con las tinciones habituales (Diff Quick o Giemsa)1,4. En una misma célula pueden aparecer gránulos opacos y refringentes. En Tiliquas se identifican gránulos rosa pálidos (en tinciones Wright-Giemsa) o rosa oscura (tinciones Romanowsky)15. En serpientes los gránulos son muy abundantes, enmascarando al núcleo, y apareciendo como un material eosinofílico en el citoplasma1. Los lagartos tienen una gran cantidad de pequeños gránulos eosinofílicos de forma angular o pleomórfica. En cambio, las tortugas tienen unos gránulos fusiformes que se diferencian fácilmente1. El núcleo es excéntrico, de forma redondeada a oval, con un patrón de cromatina densa1,3,4. Algunas especies de lagartos, como iguanas o pogonas, tienen heterófilos con el núcleo lobulado.
Son el granulocito más abundante en sangre periférica en la mayoría de las aves, como por ejemplo psitácidas, aves rapaces y aves corredoras12,13. En reptiles también son la célula más abundante en la mayoría de especies3,14.
Eosinófilos
Producción: médula ósea
Vida media: unos 30 minutos en circulación (perros/gatos), no descrita en aves y reptiles.
Distribución: pool marginal y mínima recirculación
Funciones: destrucción de parásitos (junto a otras células del sistema inmune), promueve inflamación (asma y alergia), actividad fagocítica similar a heterófilos per menos efectiva1. Función exacta en aves poco conocida12.
Tamaño:
- Aves: tamaño similar a los heterófilos, diámetro medio 8,8 µm12.
- Reptiles: son células grandes, 11-17 µm vs 9-20 µm1,4. Su tamaño varía en función de la especie, las serpientes tienen los eosinófilos más grandes, y los lagartos más pequeños. En general tienen un tamaño y forma similar a los heterófilos3. En cambio, en Tiliqua rugosa, los eosinófilos tienen un tamaño superior a les heterófilos, convirtiéndose en el leucocito de mayor tamaño, 17 µm15.
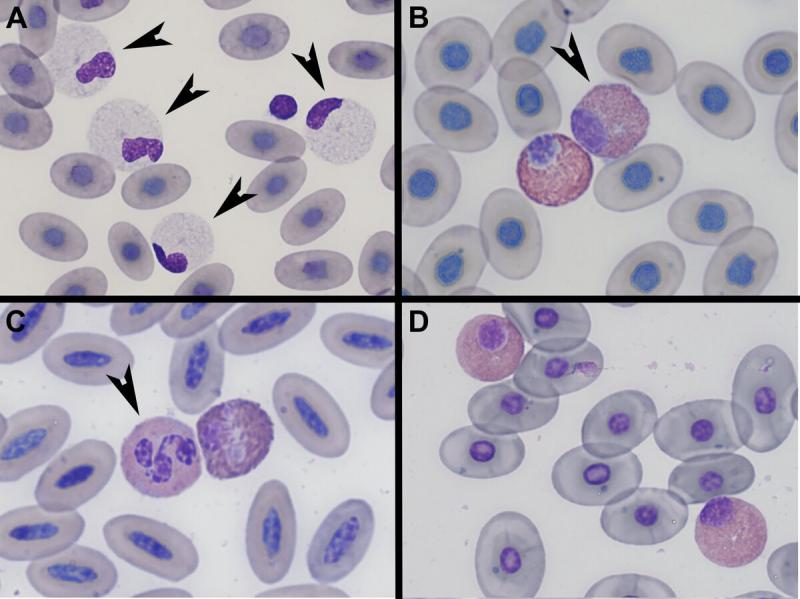
Morfología:
- En aves son células redondas, con citoplasma azulado, el núcleo es lobulado y más oscuro que el de los heterófilos11.Los gránulos son eosinofílicos, típicamente redondos (en algunas especies ovales o alargados), aunque el tamaño y el color puede variar entre especies. Cuando el color de los gránulos es eosinófilo estos se tiñen más intensamente con un color rojo-anaranjado en comparación con los gránulos de los heterófilos (por una mayor concentración de arginina)11,13. El núcleo típicamente esta menos enmascarado por los gránulos que el de los heterófilos y se tiñe de un color más basófílo.
- En reptiles son células redondeadas, con citoplasma azul claro, el núcleo tiene una forma variable, desde redondo a oval o ligeramente elongado (lobulado en algunas especies de lagartos), y ligeramente excéntrico4. El citoplasma contiene gránulos redondeados de color rosa-naranja en la mayoría de las especies. En otras especies, como en iguanas, los gránulos se tiñen de color azul con tinciones Romanowsky1,3,4. En la cobra real (Ophiophagus hannah) los granulas se tiñen de un color azul claro16, y en lagartos se observan de color magenta oscuro3,4. En Tiliqua rugosa se observan numerosas vacuolas en el citoplasma de los eosinófilos, y un bajo número de gránulos muy finos, aunque en algunos animales se observan gránulos redondeados de gran tamaño y color magenta (eosinófilos granulados)15. La vacuolización citoplasmática también esta descrita en algunas tortugas de agua15.
La presencia de eosinófilos en sangre periférica de lagartos1 y serpientes ha sido discutida por diferentes autores1,4. Se considera que no están presentes en Crotalus adamanteu y Elaphea obsoleta quadrivitatta3, pero si en cobras reales (Ophiphagus Hannah), en pitón reticulada, de Birmania, africana de roca, o arborícola verde (Phyton reticulatus, Python bivittatus, Phython secae, Morelia viridis) y en boa constrictor (Boa constrictor)14,17. En tortugas y cocodrilos están presentes y se identifican fácilmente4.
Basófilos
Producción: en médula ósea
Distribución: sangre
Funciones: destrucción de parásitos junto a otras células del sistema inmune, intervienen en la hemostasia (liberan heparina), promueven el metabolismo de lípidos1,4.
Tamaño:
- En aves: variable en función de la especie.
- En reptiles: tamaño pequeño de 8-15 vs 7-20 µm en la mayoría de las especies (tamaño inferior a heterófilos y eosinófilos)1,4,11. Los lagartos tienen basófilos pequeños y los quelonios y cocodrilos tienen basófilos más grandes1.
Morfología:
- En aves y reptiles son células redondeadas con gránulos intracitoplasmáticos redondos y metacromáticos (azul oscuro/púrpura), que frecuentemente enmascaran el núcleo11,12. Ente especies, existe variación en el tamaño, color o densidad de los gránulos13. El núcleo en aves es típicamente redondeado con un lóbulo único13.
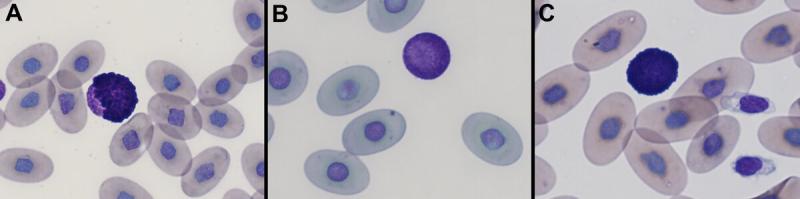
Los basófilos en aves se encuentran frecuentemente en sangre periférica a diferencia de mamíferos12. En reptiles se observan en mayor número en tortugas (con descripciones del 40-65 % del total de leucocitos en individuos sanos)14.
Trombocitos
Morfología: la característica que presentan en aves y reptiles es la presencia de núcleo12,13. Poseen un elevado pleomorfismo, aunque por definición son células pequeñas (más pequeñas que los eritrocitos y leucocitos), elípticas, redondas u ovales, con escaso citoplasma de color pálido – transparente (hecho importante para diferenciarlos de los linfocitos y eritrocitos inmaduros), con un núcleo oval (más redondeado que los eritrocitos), central y con un patrón de cromatina denso y un elevado ratio núcleo/citoplasma1,3,4,11-14. Normalmente tienden a agregarse, lo que hace más fácil su identificación4,11,12. Los trombocitos frecuentemente contienen uno o más gránulos eosinofílicos puntiformes localizados en un área del citoplasma12, unas proyecciones citoplasmáticas (pseudopodos) o vacuolas en su citoplasma13.
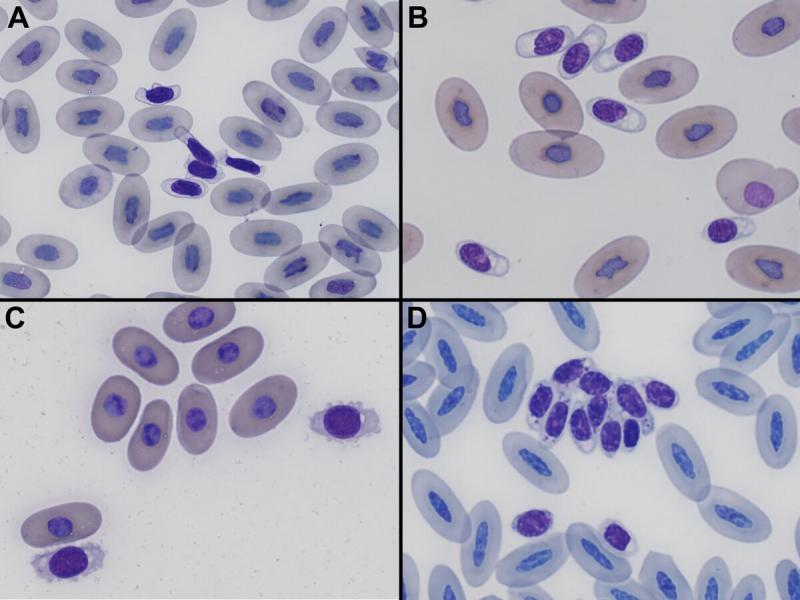
En reptiles los trombocitos juegan un papel activo en la formación del trombo, en la coagulación y en la cicatrización de las heridas1. En situaciones de anemia, pueden adquirir capacidad de transportar oxígeno, cubriendo la demanda ocasionada por la pérdida eritrocitaria. También parecen tener capacidad fagocítica en determinadas ocasiones y ante determinados agentes quimiotácticos4. En aves su principal función es la hemostasia, aunque también se consideran células fagocíticas.
Los trombocitos de aves y reptiles provienen de una célula madre, en contraste a las plaquetas de los mamíferos que provienen de la fragmentación citoplasmática de los megacariocitos12.
Parásitos hemáticos
La presencia de parásitos hemáticos en frotis sanguíneo de aves y reptiles no es rara4,18,19. La importancia clínica de la infección depende de varios factores como la especie de hemoparásito, la magnitud de la parasitemia, la especie hospedadora, la edad y estado inmunitario del animal18. En aves, las especies más frecuentemente identificadas son Hemoproteus spp, Plasmodium spp, y Leukocytozoon spp.
Muchas especies de aves son susceptibles a las infecciones con hemoparásitos, aunque los signos clínicos pueden ser más evidentes en unas especies u otras11,18,19. En reptiles su observación generalmente se considera un hallazgo incidental ya que la mayoría no se consideran patógenos. Algunos pueden causar anemias hemolíticas e inanición, especialmente en pacientes geriátricos o juveniles1.
Los parásitos hemáticos más frecuentes observados en frotis sanguíneos son:
- Hemogregarines
Hospedadores: ofidios, reptiles terrestres, aves. Escaso poder patógeno, aunque parasitosis severas pueden causar inanición y anemia. Este grupo incluye los 4 géneros más comunes en reptiles: Haemogregarina, Haemolivia, Hepatozzon, y Karyolysus1,19. Las serpientes son las más frecuentemente afectadas, y típicamente pertenecen al género Hepatozoon. En aves hay 15 especies de Hepatozoon descritas18.- Hepatozoon Los gametocitos se encuentran generalmente en el citoplasma de leucocitos mononucleares (monocitos y linfocitos). Tienen una forma de ovoide a elongada con márgenes redondeados, con un núcleo redondeado y basofílico, localizado centralmente o ligeramente excéntrico, el citoplasma es azul pálido y ocasionalmente con pequeños gránulos azurofílicos. En algunas especies se observa una cápsula (halo blanco) alrededor del parasito18,19. El parasito desplaza el núcleo de la célula que se observa comprimido en la periferia18.
- Haemoproteus
Hospedadores: columbiformes, anseriformes, rapaces, psitaciformes, paseriformes, entre otras, y reptiles (lagartos, tortugas y serpientes). El parasito se transmite por insectos picadores. Los signos clínicos asociados son raros, se ven más frecuentemente en palomas, codornices, pichones o aves con alguna otra enfermedad. Pueden causar anemia hemolítica, anorexia o debilidad, hepatomegalia y esplenomegalia. Una vez infectada el ave permanece como portador de por vida.19
Los gametocitos se localizan en los eritrocitos, ocasionalmente se pueden observar macrogametos y microgametos extraeritrocitarios. Pueden tener varias formas, pero la forma predominante es: elongada o curva, como una forma de anillo abierto o media luna, que parcialmente rodea al núcleo18. Los gametocitos maduros típicamente ocupan más de la mitad del volumen citoplasmático, causando solo un mínimo desplazamiento del núcleo. Los gametocitos contienen unos gránulos con un pigmento amarillo, marrón o negro, refráctiles y unos gránulos puntiformes purpuras18. Los eritrocitos parasitados por Haemoproteus son más grandes que los eritrocitos normales (seguramente aumentando su fragilidad). Las alteraciones hematológicas asociadas a Haemoproteous incluyen leucocitosis y anemia.19
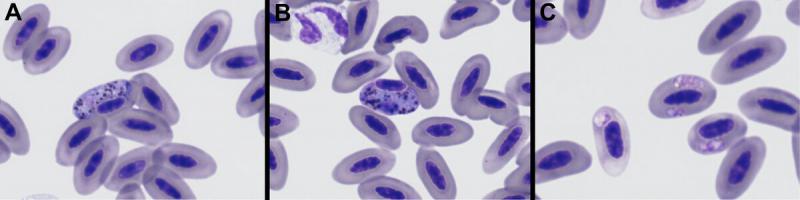
- Plasmodium
Hospedadores: paseriformes, anseriformes, psitaciformes, saurios, ofidios. Ciertas especies como los canarios, pingüinos, patos, palomas, rapaces y aves de corral presentan una susceptibilidad muy alta a la enfermedad18,19. Otras especies son asintomáticas y actúan como portadoras del parasito sin desarrollar signos clínicos11. En aves se han descrito diferentes especies de Plasmodium18. En reptiles, aunque se describen raramente, causan anemia hemolítica severa1. Se han descrito más de 60 especies de Plasmodium en reptiles, la mayoría identificadas en lagartos.
Distribución mundial, se transmite por mosquitos del género Culex y Aedes. Signos clínicos asociados: anemia, disnea o debilidad, anorexia, hepatomegalia/esplenomegalia, muerte aguda. Se puede observar hemoglobinuria o biliverdinuria. Los hallazgos hematológicos incluyen anemia hemolítica, leucocitosis y linfocitosis11,19.
La morfología de los organismos varía entre especies de Plasmodium, pero en general los gametocitos tienen una forma redondeada irregular, elongada o forma de “U” o “V”, con un núcleo redondeado y central, un citoplasma moderadamente basofílico con diversos gránulos pigmentados de color marrón-negro, refráctiles (producto de la degradación de la hemoglobina)11,18.
Desplazan de forma marcada el núcleo de la célula parasitada11,18. Los gametocitos, se localizan en los eritrocitos, aunque sus precursores también se pueden observar en trombocitos, leucocitos y células endoteliales. Los gametocitos rompen los eritrocitos, liberan los merozoitos, los cuales infectan más células. Los merozoitos tienen una apariencia pleomórfica, redondeada, ovoide o elongada, con un núcleo y citoplasma basofílico19.
- Atoxoplasma
Hospedadores: paseriformes (parasito frecuente). Puede ser altamente patogénico, especialmente en canarios. La gametogonia se desarrolla en los enterocitos intestinales y la merogonia en leucocitos mononucleares18, especialmente en linfocitos. Los merozoitos de Atoxoplasma spp son estructuras pequeñas, de 3-5 µm, redondeadas u ovales con un citoplasma azul pálido, y un núcleo central o ligeramente excéntrico18. Signos clínicos variables, desde asintomáticos a pérdida de peso, depresión, distensión abdominal y muerte19. - Leucozytozoon
Hospedadores: aves acuáticas, pavos, aves de presa jóvenes, algunas paseriformes y menos frecuentemente psitaciformes. Frecuente en aves salvajes. Se transmite por moscas mordedoras. Se han identificado numerosas especies de Leucocytozoon18.
Generalmente poco patógeno y la enfermedad es subclínica, aunque en algunas especies y en aves inmaduras la patogenicidad puede ser elevada. Signos clínicos incluyen: anorexia, depresión, deshidratación y hemoglobinuria (por anemia hemolítica), esplenomegalia/hepatomegalia19.
Los macrogametos y microgametos se localizan en los eritrocitos (y leucocitos), y ambos tienen un tamaño grande, los macrogametos ocupan el 77% de la célula parasitada. Los gametocitos son muy pleomórficos (formas fusiformes a redondeadas)18. Leukocytozoon spp., no contiene los pigmentos refráctiles típicos de Haemoproteus spp., y Plasmodium spp. Generalmente, por su grande tamaño la célula parasitada se vuelve elongada y se distiende, en muchas ocasiones es difícil identificar el origen celular. Los parásitos acaban destruyendo las células18. - Trypanosomas
Hospedadores: paseriformes, galliformes, anátidas y columbiformes, y reptiles. Generalmente no patogénico por lo que se considera un hallazgo incidental. Tiene una distribución mundial, pero la incidencia es baja, generalmente se detecta durante los meses de verano (se transmite por insectos picadores). Se han descrito unas 100 especies en aves18 y 58 en reptiles1.
Los diferentes estadios parasitarios de Trypanosoma spp tienen diferente morfología. El estadio más reconocido es el tripomastigote, extracelular, con su forma elongada o de hoja, la membrana ondulante y un flagelo anterior y posterior18. En la parte anterior se localiza el kinetoplasto (punto focal basofílico), el núcleo se localiza en la mitad de la sección del organismo18. - Otros: microfilaria (extracelular, gran tamaño, la mayoría no se consideran patógenos, descrito en aves y reptiles) 1,18, leishmania (raramente en frotis de reptiles, generalmente en lagartos. Los amastigotes se observan en el citoplasma de trombocitos y leucocitos mononucleares)1 o piroplasmidos [Babesia, Aegyptianella, Sauroplasma. descritos en reptiles (quelonios, lagartos y serpientes)1 y aves. Se observa una vacuola pequeña, de redonda a pirifome, no pigmentada en el citoplasma de los eritrocitos] 18.
OTROS AGENTES INFECCIOSOS
- Inclusion body disease (IBD). Es una enfermedad común y altamente contagiosa que afecta a las serpientes de las familias Boidae y Pythonidae. La causa exacta es desconocida, aunque existen fuertes evidencias de que este causada por un arenavirus. En los frotis de los animales afectados se pueden observar cuerpos de inclusión intracitoplasmáticos en eritrocitos, linfocitos o heterófilos4.
- Mycoplasmas hemotrópicos. Son bacterias pequeñas (0.1-1μm) que se adhieren a la superficie externa de los eritrocitos19.
Anexo
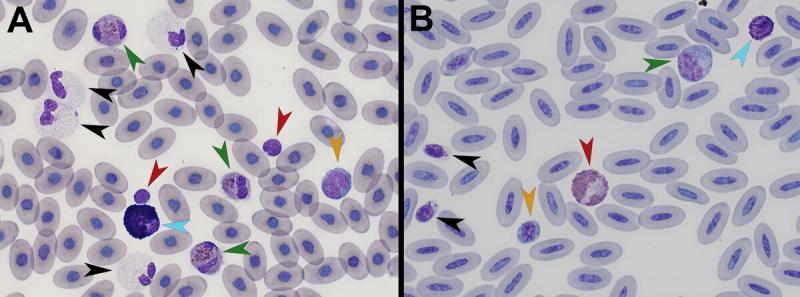
Comprueba los conocimientos que has adquirido e identifica en la siguiente figura las células marcadas.
Figura 9. A – Frotis sanguíneo en una Tiliqua gigas evanescence (Tinción Wright, magnificación a partir de preparaciones visualizadas por microscopio a 100x). B – Frotis sanguíneo un ganso común (Anser anser) (Tinción Wright, magnificación a partir de preparaciones visualizadas por microscopio a 100x).
Los resultados los encontraras al final de la bibliografía.
Resultados
Figura 9A. Puntas flecha verde: heterófilos, puntas flecha negra: eosinófilo, puntas flecha roja: linfocito, punta flecha amarilla: monocito, y punta flecha azul claro: basófilo. Figura 9B. Punta flecha verde: monocito, puntas flecha negra: trombocitos, punta flecha roja: heterófilo, punta flecha amarilla: eritrocito inmaduro, y punta flecha azul claro: basófilo.
Bibliografía
- Nardini G, Leopardi S, Bielli M. Clinical hematology in reptilian species. Vet Clin North Am Exot Anim Pract; 2013; 16:1-30
- Saggese MD. Introduction: Hematology. Topics in Medicine and Surgery. J Exot Pet Med; 2009; 18:86
- Sykes JM, Klaphake E. Reptile hematology. Vet Clin North Am Exot Anim Pract; 2015; 18:63-82
- Campbell TW. Peripheral blood of reptiles; En: Campbell TW. Exotic animal hematology and cytology. Fourth edition. Oxford: Wiley Blackwell; 2015; 67-88
- Andreani G, Carpenè E, Cannavacciuolo A, Di Girolamo N, Ferlizza E, Isani G. Reference values for hematology and plasma biochemistry variables, and protein electrophoresis of healthy Hermann’s tortoises (Testudo hermanni ssp). Vet Clin Pathol; 2014; 43:573-583
- Clark P, Boardman WSJ, Raidal SR. Physiological and pathological influences on the hematological characteristics of birds. En: Atlas of clinical avian hematology. Wiley-Blackwell. First edition 2009:97-124
- Alberton S, Vergneau-Grosset C, Summa N. Advances in exotic animal clinical pathology. Vet Clin North Am Exot Anim Pract; 2019: 22:367-385
- Healtley JJ, Rusell KE. Box turtle (Terrapene spp.) hematology. J Exot Pet Med; 2010; 19:160-164
- Cray C. Reference intervals in avian and exotic hematology. Vet Clin North Am Exot Anim Pract; 2015; 18:105-116
- Beaufrère H, Ammersbach M, Tully TN. Complete blood cell count in Psittaciformes by using high-throughput image cytometry: a pilot study. J Avian Med Surg; 2013; 27:211-217
- Jones MP. Avian hematology. Vet Clin North Am Exot Anim Pract; 2015; 18:51-61
- Campbell TW. Peripheral blood of birds; En: Campbell TW. Exotic animal hematology and cytology. Fourth edition. Oxford: Wiley Blackwell; 2015; 37-66.
- Clark P, Boardman WSJ, Raidal SR. General hematological characteristics of birds. En: Atlas of clinical avian hematology. Wiley-Blackwell. First edition 2009: 33-52
- Heatley JJ, Russell E. Hematology; En: Divers SJ, Stahl SJ. Mader’s reptile and amphibian medicine and surgery. Third edition. Elsevier; 2019; 301-318
- Moller CA, Gaál T, Mills JN. The hematology of captive Bobtail lizards (Tiligua rugosa): blood counts, light microscopy, cytochemistry, and ultrastructure. Vet Clin Pathol; 2016; 45:634-647
- Salakij C, Salakij J, Apibal S, Narkkong NA, Chanhome L, Rochanapat N. Hematology, morphology, cytochemical staining, and ultrastructural characteristics of blood cells in king cobras (Ophiophagus Hannah). Vet Clin Pathol; 2002; 31:116-126
- Carvalho MP, Queiroz-Hazarbassanov NG, Massoco CO, Rossi S, Sant’Anna SS, Catao-Dias JL, Grego KF. Flow cytometric characterization of peripheral blood leukocyte populations of 3 neotropical snake species: Boa constrictor, Bothrops jararaca and Crotalus durissus. Vet Clin Pathol; 2016; 45:271-280
- Clark P, Boardman WSJ, Raidal SR. Hemoparasites of birds. En: Atlas of clinical avian hematology. Wiley-Blackwell. First edition 2009: 125- 138
- Campbell TW. Blood parasites; En: Campbell TW. Exotic animal hematology and cytology. Fourth edition. Oxford: Wiley Blackwell; 2015; 115-129
 by Multimédica
by Multimédica