Interpretación de los hallazgos laboratoriales en disfunción de la pars intermedia (PPID) y síndrome metabólico equino (SME)
Resumen breve
Los dos problemas endocrinos que encontramos con mayor frecuencia en la medicina equina son la disfunción de la pars intermedia, conocida comúnmente como Cushing o adenoma pituitario, y el síndrome metabólico equino (SME). Ambas patologías se encuentras conectadas y, en ciertas ocasiones, aparecen de forma conjunta. Su diagnóstico puede suponer un reto para el clínico debido a la variedad de presentaciones clínicas posibles y pruebas disponibles que han sido utilizadas a lo largo de los años.Índice de contenidos
Resumen
Los dos problemas endocrinos que encontramos con mayor frecuencia en la medicina equina son la disfunción de la pars intermedia, conocida comúnmente como Cushing o adenoma pituitario, y el síndrome metabólico equino (SME). Ambas patologías se encuentras conectadas y, en ciertas ocasiones, aparecen de forma conjunta. Su diagnóstico puede suponer un reto para el clínico debido a la variedad de presentaciones clínicas posibles y pruebas disponibles que han sido utilizadas a lo largo de los años.
Este artículo pretende señalar los aspectos más importantes a la hora de diagnosticar estas enfermedades, así como la obtención de la muestra idónea, su conservación, limitaciones y posibles interpretaciones de los hallazgos laboratoriales encontrados en cada caso.
Definición de disfunción de la pars intermedia (ppid)
La disfunción de la pars intermedia es el problema endocrino más frecuente encontrado en la medicina equina. Se produce debido a una disfunción (hiperplasia) de la pars intermedia de la hipófisis (glándula pituitaria). Comúnmente se le denomina enfermedad de Cushing debido a las características similares con esta patología. Sin embargo, en contraste con la enfermedad de Cushing humana y de pequeños animales, la PPID afecta a la parte intermedia de la glándula pituitaria en lugar de a la parte distal. Además, la contribución adrenocortical al síndrome clínico es mucho menos importante que en la llamada enfermedad de Cushing en estas especies.
Por tanto, y para evitar confusiones, la enfermedad de Cushing equina ahora se denomina disfunción de la pars intermedia o por sus siglas en inglés (PPID).
Esta patología ocurre normalmente en caballos de avanzada edad, aunque se han documentado casos en caballos jóvenes. La mayor parte de los caballos afectados son mayores de 15 años, con tan solo algunos casos de caballos menores de 10 años. No se han demostrado diferencias entre sexos en la manifestación de PPID.
Por último, cabe destacar, que, a diferencia de los pequeños animales, no suele producirse debido a tumores adrenales, aunque se han descrito algunos casos aislados1.
Patogenia y síntomas
Los factores hipotalámicos que actúan sobre la pars intermedia son la dopamina (inhibe) y la serotonina (estimula).
La disfunción de la pars intermedia se debe a una falta de inhibición debido a una degeneración de las neuronas dopaminérgicas, de esta forma, disminuye la dopamina hipotalámica, lo cual produce una proliferación celular de las células que encontramos mayoritariamente en la pars intermedia, los melanotrofos. Los melanotrofos producirán péptidos derivados de la pro-opiomelanocortina (POMC), dentro de los cuales se encuentra la hormona adenocorticotropa (ACTH), la hormona estimulante de melanocitos (α-MSH), betaendorfinas (β-end) y el péptido del lóbulo intermedio semejante a la corticotropina (CLIP). Estos péptidos serán los responsables de la sintomatología.
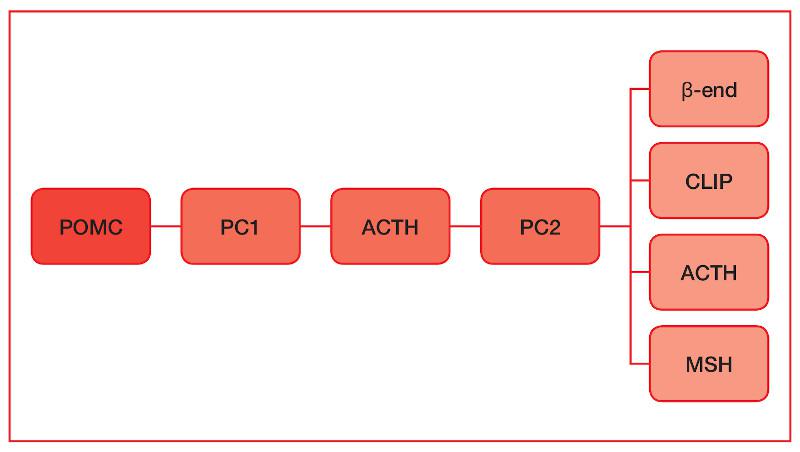
La pars intermedia tiene la capacidad de producir ACTH (aunque en menor proporción que la pars distalis) y, aunque es un producto del POMC obtenido en pequeñas cantidades en tejido sano (alrededor del 2%)2, en casos de disfunción se secretan cantidades relativamente grandes de ACTH en este proceso3 (Figura 1).
Una posible explicación propuesta para esta degeneración neuronal podría ser el estrés oxidativo. Se ha demostrado que las neuronas dopaminérgicas son especialmente sensibles al estrés oxidativo, aunque siguen existiendo varias teorías sobre el origen de este estrés oxidativo y su efecto concreto en el desarrollo del PPID4.
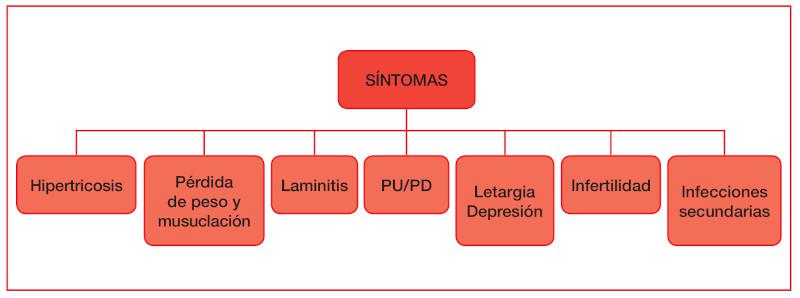
En la Figura 2 se pueden comprobar los síntomas más comunes de esta patología, siendo destacable la hipertricosis (anteriormente denominado hirsutismo), la laminitis y la pérdida de peso y musculatura. En estos animales se puede observar una pérdida de peso y de musculatura localizada en cuello, dorso y grupa. Además, se produce una inmunosupresión en el animal que puede dar lugar a infecciones recurrentes. Algunos casos de disfunción de la pars intermedia se acompañan de polidipsia (PD) y poliuria (PU) y de una redistribución de la grasa corporal dando lugar a depósitos de grasa en la región supraorbitaria. Otro síntoma es el de letargia/depresión. Hillyer y colaboradores (1992)5 obtuvieron un 82 % de caballos con letargo en una serie de 17 casos. Según estos autores, parece probable que tal comportamiento pueda ser el resultado de niveles elevados de péptidos hipofisarios, en particular endorfinas, en el líquido cefalorraquídeo6.
Diagnóstico e interpretación laboratorial
Una vez hemos tenido en cuenta los síntomas y la historia clínica, el siguiente paso cuando sospechamos de disfunción de la pars intermedia será la interpretación de los hallazgos laboratoriales más comúnmente encontrados con esta patología.
HEMOGRAMA
Son cambios inespecíficos caracterizados en ciertas ocasiones por un leucograma de estrés, incluyendo neutrofilia, linfopenia y eosinopenia.
No suelen darse variaciones en la serie eritroide, encontrándose únicamente anemia leve en ciertos casos.
BIOQUÍMICA
Es muy variable, pudiendo encontrarse:
- Hiperglucemia: Se presenta en ciertas ocasiones y se suele ver acompañada por glucosuria8.
- Hiperlipemia: Se produce una movilización de las grasas.
- Aumento de las enzimas hepáticas: Al igual que en perros, las hepatopatías por glucocorticoides se han descrito en caballos con aumentos en suero de la fosfatasa alcalina (FA) y la gamma-glutamil transferasa (GGT)9.
HORMONAS
- Hiperinsulinemia: Un tercio de los animales que sufren esta patología presentan hiperinsulinemia (≥20 µIU/ml), comparado con sólo un 3 % de caballos/ponies de avanzada edad que lo presentaban junto a concentraciones de ACTH normales7.
- Cortisol: Puede verse aumentado, aunque no es un hallazgo consistente10, por lo que se considera de escaso valor diagnóstico11. Los caballos sanos presentan diferencias en la concentración de cortisol en función del ritmo circadiano, siendo la concentración mayor por la mañana y más baja por la tarde. En caballos con PPID este ritmo se encuentra alterado.
¿Por qué no evaluar el cortisol en caballos con PPID?
- En diversos estudios en caballos que sufren esta patología se han encontrado niveles de cortisol dentro del rango normal10,11.
- Además de las variaciones circadianas, se han encontrado variaciones individuales significativas.
- Por último, cabe destacar que el caballo es un animal “presa”, por lo cual, factores como estrés, ejercicio, o dolor influyen notablemente en los niveles sanguíneos de cortisol.
Por lo tanto, la medición del cortisol sanguíneo sólo tiene sentido en caballos en los que se sospeche de disfunción de la pars intermedia mediante un test específico como el de supresión de la dexametasona.
Métodos específicos
ACTH
Los caballos con disfunción de la pars intermedia sufren un aumento de la concentración de ACTH. Sin embargo, sólo el 20 % sufren adrenomegalia derivada de esta sobreestimulación, apoyando la teoría de que esta ACTH producida en exceso por la pars intermedia afectada es biológicamente inerte, provocando una disociación ACTH-cortisol12. La medición de la concentración basal de ACTH es el método específico más utilizado en España. Se debe tomar una muestra de sangre venosa, en un ambiente tranquilo, separar el plasma de EDTA y congelarlo. La interpretación de los resultados obtenidos debe ser la siguiente (Las concentraciones indicadas pueden variar en función del método utilizado para la determinación, así como el analizador, por lo que se ha de consultar con el laboratorio de referencia):
- De noviembre a julio: < 29pg/ml
- De agosto a octubre: < 47pg/ml
Manejo y conservación de la muestra
Algunos estudios demuestran que la variabilidad a lo largo del día de la concentración de ACTH, aunque existente, es mínima en caballos con disfunción de la pars intermedia, por lo que el diagnóstico rara vez se ve afectado por la hora de toma de muestra13,14. Sin embargo, debido a que existen estos pequeños cambios, se recomienda que siempre se tome la muestra a la misma hora para una correcta monitorización del proceso.
La muestra debe ser centrifugada y congelada en las 3 horas posteriores a la extracción. Si no fuera posible su centrifugación, debe refrigerarse la muestra para la separación y congelación del plasma lo antes posible.
Según el estudio de Prutton y colaboradores (2015)15, la temperatura de conservación de la muestra es más determinante que la separación del plasma en las primeras 24 horas. En el estudio mencionado, no se detectaron cambios significativos en las primeras 24 horas entre plasma separado y sangre entera, pero sí se produjeron cambios significativos entre su conservación a 21 grados en comparación con su refrigeración a 4 grados.
Como conclusión, podríamos decir que se producen descensos marcados de la concentración de ACTH que pueden influir en nuestro diagnóstico si no se congela el plasma a partir de las 3 horas. El mecanismo de degradación de la ACTH es desconocido, pero se ha atribuido a enzimas proteolíticas16.
Limitaciones
Debidos a las variaciones marcadas que se producen en otoño en la liberación de ACTH, se ha llegado a recomendar evitar el testaje durante los meses de agosto a octubre (ambos incluidos).
Donaldson y colaboradores (2005)17 fueron los primeros en describir este proceso y comprobar que la concentración de ACTH en septiembre era considerablemente mayor en comparación a meses como enero o mayo, indicativo de un aumento otoñal en la actividad hipofisaria y secreción de ACTH. Por ello, se aconsejó evitar la prueba de PPID en esa época del año. Sin embargo, McGowan y colaboradores (2013b)18 analizaron la sensibilidad y la especificidad de la ACTH basal utilizando rangos de referencia ajustados estacionalmente para el diagnóstico de casos clínicos de PPID. En ese estudio, la sensibilidad y especificidad fueron 80 % y 82 % respectivamente durante los meses no otoñales, y 100 % y 95 % en otoño. Por lo tanto, se demostró que en caballos con PPID se dan aumentos muy marcados de ACTH y son detectables en cualquier época del año con valores de referencia ajustados al periodo estacional. Algunos casos de PPID no demostraron un aumento de ACTH, por lo que la especificidad no pudo ser del 100 %.
Supresión de la dexametasona
A diferencia de los melanotrofos de la pars intermedia, los corticotrofos de la pars distalis están sujetos a retroalimentación negativa del cortisol endógeno, y la administración de glucocorticoides exógenos conduce a la supresión de la secreción de ACTH. Por lo tanto, en el caballo sano, donde la ACTH proviene casi exclusivamente de la pars distalis, se produce una disminución significativa en la concentración plasmática de cortisol tras la administración de glucocorticoides exógenos.
Sin embargo, en caballos con disfunción de la pars intermedia, donde la pars intermedia produce cantidades significativas de ACTH, la secreción de cortisol puede mantenerse frente a la administración de glucocorticoides19.
Para la realización de la prueba se suele utilizar una dosis de 2 mg/50 kg dexametasona IM tras la cual se produce una falta de supresión de la concentración plasmática de cortisol que tiene su pico máximo entre las 19 y 24 horas posteriores. Por lo tanto, una forma de estandarización del proceso sería:
- T0: Toma muestra de sangre (a las 4-6 pm) y después administramos una cantidad conocida de dexametasona (alrededor de 20 mg/caballo).
- T1: Toma muestra de sangre 19 h después (12 pm) y se mide el cortisol.
En los animales sanos: la concentración de cortisol disminuye (< 10 ng/ml), mientras que en animales PPID la concentración se mantiene (variación mínima 30-67 ng/ml).
Manejo y conservación de la muestra
Es un test cuya principal ventaja es la mayor estabilidad in vitro del cortisol en comparación con el ACTH, así como la disponibilidad generalizada de su medición.
Limitaciones
Sin embargo, la realización de este test conlleva 2 visitas veterinarias, con su consecutivo gasto para el dueño del caballo y tiempo invertido para el veterinario.
Además, es un test que no se recomienda en caballos laminíticos o con predisposición, ya que pueden agravar el proceso o inducir su aparición.
Por último, se debe tener en cuenta que, entre los meses de agosto y octubre, incluso caballos sanos pueden no suprimir20.
Test de estimulación por hormona liberadora de tirotropina (TRH)
Se establece como la prueba de elección por la asociación de endocrinología equina (Equine Endocrinology Group). Se utiliza cuando la ACTH basal es inconcluyente o no se corresponde con la clínica. Esto suele ocurrir en estadios tempranos de la enfermedad.
La explicación de este test radica en que con el adenoma pituitario las células pierden su especificidad por las hormonas liberadoras segregadas por el hipotálamo. De este modo, los melanotrofos se ven estimulados anormalmente por la TRH (hormona liberadora de tirotropina) dando lugar a un incremento en la producción de ACTH21.
Se emplea 0.5 mg de TRH (caballos < 250 kg) o 1 mg de TRH (caballos > 250 kg) y se mide ACTH basal y 10 minutos post TRH.
Los rangos de referencia para los valores basales son los mismos mencionados anteriormente. Los valores de referencia para ACTH tras 10 minutos son:
- Negativo: < 110 pg/ml
- Dudoso: 110-120 pg/ml
- Positivo > 120 pg/ml
Manejo y conservación
De igual manera que en la ACTH basal, ya que es lo que vamos a medir.
Limitaciones
La TRH no está validada para su uso en caballos, y aunque es una prueba segura, se debe avisar al propietario que existen posibles reacciones adversas como fasciculaciones musculares, bostezos excesivos, flehmen o tos22. En España su uso se ve reducido por la dificultad para adquirir la TRH.
Por último, se ha demostrado que la respuesta a la TRH es mayor en los meses de otoño23, y aún no hay rangos de referencia adaptados para esta época, por lo que se desaconseja su uso durante estos meses.
Definición síndrome metabólico equino
El síndrome metabólico equino es un desorden de origen endocrino y metabólico. No es una enfermedad per se, sino más bien una serie de factores de riesgo para la laminitis de origen endocrino, donde la característica principal y consistente será la resistencia a la insulina (RI). El término RI se utiliza para indicar la alteración de la interrelación equilibrada entre las concentraciones plasmáticas de insulina, glucosa y lípidos.
Se relaciona con un componente genético, es más común en ponies que en caballos y existe predisposición racial en pura raza español (PRE) y árabes entre otros24. Suele darse en caballos adultos, aunque no es exclusivo de estos.
Patogenia y síntomas
Se produce debido a que los adipocitos periféricos o viscerales, aunque actúan principalmente almacenando grasa, se encargan además de la síntesis de hormonas y sustancias proinflamatorias. El SME se desencadena por un aumento de adipocitos (obesidad) o por un aumento de su actividad (estrés).
Estos adipocitos periféricos o viscerales secretan sustancias como: adipoquinas (TNF-alfa), resistina, leptina, o la enzima 11-beta-hidroxiesteroide deshidrogenasa (11βHSD) de tipo 1. Esta última regenera la cortisona (metabolito inactivo) en cortisol (metabolito activo) aumentando la vida media del cortisol y su actividad.
Estas sustancias darán lugar a:
- Alteración de la función vascular.
- Alteración de la función inmune.
- Alteración de la función reproductiva.
Además, esto ocasiona una alteración de la funcionalidad de los receptores celulares de la insulina, disminuyendo la sensibilidad de las células a la insulina dando lugar a síntomas relacionados con la resistencia a la insulina.
En cuanto a la obesidad, se produce una redistribución adiposa en crinera, hombros, glúteos, fosa supraorbitaria, cola y/o prepucio. Hay caballos que por raza o por constitución tiene predisposición a ganar peso y no adelgazar pese a no comer en exceso. Se conocen en inglés como “easy keepers”.
Otras alteraciones que se dan en menor medida en caballos con SME son infertilidad o infecciones recurrentes.
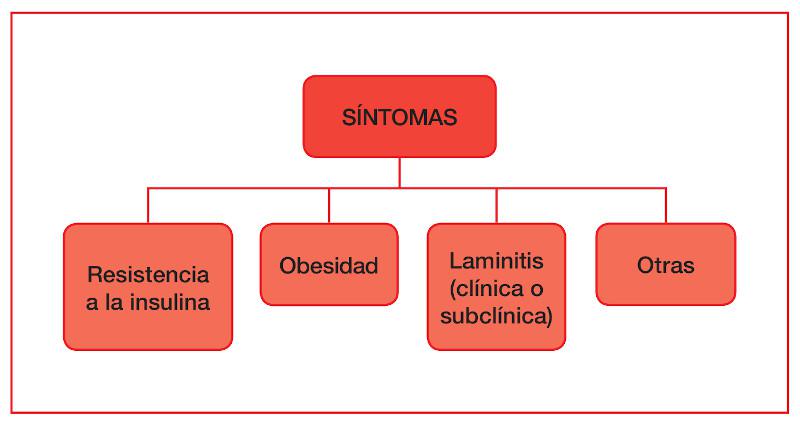
Por último, uno de los factores clave del SME será la laminitis (clínica o subclínica). Hasta ahora se creía que el cortisol favorecía la vasoespasticidad y vasoconstricción del endotelio vascular del tejido laminar impidiendo que la glucosa entrara al interior de las células epidérmicas, provocando una alteración de su funcionalidad. Los últimos estudios de Baskerville y colaboradores (2018)25 demuestran la existencia de receptores IGF-1 (insuline growth factor 1) en las células del casco, sobre los cuales la insulina puede actuar dando lugar a una excesiva proliferación celular, aunque son necesarios más estudios para hallar la causa exacta entre esa proliferación celular y el daño de la lámina epidérmica (Figura 3).
Diagnóstico e interpretación laboratorial
Tras tener en cuenta los síntomas y la historia clínica deberemos realizar pruebas laboratoriales para su confirmación.
HEMOGRAMA
No se han detectado cambios reseñables en el hemograma de estos animales26.
BIOQUÍMICA Y HORMONAS
Para las mediciones basales de glucosa e insulina, no es necesario el ayuno, pero para la estandarización de su medida, especialmente cuando quiere utilizarse para realizar seguimiento, se recomienda su medición siempre por la mañana. El animal debe haber sido alimentado por última vez a las 10 pm con forraje27.
- Glucosa: las concentraciones de glucosa en sangre en la mayoría de los caballos resistentes a la insulina están dentro del rango de referencia, ya que la concentración de glucosa se mantiene a través del aumento de la secreción de insulina pancreática.
Sin embargo, la glucosa siempre debe medirse para detectar RI no compensada o diabetes mellitus. Algunos de estos pacientes solo pueden identificarse mediante la detección de hiperglucemia, porque las concentraciones de insulina han vuelto al intervalo de referencia de normalidad como resultado de la insuficiencia pancreática. - Insulina: en la actualidad, la determinación de la concentración de insulina es la prueba más útil para de detección de RI. Debe tomarse la muestra en momentos en los que no haya estrés del animal. El estrés puede afectar a las concentraciones de glucosa e insulina por producción de catecolaminas. Los caballos con un cuadro laminítico agudo pueden presentar niveles de insulina altos sin RI28. Para que hablemos de RI, la concentración basal debe encontrarse por encima de 23 µU/ml (>300 pmol/L). El problema de esta prueba es que cuenta con una alta especificidad, pero una baja sensibilidad, por lo tanto, los positivos son fiables, pero existen falsos negativos que debemos reevaluar con test dinámicos.
- El ratio insulina/glucosa: debe encontrarse por debajo de 6. Es un parámetro poco útil ya que se ve altamente influenciado por hiperglucemias inducidas por estrés o descensos de glucosa consumida por los eritrocitos ante una separación tardía del suero.
- Por último, los denominados “proxies” en inglés (índices de sensibilidad a la insulina), calculados a partir de las mediciones de insulina y glucosa, los cuales estiman la sensibilidad a la insulina y la respuesta pancreática29. Los dos proxies más comúnmente utilizados son: RISQI (reciprocal inverse square root of insulin); el recíproco de la raíz cuadrada de la insulina, una medida de la sensibilidad a la insulina; y MIRG (modified insuline/glucosa ratio), la proporción de insulina modificada frente a la glucosa, la cual representa la capacidad del páncreas para secretar insulina. Dado que estos proxies se generan a partir de mediciones basales, están sujetos a limitaciones similares a estos. Sin embargo, como los proxies convierten valores no lineales en valores lineales, pueden ser más útiles que los valores sin procesar para monitorizar a lo largo del tiempo. Un valor RISQI por encima de 0.29 será indicativo de RI. Un valor MIRG por debajo de 5.6 indicará un daño en las células β del páncreas y su habilidad para secretar insulina30.
- Otros: en la tabla 1 podemos ver otras mediciones basales que se pueden utilizar para diagnóstico de SME pero que se realizan con menor frecuencia, ya sea por su sensibilidad baja o por la dificultad de medición. Otras posibles pruebas que se encuentran ahora en estudio y pueden ser de ayuda en un futuro son:
- Polipéptido inhibidor gástrico (GIP).
- Péptido similar al glucagón 1 y 2.
- Péptido C.
- Estudios genéticos y metabolómicos.
| Tabla 1. Otras mediciones basales que pueden ser útiles a la hora de diagnosticar SME. |
| Prueba | Muestra | Interpretación |
| Adiponectina | Suero separado y congelado | < 2.5 μg/ml (radioinmunoensayo) o < 24 μh/ml (ensayo inmunoturbidimétrico) son hallazgos consistentes con SME |
| Leptina | Suero separado y refrigerado | < 10 ng/ml = Normal 10-20 ng/ml = Intermedio > 20 ng/ml = Alto No es indicativo de SME exclusivamente, pero sí de obesidad y es un parámetro para tener en cuenta, ya que vuelve a valores de referencia normales antes que la insulina en caballos en tratamiento. Los frisones y algunos caballos de tiro tienen valores de referencia más altos en comparación al resto de razas. |
| Triglicéridos | Suero separado o plasma | Hipertrigliceridemia: es un factor común encontrado en los caballos que sufren SME. A pesar de ello, los niveles de triglicéridos en sangre suele ser un indicativo más de obesidad que de resistencia a la insulina, por lo que deberá ser interpretado con cautela. |
Debemos tener en cuenta que, a pesar de la ausencia de hiperinsulinemia basal, en un animal con una clínica que sugiera EMS debemos realizar pruebas dinámicas.
Test dinámicos
Los test dinámicos nos aportan una imagen más completa de la dinámica glucosa/insulina, y aunque el test ideal aún no existe, los test dinámicos han demostrado ser más sensible en la detección de SME que los basales31.
Prueba de glucosa oral (OGT)
La gran ventaja de esta prueba es que se realiza ofreciendo glucosa en polvo (o dextrosa) mezclado en pequeñas cantidades de comida con bajo índice glucémico, por lo que puede incluso comenzarlo el dueño antes de la llegada del veterinario. Se recomienda ayuno durante la noche antes de la prueba, tanto para garantizar el cumplimiento de la ingesta de la dosis de la prueba como para facilitar el tránsito de glucosa.
Las dosis más utilizas son 0.5 g/kg o 1 g/kg de glucosa en polvo. Se debe medir la concentración de insulina pasadas 2 horas tras la ingestión de una u otra cantidad. La concentración de insulina debe mantenerse por debajo de 68 µU/L en el caso de haber utilizado 0.5 g/kg, y por debajo de 85 µU/L en el caso de 1 g/kg32.
Manejo, conservación y limitaciones
La muestra de suero debe ser separada y refrigerada/congelada lo antes posible para evitar una disminución de la concentración de insulina. Si esto no fuese posible, la insulina en caballos, al contrario que la humana, puede mantenerse a temperatura ambiente y sin separar por hasta 72 horas y que su degradación sea mínima33.
La principal limitación del protocolo es que la palatabilidad de una gran dosis de glucosa puede ser pobre, y los resultados de las pruebas pueden verse afectados por el tiempo de ingestión, el vaciado gástrico y la absorción intestinal34.
Test de respuesta a la insulina
Esta prueba mide la respuesta a una dosis de insulina exógena, evaluando así la absorción de glucosa dependiente de insulina y la sensibilidad a la insulina. Es un test muy sencillo en el que se mide la glucosa basal, se inyecta 0.1 U/kg insulina y se mide la glucosa a los 30 minutos. Se comparan ambos resultados y en caballos sanos debe haber una bajada en la segunda medición de al menos un 50 % de la glucosa inicial.
Manejo, conservación y limitaciones
Al tratarse de glucosa, la muestra de sangre debe introducirse en un tubo de fluoruro sódico o, en el caso de emplease suero, debe ser separada lo antes posible para evitar su consumo por los eritrocitos.
Para este test no es necesario el ayuno, y se recomienda tener dextrosa a mano y forraje para ofrecer al animal tras los 30 minutos para evitar posibles casos de hipoglucemia35.
Test combinado glucosa-insulina (curva de glucosa)
Posee una mayor sensibilidad que los test previos, ya que nos aporta una representación gráfica de variación de la concentración de glucosa en el tiempo. Para esta prueba es necesario el ayuno durante la noche.
Se toma una muestra por la mañana y se mide la concentración de glucosa. Acto seguido, se inyecta por vía intravenosa 150 mg/kg de solución 50 % dextrosa. Inmediatamente se administra 0.1 U/kg de insulina. Se toman muestras de sangre cada 1/5/15/25/35/45/60/75/90/105/120/135/150 minutos. En todas estas muestras se medirá simplemente la concentración de glucosa, a excepción del minuto 45 donde mediremos también la concentración de insulina.
Los caballos sanos muestran una curva de glucosa en sangre bifásica que comienza con hiperglucemia, seguida de una fase negativa en la que la glucosa cae por debajo del valor inicial (normalmente en menos de 45 min).
En caballos con RI la curva presenta una subida de glucosa más marcada y mayor tiempo en volver a niveles basales. La hiperinsulinemia y un retraso en el retorno a niveles de glucosa basales indican RI. Así pues, se considera hiperinsulinemia cuando a los 45 minutos post-inyección la concentración de insulina se encuentra por encima de 100 µU/ml.
Existe un protocolo más sencillo y corto en el cual se realiza la medición basal de glucosa e insulina y se repite después de 45 y 75 min36.
Manejo, conservación y limitaciones
Las mediciones de glucosa debe hacerse lo antes posible para evitar su consumo por parte de los eritrocitos. Las de insulina, como ya hemos comentado, debe separarse el suero y mantenerse refrigerado.
La principal limitación de este test será la cantidad de extracciones de sangre y tiempo empleado. Además, como pasa en el test de respuesta a insulina, se pueden producir casos de hipoglucemia, por lo que debe tenerse a mano dextrosa o alimento listo para ofrecer al animal.
Bibliografía
- Fix AS, Miller LD. Equine adrenocortical carcinoma with hypercalcemia, Vet Pathol, 1987.
- Wilson MG, Nicholson WE, Holscher MA, et al: Proopiolipomelanocortin peptides in normal pituitary, pituitary tumor, and plasma of normal and Cushing’s horses, Endocrinology 110:941-954, 1982.
- Pauli et al., 1974; Moore y col., 1979; Orth y otros, 1982; Wilson y otros, 1982; Orth y Nicholson, 1982.
- McFarlane, Dianne & Cribb, Alastair. (2006). Systemic and pituitary pars intermedia antioxidant capacity associated with pars intermedia oxidative stress and dysfunction in horses. American journal of veterinary research. 66. 2065-72. 10.2460/ajvr.2005.66.2065.
- M.H. Hillyer, F.G.R. Taylor, T.S. Mair, D. Murphy, T.D.G. Watson, S. Love, Diagnosis of hyperadrenocorticism in the horse, Equine Veterinary Education, 4 (1992), pp. 131-134
- Millington, William & Dybdal, Noel & Dawson, Ralph & Manzini, Christiane & Mueller, Gregory. (1988). Equine Cushing's Disease: Differential Regulation of Endorphin Processing in Tumors of the Intermediate Pituitary. Endocrinology. 123. 1598-604. 10.1210/endo-123-3-1598.
- Milne, E.M. (1990) Differential diagnosis of hepatic disorders in horses. In Practice 12,252-258.
- McGowan TW, Pinchbeck GP, McGowan CM. Prevalence, risk factors and clinical signs predictive for equine pituitary pars intermedia dysfunction in aged horses. Equine Vet J. 2013a; 45(1):74-9.
- Beech, J. (1987b) Tumors of the pituitary gland (pars intermedia). In: Current Therapy in Equine Medicine. 2nd edn. Ed: N.E. Robinson, W.B. Saunders, Philadelphia, pp 182,185.
- Beech, J. (1987a) Evaluation of thyroid, adrenal and pituitary function. Vet. Clin. N. Am. 3,649-660.
- Eustace, R. (1991) Equine pituitary neoplasia. In Practice. 13, 147-148.
- McFarlane D. Equine pituitary pars intermedia dysfunction. Vet Clin North Am Equine Pract. 2011;27(1):93–113.
- Cordero, M., Brorsen, B.W. and McFarlane, D. (2012) Circadian and circannual rhythms of cortisol, ACTH, and α-melanocyte-stimulating hormone in healthy horses. Dom. Anim. Endocrinol. 43, 317-324.
- Lee, Z.Y., Zylstra, R. and Haritou, S.J. (2010) The use of adrenocorticotrophic hormone as a potential biomarker of pituitary pars intermedia dysfunction in horses. Vet. J. 185, 58-61.
- Prutton, J.S., Kass, P.H., Watson, J.L., & Pusterla, N. (2015). Pre-analytical stability of adrenocorticotrophic hormone from healthy horses in whole blood, plasma and frozen plasma samples. Veterinary journal, 204 1, 123-4.
- Ellis, J.M., Livesey, J.H., Evans, M.J., 2003. Hormone stability in human whole blood. Clinical Biochemistry 36, 109–112.
- Donaldson, M.T., McDonnell, S.M., Schanbacher, B.J., Lamb, S.V., McFarlane, D. and Beech, J. (2005) Variation in plasma adrenocorticotropic hormone concentration and dexamethasone suppression test results with season, age, and sex in healthy ponies and horses. J. Vet. Intern. Med. 19, 217-222.
- McGowan, T.W., Pinchbeck, G.P. and McGowan, C.M. (2013b) Evaluation of basal plasma a-melanocyte-stimulating hormone and adrenocorticotrophic hormone concentrations for the diagnosis of pituitary pars intermedia dysfunction from a population of aged horses. Equine Vet. J. 45, 66-73.
- Dybdal, N.O., Hargreaves, K.M., Madigan, J.E., Gribble, D.H., Kennedy, P.C. and Stabenfeldt, G.H. (1994) Diagnostic testing for pituitary pars intermedia dysfunction in horses. J. Am. Vet. Med. Ass. 204, 627-632
- Donaldson, M.T., McDonnell, S.M., Schanbacher, B.J., Lamb, S.V., McFarlane, D. and Beech, J. (2005) Variation in plasma adrenocorticotropic hormone concentration and dexamethasone suppression test results with season, age, and sex in healthy ponies and horses. J. Vet. Intern. Med. 19, 217-222.
- Beech, J., McFarlane, D., Lindborg, S., Sojka, J.E. and Boston, R.C. (2011a) α-Melanocyte-stimulating hormone and adrenocorticotropin concentrations in response to thyrotropinreleasing hormone and comparison with adrenocorticotropin concentration after domperidone administration in healthy horses and horses with pituitary pars intermedia dysfunction. J. Am. Vet. Med. Ass. 238, 1305-1315.
- Beech, J., Boston, R., Lindborg, S. and Russell, G.E. (2007) Adrenocorticotropin concentration following administration of thyrotropin-releasing hormone in healthy horses and those with A. E. Durham et al. 22 pituitary pars intermedia dysfunction and pituitary gland hyperplasia. J. Am. Vet. Med. Ass. 231, 417-426.
- Funk, R.A., Stewart, A.J., Wooldridge, A.A., Kwessi, E., Kemppainen, R.J., Behrend, E.N., Zhong, Q. and Johnson, A.K. (2011) Seasonal changes in plasma adrenocorticotropic hormone and α-melanocyte-stimulating hormone in response to thyrotropinreleasing hormone in normal, aged horses. J. Vet. Intern. Med. 25, 579-585.
- Bamford, N. J., Potter, S. J., Harris, P. A. & Bailey, S. R. (2014) Breed differences in insulin sensitivity and insulinemic responses to oral glucose in horses and ponies of moderate body condition score. Domestic Animal Endocrinology 47, 101-107.
- Baskerville CL, Chockalingham S, Harris PA, Bailey SR. The effect of insulin on equine lamellar basal epithelial cells mediated by the insulin-like growth factor-1 receptor. PeerJ. 2018;6:e5945. Published 2018 Nov 29.
- Morgan, R. A., Mcgowan, T. W. & Mcgowan, C. M. (2014b) Prevalence and risk factors for hyperinsulinaemia in ponies in Queensland, Australia. Australian Veterinary Journal 92, 101-106.
- Frank N, Geor RJ, Bailey SR, Durham AE, Johnson PJ, American College of Veterinary Internal Medicine. Equine metabolic syndrome. J Vet Intern Med. 2010;24(3):467-475
- Durham, A.E.; Frank, N. ECEIM consensus statement on equine metabolic syndrome. J. Vet. Intern. Med.2019, 33, 335–349. [CrossRef] [PubMed]
- Muniyappa, R., Lee, S., Chen, H. & Quon, M. J. (2008) Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. American Journal of Physiology: Endocrinology and Metabolism 294, E15-E26
- Treiber KH, Kronfeld DS, Hess TM, et al. Use of proxies and reference quintiles obtained from minimal model analysis for determination of insulin sensitivity and pancreatic beta-cell responsiveness in horses. Am J Vet Res 2005;66(12):2114–21.
- Frank, N., Geor, R. J., Bailey, S. R., Durham, A. E. & Johnson, P. J. (2010) Equine metabolic syndrome. Journal of Veterinary Internal Medicine 24, 467-475
- Bertin FR, de Laat MA. The diagnosis of equine insulin dysregulation. Equine Vet J. 2017;49(5):570-576.
- Carslake, Harry & Karikoski, Ninja & Pinchbeck, Gina & Mcgowan, Catherine. (2016). Serum insulin concentration in horses: Effect of storage and handling. The Veterinary Journal. 211. 10.1016/j.tvjl.2016.02.016.
- De Laat MA, Sillence MN. The repeatability of an oral glucose test in ponies. Equine Vet J. 2017;49(2):238-243.
- Bertin FR, Sojka-Kritchevsky JE. Comparison of a 2-step insulinresponse test to conventional insulin-sensitivity testing in horses. Domestic Anim Endocrinol. 2013;44(1):19-25.
- Morgan RA, Keen JA, McGowan CM. Treatment of equine metabolic syndrome: a clinical case series. Equine Vet J. 2016;48(4):422-426.
 by Multimédica
by Multimédica