Piroplasmosis equina: Patogenia y herramientas laboratoriales para su diagnóstico
Resumen breve
La piroplasmosis equina es una enfermedad parasitaria producida por los protozoos intraeritrocitarios Babesia caballi y Theileria equi (anteriormente conocido como Babesia equi). Principalmente afecta a caballos, burros, mulas, y cebras, aunque se ha detectado en ocasiones aisladas en cánidos o camélidos.Índice de contenidos
Resumen
La piroplasmosis equina es una enfermedad parasitaria producida por los protozoos intraeritrocitarios Babesia caballi y Theileria equi (anteriormente conocido como Babesia equi). Principalmente afecta a caballos, burros, mulas, y cebras, aunque se ha detectado en ocasiones aisladas en cánidos o camélidos.
Los vectores de la piroplasmosis equina son garrapatas pertenecientes a los géneros Dermacentor, Rhipicephalus y Hyalomma1. Sin embargo, según estudios recientes, otros géneros como Ixodes, Haemaphysalis y Ambloyomma son capaces de transmitir biológicamente los parásitos tanto en condiciones naturales como experimentales2.
Este artículo pretende hacer un recordatorio de la distribución, factores de riesgo, patogenia y síntomas de la enfermedad, así como de los cambios hematológicos y bioquímicos asociados a la enfermedad y las técnicas laboratoriales disponibles para ayudar al clínico en el diagnóstico correcto de la enfermedad.
Distribución y factores de riesgo
La piroplasmosis equina es endémica en regiones tropicales y templadas del mundo donde prevalecen los géneros de garrapatas mencionados previamente. Esta enfermedad se encuentra de forma endémica en Asia, Sudamérica y América Central y el sur de Europa.
En cuanto a la prevalencia de esta enfermedad, ciertos factores como el tipo de infección (ya que los équidos infectados por T. equi pueden llegar a ser portadores de por vida con la infección, mientras que la infección por B. caballi puede desaparecer en unos pocos años), determinan la prevalencia geográfica de esta enfermedad.
Se han estudiado otros parámetros como posibles factores de riesgo para la incidencia y prevalencia de esta enfermedad:
- Especie: Se ha descrito una mayor susceptibilidad a sufrir la enfermedad en caballos frente a burros3. Sin embargo, ciertos estudios relacionan una mayor prevalencia en mulas que en caballos en España4. Esto se atribuye a las frecuentes actividades al aire libre de las mulas y a su exposición prolongada a los pastos, lo que aumenta la probabilidad de ser picadas por las garrapatas.
- Edad y sexo: A medida que aumenta la edad, aumenta la prevalencia de piroplasmosis. La explicación para este hecho es que los animales infectados pueden y quedan en ciertos casos como portadores (carriers en inglés). Además, el porcentaje de animales positivos a T. equi aumenta en comparación a aquellos positivos a B. caballi. En cuanto al sexo, existen estudios contradictorios en los que se han descrito como más susceptibles las yeguas en comparación con los machos5. La explicación según algunos autores podría encontrarse en los niveles hormonales6, sin embargo, algunos otros investigadores no encontraron correlación entre la seropositividad y el sexo ni para B. caballi ni para T. equi7.
- Actividad: Los caballos de deporte tienen una prevalencia más baja debido a una menor exposición a la infestación por garrapatas siempre que se realice un buen control de los parásitos. Los caballos criados en granjas tienen más probabilidades de estar expuestos a garrapatas debido a medidas de control de garrapatas más deficientes.
- Clima y geografía: Altitudes por encima de los 1500 metros afectan a las especies de garrapatas que vamos a encontrar y por lo tanto a la prevalencia de piroplasmosis8. El clima también presenta un factor limitante, ya que las condiciones climáticas influyen en la distribución de las garrapatas y sus períodos de actividad.
Por último, cabe destacar, que, aunque se pensaba que la piroplasmosis equina era muy especie-específica, estudios recientes confirman la presencia de piroplasmosis equina en perros, camellos y tapires10,11.
Patogenia y síntomas
Patogenia
El ciclo de ambos parásitos no es igual, aunque tanto B. caballi como T. equi poseen tres fases en su ciclo biológico:
- El esporozoito: la fase infectante.
- El merozoíto: la fase asexual en sangre.
- El gametocito: la fase sexual en sangre.
El desarrollo de estos parásitos dentro de la garrapata varía en función de la especie de garrapata involucrada. Independientemente de la variación entre especies, tanto para B. caballi como para T. equi, los esporozoitos se transmiten a través de la saliva de la garrapata al caballo hospedador. La saliva posee características antinflamatorias, por lo que se consigue así evitar la interacción del sistema inmune del hospedador.
Una vez dentro del hospedador, los esporozoitos de B. caballi invaden directamente los eritrocitos donde se multiplican y se desarrollan primero en trofozoítos y luego en merozoítos. Tras la ruptura de los eritrocitos, se produce la liberación de los merozoítos los cuales invaden otros eritrocitos.
El inicio de T. equi es diferente ya que ingresa primero en los linfocitos. En estos, los esporozoítos de T. equi se convierten en esquizontes grandes y después de aproximadamente 9 días, los merozoítos se liberan e invaden los eritrocitos.
Para ambos parásitos, la replicación asexual da como resultado una población en expansión de merozoítos y eritrocitos parasitados.
Algunos merozoítos se desarrollan en forma de gametocitos dentro de la sangre periférica. Tras la ingestión de merozoítos (y/o gametocitos) por una garrapata, los parásitos se reproducen sexualmente, y los gametocitos se convierten en gametos, que se combinan para formar cigotos dentro del intestino de la garrapata. Los cigotos se desarrollan de manera diferente según la especie de garrapata y el parásito, pero en general tras un período de 6 a 24 días, se llega a la presencia de esporozoitos dentro de la glándula salival de la garrapata y el ciclo comienza de nuevo (Figura 1).
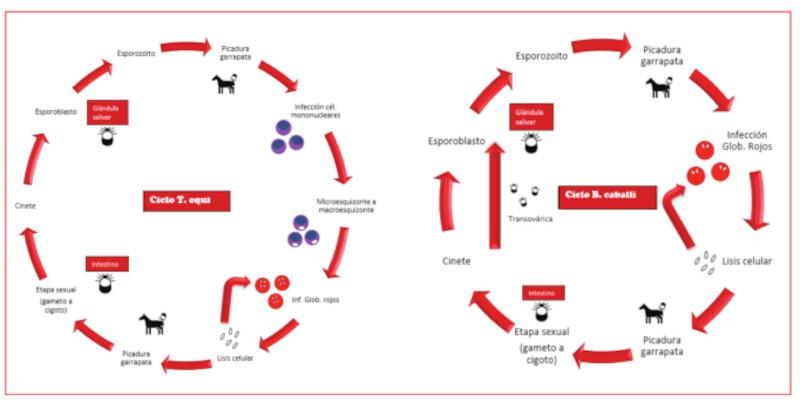
La transmisión del parásito en la garrapata puede ocurrir de tres formas: intraestadial, transestadial o transovárica. La transmisión intraestadial ocurre cuando la adquisición y transmisión del parásito ocurre dentro de una etapa de la vida de la garrapata. Transestadial describe la adquisición de la infección en una etapa y la capacidad de la misma garrapata para transmitir la infección a etapas posteriores. El parásito se mantiene dentro de la garrapata a medida que esta se desarrolla. La transmisión transovárica ocurre cuando la hembra adquiere parásitos que ingresan a los ovarios y se transmiten a la descendencia, lo que permite el mantenimiento de los parásitos a través de generaciones de garrapatas.
B. caballi se transmite por vía transestadial y transovárica, lo que permite que la garrapata sirva como fuente de infección para su descendencia. Por el contrario, T. equi se transmite únicamente por métodos transestadiales.
La liberación de los merozoítos de T. equi o B. caballi provoca la lisis de los eritrocitos dando lugar a diversos grados de anemia hemolítica intravascular.
Los macrófagos esplénicos eliminan de la circulación los glóbulos rojos infectados, lo que contribuye aún más a la anemia. Ciertos eritrocitos no parasitados también se eliminan de la circulación, pero se desconoce la razón de este fenómeno. En burros infectados experimentalmente por T. equi, se han descrito cambios bioquímicos en las membranas de los eritrocitos12. Este cambio conformacional causa una menor capacidad de deformación de los glóbulos rojos, lo que podría conducir a una reducción del flujo sanguíneo microvascular.
Los eritrocitos infectados por tanto causan microtrombos al aglutinarse dentro de los vasos pequeños, lo que lleva a estasis venosa y vasculitis siendo la posible explicación del aumento de los tiempos de coagulación descrito durante la infección por T. equi y B. caballi13.
En ciertas ocasiones graves, la piroplasmosis puede provocar hipercoagulabilidad, síndrome de respuesta inflamatoria sistémica y disfunción con fallo multiorgánico llevando a la muerte del animal (Figura 2).
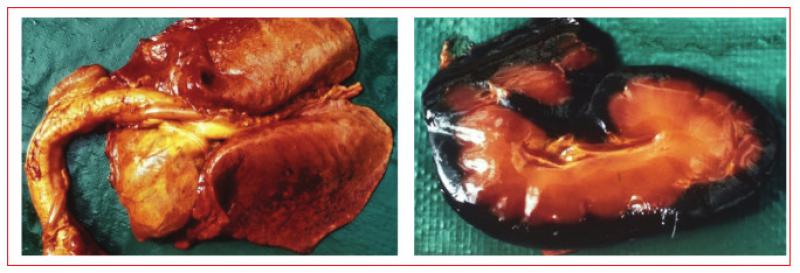
Por último, se ha descrito la transmisión placentaria de yeguas portadoras infectadas a sus fetos14. Esta transmisión puede dar lugar a abortos, normalmente en el último tercio de la gestación o infección neonatal. Se desconoce la prevalencia de este tipo de transmisión.
Síntomas
Los signos clínicos de piroplasmosis son muy variables y con frecuencia inespecíficos. T. equi tiende a causar enfermedad más grave que B. caballi.
Después de la transmisión, y variando en cada caso, los signos clínicos se suelen desarrollar dentro de los 10 a 30 días para B. caballi y de 12 a 19 días para T. equi1.
Las infecciones según los signos clínicos y su aparición pueden categorizarse en agudas, crónicas o inaparentes/silenciosas.
Infecciones agudas
Las infecciones agudas se caracterizan inicialmente por signos inespecíficos de cualquier infección, que incluyen pirexia (a menudo superior a 40 °C), letargo, anorexia y edema en extremidades. En ciertos casos, pueden observarse petequias en las mucosas debidas a trombocitopenia marcada.
Otros signos menos comunes de infección aguda incluyen neumonía, edema pulmonar, síntomas de enfermedad del sistema nervioso central, cólicos, impactaciones, diarrea y enteritis catarral.
Infecciones crónicas
Los caballos infectados de manera crónica generalmente exhiben signos de afecciones inflamatorias crónicas, que incluyen pérdida de peso, mala condición corporal, anorexia parcial, malestar y disminución del rendimiento.
Además, en el examen rectal se puede encontrar esplenomegalia.
Portadores inaparentes/silenciosos
Es importante destacar que la gran mayoría de los caballos seropositivos de B. caballi y T. equi son portadores inaparentes/silenciosos. Estos caballos normalmente poseen niveles bajos de parasitemia y no presentan signos clínicos evidentes.
Los portadores son reservorios para los parásitos y tienen el potencial de diseminar la infección de manera iatrogénica (mediante transferencias de sangres) o debido a vectores15. Estos portadores representan un gran riesgo a la hora de introducirlos en países no endémicos y las pruebas de detección son de vital importancia.
Los portadores pueden desarrollar una recaída en la enfermedad clínica si se encuentran inmunodeprimidos, estresados, esplenectomizados o si reciben corticoesteroides.
Cambios en hemograma y bioquímica
Una vez que conocemos la patogenia de la enfermedad vamos a describir los cambios más habituales que se producen en el hemograma y la bioquímica de animales parasitados por B. caballi y T. equi.
HEMOGRAMA: Como ya hemos descrito el cambio más importante será la anemia. La mayoría de los équidos, independientemente del tipo de infección que sufran (aguda, crónica e incluso algunos portadores), mostrarán algún grado de anemia.
El hematocrito (PCV), la hemoglobina (Hb) y el número total de glóbulos rojos (RBC) aparecen disminuidos en comparación con animales sanos. En otros parámetros se puede producir un aumento como en la hemoglobina corpuscular media (MCH) y la concentración corpuscular media de hemoglobina (MHCH)16.
La trombocitopenia es un hallazgo que se encuentra con frecuencia, y se ha descrito en el 39% de las infecciones por T. equi, el 80% de las infecciones por B. caballi y el 100% de las infecciones mixtas17.
La patogenia del recuento plaquetario disminuido incluye la destrucción mediada por el sistema inmunitario, secuestro esplénico y / o consumo excesivo, como se observa en la coagulación intravascular diseminada.
BIOQUÍMICA: Es muy variable, y depende de factores individuales como la alimentación o el ejercicio.
En caballos de carreras clínicamente afectados por B. caballi se observó una disminución significativa de las proteínas totales y un aumento de bilirrubina, aspartato aminotransaminasa (AST), gamma-glutamiltransferasa (GGT), creatinina quinasa (CK) y fosfatasa alcalina (ALP).
Además, Camacho y colaboradores18 describen mediante un estudio en Galicia que los caballos infectados con B. caballi y T. equi tenían concentraciones séricas más altas de bilirrubina, urea, AST, GGT y lactato deshidrogenasa (LDH). El aumento en las concentraciones de bilirrubina se atribuye a la anemia hemolítica característica de la piroplasmosis equina. Las elevaciones en los niveles séricos de enzimas hepáticas se deben a la reducción del flujo de sangre al hígado que conduce a necrosis centrolobulillar17.
Diagnóstico
Para el diagnóstico de la piroplasmosis equina se pueden usar varias técnicas de diagnóstico por sí solas o en combinación, pero la prueba más apropiada varía, según la fase de la infección, el acceso del clínico a estas pruebas y si el caballo se encuentra en una región endémica o no endémica. El diagnóstico de la piroplasmosis aguda se puede hacer basándose en los signos clínicos y el examen cuidadoso del frotis de sangre periférica, sin embargo y con carácter general, las pruebas serológicas son necesarias para diagnosticar caballos con infección crónica y con fines regulatorios (exportación/importación).
A continuación, hablaremos de las técnicas disponibles en mayor profundidad.
Visualización directa del frotis
Debe realizarse siempre dada su facilidad, bajo costo y alta especificidad si el clínico tiene experiencia.
Los piroplasmas de T. equi y B. caballi se pueden distinguir fácilmente entre sí. Dentro del eritrocito, B. caballi suele aparecer como dos grandes merozoítos piriformes (forma de pera) que miden aproximadamente de 2 a 5 μm. Por otra parte, los merozoítos de T. equi se encuentran dentro de los eritrocitos como piroplasmas pequeños polimórficos, ocasionalmente dispuestos en formación de “cruz de Malta”. Los merozoítos de T. equi son más pequeños midiendo normalmente de 2 a 3 μm (Figura 3).
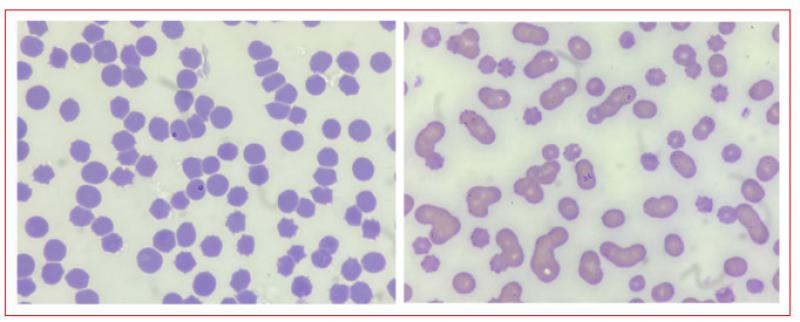
La tinción de los frotis sanguíneos debe realizarse mediante tinciones tipo Romanowsky (Giemsa, Wright, o Diff-Quik). Su principal desventaja es que posee una baja sensibilidad ya que no permite detectar hemoparásitos en etapas crónicas y subclínicas (portadores) debido a los bajos niveles de parasitemia19.
Incluso en casos agudos se requiere de entrenamiento para su visualización ya que durante la infección clínica por B. caballi, el porcentaje de eritrocitos parasitados suele ser inferior al 1% y puede llegar a ser inferior al 0,1%. El porcentaje de eritrocitos infectados durante la enfermedad como resultado de T. equi suele estar entre el 1% y el 5%. pero en casos severos puede superar el 20%20.
Serología
Existen diversos ensayos serológicos para aumentar la sensibilidad diagnóstica en équidos infectados crónicamente con piroplasmas de B. caballi y T. equi. A continuación, hablaremos de la inmunofluerescencia indirecta (IFI), el ensayo por inmunoabsorción ligado a enzimas (ELISA) y la prueba de fijación del complemento (RFC).
Cabe destacar que ninguna de estas pruebas es infalible por lo que en caso de duda se recomienda utilizar al menos dos pruebas serológicas diferentes21. Por otra parte, se ha demostrado que los títulos de anticuerpos no tienen una relación directa con la carga parasitaria22.
Fijación de complemento (RFC/CFT)
La RFC ha sido históricamente el método regulatorio aceptado para la importación y exportación de caballos entre países endémicos y no endémicos. La RFC se basa en la fijación del complemento durante la reacción entre el antígeno y el anticuerpo de sueros de caballos infectados. Las muestras de suero de caballos que reaccionan a una dilución de 1: 5 o superiores se consideran positivas. Mediante esta técnica se pueden detectar anticuerpos aproximadamente de 8 a 11 días tras la infección, y los títulos comienzan a disminuir a los 2 a 3 meses23.
Las grandes desventajas de esta técnica, son su baja sensibilidad (da lugar a falsos negativos) y que no es capaz de diferenciar entre infecciones producidas por B. caballi y T. equi, ya que se produce una reacción cruzada entre ambos anticuerpos. Por estas razones esta técnica se está viendo relegada y en la actualidad son la IFI o principalmente el Elisa las técnicas serológicas de elección.
Inmunofluorescencia indirecta (IFI/IFAT)
La IFI es una técnica serológica más sensible que la CFT. También tiene una alta especificidad y es una prueba que históricamente se ha utilizado como prueba complementaria cuando los resultados obtenidos por la RFC no eran concluyentes. El principio de esta prueba se basa en la fluorescencia de anticuerpos marcados los cuales se unen a los anticuerpos de la muestra.
La fluorescencia se debe observar bajo luz ultravioleta considerándose positiva con una dilución igual o superior a 1:80. En los caballos infectados de forma experimental con B. caballi y T. equi, las respuestas de anticuerpos detectables mediante IFI se produjeron aproximadamente entre los 3 y los 20 días después de la infección manteniéndose altos durante el período crónico de la infección24.
La gran desventaja de esta técnica es la subjetividad del patólogo frente a la fluorescencia y que esta técnica requiere una gran cantidad de antígeno para que su detección sea fiable23.
Elisa de competición (C-Elisa)
El uso de la técnica serológica c-ELISA para la detección de la infección por T. equi fue desarrollado por Knowles y colaboradores25 en 1991 utilizando T. equi EMA-1 y anticuerpos monoclonales específicos.
EMA-1 es una proteína que se encuentra en la superficie de los eritrocitos infectados específicamente con T. equi y posee un epítopo que se conserva en todo el mundo. Los caballos infectados con T. equi pueden detectarse con cELISA a partir del día 21 tras la infección y permanecer positivos hasta 24 meses después25. Esta prueba posee una mayor sensibilidad en infecciones crónicas en comparación con otros ensayos serológicos por lo que es la prueba de elección para detectar infecciones crónicas y portadores de T. equi26.
Sin embargo, no ocurre lo mismo para B. caballi en donde esta técnica ha demostrado problemas en el diagnóstico de B. caballi en países como Sudáfrica, Egipto, Jordania e Israel, debido al amplio polimorfismo encontrado en la región de la proteína RAP-1 que contiene el epítopo celular empleado en el ensayo de c-ELISA27. A pesar de esta desventaja, en un estudio epidemiológico se comparó esta prueba frente a la RFC para la detección de anticuerpos frente a B. caballi, obteniéndose un resultado de un 25% más de muestras positivas26 en c-Elisa que en RFC.
Por todas estas razones, en 2004, la OIE aprobó el c-ELISA como una de las pruebas reglamentarias para testar a caballos, tanto para B. caballi como para T. equi, antes del transporte internacional a países no endémicos24.
Reacción en cadena de la polimerasa (PCR)
La PCR detecta la presencia de ácido desoxirribonucleico (ADN) del parásito. Es una técnica cuyo uso está en aumento y que permite la detección de parasitemia en sangre. Es más sensible que cualquier otro método por lo que se debe usar siempre, teniendo en cuenta que no será capaz de diferenciar infecciones agudas/crónicas de aquellos animales portadores/inaparentes. Se ha utilizado ampliamente en entornos de investigación para la detección de infecciones por B. caballi y T. equi y se considera un complemento de la microscopía y serología. Variaciones de la PCR, incluyen la PCR convencional, la PCR anidada, la PCR en tiempo real y la amplificación isotérmica en forma cíclica LAMP (Loop-mediated isothermal amplification).
En general, la técnica de PCR es sencilla y cada vez más asequible y no se ha utilizado ya que no se encuentra disponible en muchos de los países endémicos.
Su mayor desventaja como ya hemos mencionado, es que no es capaz de diferenciar animales con una infección aguda/crónica de aquellos portadores en zonas endémicas los cuales no están sufriendo una recaída de la enfermedad por lo que puede dar lugar a diagnósticos erróneos si no se conoce el estado previo del animal28.
Tratamiento y prevención
Tratamiento
El tratamiento de la piroplasmosis depende de si el animal se encuentra en una zona endémica o libre de piroplasmosis. En una zona endémica el objetivo será la reducción de los síntomas clínicos, mientras que en países libres de la enfermedad el objetivo será la eliminación total de la parasitemia. La razón para esta diferencia es que se ha descrito que la presencia del parasito en bajas cargas confiere inmunidad frente a nuevas infecciones por lo que no es aconsejable la eliminación absoluta del parásito29.
Las infecciones por T. equi son más difíciles de tratar que las infecciones por B. caballi. Algunos fármacos han demostrado una eficacia considerable para eliminar ambas infecciones. El uso del dipropionato de imidocarb ha demostrado una eficacia elevada en la eliminación de los parásitos T. equi y B. caballi durante la infección30. Según Frerichs y colaboradores31, la dosis recomendada para el tratamiento en el caso de B. caballi es de 2 mg/kg en dos dosis administradas en un intervalo de 24 horas. En el caso de T. equi la dosis debe ser de 4 mg/kg en cuatro dosis con un intervalo de 72 horas entre dosis.
Todo el tratamiento debe realizarse por vía intramuscular y existen ciertos efectos secundarios adversos (como sudoración, cólico, rigidez muscular y diarrea). Por lo general, estos signos son transitorios y rara vez ponen en peligro la vida del animal32.
Se han descrito otros tratamientos o fármacos complementarios para el tratamiento de la piroplasmosis como el diaminaceno o la oxitetraciclina, pero los resultados obtenidos han sido variables por lo que el imidocarb sigue siendo el fármaco de uso habitual.
Aparte de los medicamentos antiprotozoarios, los caballos con infección aguda a menudo requieren otros cuidados que incluyen, entre otros, hidratación por vía intravenosa, antiinflamatorios no esteroideos, analgesia y en ciertos casos transfusiones de sangre.
Prevención
La prevención de la infección en países endémicos es prácticamente imposible, y se supone que la inmunidad conferida con la infección inicial actúa para proteger al caballo de la enfermedad en exposiciones posteriores. En las naciones no endémicas, la piedra angular de la protección consiste en la regulación del movimiento de caballos provenientes de naciones endémicas. Además de los test serológicos obligatorios por la OIE, es recomendable la aplicación de acaricidas antes de su introducción en el país de destino para asegurar que no se introduzcan garrapatas infectadas.
Por último, cabe mencionar que varios estudios han evaluado el uso potencial de la vacunación para inducir inmunidad a la infección por B. caballi y T. equi33, pero actualmente no existe una vacuna en el mercado.
Bibliografía
- DeWaal, D.T. equine piroplasmosis: A review. Br. Vet. J. 1992, 148, 6–14.
- Scoles, G.A.; Ueti, M.W. Vector ecology of equine piroplasmosis. Annu. Rev. Entomol. 2015, 60, 561–580.
- Qablan, M.A.; Obornik, M.; Petrželková, K.J.; Sloboda, M.; Shudiefat, M.; Hoˇrín, P.; Modrý, D. Infections by Babesia caballi and Theileria equi in Jordanian equids: Epidemiology and genetic diversity. Parasitology 2013, 140, 1096–1103.
- García-Bocanegra, I.; Arenas-Montes, A.; Hernández, E.; Adaszek, Ł.; Carbonero, A.; Almería, S.; Arenas, A. Seroprevalence and risk factors associated with Babesia caballi and Theileria equi infection in equids. Vet. J. 2013, 195, 172–178.
- Moretti, A.; Mangili, V.; Salvatori, R.; Maresca, C.; Scoccia, E.; Torina, A.; Pietrobelli, M. Prevalence and diagnosis of Babesia and Theileria infections in horses in Italy: A preliminary study. Vet. J. 2010, 184, 346–350.
- Roberts, C.W.; Walker, W.; Alexander, J. Sex-associated hormones and immunity to protozoan parasites. Clin. Microbiol. Rev. 2001, 14, 476–488.
- Grandi, G.; Molinari, G.; Tittarelli, M.; Sassera, D.; Kramer, L.H. Prevalence of Theileria equi and Babesia caballi infection in horses from northern Italy. Vector-Borne Zoonotic Dis. 2011, 11, 955–956.
- Byambaa, B.; Dash, M.; Tarasevic, I.W. New Research about Tick-Borne Rickettsiosis; University of Ulaanbaatar: Ulaanbaatar, Mongolia, 1994.
- Onyiche TE, Suganuma K, Igarashi I, Yokoyama N, Xuan X, Thekisoe O. A Review on Equine Piroplasmosis: Epidemiology, Vector Ecology, Risk Factors, Host Immunity, Diagnosis and Control. Int J Environ Res Public Health. 2019;16(10):1736. Published 2019 May 16. doi:10.3390/ijerph16101736
- Fritz, D. A PCR study of piroplasms in 166 dogs and 111 horses in France (March 2006 to March 2008).Parasitol. Res. 2010, 106, 1339–1342.
- Jasim, H.J.; Azzal, G.Y.; Othman, R.M. Conventional and molecular detection of Babesia caballi and Theileria equi parasites in infected camels in south of Iraq. Basrah J. Vet. Res. 2015, 14, 110–121.
- Ambawat HK, Malhotra DV, Kumar S, et al. Erythrocyte associated haemato-biochemical changes in Babesia equi infection experimentally produced in donkeys. Vet Parasitol 1999;85:319–324.
- Allen PC, Frerichs WM, Holbrook AA. Experimental acute Babesia caballi infections. II. Response of platelets and fibrinogen. Exp Parasitol 1975;37:373–379.
- Allsopp MT, Lewis BD, Penzhorn BL. Molecular evidence for transplacental transmission of Theileria equi from carrier mares to their apparently healthy foals. Vet Parasitol 2007;148:130–136.
- Ueti MW, Palmer GH, Scoles GA, et al: Persistently infected horses are reservoirs for intrastadial tick-borne transmission of the apicomplexan parasite Babesia equi. Infect Immun 76:3525–3529, 2008.
- Osman, S.A. Clinical, haematological and therapeutic studies on babesiosis in Arabian horses in the Qassim region, central of Saudi Arabia. J. Appl. Anim. Res. 2017, 45, 118–121.
- Zobba R, Ardu M, Niccolini S, et al: Clinical and laboratory findings in equine piroplasmosis. J Equine Vet Sci 28:301–308, 2008.
- Camacho, A.T.; Guitian, F.J.; Pallas, E.; Gestal, J.J.; Olmeda, A.S.; Habela, M.A.; Spielman, A. Theilera (Babesia) equi and Babesia caballi infections in horses in Galicia, Spain. Trop. Anim. Health Prod. 2005, 37, 293–302.
- Baldani CD, Machado RZ, Raso TF, Pinto AA. Serodiagnosis of Babesia equi in horses submitted to exercise stress. Pesq Vet Bras. 2007;27(4):179-183.
- Donnellan CM, Marais HJ: Equine Piroplasmosis. In: Mair TS, Hutchinson RE, editors: Infectious Disease of Horses, UK, 2009, EVJ Ltd, pp 333–340.
- Ali, S.; Sugimoto, C.; Onuma, M. Equine piroplasmosis. J. Equine Sci. 2001, 7, 67–77.
- Weiland, G. Species-specific serodiagnosis of equine piroplasma infections by means of complement fixation test (CFT), immunofluorescence (IIF), and enzyme-linked immunosorbent assay (ELISA). Vet. Parasitol. 1986, 20, 43–48.
- Brüning A: Equine piroplasmosis an update on diagnosis, treatment and prevention. Br Vet J 152:139–151, 1996.
- Rothschild, C.M. Equine piroplasmosis. J. Equine Vet. Sci. 2013, 33, 497–508.
- Knowles, D.P.; Kappmeyer, L.S.; Stiller, D.; Hennager, S.G.; Perryman, L.E. Antibody to a recombinant merozoite protein epitope identifies horses infected with Babesia equi. J. Clin. Microbiol. 1992, 30, 3122–3126.
- Kappmeyer LS, Perryman LE, Hines SA, Baszler TV, Katz JB, Hennager SG, et al. Detection of Equine Antibodies to Babesia caballi by Recombinant B. caballi Rhoptry-Associated Protein 1 in a Competitive-Inhibition Enzyme-Linked Immunosorbent Assay. J Clin Microbiol. 1999;37(7):2285-2290.
- AA Díaz-Sánchez, L Roblejo-Arias, R Marrero-Perera Equine piroplasmosis- Revista de Salud Animal, 2020
- Jaer, O.; Abdishakur, F.; Hakimuddin, F.; Riya, A.; Wernery, U.; Schuster, R.K. A comparative study of serological tests and PCR for the diagnosis of equine piroplasmosis. Parasitol. Res. 2010, 106, 709–713.
- Wise, L.N.; Kappmeyer, L.S.; Mealey, R.H.; Knowles, D.P. Review of equine piroplasmosis. J. Vet. Intern. Med. 2013, 27, 1334–1346.
- Ueti, M.W.; Mealey, R.H.; Kappmeyer, L.S.; White, S.N.; Kumpula-McWhirter, N.; Pelzel, A.M.; Hendrickson, A. Re-emergence of the apicomplexan Theileria equi in the United States: Elimination of persistent infection and transmission risk. PLoS ONE 2012, 7, e44713.
- Frerichs, W.M.; Holbrook, A.A. Treatment of equine piroplasmosis (B. caballi) with imidocarb dipropionate. Vet. Rec. 1974, 95, 188–189.
- Meyer C, Guthrie AJ, Stevens KB. Clinical and clinicopathological changes in 6 healthy ponies following intramuscular administration of multiple doses of imidocarb dipropionate. J S Afr Vet Assoc 2005;76:26–32
- Kumar, S.; Malhotra, D.V.; Dhar, S.; Nichani, A.K. Vaccination of donkeys against Babesia equi using killed merozoite immunogen. Vet. Parasitol. 2002, 106, 19–33.
 by Multimédica
by Multimédica