Trombocitopenia inmune
Resumen breve
La trombocitopenia es una de las alteraciones más frecuentes en perros. Está presente en aproximadamente un 18% de los perros que se presentan en hospitales veterinarios de referencia, con un 6% de los perros presentando recuentos plaquetarios inferiores a 100.000 plq/mcL. De todos los pacientes con trombocitopenia, aproximadamente un 5% presentan trombocitopenia inmune (TPI), un 13% neoplasia, un 23% enfermedades infecciosas o inflamatorias y un 59% a otras causas. Sin embargo, la TPI se considera…Índice de contenidos
Introducción
La trombocitopenia es una de las alteraciones más frecuentes en perros. Está presente en aproximadamente un 18% de los perros que se presentan en hospitales veterinarios de referencia, con un 6% de los perros presentando recuentos plaquetarios inferiores a 100.000 plq/mcL. De todos los pacientes con trombocitopenia, aproximadamente un 5% presentan trombocitopenia inmune (TPI), un 13% neoplasia, un 23% enfermedades infecciosas o inflamatorias y un 59% a otras causas. Sin embargo, la TPI se considera con diferencia la alteración de la hemostasia primaria más frecuente en perros con trombocitopenia grave (< 30.000-50.000 plq/mcL)1. En esta revisión se realizará una actualización de las últimas novedades publicadas sobre los mecanismos fisiopatológicos de la enfermedad, protocolo diagnóstico, tratamiento y pronóstico de la enfermedad.
Hemostasia primaria y fisiología plaquetaria
Las plaquetas provienen de los megacariocitos, las células precursoras en la médula ósea, que en la fase final de maduración emiten pseudópodos que finalmente se fragmentarán, se liberarán de la médula ósea y darán lugar a las plaquetas circulantes en el compartimento vascular. Aproximadamente 100 billones de plaquetas se liberan cada día para mantener un recuento plaquetario aproximado de 200-500 millones de plaquetas por mililitro de sangre, y su vida media será aproximadamente de 6-10 días en circulación.
Estas plaquetas circulantes juegan un papel fundamental en el inicio y regulación de la hemostasia. El término “hemostasia primaria” se refiere a la interacción entre las plaquetas, el factor de von Willebrand y el endotelio vascular, que termina con la formación del tapón plaquetario. Al dañarse el endotelio vascular, se inicia la “activación” de las plaquetas que se transforman en esferas espinosas capaces de adherirse al colágeno subendotelial mediante la interacción con el factor de von Willebrand en un proceso conocido como “adhesión”.
Además, al unirse las glicoproteínas de membrana de las plaquetas con el factor de von Willebrand, se inicia la degranulación de los gránulos de las plaquetas que contienen calcio, serotonina, fibrinógeno, factor de von Willebrand, fibronectina y P-selectina. Estos mediadores producen la “agregación” de nuevas plaquetas, que por medio de su unión dan lugar a la formación del tapón hemostático primaria y a un ambiente protrombótico.
La fijación del fibrinógeno fortalecerá el tapón plaquetario dando lugar a una red de fibrina-plaquetas. Además, una subpoblación de plaquetas liberará micropartículas que expresan fosfatidil-serina, las cuales servirán como estructura para la fijación de los factores de coagulación activados.
Mecanismos de Trombocitopenia
La trombocitopenia puede ocurrir por diferentes mecanismos, los cuales en ocasiones ocurren de manera simultánea dentro de una misma enfermedad:
- Disminución de la producción: puede ocurrir por fármacos, agentes infecciosos, mieloptisis o destrucción inmunomediada de megacariocitos.
- Consumo: ocurre en casos de coagulación intravascular diseminada (CID) por daño vascular masivo, septicemia, endotoxemia, necrosis tisular, fármacos procoagulantes, neoplasia o enfermedad infecciosa.
- Destrucción: es de naturaleza inmune y puede ser primaria (cuando no hay ninguna otra etiología que lo justifique), o secundaria a neoplasia, infección, inflamación, fármacos o toxinas.
- Secuestro: ocurre por esplenomegalia, hepatomegalia, neoplasia o endotoxemia.
- Pérdida excesiva: puede ocurrir en hemorragias masivas (p.ej. intoxicación por rodenticidas).
Actualización de la nomenclatura y l fisiopatología de la trombocitopenia inmune
En la literatura antigua, la TPI históricamente ha sido denominada púrpura trombocitopénica idiopática. Sin embargo, esta terminología fue considerada inapropiada por el Grupo de Trabajo Internacional de expertos en TPI humana ya que los signos de sangrado generalmente están ausentes o son mínimos en la mayoría de los pacientes2. La enfermedad fue renombrada como TPI para hacer énfasis en su fisiopatología autoinmune.
La TPI se trata de un síndrome complejo y heterogéneo que resulta de la combinación de una respuesta inmune humoral y celular frente a las plaquetas circulantes en sangre periférica y, en raras ocasiones, por la falta de producción de plaquetas por destrucción de los megacariocitos en la médula ósea (trombocitopenia amegakariocítica)3,4.
La presencia de autoanticuerpos frente a glicoproteínas en la superficie de las plaquetas determina la destrucción inmunomediada de dichas plaquetas principalmente en el bazo, produciendo trombocitopenia grave3. Sin embargo, la destrucción mediada por anticuerpos no es el único mecanismo, y los linfocitos T juegan un papel importante en la enfermedad 5-7.
Por un lado, existe un predominio de linfocitos proinflamatorios Th1, Th17 y Th22 que promueven la actividad macrofágica, el desarrollo de linfocitos B autorreactivos y la presencia de linfocitos T citotóxicos; mientras que, por otro lado, existe una disminución de los linfocitos T reguladores que mantienen la tolerancia frente a los antígenos y regulan la respuesta inmune3,8-10.
En raras ocasiones, el ataque ocurre también a nivel de los megacariocitos en la médula ósea, resultando en un descenso de la producción que agrava aún más la trombocitopenia11-12. Otro hallazgo reciente importante es que los niveles de trombopoyetina son “inapropiadamente normales” en la mayor parte de pacientes con TPI.
La trombopoyetina es el mayor regulador de la producción de plaquetas y es necesaria para la supervivencia, proliferación y diferenciación de megacariocitos a plaquetas. Es por ello que, en pacientes con TPI, la trombopoyetina debería estar aumentada. Sin embargo, la mayor parte de pacientes con TPI presentan niveles normales de trombopoyetina, impidiendo así una estimulación efectiva de la producción de plaquetas13-15. Como veremos posteriormente, este descubrimiento podría tener importantes implicaciones en las nuevas terapias de TPI.
Clasificación de la trombocitopenia inmune
El diagnóstico de TPI primaria es por exclusión, y deben descartarse todas aquellas otras causas de TPI secundaria. La TPI secundaria ocurre cuando se producen anticuerpos frente antígenos no plaquetarios depositados en la superficie de las plaquetas, y normalmente se asocia a fármacos, enfermedades infecciosas o inflamatorias, neoplasias u otros procesos inmunomediados.
En principio, cualquier fármaco tiene el potencial de producir TPI secundaria, sin embargo, antibióticos como sulfonamidas o cefalosporinas son los más frecuentes16. Existe también un caso anecdótico de un paciente con TPI, junto con anemia hemolítica y dermatitis neutrofílica después de la administración de carprofeno17.
La trombocitopenia asociada a agentes infecciosos es multifactorial, incluyendo mecanismos de consumo, destrucción inmune, vasculitis o secuestro. Los agentes infecciosos que se han asociado al desarrollo de anticuerpos anti-plaquetarios son Anaplasma spp., Babesia spp., Ehrlichia spp., leptospira spp y leishmania spp.18-21.
En un estudio, hasta un 10% de los pacientes con neoplasia presentaban trombocitopenia1. La asociación entre neoplasia y trombocitopenia suele ser también multifactorial por consumo secundario a sangrado del tumor, coagulación intravascular diseminada, secuestro en bazo, disminución de la producción por mieloptisis o destrucción inmune.
Algunas de las neoplasias en las que se han descrito anticuerpos anti-plaquetarios son el linfoma, hemangiosarcoma o sarcoma histiocítico18-19. Por último, algunas enfermedades inflamatorias tales como hepatitis crónica, pancreatitis o síndrome de respuesta inflamatorio sistémico, también se han asociado a la presencia de anticuerpos antiplaquetarios en perros trombocitopénicos18,19.
Presentación clínica
Aunque no se ha demostrado susceptibilidad genética, la TPI es más común en hembras de edad media y existe una clara predisposición racial con una sobrerrepresentación de Cocker Spaniels, Pastor Alemán, Caniche y Old English Sheepdogs18,22-26.
Dada la predisposición racial, es muy probable que factores genéticos influyan en la patogénesis de la TPI. Además, podrían existir ciertos desencadenantes infecciosos o ambientales, que hasta la fecha no han sido identificados3.
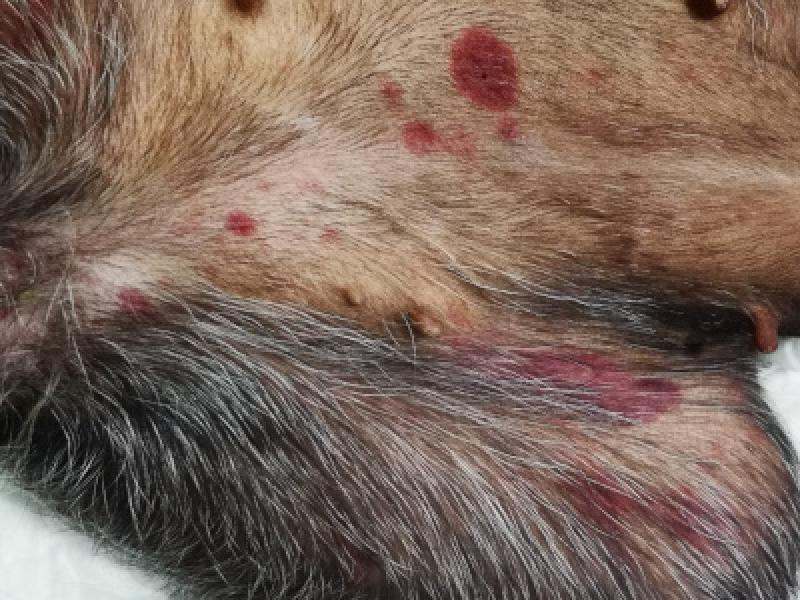
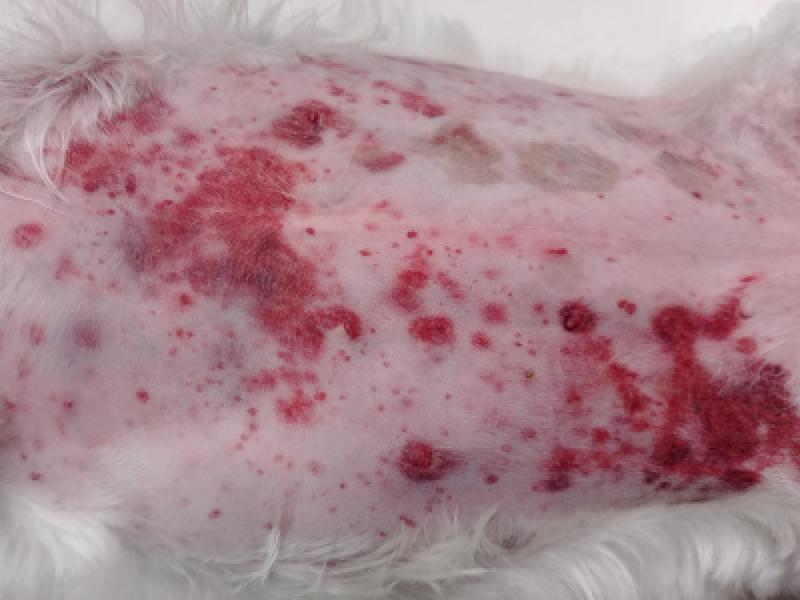
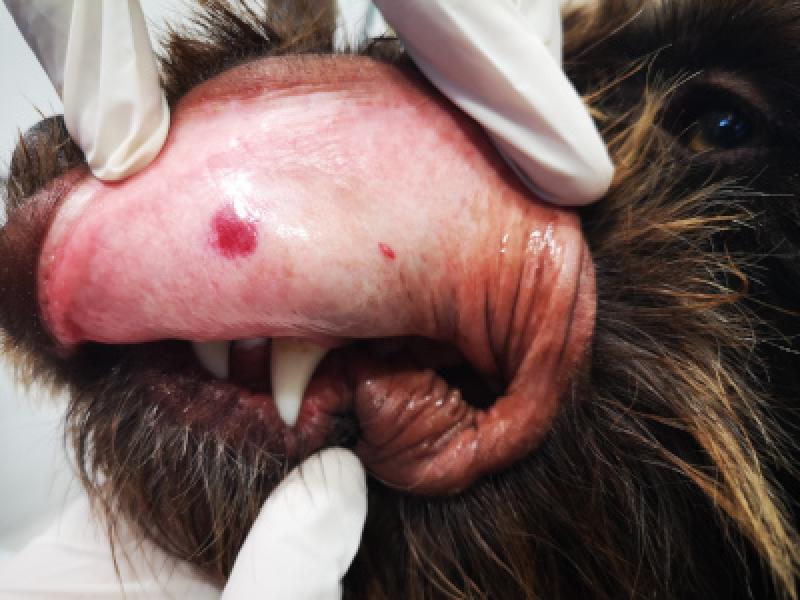
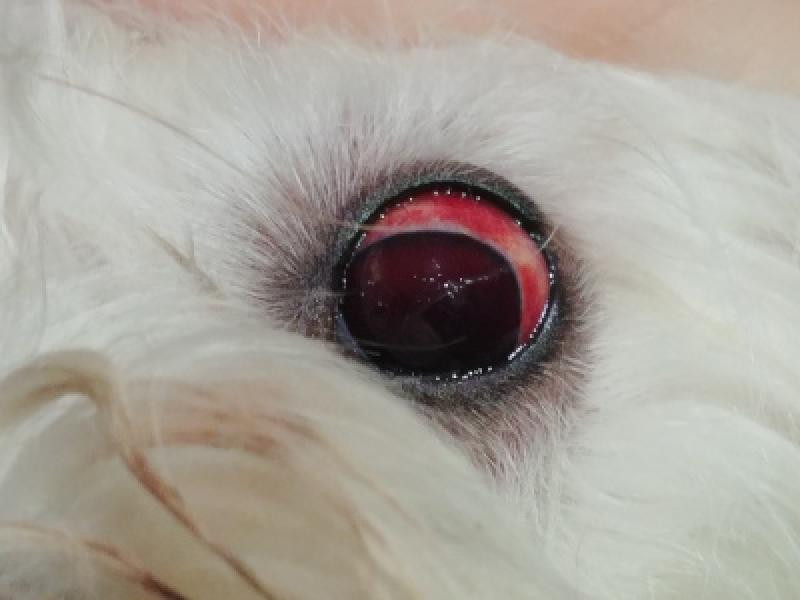
El sangrado de superficies mucosas es la característica principal de la TPI. El riesgo de sangrado espontáneo teóricamente aparece con recuentos plaquetarios < 30.000 plq/mcL. Se manifiesta mediante petequias, equimosis, hematomas, epistaxis, sangrado de la mucosa oral, melena, hematemesis, hemorragia intraocular, hematuria o sangrados prolongados tras traumatismo o venipunción
En ocasiones, el sangrado puede ser masivo manifestando signos de hipoxia e hipoperfusión (taquicardia, taquipnea, hipotensión, mucosas pálidas, retraso del tiempo de relleno capilar…). El sangrado también puede producirse en sistema nervioso central mostrando signos neurológicos24.
Aunque el sangrado cavitario es más propio de alteraciones de la hemostasia secundaria, en ocasiones puntuales se ha descrito la presencia de hemotórax, hemoabdomen o hemoartrosis18,19. No obstante, la TPI es una enfermedad heterogénea a nivel clínico4,29. No todos los pacientes con TPI sangrarán y otros lo harán excesivamente, y el recuento de plaquetas por sí solo no predice el riesgo de sangrado24,27.

Recientemente se ha descrito que las plaquetas también cumplen un rol fundamental en mantener la integridad del endotelio vascular y la estructura de los vasos sanguíneos. Las alteraciones en la integridad del endotelio vascular, junto con la presencia de anemia o inflamación, podrían ser los principales determinantes del riesgo de sangrado y los responsables la variabilidad en pacientes con recuentos plaquetarios similares28,29.
Protocolo diagnóstico
En medicina humana, la TPI se define como un recuento plaquetario inferior a 100.000 plq/mcL en ausencia de otras patologías que podrían estar asociadas a trombocitopenia30. Otros posibles mecanismos de trombocitopenia incluyen consumo de plaquetas, descenso de la producción, secuestro o perdida excesiva. Actualmente, no existe ninguna prueba diagnóstica de referencia o biomarcadores específicos de TPI. No obstante, existen numerosas pruebas con utilidad para guiar el diagnóstico, determinar la gravedad y predecir la respuesta al tratamiento.
El diagnóstico se basa en una combinación de la historia clínica, examen físico, pruebas clinicopatológicas de rutina y exclusión de otras posibles etiologías mediante pruebas de imagen y valoración de enfermedades infecciosas31. Además, la TPI primaria debe diferenciarse de TPI secundaria a infección, inflamación, fármacos o neoplasia.
- Recuento plaquetario: El recuento plaquetario es significativamente más bajo en perros con TPI que en otras causas de trombocitopenia1,19,29. Aunque existe solapamiento con otras causas, recuentos plaquetarios < 20000 plaquetas/mcL suelen ser indicativos de TPI primaria4. Incluso, al comparar TPI primaria y secundaria, el recuento plaquetario suele ser menor en TPI primaria1,29.Sin embargo, aunque la trombocitopenia es más grave en pacientes con TPI, es importante descartar otras etiologías con recuentos bajos tales como sepsis, CID o ehrlichiosis. Por lo general, el recuento plaquetario en el momento de admisión es un mal predictor del riesgo de sangrado, de la necesidad de transfusión, de la duración de hospitalización y de la supervivencia29. Es importante recordar que algunas razas como los galgos, y los Sighthounds en general, tienen de forma fisiológica recuentos plaquetarios por debajo de los valores de referencia para otras razas.
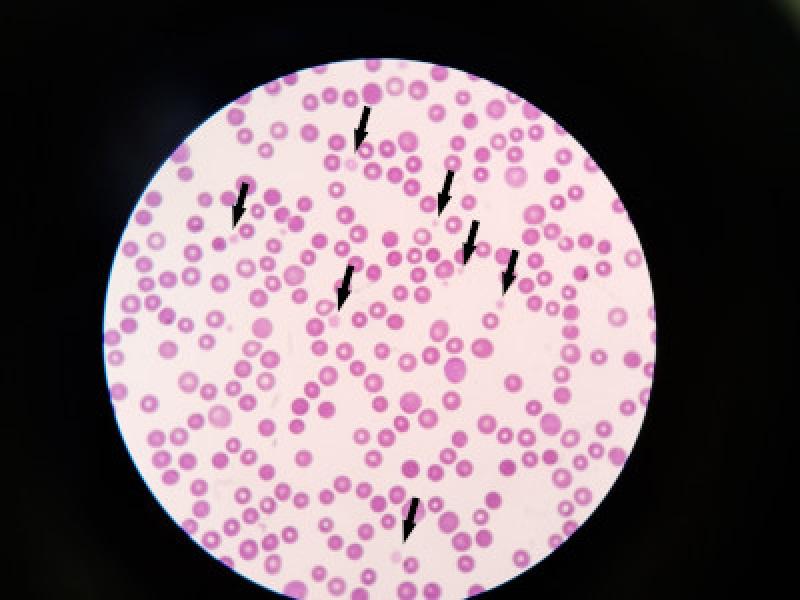
- Frotis sanguíneo: El primer paso es confirmar que la trombocitopenia es real mediante un recuento manual de plaquetas en el frotis sanguíneo. La presencia de agregados plaquetarios como consecuencia de la extracción o la presencia de plaquetas de mayor tamaño (ej. macrotrombocitopenia congénita) son dos de las causas más frecuentes de pseudotrombocitopenia. Ambas causas de falsa trombocitopenia se pueden observar en el borde de la pluma del frotis sanguíneo. Si se observan agregados plaquetarios, normalmente el recuento de plaquetas es suficiente para descartar hemorragia espontánea. Si no se observan agregados plaquetarios, el recuento manual puede estimarse multiplicando por 10.000-15.000 el recuento plaquetario medio en 10 campos de 100 aumentos en la zona de monocapa. De esta forma obtendremos el total de plaquetas por microlitro. La macrotrombocitopenia congénita se debe a una mutación en el gen tubulina beta-1 y ha sido identificada en el Cavalier King Charles Spaniel, Norfolk, Cairn Terrier y otras razas32. Estas razas presentarán plaquetas de mayor tamaño no detectables por los analizadores de impedancia, sin embargo, su función plaquetaria es normal. Varios laboratorios comerciales ofrecen pruebas de DNA que pueden ser utilizados para detectar dicha mutación.
- Tamaño y morfología plaquetaria: La presencia de plaquetas de mayor tamaño suele ser indicativo de respuesta regenerativa por parte de la médula ósea, mientras que plaquetas de tamaño normal indican falta de respuesta de la médula o falta de tiempo para la misma. Normalmente, las plaquetas circulantes presentan heterogenicidad de tamaño, y en los analizadores automáticos esta variabilidad puede medirse mediante el volumen plaquetario medio (MPV) y el ancho de distribución plaquetaria (PDW). Un incremento en MPV suele ser indicativo de la presencia de plaquetas jóvenes y más activas. Aunque existe controversia, los perros con TPI podrían tener significativamente mayor MPV que los perros sanos control33. Un estudio retrospectivo encontró que un MPV > 12 fL tuvo un 96% de valor predictivo positivo de presencia de una población megakariocítica en médula ósea normal o hiperplásica16. Por tanto, un incremento en MPV podría apoyar el diagnóstico de TPI, aunque un valor normal no descarta el diagnóstico.
- Plaquetas reticuladas: Las plaquetas recién liberadas de los megakariocitos contienen pequeñas cantidades de RNA y se denominan plaquetas reticuladas. La presencia de plaquetas reticuladas es un marcador de regeneración plaquetaria. Aunque dichas plaquetas técnicamente son difíciles de identificar, podrían ayudar a diferenciar trombocitopenias hipoproliferativas de coagulopatías de consumo y destrucción inmunomediada. Los analizadores automatizados más avanzados (ej. Sysmex XE y XN, Sysmex Corporation) permiten identificar plaquetas reticuladas en un parámetro denominado “fracción de plaquetas inmaduras” (IPF) o “porcentaje de plaquetas reticuladas”. Aunque podría existir solapamiento entre grupos, un estudio mostró un incremento en la IPF en pacientes con TPI respecto a pacientes con una disminución de la síntesis en la médula ósea34. Un estudio prospectivo determinó que una presencia de plaquetas reticuladas superior al 8% combinado con la presencia de anticuerpos plaquetarios era capaz de distinguir TPI primaria de otras causas de trombocitopenia con alta sensibilidad, pero con poca especificidad35. Además, la IPF puede ayudar a determinar si en un individuo concreto con TPI el mecanismo fisiopatológico es debido solamente a un incremento de la destrucción o además existe una disminución de la producción, lo que podría ayudar a determinar la terapia y monitorizar la respuesta de un paciente concreto36. Los tratamientos que estimulan la producción de plaquetas (ver más adelante) deberían incrementar la IPF, mientras que aquellos tratamientos que frenan la destrucción plaquetaria aumentarían el número de plaquetas sin un incremento sustancial de la IPF.
- Perfil de coagulación: La valoración de PT, aPTT, productos de degradación de la fibrina, D-dimeros, etc pueden ayudar a descartar coagulopatías de consumo o intoxicación por rodenticidas en pacientes con trombocitopenia grave. La presencia de CID aguda se suele caracterizar por un incremento de PT, aPTT y D-dimero, sin embargo, no se debe descartar una CID crónica en pacientes con parámetros de coagulación en valores de referencia y cuadro clínico compatible.
- Pruebas de imagen: La ecografía y la radiografía pueden emplearse para descartar neoplasia o focos de infección. La presencia de linfadenopatía, organomegalia, efusiones o masas debe ser analizada mediante citología, histopatología o cultivo.
- Discriminación entre TPI primaria y secundaria: En un estudio reciente, de 61 perros con trombocitopenia grave, 57% presentaron TPI primaria, 28% TPI secundaria [9.8% secundaria a neoplasia, 9,8% a enfermedad infecciosa, 5% a enfermedad hepática y 3% por exposición a fármacos] y un 15% tuvo trombocitopenia no inmunomediada por aplasia medular o coagulopatía de consumo29. La investigación de causas secundarias de TPI debe incluir una historia clínica detallada (fármacos, exposición a pulgas y garrapatas, viajes a zonas endémicas de enfermedades infecciosas…), hemograma, frotis sanguíneo, bioquímica sérica, análisis de orina, screening de enfermedades transmitidas por vectores y pruebas de imagen. Los agentes infecciosos que se han asociado al desarrollo de anticuerpos anti-plaquetarios son Anaplasma spp., Babesia spp., Ehrlichia spp., leptospira spp y leishmania spp.18-21. Algunas de las neoplasias en las que se han descrito anticuerpos anti-plaquetarios son el linfoma, hemangiosarcoma o sarcoma histiocítico18,19. Por último, algunas enfermedades inflamatorias tales como hepatitis crónica, pancreatitis o síndrome de respuesta inflamatorio sistémico, también se han asociado a la presencia de anticuerpos antiplaquetarios en perros trombocitopénicos18,19. En personas, se recomienda testar también de Helicobacter pylori ya que se ha descrito asociación a TPI y aproximadamente la mitad de los pacientes resuelven la TPI al erradicar a H. pylori37. Hasta la fecha no se han realizado estudios para determinar si H. pylori puede causar TPI secundaria en perros, pero podría ser interesante en aquellos pacientes con TPI y signos clínicos compatibles.
- Médula ósea: El estudio de médula ósea no es necesario en la evaluación inicial de pacientes con TPI no complicadas. Un estudio retrospectivo de perros con trombocitopenia concluyó que la citología de médula ósea no aporta información pronóstica o diagnóstica en perros con trombocitopenia grave38. Otro estudio en perros con TPI encontró que la presencia de hipoplasia megacariocítica no afectaba a la probabilidad de supervivencia o al tiempo hasta la remisión24. Sin embargo, un estudio reciente contradice a estos estudios al mostrar que la presencia de hipoplasia megacariocítica (trombocitopenia amegacariocítica) fue asociada a mayor sangrado, anemia y necesidad de transfusión, y menor supervivencia, considerándose un factor pronóstico grave39. Personalmente, realizo un estudio de médula ósea en aquellos pacientes con enfermedad refractaria en los primeros 7-10 días, presentaciones atípicas, presencia de múltiples citopenias (p. ej. trombocitopenia y anemia no regenerativa) o en pacientes geriátricos con posibles procesos linfoproliferativos, mieloproliferativos u otras alteraciones de la médula ósea. En caso de decidir realizar la valoración de la médula ósea, la trombocitopenia no es una contraindicación, incluso si ésta es grave.
- Anticuerpos antiplaquetarios: juegan un papel importante en la fisiopatología de la enfermedad, sin embargo, su valoración no suele incluirse en los protocolos de trabajo de TPI en medicina humana debido a la falta de sensibilidad y especificidad31. Las plaquetas expresan de forma habitual receptores de inmunoglobulinas que causan unión de anticuerpos inespecíficos y podrían dificultar la interpretación de un resultado positivo40,41. Dichos anticuerpos han sido bien documentados en casos de trombocitopenia inmunomediada secundaria a anaplasmosisis, babesiosis, ehrlichiosis, leishmaniasis, leptospirosis, sepsis, hepatitis, linfoma y sarcoma histiocítico, lo que limita la capacidad de la prueba para diferenciar entre TPI primaria y secundaria19. Además, el tiempo desde la toma de la muestra puede influir en el resultado y se ha observado el incremento de anticuerpos antiplaquetarios de 3-7 veces en muestras almacenadas 24-72 horas20. La sensibilidad podría ser también baja y dar lugar a la presencia de falsos negativos ya que no siempre el proceso está mediado por anticuerpos. En medicina humana, hasta un 40% de las TPI no presentan anticuerpos, probablemente porque la destrucción de las plaquetas está mediada por linfocitos T citotóxicos39. Un estudio prospectivo reciente de perros con trombocitopenia determinó que la sensibilidad y la especificidad de la valoración de IgG e IgM para distinguir la TPI primaria de otras causas de trombocitopenia fueron 76.5% y 65.5%, respectivamente35. Otro artículo en perros mostró que, aunque un 100% de los pacientes con TPI primaria presentó anticuerpos antiplaquetarios, hasta un 20% de pacientes con trombocitopenia asociada a neoplasia, fármacos, neoplasia o enfermedades inflamatorias presentaban también anticuerpos, con el consiguiente riesgo de falsos positivos de TPI primaria42. En este estudio, la nueva aparición de anticuerpos antiplaquetarios una vez el paciente estaba en remisión se asoció a la aparición de nuevas recidivas, por lo que la monitorización de los anticuerpos antiplaquetarios podría ayudar a detectar recidivas tempranas42.
- Trombopoyetina: En medicina humana, la medición de trombopeyetina en TPI ha demostrado que muchos pacientes presentan unos niveles “inapropiadamente normales”, cuando esta debería estar incrementada. Este concepto ha revolucionado el tratamiento de la TPI, ya que estos pacientes parecen responder a análogos de la trombopoyetina31. Además, la valoración de trombopoyetina podría tener un valor pronóstico; se ha propuesto que pacientes con un alto valor de trombopoyetina (> 95 pg/mL) solo presentan respuesta parcial o transitoria a los análogos de la trombopoyetina. Sin embargo, dicha valoración está disponible fundamentalmente en laboratorios de investigación en medicina humana, y no está actualmente disponible para medicina veterinaria
Tratamiento de la trombocitopenia inmune primaria
El objetivo del tratamiento será detener la hemorragia, detener la destrucción y tratar las complicaciones asociadas. Habitualmente, se ha basado en monoterapia con glucocorticoides o combinación con inmunosupresores de segunda línea. Sin embargo, los nuevos avances científicos sobre su patogenia en medicina humana han ampliado las opciones de tratamiento. Actualmente se considera una enfermedad que va más allá de una siempre destrucción mediada por anticuerpos, implicando además una activación de la inmunidad celular y una trombopoyesis inefectiva.
El descubrimiento de estos nuevos conceptos ha permitido incluir en el arsenal terapéutico nuevos fármacos como los análogos de la trombopoyetina, los cuales comienzan a utilizarse también en medicina veterinaria. En medicina humana, los tratamientos de primera línea más empleados son protocolos cortos de glucocorticoides e inmunoglobulina intravenosa; mientras que los tratamientos de segunda línea incluyen el rituximab (un anticuerpo monoclonal frente a la proteína CD20 de los linfocitos B), esplenectomía o agonistas de los receptores de la trombopoyetina.
- Inmunosupresión: Los glucocorticoides constituyen la primera línea de tratamiento con una recuperación del recuento plaquetario entre 5-15 días. Presentan una doble acción; inicialmente inhiben la destrucción plaquetaria por parte de los macrófagos y posteriormente inhiben la producción de anticuerpos por parte de los linfocitos B. Se puede emplear prednisona o prednisolona a 2 mg/kg/24h en perros de menos de 25kg, y a 40-60 mg/m2/24h en perros de más de 25 kg. La duración del tratamiento es variable, pero normalmente se suele recomendar una bajada progresiva de un 25% de la dosis cada 3-4 semanas, siendo necesarios 4-6 meses hasta retirarlos completamente. El principal inconveniente de los glucocorticoides es los numerosos efectos adversos a los que se asocia (especialmente en perros de más de 25kg) tales como poliuria/polidipsia (80-100%), polifagia (80%), jadeo (50-80%), atrofia muscular y letargia (30%), tromboembolismo, inmunosupresión e infecciones asociadas (infección de orina, bacteriuria subclínica, demodicosis, leishmaniasis, toxoplasmosis, neosporosis), redistribución de la grasa abdominal y abdomen péndulo, hepatomegalia, alopecia, pioderma, calcinosis cutis, exacerbación de fallo cardiaco congestivo o predisposición a diabetes mellitus y pancreatitis. En caso de que los efectos adversos asociados a glucocorticoides sean graves, se puede añadir un segundo inmunosupresor (ver inmunosupresores de 2ª línea más adelante) para disminuir la dosis de glucocorticoides mas rápido (p. ej. un 25% cada 2 semanas). La causa más frecuente de recidivas suele ser una bajada demasiado rápido de la terapia de corticoides o no valorar el recuento plaquetario antes de cada bajada de dosis. En caso de que la recidiva se produzca antes de la bajada de dosis de cortisona, se recomienda introducir un nuevo inmunosupresor; mientras que si la recidiva se produce tras bajar la dosis de cortisona podemos volver a la última dosis efectiva (en pacientes estables con recidivas leves), volver a la dosis inicial de 2 mg/kg/24h (en recidivas fulminantes) o incluir un segundo inmunosupresor. Tras conseguir una nueva remisión, comenzaremos una pauta de disminución de dosis más progresiva que la anterior (p. ej. doblar los intervalos entre bajadas de dosis).
Se ha demostrado que la vincristina (0,02 mg/kg IV en dosis única) y la inmunoglobulina humana intravenosa (0,5 g/kg IV en dosis única) aceleran la recuperación del recuento plaquetario en comparación con los glucocorticoides solos25,26,43. La vincristina podría incrementar el recuento plaquetario por varios mecanismos; inhibe la fagocitosis de las plaquetas, interfiere con la formación de anticuerpos antiplaquetarios y evita su unión a las plaquetas, acelera la liberación de plaquetas de los megacariocitos y estimula la trombopoyesis44. Mientras que la cortisona sola podría tardar 6,8 días en incrementar el recuento plaquetario por encima de 40.000 plq/mcL, la combinación de glucocorticoides y vincristina lo hizo en 4,9 días26. Un estudio mostró que la inmunoglobulina humana intravenosa junto con glucocorticoides acorta el tiempo de respuesta a 3,5 días frente a los 7,5 días necesarios con los glucocorticoides solos25. Otro estudio demostró que la administración de vincristina o inmunoglobulina humana está asociada a una recuperación más rápida del recuento plaquetario, a un cese más rápido de los signos clínicos y a un menor tiempo de hospitalización, aunque no encontró diferencias significativas en el tiempo de respuesta entre la inmunoglobulina humana y la vincristina (aproximadamente 2,5 días). Debido a que la vincristina es bastante más económica y a que raramente se asocia a efectos adversos, los autores concluyeron que se debía considerar como primera línea de tratamiento43. También se ha descrito el empleo de plasma rico en plaquetas pretratado previamente con vincristina en casos refractarios al resto de terapias. Los autores sugieren que la administración tradicional de vincristina intravenosa es eliminada rápidamente de circulación, y sugieren que administrar la vincristina por medio de plaquetas cargadas de vincristina podría maximizar su efectividad y minimizar los efectos secundarios. Para ello, administraron plasma rico en plaquetas al que previamente se había añadido la vincristina y se había dejado incubar 1 hora en oscuridad a 37ºC. De esta forma, la vincristina podría liberarse directamente en los macrófagos del sistema mononuclear fagocítico cuando éstos fagocitan las plaquetas cargadas de vincristina, maximizando así su acción45.
Existen pocos estudios que valoren inmunosupresores de 2ª línea más allá de los glucocorticoides, la vincristina y la inmunoglobulina humana. Se ha descrito el empleo de azatioprina, ciclosporina, mofetil micofenolato o leflunomida, pero hasta la fecha, ningún inmunosupresor o combinación de los mismos ha demostrado ningún beneficio en la supervivencia o la disminución del número de recidivas respecto al tratamiento con glucocorticoides18,24,26,46-48. En un estudio, el mofetil micofenolato fue empleado como monoterapia en 5 perros con contraindicación para el uso de glucocorticoides, consiguiendo remisión completa en todos ellos, con un tiempo de respuesta (> 50.000 plq/mcL) de 2-6 días y sin evidencia de recidiva durante un tiempo de seguimiento46. Otro estudio reciente comparó el tratamiento con mofetil micofenolato más glucocorticoides frente al tratamiento con ciclosporina más glucocorticoides, sin encontrar diferencias significativas entre ambos grupos en cuanto a tiempo de hospitalización y supervivencia a los 30 días (85% con mofetil micofenolato y 88% con ciclosporina) y a los 60 días (80% con mofetil micofenolato y 82% con ciclosporina)48.
La falta de conocimiento de factores pronósticos y gravedad en TPI hace que a la mayoría de los pacientes se le administre un tratamiento no individualizado con inmunosupresores a largo plazo. Los inmunosupresores a largo plazo se pueden asociar a importantes efectos secundarios, incluyendo mielosupresión y posibles infecciones secundarias que podrían llegar a ser fatales. En medicina humana, la mortalidad en pacientes graves con TPI que son inmunosuprimidos está igualmente representada por hemorragias refractarias como por infecciones secundarias a la inmunosupresión49. Esto ha puesto de manifiesto que quizás sería interesante llevar a cabo un tratamiento individualizado y valorar qué pacientes requieren realmente una terapia inmunosupresora agresiva durante largos periodos de tiempo. Mientras que en medicina veterinaria el objetivo habitual es normalizar el número de plaquetas, actualmente en medicina humana, la Sociedad Americana de hematología recomienda no tratar si el recuento plaquetario no es inferior a 30.000 plq/mcL o si no hay sangrado activo. Además, en ausencia de sangrado, recomiendan como objetivo terapéutico un recuento plaquetario de 30.000 plq/mcL. Tratar de conseguir un recuento plaquetario normal puede ser en ocasiones un objetivo poco razonable y que lleve a un sobretratamiento del paciente (sobredosificación o adición de inmunosupresores de segunda línea que no aporten beneficio adicional en controlar o evitar el sangrado)30. Es probable que en medicina veterinaria comencemos a aplicar también estos criterios en un futuro no muy lejano.

- Transfusión de plaquetas: Las transfusiones de plaquetas (plasma rico en plaquetas, concentrado de plaqueas o sangre entera fresca) tienen una utilidad limitada debido a la dificultad para incrementar el número de plaquetas en el paciente (incremento aproximado de 10.000-40.000 plq/mcL), su corto tiempo de almacenamiento (aproximadamente 5 días) y su corta vida media después de ser transfundidas (3-5 días). Sin embargo, podrían tener un beneficio transitorio en pacientes con sangrados activos que amenazan la vida (sangrado pulmonar o en sistema nervioso central), en pacientes con TPI que requieren un procedimiento invasivo o en pacientes con menos de 5.000-10.000 plq/mcL50,51. En estos casos, la transfusión de plaquetas podría aportar poder hemostático durante un corto periodo de tiempo y evitar el sangrado, a pesar de que el recuento plaquetario raramente incrementa. El concentrado de plaquetas se considera el hemoderivado de elección en personas trombocitopénicas pudiendo incrementar unas 10.000-40.000 plq/mcL en la siguiente hora de la transfusión, con una supervivencia in vivo del 80% a las 2 horas post-transfusión y una vida media de 3.5 días. Sin embargo, solo puede ser almacenado 5-7 días52,53. Las plaquetas liofilizadas podrían ser una buena alternativa en el futuro al permitir largos periodos de almacenamiento y presentar mayor concentración de plaquetas por unidad de volumen. El concentrado de plaquetas criopreservado podría ser otra opción para permitir el almacenamiento largos periodos de tiempo (6-12 meses) a -80ºC. El inconveniente es que durante la crioconservación existe una pérdida del 30% de plaquetas respecto al concentrado de plaquetas, la supervivencia in vivo es solo del 50% a las 2 horas post-transfusión y la vida media se acorta a 2 días52.
- Transfusión de concentrado de eritrocitos: Podría ser necesaria para resolver el estado de hipoxia e hipoperfusión en pacientes con sangrado de mucosas y anemia grave. Pero además, existen motivos adicionales para transfundir concentrado de eritrocitos en pacientes con trombocitopenia por la relación existente el valor hematocrito y la función plaquetaria. En medicina humana se sabe que una disminución del valor hematocrito de un 15% aumenta el tiempo de sangrado hasta un 60% (independientemente del recuento de plaquetas). Además, la corrección del valor hematocrito mediante transfusión corrige los tiempos de sangrado. Se cree que esto es debido a que un adecuado valor hematocrito desplaza a las plaquetas a la periferia y permite un flujo laminar, lo que aumenta la interacción de las plaquetas con el endotelio vascular y por tanto la función plaquetaria. Además, los eritrocitos transfundidos aportan ADP y ácido araquidónico que estimulan la producción de tromboxano y disminuyen el óxido nítrico, lo cual también mejorará la hemostasia primaria. Es por ello que en medicina humana se recomienda tratar a los pacientes con anemia y trombocitopenia con concentrado de eritrocitos hasta incrementar el valor hematocrito a 30-35% antes de transfundir plaquetas54.
- Acetato de desmopresina (0.3–1 µg/kg, diluido en 20-100 ml de suero salino y administrado en 20 minutos): Es un análogo de la vasopresina que se ha empleado por vía endovenosa para controlar el sangrado en pacientes con problemas de hemostasia primaria (principalmente con enfermedad de von Willebrand, disfunciones plaquetarias o en intoxicaciones por aspirina). Además de incrementar los niveles plasmáticos de factor de von Willebrand entre un 10-17%, el acetato de desmopresina mejora la función plaquetaria medida por PFA-100 y tromboelastografía, incrementa la liberación de factor VIII y de plasminógeno y acorta el tiempo de sangrado de la mucosa oral, por lo que podría ser empleado en un intento de detener el sangrado en pacientes con TPI52,55-57.
- Ácido tranexámico (10-15 mg/kg/8h): Se trata de un antifibrinolítico que impide la lisis del coágulo formado en respuesta al sangrado. Los antifibrinolíticos han demostrado evitar el sangrado, disminuir la pérdida de sangre y el uso de transfusiones de concentrado de eritrocitos. Aunque no existen estudios en pacientes con TPI, se ha empleado de manera empírica en pacientes con trombocitopenia persistente por mielodisplasia en un intento de disminuir el sangrado de mucosas58.
- Melatonina (3-6 mg/perro PO q 12h): La melatonina es una hormona producida en la glándula pineal que sincroniza el ambiente hormonal según el ciclo circadiano, con efecto antioxidante e inmunomodulador y que ha demostrado beneficio en humanos con TPI. Además, podría tener efecto estimulando la producción de megacariocitos e inhibiendo su apoptosis. Un estudio reciente sobre la administración de melatonina en perros sanos no demostró ningún efecto en la trombopoyesis, sin embargo, aún es necesario valorar su efecto inmunomodulador en una amplia población de pacientes con TPI59.
- Agonistas de los receptores de la trombopeyetina: Como se comentó anteriormente, la fisiología de la TPI no se basa exclusivamente en una destrucción inmune de las plaquetas, sino que además existe un déficit en la trombopoyesis en la mayor parte de los pacientes. Por lo tanto, los agonistas de los receptores de la trombopeyetina (romiplostim o eltrombopag) podrían tener un importante papel terapéutico estimulando la síntesis de plaquetas en pacientes refractarios o que no responden a la terapia estándar. El romiplostim (1–10 μg/kg SC una vez por semana) es bien tolerado por los perros sin evidencia de aumento del riesgo de trombosis o desarrollo de anticuerpos frente a la trombopoyetina natural, y podría aumentar la respuesta al tratamiento. Parece que el incremento de plaquetas podría iniciarse tan solo 2 días después de la primera inyección. La media de duración del tratamiento en medicina humana es de 60 semanas, aunque la duración en perros se desconoce60. Eltrombopag es un análogo de la trombopoyetina que puede tener efecto estimulador en las 3 líneas celulares y que recientemente ha sido empleado con éxito y sin nuevas recidivas en un paciente con pancitopenia aplásica idiopática que no respondía a glucocorticoides y ciclosporina61.
- Esplenectomía: En casos de múltiples recidivas se puede considerar esplenectomía como último recurso. La esplenectomía se ha empleado en medicina humana con altas tasas de supervivencia. No obstante, la esplenectomía también evita la hematopoyesis extramedular y en ciertos casos podría ser contraproducente. Previamente a la esplenectomía se debe descartar la presencia de infecciones subclínicas (p.ej. babesiosis y mycoplasmosis). En medicina veterinaria existe poca evidencia científica sobre su utilidad y solo ha sido estudiado superficialmente en pacientes con anemia hemolítica inmunomediada.
- Gastroprotectores: debido a que el tracto gastrointestinal es uno de los sitios más comunes de sangrado en pacientes con TPI, los gastroprotectores se han empleado con frecuencia en la clínica diaria. Sin embargo, debido a que la presencia de verdaderas úlceras es poco frecuente en estos pacientes y a que el cambio de pH podría alterar la absorción de algunos fármacos (p.ej. mofetil micofenolato), su uso es cuestionable.
- Antimicrobianos: En determinados pacientes puede ser necesario el empleo de antimicrobianos de forma empírica hasta obtener los resultados de las pruebas de enfermedades infecciosas. Usaremos doxiciclina en pacientes con alto riesgo de ehrlichiosis o anaplasmosis; propionato de imidocarb en pacientes con alto riesgo de babesiosis; o ampicilina en pacientes con alto riesgo de leptospirosis.
Predictores de gravedad y pronóstico
Una cuestión sin resolver es la gran variabilidad en la tendencia al sangrado en pacientes con TPI. La capacidad para identificar pacientes con riesgo de sangrado grave o recidivas permitiría la individualización de la intensidad de la terapia. Tanto en medicina humana como en medicina veterinaria, el recuento plaquetario es considerado como un mal predictor del riesgo de sangrado, necesidad de transfusión, tiempo de hospitalización o de mortalidad24,29.
En medicina humana, algunas valoraciones de la hemostasia como la valoración de la función plaquetaria por citometría de flujo, la tromboelastografía, la IPF o el incremento de expresión de P-selectina se han mostrado prometedoras en la capacidad para predecir sangrado, y han sido empleadas para individualizar la terapia del paciente39,62.
También en medicina humana, para valorar el riesgo de sangrado, se ha desarrollado una escala de valoración de sangrado específica para TPI (“ITP‐specific Bleeding Assessment Tool” or ITP‐BAT)2. Dicho sistema de puntuación categoriza el sangrado según sea en piel, mucosa u orgánico, y aplica una puntuación numérica basado en la gravedad de la hemorragia.
Dicha escala ha sido adaptada a veterinaria (DOGiBAT) para permitir la estratificación de los pacientes en función del grado de sangrado independientemente del recuento plaquetario y para poder monitorizar la respuesta al tratamiento en función de una clasificación objetiva. Esta escala de valoración clasifica el sangrado entre cero (sin sangrado) y dos (sangrado grave) en nueve sitios anatómicos.
Esta puntuación se considera fácil de realizar y se ha correlacionado con la necesidad de transfusión y la duración de la hospitalización, por lo que podría ser usado como indicador pronóstico29. Aunque pocos estudios han evaluado los factores pronósticos, existe la sensación clínica que aquellos pacientes con sangrados masivos o signos neurológicos presentan peor pronóstico. En un estudio retrospectivo en perros, la presencia de melena y un incremento del BUN en el momento del ingreso se asoció a una menor supervivencia (60%) comparado con los pacientes con el BUN dentro de referencia (90%)24.
Por lo general, el pronóstico suele ser bueno con tratamiento apropiado y cuidados de soporte, incluyendo trasfusión en pacientes con anemia grave. La supervivencia a corto plazo es del 70-93%, con tasas de recidiva del 26-58%18,24,63. En un estudio reciente, un 89% de los pacientes sobrevivieron al alta, un 86% consiguieron remisión y un 31% de pacientes recidivaron con el tiempo62.
Además, un 50% de los perros que presentaron una recidiva, posteriormente presentaron al menos otra recidiva más. La recidiva inicial ocurrió tras un tiempo medio de 79 días, y la probabilidad de recidiva en perros que estaban en remisión a los 90 y 180 días fue solo del 15% y 11% respectivamente. Algunos factores ocurridos durante la hospitalización influyeron en el riesgo de recidiva; aquellos pacientes que requirieron transfusión durante la hospitalización o necesitaron un mayor tiempo hasta la respuesta al tratamiento, presentaron un mayor riesgo de recidiva. Por tanto, una presentación más grave en el momento de admisión podría incrementar el riesgo de recidiva y requieren un seguimiento más constante63.
Bibliografía
- Grindem CB, Breitschwerdt EB, Corbett WT, Jans HE. Epidemiologic survey of thrombocytopenia in dogs: a report on 987 cases. Vet Clin Pathol. 1991;20(2):38‐43.
- Rodeghiero F, Stasi R, Gernsheimer T, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group. Blood. 2009;113(11):2386‐2393.
- Consolini R, Legitimo A, Caparello MC. The centenary of immune thrombocytopenia—Part 1: revising nomenclature and pathogenesis. Front Pediatr. 2016;4:102.
- Cooper SA, Huang AA, Raskin RE, Weng HY, Scott‐Moncrieff JC. Clinical data, clinicopathologic findings and outcome in dogs with amegakaryocytic thrombocytopenia and primary immune‐mediated thrombocytopenia. J Small Anim Pract. 2016;57(3):142‐147.
- Panitsas FP, Theodoropoulou M, Kouraklis A, et al. Adult chronic idiopathic thrombocytopenic purpura (ITP) is the manifestation of a type‐1 polarized immune response. Blood. 2004;103(7):2645‐2647.
- Semple JW, Milev Y, Cosgrave D, et al. Differences in serum cytokine levels in acute and chronic autoimmune thrombocytopenic purpura: relationship to platelet phenotype and antiplatelet T‐cell reactivity. Blood. 1996;87(10):4245‐4254.
- Zhang F, Chu X, Wang L, et al. Cell‐mediated lysis of autologous platelets in chronic idiopathic thrombocytopenic purpura. Eur J Haematol. 2006;76(5):427‐431.
- Ji L, Zhan Y, Hua F, et al. The ratio of Treg/Th17 cells correlates with the disease activity of primary immune thrombocytopenia. PLoS ONE. 2012;7(12):e50909.
- Li X, Zhong H, Bao W, et al. Defective regulatory B‐cell compartment in patients with immune thrombocytopenia. Blood. 2012;120(16):3318‐3325.
- Volkmann M, Hepworth MR, Ebner F, Rausch S, Kohn B, Hartmann S. Frequencies of regulatory T cells in the peripheral blood of dogs with primary immune‐mediated thrombocytopenia and chronic enteropathy: a pilot study. Vet J. 2014;202(3):630‐633.
- Zufferey A, Kapur R, Semple JW. Pathogenesis and therapeutic mechanisms in immune thrombocytopenia (ITP). J Clin Med. 2017;6(2):16.
- Iraqi M, Perdomo J, Yan F, Choi PY, Chong BH. Immune thrombocytopenia: antiplatelet autoantibodies inhibit proplatelet formation by megakaryocytes and impair platelet production in vitro. Haematologica. 2015;100(5):623‐632.
- Aledort LM, Hayward C, Chen M‐G, Nichol JL, Bussel J. Prospective screening of 205 patients with ITP, including diagnosis, serological markers, and the relationship between platelet counts, endogenous thrombopoietin, and circulating antithrombopoietin antibodies. Am J Hematol. 2004;76(3):205‐213.
- Chang M, Qian JX, Lee SM, et al. Tissue uptake of circulating thrombopoietin is increased in immune‐mediated compared with irradiated thrombocytopenic mice. Blood. 1999;93(8):2515‐2524.
- Grozovsky R, Begonja AJ, Liu K, et al. The Ashwell‐Morell receptor regulates hepatic thrombopoietin production via JAK2‐STAT3 signaling. Nat Med. 2015;21(1):47‐54.
- Sullivan PS, Manning KL, McDonald TP. Association of mean platelet volume and bone marrow megakaryocytopoiesis in thrombocytopenic dogs: 60 cases (1984–1993). J Am Vet Med Assoc. 1995;206(3):332‐334.
- Mellor PJ, Roulois AJA, Day MJ, et al. Neutrophilic dermatitis and immune-mediated haematological disorders in a dog: suspected adverse reaction to carprofeno. J Small Anim Pract. 2005;46:237-242
- Putsche JC, Kohn B. Primary immune‐mediated thrombocytopenia in 30 dogs (1997–2003). J Am Anim Hosp Assoc. 2008;44(5):250‐257.
- Dircks BH, Schuberth HJ, Mischke R. Underlying diseases and clinicopathologic variables of thrombocytopenic dogs with and without platelet‐bound antibodies detected by use of a flow cytometric assay: 83 cases (2004–2006). J Am Vet Med Assoc. 2009;235(8):960‐966.
- Wilkerson MJ, Shuman W, Swist S, Harkin K, Meinkoth J, Kocan AA. Platelet size, platelet surface‐associated IgG, and reticulated platelets in dogs with immune‐mediated thrombocytopenia. Vet Clin Pathol. 2001;30(3):141‐149.
- Terrazzano G, Cortese L, Piantedosi D, et al. Presence of anti‐platelet IgM and IgG antibodies in dogs naturally infected by Leishmania infantum. Vet Immunol Immunopathol. 2006;110(3–4):331‐337.
- Botsch V, Kuchenhoff H, Hartmann K, Hirschberger J. Retrospective study of 871 dogs with thrombocytopenia. Vet Rec. 2009;164(21):647‐651.
- Huang AA, Moore GE, Scott‐Moncrieff JC. Idiopathic immunemediated thrombocytopenia and recent vaccination in dogs. J Vet Intern Med. 2012;26(1):142‐148.
- O'Marra SK, Delaforcade AM, Shaw SP. Treatment and predictors of outcome in dogs with immune‐mediated thrombocytopenia. J Am Vet Med Assoc. 2011;238(3):346‐352.
- Bianco D, Armstrong PJ, Washabau RJ. A prospective, randomized, double‐blinded, placebo‐controlled study of human intravenous immunoglobulin for the acute management of presumptive primary immune‐mediated thrombocytopenia in dogs. J Vet Intern Med. 2009;23(5):1071‐1078.
- Rozanski EA, Callan MB, Hughes D, Sanders N, Giger U. Comparison of platelet count recovery with use of vincristine and prednisone or prednisone alone for treatment for severe immune‐mediated thrombocytopenia in dogs. J Am Vet Med Assoc. 2002;220(4):477‐481.
- Page LK, Psaila B, Provan D, et al. The immune thrombocytopenic purpura (ITP) bleeding score: assessment of bleeding in patients with ITP. Br J Haematol. 2007;138(2):245‐248.
- LeVine DN, Makielski KM, Jeffery U, Hayward J, Brooks M. Canine immune thrombocytopenia: A translational model to fill the gaps in the genetic and environmental triggers of adult ITP [abstract]. Blood. 2016;128:2553.
- Makielski KM, Brooks MB, Wang C, Cullen JN, O'Connor AM, LeVine DN. Development and implementation of a novel immune thrombocytopenia bleeding score for dogs. J Vet Intern Med. 2018;32(3):1041‐1050.
- Neunert C, Lim W, Crowther M, Cohen A, Solberg L, Crowther MA. The American Society of Hematology 2011 evidencebased practice guideline for immune thrombocytopenia. Blood. 2011;117(16):4190‐4207.
- Provan D, Stasi R, Newland AC, et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood. 2010;115(2):168‐186.
- Gelain ME, Bertazzolo W, Tutino G, et al. A novel point mutation in the beta1‐tubulin gene in asymptomatic macrothrombocytopenic Norfolk and Cairn Terriers. Vet Clin Pathol. 2014;43(3):317‐321.
- Schwartz D, Sharkey L, Armstrong PJ, Knudson C, Kelley J. Platelet volume and plateletcrit in dogs with presumed primary immune‐mediated thrombocytopenia. J Vet Intern Med. 2014;28(5):1575‐1579.
- Cybulska A, Meintker L, Ringwald J, Krause SW. Measurements of immature platelets with haematology analysers are of limited value to separate immune thrombocytopenia from bone marrow failure. Br J Haematol. 2017;177(4):612‐619.
- Bachman DE, Forman MA, Hostutler RA, Corn S, Lin JuiMing, Kociba GJ. Prospective diagnostic accuracy evaluation and clinical utilization of a modified assay for platelet‐associated immunoglobulin in thrombocytopenic and nonthrombocytopenic dogs. Vet Clin Pathol. 2015;44(3):355‐368.
- Barsam SJ, Psaila B, Forestier M, et al. Platelet production and platelet destruction: assessing mechanisms of treatment effect in immune thrombocytopenia. Blood. 2011;117(21):5723‐5732.
- Frydman GH, Davis N, Beck PL, Fox JG Helicobacter pylori eradication in patients with immune thrombocytopenic purpura: a review and the role of biogeography. Helicobacter. 2015;20(4):239‐251.
- Miller MD, Lunn KF. Diagnostic use of cytologic examination of bone marrow from dogs with thrombocytopenia: 58 cases (1994– 2004). J Am Vet Med Assoc. 2007;231(10):1540‐1544.
- Cooper N. State of the art—how I manage immune thrombocytopenia. Br J Haematol. 2017;177(1):39‐54.
- Porcelijn L, Huiskes E, Oldert G, Schipperus M, Zwaginga JJ, de Haas M. Detection of platelet autoantibodies to identify immune thrombocytopenia: state of the art. Br J Haematol. 2018;182(3):423‐426.
- Tomer A, Koziol J, McMillan R. Autoimmune thrombocytopenia: flow cytometric determination of platelet‐associated autoantibodies against platelet‐specific receptors. J Thromb Haemost. 2005;3(1):74‐78.
- Shropshire S, Dow S, Lappin M. Detection and dynamics of anti-platelet antibodies in thrombocytopenic dogs with and without idiopathic immune thrombocytopenia. J Vet Intern Med. 2020;1–10.
- Balog K, Huan AA, Sum SO, et al. A prospective randomized clinical trial of vincristine versus human intravenous immunoglobulin for acute adjunctive management of presumptive primary immune-mediated thrombocytopenia in dogs. J Vet Intern Med. 2009;27: 536-541
- Ahn YS, Byrnes JJ, Harrington WJ, Cayer ML, Smith DS, Brunskill DE, Pall LM. The treatment of idiopathic thrombocytopenia with vinblastine-loaded platelets. N Engl J Med 1978, 298, 1101-1107.
- Park HJ, Kim JW, Song KH, Seo KW. Application of vincristine-loaded platelet therapy in three dogs with refractory immune-mediated thrombocytopenia. J Vet Sci. 2015;16(1):127‐130.
- Yau VK, Biando D. Treatment of five haemodynamically stable dogs with immune-mediated thrombocytopenia using mycophenolate mofetil as single agent. J Small Anim Pract. 2014;55:330-333
- Sato M, Veir JK, Legare M, Lappin MR. A Retrospective Study on the Safety and Efficacy of Leflunomide in Dogs. J Vet Intern Med. 2017;31(5):1502‐1507.
- Cummings FO, Rizzo SA. Treatment of presumptive primary immune-mediated thrombocytopenia with mycophenolate mofetil versus cyclosporine in dogs. J Small Anim Pract. 2017;58(2):96‐102.
- Portielje JE, Westendorp RG, Kluin‐Nelemans HC, Brand A. Morbidity and mortality in adults with idiopathic thrombocytopenic purpura. Blood. 2001;97(9):2549‐2554.
- Greeno E, McCullough J, Weisdorf D. Platelet utilization and the transfusion trigger: a prospective analysis. Transfusion 2007; 47(2):201–205.
- Blajchman MA, Slichter SJ, Heddle NM, et al. New strategies for the optimal use of platelet transfusions. Hematol Am Soc Hematol Educ Program 2008; 2008(1):198–204.
- CallanMB, Appleman EH, Sachais BS. Canine platelet transfusions. J Vet Emerg Crit Care 2009; 19(5):401–415.
- Abrams-Ogg AC. Triggers for prophylactic use of platelet transfusions and optimal platelet dosing in thrombocytopenic dogs and cats. Vet Clin North Am Small Anim Pract 2003; 33(6):1401–1418.
- Spann AP, Campbell JE, Fitzgibbon SR, et al. The Effect of Hematocrit on Platelet Adhesion: Experiments and Simulations. Biophys J. 2016;111(3):577‐588.
- Callan MB, Giger U. Effect of desmopressin acetate administration on primary hemostasis in Doberman pinscher with type-1 von Willebrand disease as assessed by a point-of care instrument. Am J Vet Res. 2002; 63:1700-1706
- Levi M, Eerenberg E, Kamphuisen PW. Bleeding risk and reversal strategies for old and new anticoagulants and antiplatelet agents. J Thromb Haemost 2011; 9(9):1705–1712.
- McMillianWD, Rogers FB. Management of prehospital antiplatelet and anticoagulant therapy in traumatic head injury: a review. J Trauma 2009; 66(3):942–950.
- Vijenthira A, Premkumar D, Callum J, et al. The management and outcomes of patients with myelodysplastic syndrome with persistent severe thrombocytopenia: An observational single centre registry study. Leuk Res. 2019;76:76‐81.
- Chen M, Stone R. Lack of Effect of Oral Melatonin on Platelet Parameters in Normal Healthy Dogs. J Am Anim Hosp Assoc. 2019;55(5):226‐230.
- Kohn B, Bal G, Chirek A, Rehbein S, Salama A. Treatment of 5 dogs with immune-mediated thrombocytopenia using Romiplostim. BMC Vet Res. 2016;12:96.
- Kelly D, Lamb V, Juvet F. Eltrombopag treatment of a dog with idiopathic aplastic pancytopenia. J Vet Intern Med. 2020;34(2):890‐892.
- Greene LA, Chen S, Seery C, Imahiyerobo AM, Bussel JB. Beyond the platelet count: immature platelet fraction and thromboelastometry correlate with bleeding in patients with immune thrombocytopenia. Br J Haematol. 2014;166(4):592‐600.
- Simpson K, Chapman P, Klag A. Long-term outcome of primary immune-mediated thrombocytopenia in dogs. J Small Anim Pract. 2018;59(11):674‐680.
 by Multimédica
by Multimédica