Cáncer mamario canino: alternativas terapéuticas en pacientes positivos a marcadores de mal pronóstico
Resumen breve
El cáncer mamario canino representa una de las neoplasias más comunes en hembras adultas. Su tratamiento se complejiza en presencia de marcadores de mal pronóstico como VEGF, COX-2, Ki-67, p53, RE, RP y el protooncogen HER-2/neu. Este trabajo evaluó alternativas terapéuticas aplicadas a 12 pacientes caninas con neoplasias mamarias malignas, analizando la expresión de dichos marcadores mediante inmunohistoquímica.Índice de contenidos

Resumen
El cáncer mamario canino representa una de las neoplasias más comunes en hembras adultas. Su tratamiento se complejiza en presencia de marcadores de mal pronóstico como VEGF, COX-2, Ki-67, p53, RE, RP y el protooncogen HER-2/neu. Este trabajo evaluó alternativas terapéuticas aplicadas a 12 pacientes caninas con neoplasias mamarias malignas, analizando la expresión de dichos marcadores mediante inmunohistoquímica. Se compararon protocolos convencionales de quimioterapia con tratamientos alternativos que incluyeron esquemas metronómicos, antiinflamatorios no esteroideos (AINE) y agentes antiangiogénicos. Los resultados demostraron una mayor mediana de supervivencia en los pacientes tratados con protocolos alternativos (400 días) respecto a los convencionales (170 días), siendo estadísticamente significativa (p = 0.001). Estos hallazgos refuerzan la importancia del enfoque personalizado basado en biomarcadores tumorales. El uso de terapias dirigidas a la inhibición de la angiogénesis y la proliferación celular, como los inhibidores de tirosina quinasa (RTK) e inhibidores de COX-2 (AINE), se perfila como una estrategia prometedora para mejorar el pronóstico y la calidad de vida de pacientes caninos con tumores mamarios de alto riesgo. Se concluye que es fundamental continuar investigando con mayor tamaño muestral para validar la eficacia de estas estrategias terapéuticas.
Palabras clave: cáncer mamario canino, antiangiogénicos, inhibidores de COX-2
Summary
Canine mammary cancer is one of the most common neoplasms in adult female dogs. Its treatment becomes more complex when poor prognosis biomarkers are present, such as VEGF, COX-2, Ki-67, p53, ER, PR, and the HER-2/neu proto-oncogene. This study evaluated therapeutic alternatives in 12 female dogs with malignant mammary tumors by analyzing the expression of these markers through immunohistochemistry. Conventional chemotherapy protocols were compared to alternative treatments including metronomic regimens, nonsteroidal anti-inflammatory drugs (NSAIDs), and anti-angiogenic agents. Results showed a higher median survival in patients receiving alternative protocols (400 days) compared to conventional ones (170 days), with statistical significance (p = 0.001). These findings highlight the importance of personalized treatment based on tumor biomarkers. Targeted therapies aimed at angiogenesis inhibition and cellular proliferation, such as tyrosine kinase inhibitors (RTKs) and inhibition of COX-2 (NSAIDs), appear to be a promising strategy to improve prognosis and quality of life in high-risk canine mammary tumors. The study concludes that further research with larger patient samples is necessary to validate the effectiveness of these therapeutic strategies.
Keywords: canine mammary cancer, inhibition of angiogénesis, inhibition of COX-2
Introducción
Los esquemas terapéuticos deberían ajustarse a índices pronósticos, que permitan agrupar a los pacientes con factores de riesgo similares para crear un modelo predictivo de evolución a partir de las variables de mayor peso presentes al momento del diagnóstico. Dentro de las opciones terapéuticas en el cáncer mamario en caninos la cirugía sigue siendo, en muchos casos, la primera opción de tratamiento altamente eficaz para el control regional del tumor. La posterior evaluación histopatológica e inmunohistoquímica permite determinar el tipo tumoral y la presencia de biomarcadores de mal pronóstico2,9,12.El factor de crecimiento endotelial vascular (VEGF), la enzima ciclooxigenasa (COX-2), la amplificación y/o sobreexpresión del protooncogen HER-2/neu, la expresión de Ki-67, p53 y receptores hormonales para estrógenos (RE) y progesterona (RP) son los biomarcadores detectados con mayor frecuencia en cáncer mamario canino2,6,9,18.
El VEGF es un importante regulador de la angiogénesis y de la permeabilidad vascular. La angiogénesis es un proceso esencial en el tumor primario para crecer e invadir estructuras adyacentes. El grado de densidad microvascular intratumoral refleja la actividad angiogénica generada por las células neoplásicas y el estroma1,7,10,18.Es considerado el mitógeno más potente para células endoteliales y está inducido por rutas de señalización transformante y por la hipoxia tumoral. Varios tipos de células del estroma tumoral contribuyen en el proceso angiogénico. Las células endoteliales secretan factores angiogénicos que afectan al estado de activación del endotelio y su diferenciación dentro de los vasos maduros. Los macrófagos y mastocitos que infiltran el tumor producen factores angiogénicos como VEGF, factor de crecimiento fibroblástico (FGF-2), interleucina-8 (IL-8), y metaloproteínas (MMPs) que promueven el crecimiento tumoral en todas sus etapas. Células inmunes y fibroblastos anormales asociados al cáncer pueden generar factores que actúan como proangiogénicos del mismo modo que algunas citoquinas modulan la matriz extracelular estimulando a las células tumorales1,6,7,10.
La enzima ciclooxigenasa (COX) controla la síntesis de prostaglandinas (PG) a partir del ácido araquidónico de las membranas celulares1,8.La COX-2 (inducible) no se encuentra en la mayoría de los tejidos y puede ser inducida por hipoxia, factores de crecimiento, estímulos inflamatorios y varios oncogenes1,6,8.Las PG que genera pueden, mediante varios mecanismos, inducir en algunas neoplasias la resistencia a la apoptosis, la proliferación, el incremento de la angiogénesis, la invasión y la inmunosupresión8. La sobreexpresión de COX-2 está correlacionada de forma positiva con el aumento de la densidad capilar en las neoplasias mamarias en caninos, así como también con un mal pronóstico y un periodo corto de sobrevida1,6,18.
El estudio de la angiogénesis permite evaluar el riesgo de metástasis y la posible recidiva y mejora la predicción del tiempo de sobrevida libre de enfermedad. Se analiza junto con otros factores que influyen en el pronóstico como el estado de los receptores para estrógenos (RE) y progesterona (RP), la expresión de Ki-67, el protooncogen HER-2/neu y el gen p531,5,11,13,14.
La evaluación de los RE y RP en medicina humana identifica a aquellos pacientes que podrán beneficiarse con la terapia adyuvante endocrina. Su presencia se asocia a mayor supervivencia y menores posibilidades de recidivas. En medicina veterinaria, bajos niveles de RE en tumores malignos primarios se asociaron con ocurrencias de metástasis5,18.
Los marcadores de proliferación celular, como el Ki-67, tiene utilidad pronóstica en el cáncer mamario canino del mismo modo que en medicina humana. Altos porcentajes de Ki-67 se correlacionan con el grado de diferenciación histológica, invasión vascular, posibilidad de metástasis, recurrencia temprana con corta sobrevida y se correlaciona inversamente con la presencia de RE y RP5,6,13,14.
El protooncogen HER-2/neu codifica una glucoproteína que actúa como receptora de membrana celular y capta las señales de proliferación, específicamente, al factor de crecimiento epitelial5,18. En medicina humana de un 20 a un 30 % aproximadamente de los cánceres de mama tienen amplificado y/o sobreexpresado al protooncogen HER-2/neu. Esto se correlaciona con incrementos en las tasas de proliferación con elevados niveles de Ki67, lo que lleva a una rápida progresión de la enfermedad con un comportamiento más agresivo, independencia hormonal y, en algunos estudios, aumento de la resistencia a determinados agentes quimioterápicos y mayor riesgo de metástasis5,6,13,14. También se ha demostrado que el HER-2/neu juega un importante papel en la carcinogénesis de la glándula mamaria canina y revela que no se expresa en glándulas mamarias normales mientras que si es expresado en tumores mamarios benignos y malignos5,6.
El gen p53 es un gen supresor que advierte la presencia de ADN dañado provocando un arresto en G1 e induciendo a su reparación o apoptosis. El 40 % de los carcinomas de mama en medicina humana presentan el gen p53 mutado mientras que en medicina veterinaria entre el 15 y el 30 %11,13.La mutación p53 se asocia a tumores mamarios con altos grados histológicos, elevados índices de proliferación y expresión de Ki67, receptores hormonales negativos y corta sobrevida global y libre de enfermedad5,11,13,14.
La evaluación de estos marcadores tumorales se suma a los estudios histopatológicos y a los análisis hematológicos y bioquímicos realizados de rutina a pacientes caninos con cáncer mamario con el objetivo de mejorar la terapéutica a emplear en cada caso. Opciones terapéuticas como la quirúrgica y la quimioterapia pueden ser beneficiosas ya sea como tratamiento primario en pacientes con marcadores como Ki67, HER-2/neu y p53 negativos o en combinación en los casos positivos a uno o más marcadores de mal pronóstico2,5,9,11,13,18. En neoplasias mamarias muy avanzadas con linfoadenopatías fijas a los tejidos circundantes, la resección quirúrgica resulta dificultosa. La quimioterapia administrada como neoadyuvante permite disminuir el tamaño tumoral y volverlo resecable2,9.Por otro lado, los casos en donde la resección quirúrgica ha sido completa pero se trata de neoplasias con un alto poder metastásico por el tipo tumoral y/o la presencia de marcadores como p53, VEGF y COX-2, o donde la resección fue incompleta, la quimioterapia como adyuvante reduce la posibilidad de metástasis y de recidivas locales1,2,7,9. En este sentido la quimioterapia en bajas dosis, continuas tiene como principal objetivo la inhibición de células endoteliales que forman los vasos sanguíneos, es decir que tendría un efecto antiangiogénico más que el de eliminar células tumorales como en la quimioterapia convencional2,9.
Hay evidencia de que la inhibición de COX-2 utilizando antiinflamatorios no esteroidales (AINE) puede jugar un papel importante en la inhibición de la angiogénesis y supresión de la generación de células T reguladoras, por lo que su uso dentro de los protocolos en bajas dosis resultaría beneficioso2-4,9,15. También se encuentra bajo evaluación el uso de antiangiogénicos específicos, como los inhibidores de los receptores de tirosina quinasa (RTK). El toceranib, inhibidor del receptor del VEGF y del receptor del factor de crecimiento derivado de plaquetas (PDGFR) y el masitinib, inhibidor del receptor del PDGF. Ambos receptores son RTK que juegan un papel importante en angiogénesis2,9,16. El uso de protocolos a bajas dosis y continuas junto con un AINE inhibidor de COX-2 o en combinación con agentes antiangiogénicos específicos resulta ser una terapéutica prometedora en pacientes con expresión positiva para p53 o que presentan amplificado y/o sobreexpresado el protooncogen HER-2/neu y que son de alto riesgo, con altas posibilidades de desarrollar metástasis, con corta sobrevida global y mala calidad de vida2-4,9,15,16. Las posibilidades terapéuticas son amplias y la decisión del tratamiento a seguir en cada caso tiene una importancia trascendental, ya que un fracaso en la terapia inicial implica una remisión parcial, o la recaída temprana con corto tiempo libre de recaída y reducción en la sobrevida global del paciente2,9.
El objetivo del presente trabajo fue evaluar alternativas terapéuticas en pacientes caninos con cáncer mamario positivos a marcadores de mal pronóstico.
Materiales y métodos
Pacientes
Se trabajó con 12 pacientes caninos con neoplasias mamarias malignas provenientes del Servicio de Oncología General de la Facultad de Ciencias Veterinarias, Universidad de Buenos Aires. La edad, raza, estado ginecológico y estadificación clínica de las pacientes12,14 se detallan en la Tabla 1.
| Paciente | Edad (años) | Raza | Estado ginecológico (Castrada No/Sí*) | Estadificación clínica |
|---|---|---|---|---|
| 1 | 8 | Dachshund | No | 5 |
| 2 | 8 | Mastín napolitano | No | 5 |
| 3 | 6 | Labrador retriever | No | 5 |
| 4 | 10 | Ovejero alemán | No | 5 |
| 5 | 15 | Setter irlandés | No | 5 |
| 6 | 12 | Mestizo | Sí | 5 |
| 7 | 7 | Cócker spaniel | No | 5 |
| 8 | 12 | Mestizo | No | 5 |
| 9 | 9 | Ovejero alemán | Sí | 5 |
| 10 | 7 | Cócker spaniel | No | 5 |
| 11 | 10 | Mestizo | No | 5 |
| 12 | 6 | Mestizo | Sí | 5 |
Tabla 1. Edad, raza, estado ginecológico y estadificación clínica de las pacientes.
*Castradas después de los 4 años de edad.
Muestras
Histopatología.
Las muestras de tejido mamario fueron fijadas en formalina bufferada al 10 % y procesadas por el método histológico convencional. Posteriormente los cortes de 5 μm, se tiñeron con hematoxilina-eosina.
Inmunohistoquímica
Anticuerpos monoclonales utilizados:
- Anticuerpo monoclonal de ratón anti-VEGF (clon C-1), Santa Cruz, Biotechnology, CA, USA.
- Anticuerpo monoclonal de ratón anti-COX-2 (clon 29), Santa Cruz, Biotechnology, CA, USA.
- Anticuerpo monoclonal de ratón anti-p53 (clon EP9), Cell Marque, Rockling, CA, USA.
- Anticuerpo monoclonal de conejo anti-RE (clon SP1), Cell Marque, Rockling, CA, USA.
- Anticuerpo monoclonal de conejo anti-RP (clon Y85), Cell Marque, Rockling, CA, USA.
- Anticuerpo monoclonal de ratón anti- HER-2/neu (clon CB-11), Cell Marque, Rockling, CA, USA.
- Anticuerpo monoclonal de ratón anti-Ki67 (clon SP6), Cell Marque, Rockling, CA, USA.
Procesamiento de las muestras
Para la detección de RE, RP, HER-2/neu, Ki-67 y p53 las secciones de tejido fueron desparafinadas y rehidratadas. Para la recuperación antigénica se utilizó la técnica de recuperación de epítopos inducida por calor (HIER) utilizando el reactivo Trilogy® (Cell Marque) lo que permitió el desparafinado, rehidratación y recuperación antigénica en forma simultánea. Luego los portaobjetos se lavaron con agua destilada y se incubaron con el anticuerpo primario correspondiente (Cell Marque, Rockling, CA, USA) en una dilución 1:100 durante 1 hora a temperatura ambiente y se lavaron con Tris-solución salina bufferada (TBS). El anticuerpo secundario correspondiente (Cell Marque, Rockling, CA, USA) se aplicó durante 10 minutos y luego los portaobjetos se lavaron nuevamente con TBS. El color fue desarrollado a los 5 minutos de incubación con el cromógeno. Por último, las muestras fueron deshidratadas y cubiertas con un cubreobjetos.
Para la detección del VEGF y de COX-2 las secciones de tejido fueron desparafinadas y rehidratadas. Se realizó la técnica HIER utilizando tampón de citrato de sodio 10 mM a pH 6.0 y a 95 °C durante 5 minutos. Posteriormente se lavaron con agua desionizada. Luego se incubaron con el anticuerpo primario correspondiente (Santa Cruz, Biotechnology, CA, USA) en una dilución 1:100 durante 1 hora a temperatura ambiente y se lavaron con TBS. El anticuerpo secundario correspondiente (Santa Cruz, Biotechnology, CA, USA) se aplicó durante 10 minutos y luego fue lavado con TBS. El color fue desarrollado a los 5 minutos de incubación con el cromógeno. Por último, las muestras fueron deshidratadas y cubiertas con un cubreobjetos.
Para el control negativo se sustituyó el anticuerpo primario y como control positivo se utilizó una muestra con reactividad conocida frente al anticuerpo primario.
Evaluación de la inmunomarcación
Las muestras fueron evaluadas a bajo aumento (10x) y luego a mayor aumento (40x). Para el VEGF se establecieron grupos a partir del porcentaje de células marcadas. La interpretación de los resultados se detalla en la Tabla 2.
| Escala | Interpretación |
|---|---|
| Negativo: - | 0-24 % de las células marcadas |
| Negativo: - | 25-49 % de las células marcadas |
| Positivo: + | 50-74 % de las células marcadas |
| Positivo: ++ | ≥ 75 % de las células marcadas |
Tabla 2. Patrón de tinción para VEGF.
Para la COX-2 se valoró la intensidad de la tinción citoplásmica y se establecieron los grupos 0: ausencia de tinción, 1: débil tinción, 2: moderada tinción y 3: fuerte tinción. Luego se estimó el porcentaje de células positivas para cada intensidad en 10 campos de gran aumento y ese porcentaje se multiplicó por la intensidad de tinción. La interpretación de los resultados se detalla en la Tabla 3.
| Escala | Interpretación |
|---|---|
| Negativo: - | Intensidad de tinción x % de células teñidas = 0-100 |
| Positivo: + | Intensidad de tinción x % de células teñidas = 101-200 |
| Positivo: ++ | Intensidad de tinción x % de células teñidas = 201-300 |
Tabla 3. Patrón de tinción para COX-2.
Para RE, RP, p53 y HER-2/neu se calculó el porcentaje de células con expresión positiva sobre un total de 3000 células. La interpretación de los resultados se detalla en las Tablas 4 a 7.
| Escala | Interpretación |
|---|---|
| Negativo: - | 0-10 % de células marcadas |
| Positivo: + | 11-29 % de células marcadas |
| Positivo: ++ | ≥30 % de células marcadas |
Tabla 4. Patrón de tinción para receptores hormonales RE y RP.
| Escala | Interpretación |
|---|---|
| Negativo: - | 0-10 % de células marcadas |
| Positivo: + | 11-29 % de células marcadas |
| Positivo: ++ | ≥30 % de células marcadas |
Tabla 5. Patrón de tinción para p53.
| Escala | Interpretación |
|---|---|
| Negativo: - | 0-29 % de células marcadas (tinción en membrana) |
| Negativo: - | >30 % de células marcadas (tinción levemente perceptible en parte de la membrana celular) |
| Positivo: + | >30 % de células marcadas (tinción leve/moderada en la membrana completa) |
| Positivo: ++ | >30 % de células marcadas (tinción intensa en la membrana completa) |
Tabla 6. Patrón de tinción para HER-2/neu.
| Escala | Interpretación |
|---|---|
| Negativo: - | 11-39 % de células marcadas |
| Positivo: + | 40-65 % de células marcadas |
| Positivo: ++ | >65 % de células marcadas |
Tabla 7. Patrón de tinción para Ki-67.
Protocolos implementados
Protocolo convencional
- Doxorrubicina a 30 mg/m² EV cada 21 días.
- Ciclofosfamida a 100-200 mg/m2 EV o 50 mg/m2 VO 4 días por semana.
- Vincristina 0.75 mg/m2 EV una vez por semana.
- Otros protocolos utilizan Mitoxantrona a 5.5 mg/m2 EV cada 21 días en lugar de doxorrubicina y otros pueden utilizar cisplatino a 50-70 mg/m2 EV cada 21 días. Se requieren controles semanales tanto hematológicos como de la función hepática y renal.
Protocolo alternativo
- Clorambucilo 2 mg/m2 días 1 y 4 (agente alquilante).
- Imatinib 10 mg/kg días 2 y 5 (inhibidor de la tirosinquinasa).
- Firocoxib 1 mg/kg días 3 y 6 (anti COX-2)
- Famotidina 2 mg/kg cada 12 horas. Protector de la mucosa y con leve acción antineoplásica por ser moduladora de la producción de PG.
- Los ciclos terapéuticos se realizaron con dos días semanales de cada fármaco y un día de descanso por semana.
- A diferencia de los regímenes de dosis alta, la evaluación de toxicidad hematológica y de la función hepática y renal, es necesaria con menor frecuencia, realizándose de forma mensual.
Análisis estadístico
Se realizó un análisis descriptivo de la situación con medidas de posición y con el estudio de las frecuencias de distribución. Para evaluar sobrevida global de los grupos, tratados con protocolos convencionales y protocolos alternativos, se empleó el método estadístico de análisis de supervivencia de Kaplan Meier. La comparación entre ellos se realizó mediante el Test de Log-Rank y Cox-Mantel, considerándose significativos los p menores o iguales a 0,0517.
Resultados
La expresión del VEGF, COX-2, HER-2/neu, p53, Ki-67 y la sobrevida global de los pacientes se detallan en la Tabla 8. El tipo y grado histológico12 de las neoplasias mamarias malignas y su frecuencia se detallan en la Tabla 9. De los 12 pacientes evaluados, 8 fueron tratados con protocolos convencionales de quimioterapia a dosis altas, mientras que 4 recibieron esquemas terapéuticos alternativos basados en quimioterapia metronómica, inhibidores de RTK, AINE e inhibidores de COX-2.
| Paciente | VEGF | COX-2 | HER-2/neu | p53 | Ki-67 | Sobrevida global (días) |
|---|---|---|---|---|---|---|
| 1 | + | ++ | + | ++ | ++ | 177 |
| 2 | ++ | ++ | + | ++ | ++ | 93 |
| 3 | + | + | + | ++ | + | 171 |
| 4 | + | + | + | ++ | + | 185 |
| 5 | + | + | ++ | ++ | + | 143 |
| 6 | ++ | ++ | ++ | ++ | ++ | 118 |
| 7 | + | + | + | + | + | 215 |
| 8 | + | ++ | ++ | ++ | ++ | 190 |
| 9 | ++ | + | + | ++ | ++ | 380 |
| 10 | ++ | + | + | ++ | ++ | 405 |
| 11 | + | ++ | + | ++ | + | 410 |
| 12 | ++ | + | ++ | ++ | ++ | 307 |
Tabla 8. Expresión de VEGF, COX-2, HER-2/neu, p53, Ki-67 y sobrevida global de los pacientes.
| Paciente | Neoplasia mamaria (tipo histológico OMS-2010) | Grado | Frecuencia (%) | Protocolo de tratamiento |
|---|---|---|---|---|
| 1 | Carcinoma simple | I | 66.7 % | Convencional |
| 2 | Carcinoma simple | A | 66.7 % | Convencional |
| 3 | Carcinoma simple | B | 66.7 % | Convencional |
| 4 | Carcinoma simple | A | 66.7 % | Convencional |
| 5 | Carcinoma mixto | A | 66.7 % | Convencional |
| 6 | Carcinoma mixto | I | 66.7 % | Convencional |
| 7 | Carcinoma mixto | A | 66.7 % | Convencional |
| 8 | Carcinoma mixto | I | 66.7 % | Convencional |
| 9 | Carcinoma simple | A | 33.33 % | Alternativo |
| 10 | Carcinoma simple | A | 33.33 % | Alternativo |
| 11 | Carcinoma simple | I | 33.33 % | Alternativo |
| 12 | Carcinoma mixto | A | 33.33 % | Alternativo |
Tabla 9. Tipo, grado histológico y frecuencia de las neoplasias mamarias malignas.
El grupo (n = 8) de pacientes, que en el contexto del tratamiento, recibió protocolos convencionales con quimioterapia a altas dosis, presentó diferencias significativas en relación al grupo (n = 4) de pacientes que recibió protocolos alternativos que utilizaron quimioterapia metronómica en combinación con inhibidores de RTK e inhibidores de COX2, con una mediana de supervivencia de 170 y 400 días respectivamente (p = 0.001) según el análisis de Kaplan-Meier y la prueba de Log-Rank (Figura 1).
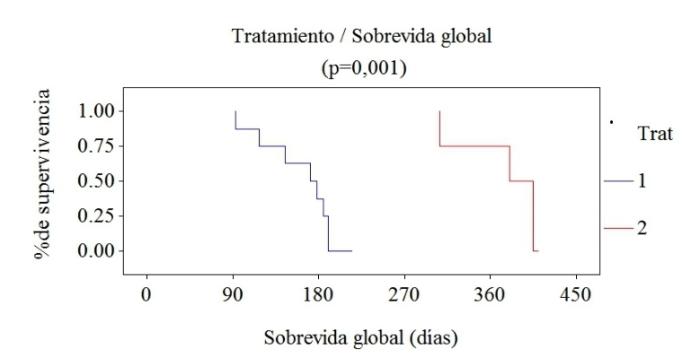
Figura 1. Sobrevida global en relación con el tratamiento. Tratamiento 1 (convencional): 170 días. Tratamiento 2 (alternativo): 400 días.
Además, se evidenció una mejor calidad de vida en el grupo alternativo, con menores efectos adversos y mejor tolerancia al tratamiento. La correlación entre la expresión positiva de marcadores como VEGF, COX-2 y p53 con menores tasas de supervivencia reafirma su valor pronóstico. Asimismo, los pacientes con sobreexpresión de HER-2/neu y altos índices de Ki-67 presentaron evolución más agresiva y respuesta limitada a la quimioterapia convencional, pero respondieron favorablemente al enfoque combinado con agentes dirigidos.
Conclusiones
El estudio demuestra que las terapias dirigidas, en particular aquellas basadas en quimioterapia metronómica combinada con inhibidores de COX-2 y antiangiogénicos como los inhibidores RTK, representan una alternativa terapéutica eficaz para pacientes caninos con cáncer mamario positivo a marcadores de mal pronóstico.
La incorporación de biomarcadores en el diseño del tratamiento permite personalizar la terapéutica, mejorando significativamente la sobrevida y calidad de vida de los pacientes. Se destaca la relevancia clínica del VEGF, COX-2, p53 y HER-2/neu como indicadores no solo pronósticos, sino también terapéuticos.
Por otro lado, pese al tamaño de la muestra, los resultados sugieren que los tratamientos alternativos ofrecen beneficios sustanciales respecto a los esquemas convencionales, particularmente en tumores avanzados o de comportamiento biológico agresivo.
Es necesario continuar con investigaciones que incluyan un mayor número de casos y seguimiento a largo plazo, con el fin de validar y optimizar estas estrategias terapéuticas en la práctica clínica veterinaria.
Bibliografía
- Anadol E, et al. Expression of iNOS, COX-2 and VEGF in canine mammary tumours. Acta Vet Hung. 2017; 65(3):382–393.
- Arenas C, et al. Adjuvant therapy for highly malignant canine mammary tumours: COX-2 inhibitor versus chemotherapy. Vet Rec. 2016; 179(5):125.
- Brandi A, et al. Firocoxib as a potential neoadjuvant treatment in canine patients with triple-negative mammary gland tumors. Animals (Basel). 2023; 13(1):60.
- Hurst EA, et al. The selective cyclooxygenase-2 inhibitor mavacoxib (Trocoxil) exerts anti-tumour effects in vitro. Vet Comp Oncol. 2019; 17(2):194–207.
- Kabir, FML.; DeInnocentes, P.; Agarwal, P.; Mill, CP.; Riese, DJ.; Bird, RC. Estrogen receptor-α, progesterone receptor, and c-erbB/HER-family receptor mRNA detection and phenotype analysis in spontaneous canine models of breast cancer. J. Vet. Sci. 2017; 30;18(2):149-58. doi:10.4142/jvs.2017.18.2.149.
- Kaszak, I.; Ruszczak, A.; Kanafa, S.; Kacprzak, K.; Król, M.; Jurka, P. Current biomarkers of canine mammary tumors. Acta Vet. Scand. 2018; 29;60(1):66. doi:10.1186/s13028.018.0417.1.
- Koutras, A.; Kotoula, V.; Fountzilas, G. Prognostic and predictive role of vascular endothelial growth factor polymorphisms in breast cancer. Pharmacogenomics. 2015; 16:79-94.
- Lala,PK.; Nandi, P.; Majumder, M. Roles of prostaglandins intumor-associated lymphangiogenesis with special reference to breast cancer. Cancer Metastasis Rev. 2018 Sep; 37(2,3):369-84. doi:10.1007/s10555.018.9734.0.
- Lu Y, et al. Zinc-Iron Bimetallic Peroxides Enhance Breast Cancer Immunotherapy. ACS Nano. 2024; 18(8):10542–10556.
- Moschetta, MG.; Maschio, LB.; Jardim-Perassi, BV.; et. al. Prognostic value of vascular endothelial growth factor and hypoxia-inducible factor 1α in canine malignant mammary tumors. Oncology Reports. 2015; 33:2345-53.
- Oliveira TF, et al. TP53 gene expression levels and tumor aggressiveness in canine mammary carcinomas. J Vet Diagn Invest. 2017; 29(6):865–868.
- Owen, LN.TNM Classification of Tumors in Domestic Animals.1st ed. Geneva, Switzerland: World Health Organization. 1980:1-53.
- Raposo, TP.;Pires, I.;Prada, J.;Queiroga, FL.; Argyle, DJ. Exploring new biomarkers in the tumour microenvironment of canine inflammatory mammary tumours.Vet. Comp. Col. 2017;15:65-66.
- Razavirad M, et al. Canine Mammary Tumors as a Potential Model for Human Breast Cancer in Comparative Oncology. Vet Med Int. 2024; 2024:9319651.
- Tamura D, et al. Celecoxib exerts antitumor effects in canine mammary tumor cells via COX‑2‑independent mechanisms. Int J Oncol. 2015; 46(3):1393–1404.
- Ustun-Alkan F, et al. Effects of tyrosine kinase inhibitor-masitinib mesylate on canine mammary tumour cell lines. J Vet Res. 2021; 65(3):351–359.
- Watson, P.; Petri, A. Statistic for Veterinary and Animal Science, 2nd ed. Blackwell Science, London. 2000.
- Yang NY, et al. Research progress of good markers for canine mammary carcinoma. Mol Biol Rep. 2023; 50(12):10617–10625.
 by Multimédica
by Multimédica