Expresión de la cicloxigenasa (cox-2) en cáncer mamario canino
Resumen breve
El objetivo del presente trabajo fue investigar la expresión de la COX-2 y su relación con la expresión del proto-oncogén Herb2-Neu y con la expresión de los receptores hormonales para estrógenos (RE) y progesterona (RP) en cáncer mamario canino. Se trabajó con cortes histopatológicos de tejido neoplásico mamario maligno de pacientes provenientes del Hospital Escuela de la Facultad de Ciencias Veterinarias, Universidad de Buenos Aires.Índice de contenidos

Resumen
El objetivo del presente trabajo fue investigar la expresión de la COX-2 y su relación con la expresión del proto-oncogén Herb2-Neu y con la expresión de los receptores hormonales para estrógenos (RE) y progesterona (RP) en cáncer mamario canino. Se trabajó con cortes histopatológicos de tejido neoplásico mamario maligno de pacientes provenientes del Hospital Escuela de la Facultad de Ciencias Veterinarias, Universidad de Buenos Aires. La expresión de la COX-2, de los RE, RP y la sobreexpresión del proto-oncogén Herb2-Neu, se evaluaron por inmunohistoquímica. El 47 % presentaron expresión positiva para la COX-2 con una mediana de supervivencia para este grupo de 175 días significativamente menor al grupo con expresión negativa que presentó una sobrevida de 850 días (p = 0,009). En el 100 % de los pacientes con expresión positiva para la COX-2 se observó compromiso ganglionar y metástasis, una correlación positiva entre los resultados obtenidos de evaluar la expresión de COX-2 y la sobreexpresión de Herb2-Neu (p < 0,0001) y una correlación negativa entre los resultados obtenidos de evaluar la expresión de COX-2 y Herb2-Neu con la sobrevida global de los pacientes (p = 0,001). Esta patología requiere de la permanente búsqueda de marcadores que contribuyan a predecir su comportamiento biológico, su evolución clínica y que permitan evaluar posibles estrategias terapéuticas.
Introducción
El cáncer de mama es una enfermedad sumamente heterogénea con alteraciones moleculares diferentes en relación con los distintos tipos histológicos. El conocimiento y estudio de los patrones moleculares alterados es de suma importancia ya que son responsables de las variaciones en la agresividad del tumor, de la respuesta al tratamiento y del pronóstico en cada caso1,2.
La expresión de la enzima ciclooxigenasa 2 (COX-2) en el cáncer de mama se correlaciona con mayor agresividad del tumor y peor pronóstico. Interviene en la conversión del ácido araquidónico de las membranas celulares a prostaglandinas (PGs)3. Las dos isoformas más importantes de esta enzima son la COX-1 y COX-2 que, pese a compartir importantes similitudes a nivel proteico, son codificadas por distintos genes en diferentes cromosomas. La COX-1 (constitutiva) se encuentra en el citoplasma de las células de la mayoría de los tejidos y cumple un papel importante en el mantenimiento de la homeostasis celular3-5. Las PGs derivadas de su síntesis permiten la integridad de las células de la mucosa gástrica, contribuyen a la vasodilatación de los capilares renales y son esenciales en la producción de tromboxanos proagregatorios plaquetarios. Contrariamente a la anterior, la COX-2 (inducible) no se encuentra en la mayoría de los tejidos y puede ser inducida por hipoxia, factores de crecimiento, estímulos inflamatorios y varios oncogenes como el proto-oncogén Herb2-Neu2-4,6,7.
En Medicina Humana varios estudios indican que la expresión de la COX-2 es inapreciable en tejido mamario normal pero aumenta en estadios pre-malignos, en carcinomas ductales, en carcinoma invasivo y en lesiones metastásicas. También se ha observado que la sobreexpresión tiene lugar preferentemente en los casos que presentan sobreexpresión del proto-oncogén Herb2-Neu, lo cual se debería a la activación de ciertas quinasas y vías metabólicas que estimulan la transcripción de la COX-25,7. Aproximadamente de un 20 a un 30 % de los cánceres de mama en humanos tienen amplificado y/o sobreexpresado el proto-oncogén Herb2-Neu. Este se asocia a incrementos en las tasas de proliferación, comportamientos más agresivos, independencia hormonal y en algunos estudios, aumento de la resistencia a determinados agentes quimioterápicos1,2,5,7-9. En Medicina Veterinaria su expresión fue correlacionada con un elevado índice mitótico lo que lleva a una rápida progresión y mal pronóstico con pobre respuesta a la quimioterapia en cáncer de mama. También se ha demostrado que juega un importante papel en la carcinogénesis de la glándula mamaria canina1,5,8.
La COX-2 estimula la angiogénesis, a través de la producción excesiva del factor de crecimiento de endotelio vascular (VEGF) por parte de las células tumorales, fenómeno fundamental para el crecimiento de una neoplasia y el desarrollo de metástasis. Produce el aumento de la capacidad invasora de un tumor mediante el incremento de la actividad de las metaloproteínas (MMP)4, que son enzimas responsables de la digestión de la matriz de colágeno. Induce la sobreexpresión de la proteína antiapoptótica bcl2, lo que conduce a la acumulación de errores en el ADN y a la prolongación de la vida de las células tumorales3,4. Las PGs resultantes de la acción de la COX-2 especialmente la prostaglandina E2 (PGE2) afecta el sistema inmune por disminución en la proliferación de las células T y B y en la producción de algunas citoquinas, entorpeciendo de esta manera los procesos de presentación antigénica y por tanto, favoreciendo el desarrollo de la neoplasia. Estimula la mitogénesis del epitelio mamario a través del exceso de PG y en presencia del factor de crecimiento epidérmico (EGF) en las células mamarias, células que tendrían la capacidad de estimular la proliferación celular aumentando la producción local de estrógenos3-5.
En Medicina Humana las altas concentraciones de PGE2 se han asociado a la pérdida de RE y RP y a un elevado riesgo de padecer metástasis. También se ha observado una correlación entre los niveles de COX-2 y un incremento en la densidad, tamaño y grado del tumor, factores que reflejan un peor pronóstico. La COX-2 afectaría tanto a la iniciación como a la progresión del cáncer1-4,6.
El objetivo del presente trabajo fue investigar la expresión de la COX-2 y su relación con la expresión del proto-oncogén Herb2-Neu y con la expresión de los RE y RP en cáncer mamario canino.
Materiales y métodos
Pacientes
Se trabajó con 17 pacientes caninos con tumores de mama malignos confirmados por histopatología, provenientes del Servicio de Oncología General de la Facultad de Ciencias Veterinarias-UBA.
Histopatología
Las muestras de tejido mamario fueron fijadas en formalina bufferada al 10 % y procesadas por el método histológico convencional, que consiste en la deshidratación en alcoholes ascendentes y su inclusión en parafina. Posteriormente los cortes de 5μm, se tiñeron con Hematoxilina-Eosina.
Inmunohistoquímica
Anticuerpos monoclonales utilizados
- Anticuerpo monoclonal de ratón anti-COX-2 (clon 29, Santa Cruz, Biotechnology, CA, USA).
- Anticuerpo monoclonal de conejo anti-Receptor de estrógeno (RE clon SP1, Cell Marque, Rockling, CA, USA).
- Anticuerpo monoclonal de conejo anti-Receptor de progesterona (RP clon Y85, Cell Marque, Rockling, CA, USA).
- Anticuerpo monoclonal de ratón anti-Herb2-Neu (c-erbB-2) (clon CB-11).
Procesamiento de las muestras
Para la detección de RE, RP y Herb2-Neu las secciones de tejido fueron desparafinadas y rehidratadas. Para la recuperación antigénica se utilizó la técnica Recuperación de Epitopes inducida por calor (HIER) utilizando el reactivo Trilogy de Cell Marque lo que permitió el desparafinado, rehidratación y recuperación antigénica en forma simultánea. Luego los portaobjetos se lavaron con agua destilada y se incubaron con el anticuerpo primario (dilución 1:100) durante 1 hora a temperatura ambiente y se lavaron con Tris-solución salina bufferada (TBS). El anticuerpo secundario (Cell Marque, Rockling, CA, USA) se aplicó durante 10 minutos y luego los portaobjetos se lavaron nuevamente con TBS. El color fue desarrollado a los 5 minutos de incubación con el cromógeno. Por último las muestras fueron deshidratadas y cubiertas con un portaobjetos.
Para la detección de la COX-2 las secciones de tejido fueron desparafinadas y rehidratadas. Se realizó la técnica HIER utilizando tampón de citrato de sodio 10 mM a pH 6.0 y a 95°C durante 5 minutos. Posteriormente se lavaron con agua desionizada. Luego se incubaron con el anticuerpo primario (dilución 1:100) durante 1 hora a temperatura ambiente, y se lavaron con TBS. El anticuerpo secundario (Santa Cruz, Biotechnology, CA, USA) se aplicó durante 10 minutos y luego fue lavado con TBS. El color fue desarrollado a los 5 minutos de incubación con el cromógeno. Por último, las muestras fueron deshidratadas y cubiertas con un portaobjetos.
Evaluación de la inmunomarcación
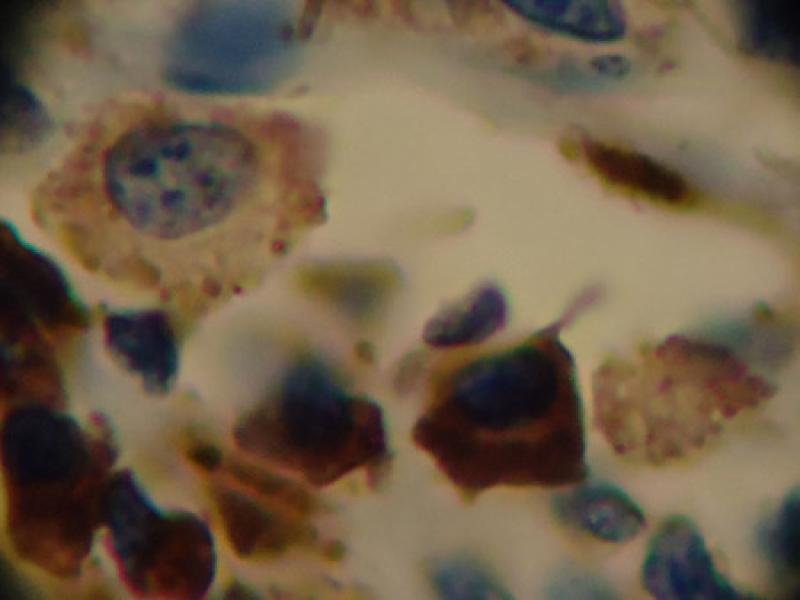
Las muestras fueron evaluadas simultáneamente por dos observadores. Para RE, RP y Herb2-Neu fueron evaluadas a bajo aumento (×40) y luego a gran aumento (x100) para el recuento. Se evaluaron 3000 células tumorales y se calculó el porcentaje de células con expresión positiva sobre el total de células tumorales evaluadas. (Figura 1) Los resultados se interpretaron según Tablas 1 y 2.
| Tabla 1. Patrón de tinción para receptores hormonales RE y RPs. |
| Rango | Reporte | Interpretación |
| 0 | Negativo | < 10 % |
| 1 | Positivo | > 10 % |
| Tabla 2. Patrón de tinción para Herb2-Neu. |
| Rango | Reporte | Interpretación |
| 0 | Negativo | No se observa tinción o la tinción en membrana es en menos del 30 % de las células tumorales. |
| 1 | Negativo | Tinción levemente perceptible en menos del 30 % de células. Se tiñe parte de la membrana celular. |
| 2 | Positivo | Tinción leve/moderada de la membrana completa en más del 30 % de las células tumorales. |
| 3 | Positivo | Tinción intensa en la membrana completa en más del 30 % de las células tumorales. |
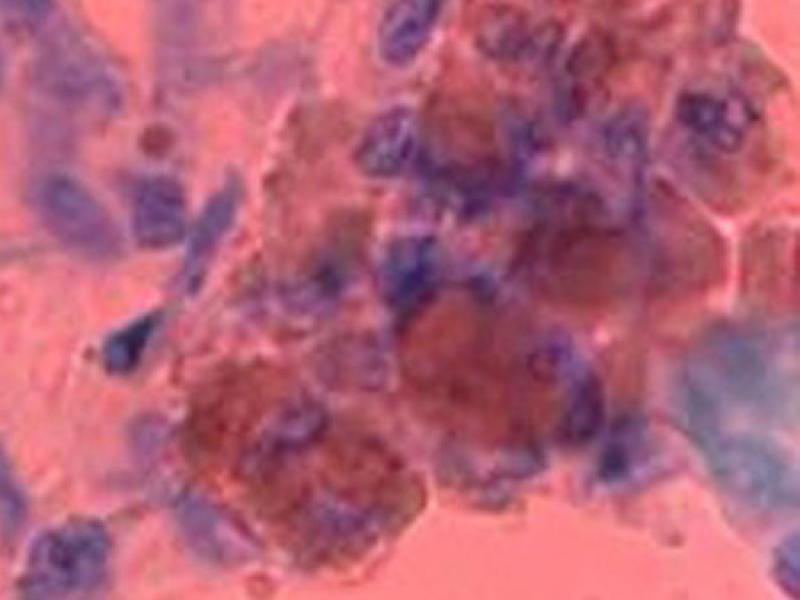
Para COX-2 las muestras fueron evaluadas a bajo aumento (×40) y luego a gran aumento (x400) para valorar la intensidad de la tinción citoplásmica. Se establecieron los grupos 0: ausencia de tinción, 1: débil tinción, 2: moderada tinción y 3: fuerte tinción. Luego se estimó el porcentaje de células positivas para cada intensidad en 10 campos de gran aumento y ese porcentaje se multiplicó por la intensidad de tinción. (Figura 2) Los resultados se interpretaron según Tabla 3.
Análisis estadístico
Se realizó un análisis descriptivo de la situación con medidas de posición y con el estudio de las frecuencias de distribución. Para evaluar sobrevida global se empleó el método estadístico de análisis de supervivencia de Kaplan Meier. La comparación entre ellos se realizó mediante el Test de Log-Rank y Cox-Mantel, considerándose significativos los p menores o iguales a 0,05. Se analizó la correlación entre los resultados obtenidos de la marcación de COX-2, RE, RP y Herb2-Neu utilizando el coeficiente de correlación de Spearman, considerándose significativos los p menores o iguales a 0,0510.
| Tabla 3. Patrón de tinción para COX-2. |
| Rango | Reporte | Interpretación |
| 1 | Negativo | Intensidad de tinción x % de células teñidas = 0-100 |
| 2 | Positivo | Intensidad de tinción x % de células teñidas = 101-300 |
Resultados
Del total (n = 17) de muestras histopatológicas pertenecientes a pacientes con tumores mamarios malignos el 47 % (n = 8/17) presentaron expresión positiva para COX-2 y el 58,8 % (n = 10/17) presentaron expresión positiva para Herb2-Neu. El 100 % (n = 17/17) presentaron expresión negativa para los RE y RP. El grupo de pacientes con expresión positiva para la COX-2 y Herb2-Neu presentó diferencias significativas en relación al grupo con expresión negativa, con una mediana de supervivencia de 175 y 850 días respectivamente (p = 0,009) (Figura 3). Se observó que el 47,05 % (n = 8/17) de los pacientes presentaron expresión positiva para COX-2 y Herb2-Neu con compromiso ganglionar y metástasis mientras que el 11,8 % (n = 2/17) presentaron expresión negativa para COX-2 y positiva para Herb2-Neu con compromiso ganglionar y metástasis.
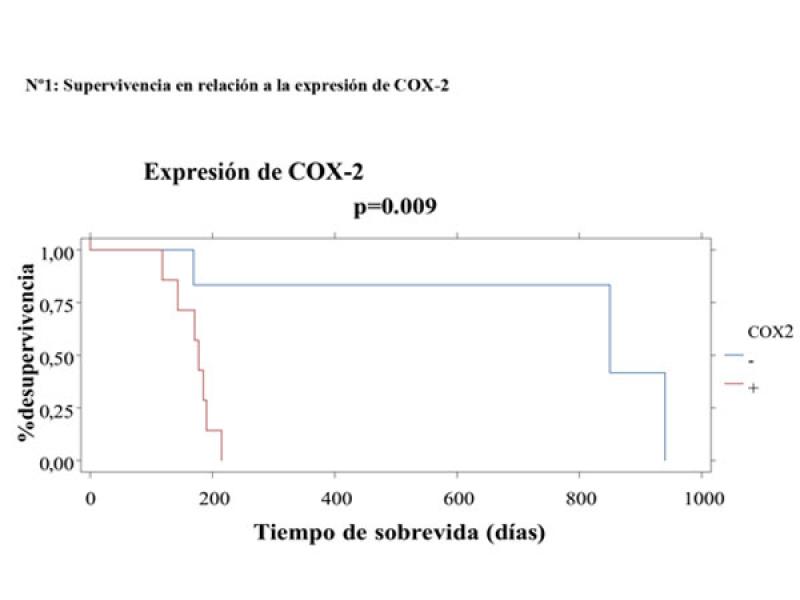
Se observó una correlación positiva entre los resultados obtenidos de evaluar la expresión de COX-2 y la sobreexpresión de Herb2-Neu (Rho = 0,82, p < 0,0001). Se observó una correlación negativa entre la sobrevida global de los pacientes y los resultados obtenidos de evaluar la expresión de COX-2 y Herb2-Neu (Rho = -0,49; p < 0,0001; Rho = -0.46; p < 0,0001 respectivamente).
Conclusiones
En concordancia con la bibliografía consultada, la expresión positiva de COX-2 y Herb2-Neu se asoció a corta sobrevida global, rápido crecimiento y progresión tumoral con alta posibilidad de metástasis y recidiva del tumor lo cual se observó en el 47,05 % de los pacientes positivos a la expresión de COX-2 y Herb2-Neu y en el 11,8 % de los pacientes positivos solo a la expresión de Herb2-Neu1,4,6,8. También acorde a lo reportado en Medicina Humana y Veterinaria, se observó una pérdida de la expresión de RE y RP ante la expresión de COX-2 y Herb2-Neu4-7.
El proto-oncogén Herb2-Neu se asoció a un comportamiento más agresivo con incremento en las tasas de proliferación e independencia hormonal y la presencia de COX-2 pudo contribuir aún más al desarrollo de metástasis gracias a su habilidad para regular la angiogénesis, favoreciendo el aporte sanguíneo necesario para la diseminación de las células neoplásicas2,4,6-9. Se requiere de más estudios que involucren un mayor número de pacientes que validen o no dichos hallazgos y permitan su justificación. Se observó una correlación positiva entre la expresión de COX-2 y Herb2-Neu, considerando que la expresión de COX-2 puede ser inducida por varios oncogenes como el proto-oncogén Herb2-Neu y que el 58,8 % de los pacientes con tumores mamarios malignos presentaron amplificado y/o sobreexpresado el proto-oncogén Herb2-Neu en un porcentaje mayor que el reportado por la bibliografía consultada2,4,5,7,8.
La modalidad terapéutica más conveniente en cada caso se basa en el estudio de factores pronósticos, variables que relacionadas con el paciente, el tumor o el tratamiento, influyen de forma independiente sobre la evolución de la enfermedad y en la supervivencia total, en el tiempo libre de recaída y en la respuesta al tratamiento2.
Bibliografía
- Raposo TP.; Pires I.; Prada J.; Queiroga FL.; Argyle DJ. (2017). Exploring new biomarkers in the tumour microenvironment of canine inflammatory mammary tumours. Vet Comp ncol. ; 15:65-666.
- Santos AA.; Lopes CC.; Ribeiro JR.; Martins LR.; Santos JC.; Amorim IF.; Gärtner F.; Matos AJ. (2013). Identification; of prognostic factors in canine mammary malignant tumours: a multivariable survival study. BMC Vet Res. Jan 4;9:1. doi: 10.1186/1746-6148-9-1,.
- Lala PK.; Nandi P.; Majumder M. (2018). Roles of prostaglandins in tumor-associated lymphangiogenesis with special reference to breast cancer. Cancer Metastasis Rev. Sep;37(2-3):369-384. doi: 10.1007/s10555-018-9734-0.
- De Nardia AB.; Dalecka CR.; Amorinb RL.: Huppesc RR.; Uscateguid RAR.; Rodaskie S.; Calderonf C.; Netob RT. (2013). Cyclooxigenase-2 expression in primary metastatic and non metastatic canine mammarian carcinomas, Arch Med Vet.; 45(3):311-316.
- Kaszak I.; Ruszczak A.; Kanafa S.; Kacprzak K.; Król M.; Jurka P. (2018). Current biomarkers of canine mammary tumors. Acta Vet. Scand., 29;60(1):66. doi: 10.1186/s13028-018-0417-1.
- Kabir FML.; DeInnocentes P.; Agarwal P.; Mill CP.; Riese Nd DJ.; Bird RC. (2017). Estrogen receptor-α, progesterone receptor, and c-erbB/HER-family receptor mRNA detection and phenotype analysis in spontaneous canine models of breast cancer. Send to J. Vet. Sci. 30;18(2):149-158. doi: 10.4142/jvs.2017.18.2.149.
- Muhammadnejad A.; Keyhani E. et al. (2012). Overexpression of her-2/neu in malignant mammary tumors; translation of clinicopathological features from dog to human. Asian Pac J Cancer Prev. 13(12),6415-21.
- Andrea GK.; Marko H.; Branka A.; et. al. (2011). Histopathological evaluation and immunohistochemical study of estrogen receptor α, HER-2 and Ki-67 in canine
neoplastic mammary lesions. Veternarski arhiv. 81 (6), 709-722. - Lange CA. (2007). Integration of progesterone receptor action with rapid signaling events
in breast cancer models. J. Steroid Biochem. Mol. Biol. 108:203-212. - Watson P.; Petri A. (2000). Statistic for Veterinary and Animal Science, 2nd ed. Blackwell
Science, London 243.
 by Multimédica
by Multimédica