Hipoglucemia paraneoplásica asociada a un leiomioma vesical en un perro: primer caso descrito
Resumen breve
A continuación, se expone el caso clínico de un paciente canino, bichón maltés macho no castrado, de 9 años con un leiomioma vesical asociado a hipoglucemia, un síndrome paraneoplásico no descrito en tumores en dicha localización en la especie canina.Índice de contenidos

Resumen
El paciente acudió al servicio de oncología remitido por un cuadro clínico de debilidad episódica asociada a hipoglucemia y una masa intraabdominal. El examen físico era compatible con la normalidad a excepción de la palpación de una masa en el abdomen medio, no dolorosa ni móvil. Las analíticas sanguíneas mostraron eritrocitosis (64.6 %; 36.6-54.5) con reticulocitosis (116.9 K/μl; 10-110), hipoglucemia (36 mg/dl; 70-143) y un valor de fructosamina de 119 μmol/l (177-314). Mediante ecografía se detectó una masa adyacente a la pared de la curvatura menor del estómago que tras su estudio citológico era compatible con un sarcoma. Con el objetivo de determinar el origen de la lesión, completar el estadiaje y planificar una posible intervención quirúrgica se decidió realizar una tomografía computarizada (TC), en el cual se observó que la masa abdominal presentaba un crecimiento excéntrico a partir del aspecto craneal y dorsal de la vejiga urinaria, sin evidencia de metástasis, por lo que, tras ello, se realizó una laparotomía con cistectomía asociada. Las características histológicas eran compatibles con un leiomioma vesical reseccionado de forma completa. Tras 48 horas de hospitalización, el paciente fue dado de alta sin presentar complicaciones y, 22 meses después de la cirugía, continua asintomático sin haber vuelto a presentar episodios de hipoglucemia.
Introducción
La hipoglucemia es un síndrome paraneoplásico producido fundamentalmente por tumores como el insulinoma, principalmente debido a la producción excesiva de insulina. Sin embargo, de forma menos frecuente, este síndrome puede aparecer en tumores primarios hepáticos o en neoplasias del músculo liso, especialmente en el tracto gastrointestinal1. El mecanismo principal por el que se produce la hipoglucemia en esta clase de neoplasias se debe a la producción IGF-2 (Insulin Like Growth Factor 2), y en menor medida, IGF-1 y somatomedinas1-3. A diferencia de los insulinomas, la mayoría de los tumores extrapancreáticos que causan hipoglucemia son masas intrabdominales de gran tamaño detectadas mediante palpación abdominal o ecografía1,2. Los leiomiomas y leiomiosarcomas de la vejiga son infrecuentes, tanto en personas como en animales, representando menos del 0.5 % de los tumores vesicales en la especie canina4. La resección completa de los tumores que generan hipoglucemia paraneoplásica y, en concreto, en los leiomiomas/leiomiosarcomas, es suficiente para volver a valores de normoglicemia en las horas sucesivas tras la intervención en la mayoría de los casos2. A continuación, se describe el caso de un perro con un leiomioma vesical e hipoglucemia paraneoplásica en el que se consigue volver a valores de normoglicemia tras la realización de una resección completa mediante cistectomía parcial.
Caso clínico
Un Bichón maltés, macho no castrado de 9 años y 4.6 kg, fue remitido para una consulta por una masa intrabdominal y episodios de debilidad asociados a hipoglucemias recurrentes de varias semanas de evolución. Los propietarios no habían apreciado convulsiones, el perro mantenía su apetito y no presentaba vómitos ni diarrea. Durante el examen físico, el paciente mostraba un estado mental alerta, condición corporal adecuada, constantes vitales dentro de los parámetros normales y una masa palpable en el abdomen medio, no dolorosa ni móvil. Las analíticas sanguíneas revelaron eritrocitosis (64.6 %; rango normal 36.6-54.5) con reticulocitosis (116.9 K/μl; rango normal 10-110), hipoglucemia (36 mg/dl; rango normal 70-143) y un valor de fructosamina de 119 μmol/l (rango normal 177-314).
Posteriormente, se realizó una ecografía abdominal, la cual evidenció una masa de 2.85 x 4.81 cm, de ecotextura heterogénea y morfología ovalada, ubicada adyacente a la curvatura menor del estómago, aunque sin poder determinar su origen exacto (Figura 1). La citología obtenida mediante punción y aspiración con aguja fina mostró una abundante contaminación sanguínea y una escasa cantidad de células de morfología fusiforme dispuestas individualmente, con bordes bien definidos y un núcleo ovalado en posición central y sin criterios de malignidad, lo que era compatible con un sarcoma (Figura 2).
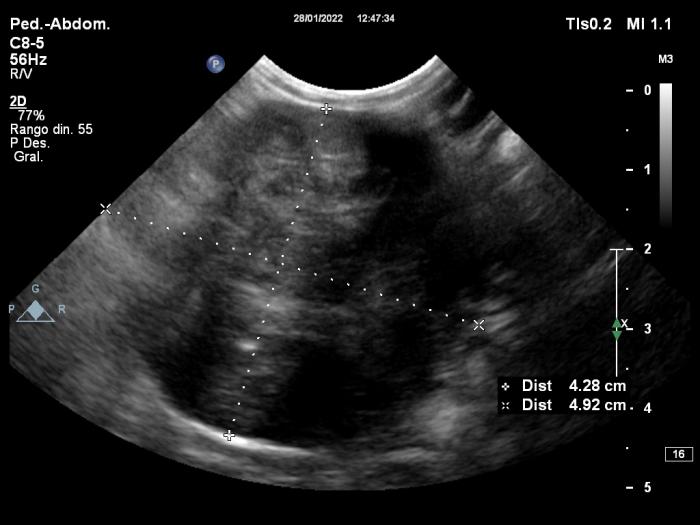
Figura 1. Imagen ecográfica donde se observa la masa intrabdominal de 2.85 x 4.81 cm.
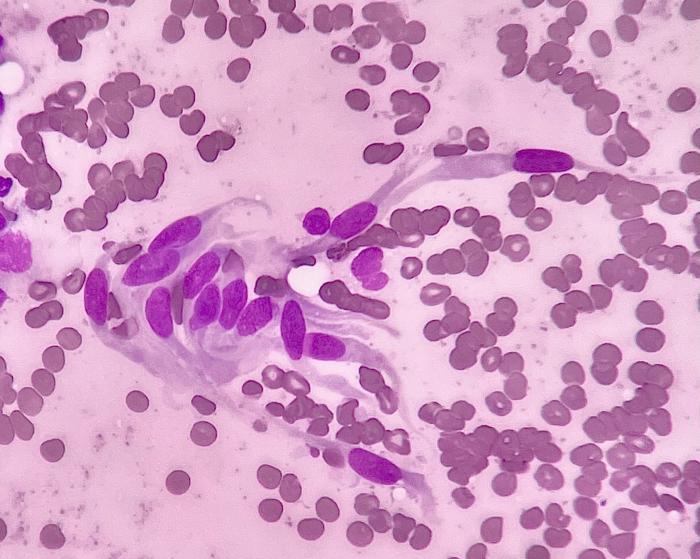
Figura 2. Imagen citológica con células de morfología fusiforme sin atipias compatible con un sarcoma.
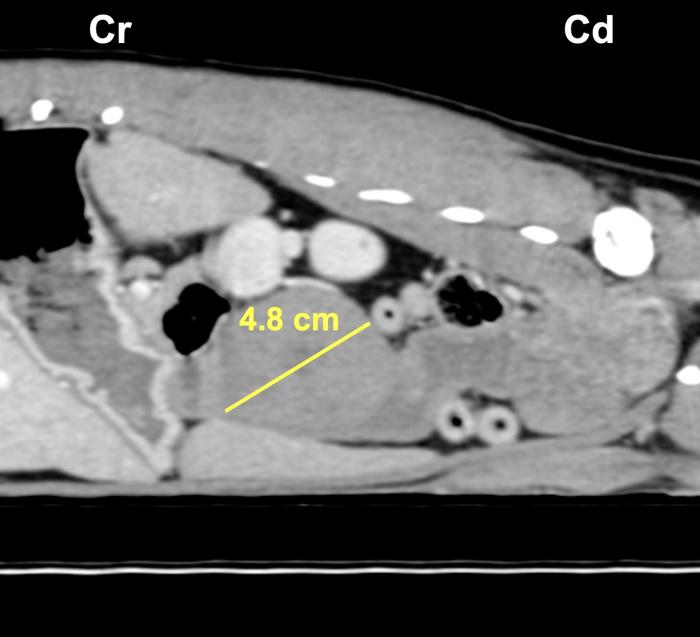
En base a estos hallazgos, se decidió realizar un TC para intentar determinar el origen de la lesión, completar el estadiaje y planificar una posible intervención quirúrgica. El estudio reveló una masa abdominal de 4.8 cm de diámetro y crecimiento excéntrico con origen en el aspecto craneodorsal de la vejiga urinaria, presentando atenuación de tejido blando, un aspecto ligeramente heterogéneo con márgenes lisos, incluyendo algunos focos de mineralización y un leve realce tras la administración de contraste (Figura 3).
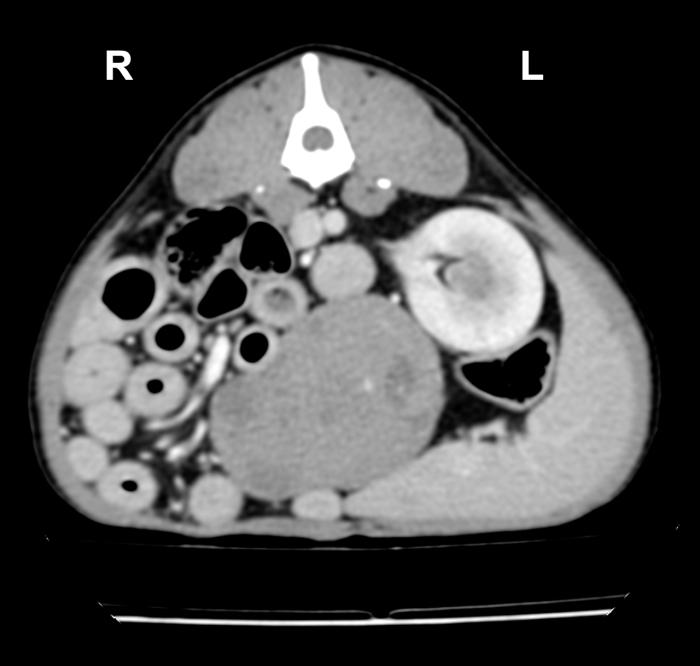
Figura 3. Imágenes en corte transversal (A) y (B) sagital del TC donde se observa la masa abdominal con origen del aspecto craneal y dorsal de la vejiga urinaria de hasta 4.8 cm de diámetro.
También se observó un aumento marcado y generalizado en el tamaño de la próstata manteniendo márgenes lisos bien definido y un realce ligeramente heterogéneo en su parénquima, siendo compatible con una hiperplasia prostática benigna. No se detectaron lesiones metastáticas ni en abdomen y ni en tórax.
Hasta el momento de la intervención, se prescribió un tratamiento con prednisona a 0.25 mg/kg cada 12 horas además de una dieta a base de carbohidratos de absorción lenta (w/d Royal Canin®) repartida en varias tomas diarias.
El procedimiento quirúrgico comenzó con una orquiectomía prescrotal, utilizando una técnica cerrada. Luego, se llevó a cabo una laparoscopia exploratoria para confirmar el origen y posibilidad de resección de la masa vesical, la cual era apical y extraluminal y no presentaba adherencias a órganos periféricos ni linfadenopatía (Vídeo 1). A continuación, se realizó una mini-laparotomía media caudal utilizando un distractor atraumático de anillo (SurgiSlevee®) para exteriorizar la vejiga del abdomen, seguida de una cistectomía parcial, con márgenes macroscópicamente sanos de más de 1 cm, realizando una cistectomía del 40 % de la vejiga (Figura 4). La pared vesical se cerró con un patrón de sutura simple y continuo, no perforante de la mucosa, utilizando una sutura monofilamento absorbible (gliconato) y aguja atraumática (Figura 5). Posteriormente, se procedió a lavar la zona quirúrgica, omentalizarla y cerrar de forma rutinaria la pared abdominal por capas, colocando una sonda vesical tipo Foley para mantener la vejiga en reposo (Figura 6 y 7).
Vídeo 1. Vídeo mostrando la laparoscopia exploratoria previa laparotomía.
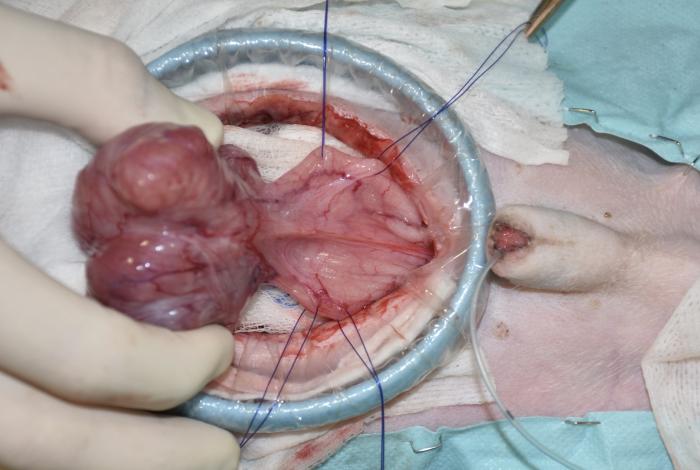
Figura 4. Exteriorización de la vejiga del abdomen y colocación de puntos directores.
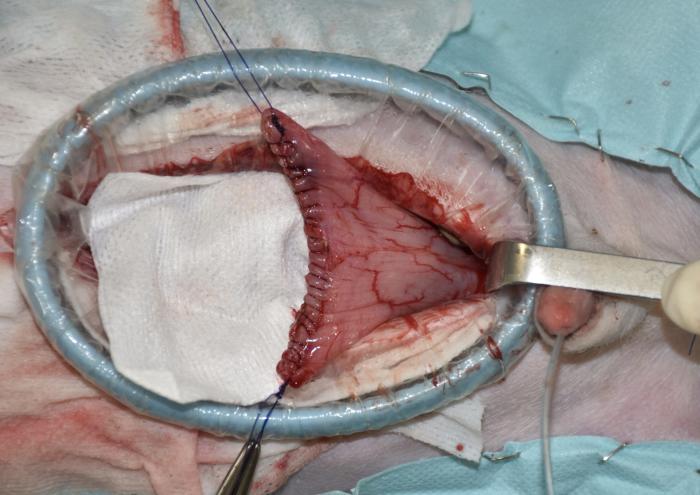
Figura 5. Cierre de la cistectomía con un patrón simple continuo.
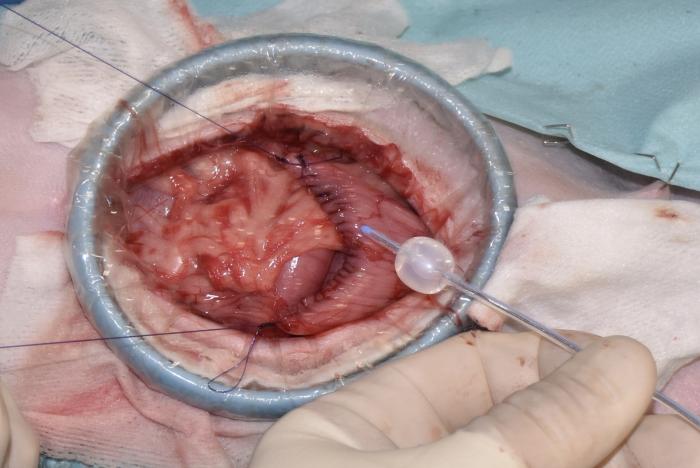
Figura 6. Colocación de una sonda vesical tipo Foley para mantener la vejiga en reposo.
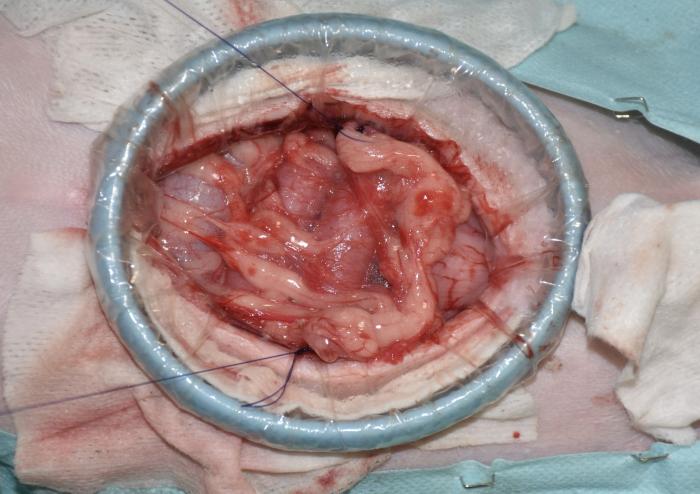
Figura 7. Omentalización de la zona de cistectomía.
El informe histopatológico describió una proliferación neoplásica de fibra muscular lisa que se desarrollaba de forma intramural en la capa muscular lisa interna de la vejiga, sobresaliendo hacia la superficie de la mucosa y la serosa con un patrón de crecimiento expansivo, sin signos de infiltración. El grado de atipia era bajo, con un recuento mitótico de 2 mitosis en 2.37 mm2 y sin áreas de necrosis ni invasión vascular. Estos hallazgos fueron compatibles con un leiomioma vesical reseccionado completamente con márgenes de 1 cm (Figura 8).
Durante el posoperatorio inmediato, la recuperación anestésica fue favorable, manteniendo todas las constantes vitales dentro de rangos normales y sin presentar episodios de hipoglucemia. Tras 48 horas de hospitalización, el paciente fue dado de alta sin complicaciones y, ocho meses después de la cirugía continua asintomático y sin volver a manifestar episodios de hipoglucemia.
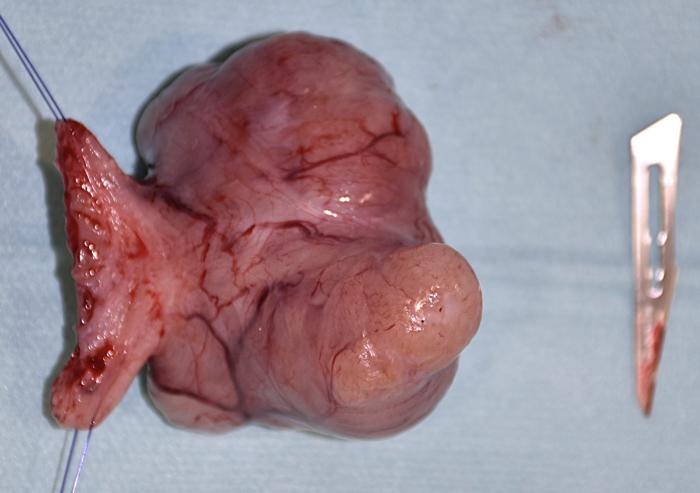
Figura 8. Imagen macroscópica del tumor con parte de la pared vesical libre de invasión.
Discusión
La hipoglucemia es un síndrome paraneoplásico observado con frecuencia en los insulinomas; sin embargo, aunque existen varios casos publicados de tumores de músculo liso que producen este síndrome2, después de revisar la literatura, no se encontraron otros casos descritos, por lo que se trataría del primer caso descrito de hipoglucemia paraneoplásica asociada a un leiomioma vesical en la especie canina.
Los pacientes con hipoglucemia paraneoplásica generalmente se presentan en consulta con signos clínicos neurológicos leves o incluso ausentes, debido a que la hipoglucemia se produce de forma paulatina, activándose los mecanismos compensatorios, pudiendo presentar niveles de glucosa por debajo de 50 mg/dl sin signos clínicos. Por el contrario, si los episodios se instauran de forma aguda, inducen una situación de neuroglicopenia que provocan signos clínicos como debilidad, ataxia, alteración del estado mental o convulsiones5. Por otra parte, los niveles bajos de fructosamina observados en este caso son consistentes con un periodo prolongado de hipoglucemia, sugiriendo un curso crónico.
El tratamiento de la hipoglucemia paraneoplásica es la extirpación completa del tumor, sin embargo, en los casos en los que no es posible, el uso de corticoides (por su efecto gluconeogénico y antagonizante de la insulina) y dietas a base de carbohidratos de absorción lenta con incremento de tomas diarias, pueden conseguir un buen control inicial de la hipoglucemia5.
Generalmente estos tumores, al igual que otros sarcomas de tejidos blandos, son potencialmente curables solo con cirugía, sin requerir tratamiento adyuvante con quimioterapia6.
Bibliografía
1. Bailey DB: Paraneoplastic syndromes. En Vail DM, Thamm DH, Liptak JM (ed): Withrow & MacEwen’s Small Animal Clinical Oncology, Missouri, Elsevier, 2020; 98-112.
2. Beaudry D, Knapp DW, Montgomery T, Sandusky GS, Morrison WB, Nelson RW: Hypoglycemia in four dogs with smooth muscle tumors. J Vet Intern Med 1995; 9(6):415-418.
3. Noguchi S, Kubo Y, Araki M: Big insulin-like growth factor 2-producing tumor in a hypoglycemic dog. Vet Pathol 2020; 57(3):432-436.
4. Heng HG, Lowry JE, Boston S, Gabel C, Ehrhart N, Gulden SM: Smooth muscle neoplasia of the urinary bladder wall in three dogs. Vet Radiol Utrasound 2006; 47(1):83-86.
5. Lunn KF, Boston SE: Tumors of the endocrine system. En Vail DM, Thamm DH, Liptak JM (ed): Withrow & MacEwen’s Small Animal Clinical Oncology, Missouri, Elsevier, 2020; 565-596.
6. Skinner OT: Cancer of the gastrointestinal tract (Gastric cancer). En Vail DM, Thamm DH, Liptak JM (ed): Withrow & MacEwen’s Small Animal Clinical Oncology, Missouri, Elsevier, 2020; 432-491.
 by Multimédica
by Multimédica