Inhibidores de la tirosina cinasa: actualización clínica
Resumen breve
La terapia con inhibidores de la tirosina cinasa (ITK, por sus siglas en inglés) se ha utilizado ampliamente en medicina humana como tratamiento frente a diferentes tipos de cánceres, pero su uso en veterinaria es relativamente reciente. Se trata de moléculas con actividad antitumoral, cuyo uso en medicina veterinaria está registrado para el tratamiento del mastocitoma canino (MCT) cutáneo. En la actualidad existen dos fármacos en medicina veterinaria, toceranib fosfato y masitinib.Índice de contenidos

¿Qué son los inhibidores de la tirosina cinasa?
La terapia con inhibidores de la tirosina cinasa (ITK, por sus siglas en inglés) se ha utilizado ampliamente en medicina humana como tratamiento frente a diferentes tipos de cánceres, pero su uso en veterinaria es relativamente reciente.
Se trata de moléculas con actividad antitumoral, cuyo uso en medicina veterinaria está registrado para el tratamiento del mastocitoma canino (MCT) cutáneo. En la actualidad existen dos fármacos en medicina veterinaria, toceranib fosfato y masitinib.
El toceranib fosfato, comercialmente conocido como Palladia©, es un inhibidor de la tirosina cinasa (ITK) aprobado por la FDA (Food and Drug Administration) en junio de 2009. Se administra por vía oral y, gracias a su actividad antitumoral y antiangiogénica, ayuda a controlar el microambiente tumoral y la angiogénesis. Dirige su efecto frente a gran cantidad de receptores celulares y receptores angiogénicos, como son el factor de crecimiento endotelial vascular (VEGFR, por sus siglas en inglés), factor de crecimiento derivado de plaquetas (PDGFR, por sus siglas en inglés), c- kit y Flt3.
La dosis máxima tolerada es de 3.25 mg/kg, administrada vía oral cada dos días, pero se ha descrito efectividad con dosis menores (de 2.5 a 2.8 mg/kg PO cada 2 días) gracias a lo cual los efectos adversos son mucho menores. En ocasiones se pueden emplear frecuencias y esquemas de dosificación flexibles que favorezcan la administración del fármaco, puesto que no se deben fraccionar los comprimidos.
Es un fármaco que, en general, presenta buena tolerancia, lo cual favorece su administración a largo plazo, aun así, es importante saber reconocer la toxicidad asociada a la medicación, para controlarla lo antes posible.
El cuadro descrito con mayor frecuencia está relacionado con alteraciones gastrointestinales (pérdida de apetito, vómitos y diarrea). Los síntomas se resuelven en la mayoría de los casos retirando la medicación durante unos días o reduciendo la dosis del fármaco. En ocasiones, es necesario administrar terapias de soporte como antieméticos, protectores de mucosa y probióticos; en casos graves puede ser necesaria la hospitalización del paciente.
También está descrita la aparición de neutropenias leves (en la mayoría de los casos asintomáticas y que se resolverán por sí solas, pero en casos de neutropenia grave, es necesario administrar antibioterapia de amplio espectro) y aumento de las enzimas hepáticas (en concreto de ALT) y de creatinina.
Por este motivo, se recomienda una base de datos clínicos y analíticos del paciente antes de comenzar el tratamiento y la monitorización de forma rutinaria mediante analítica sanguínea, hemograma y bioquímica, analítica de orina completa, medición de presión arterial y exploración física del paciente (Tabla 1).
| Visita | Hemograma | Bioquímica | Urianálisis/ presión arterial | Peso |
|---|---|---|---|---|
| Día 0 | + | + | + | + |
| Semana 2 | + | + | - | + |
| Semana 6 | + | - | + | + |
| C/ 4-6 sem | + | + | + | + |
Tabla 1. Esquema de revisiones durante el tratamiento con inhibidores de la tirosina cinasa.
Un pequeño porcentaje de perros tratados con toceranib puede desarrollar calambres musculares localizados, que se manejan con analgésicos o AINE, y los síntomas no suelen recurrir cuando se retoma la terapia.
Se ha descrito su uso fuera de registro para neoplasias no mastocíticas y junto con otras moléculas, como AINE, carboplatino o doxorrubicina.
Masitinib es el otro ITK comercializado en Europa y registrado para su uso en MCT cutáneo, que actúa principalmente sobre los receptores de Kit y posiblemente sobre los receptores de PDGF; se conoce comercialmente como Masivet©.
Su uso se describe también para el tratamiento de los MCT de alto grado, en este caso la respuesta al tratamiento es mejor en los pacientes que muestran mutación en el gen KIT, ya que aumenta el tiempo libre de progresión de la enfermedad.
La pauta de administración del tratamiento es diferente, en este caso se recomienda comenzar a razón de 12.5 mg/kg cada 24 h PO (con un intervalo de dosificación eficaz descrita de 11 a 14 mg/kg)
Los efectos adversos y las pautas de manejo, en caso de que se desarrollen, son similares a los descritos anteriormente (Figura 1).
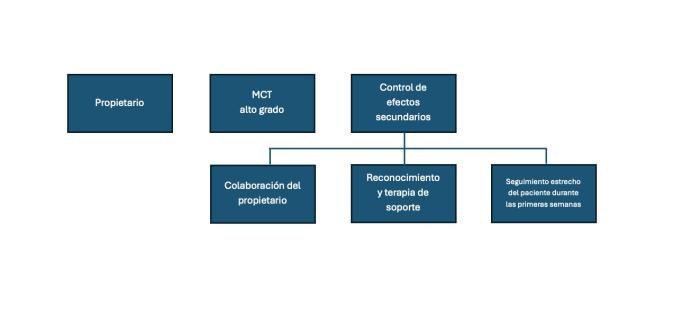
Figura 1. Selección de pacientes aptos para el tratamiento con inhibidores de la tirosina cinasa.
¿En qué tumores está registrado el uso de inhibidores de la tirosina cinasa en medicina veterinaria?
Tanto toceranib fosfato como masitinib están registrados como terapia frente al MCT cutáneo canino de alto grado Kiupel (antiguamente clasificado como grado II o grado III, según Patnakit).
Los MCT son una de las neoplasias cutáneas más comunes en el perro, su comportamiento biológico es variable (según la raza, la localización, etc.) y existen múltiples factores pronóstico que se deben tener en cuenta. El tratamiento de elección consiste en la resección quirúrgica y, en ocasiones, la administración de terapias adyuvantes.
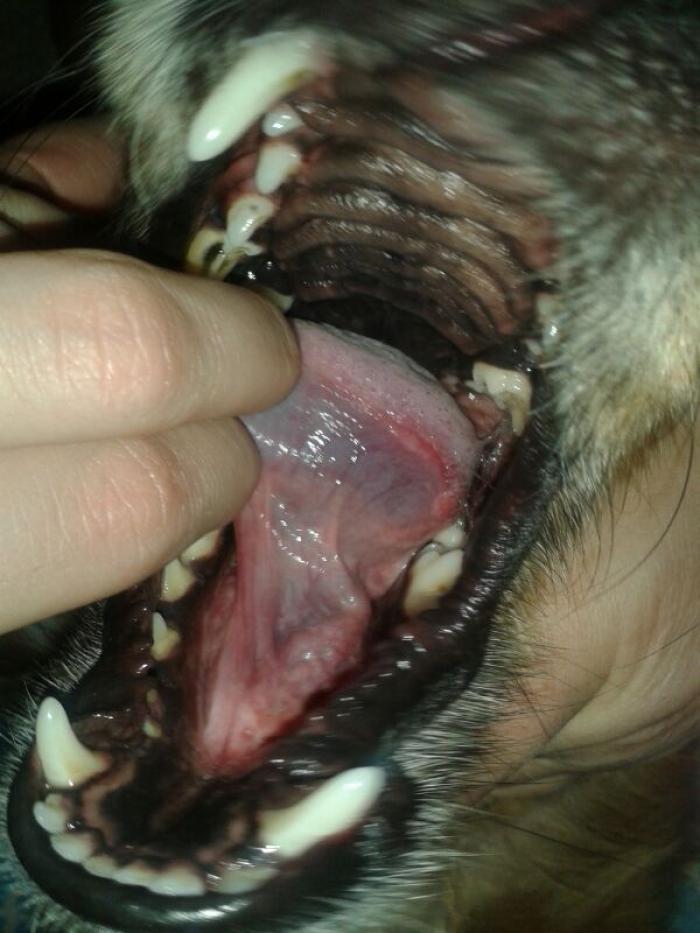
El uso de toceranib como tratamiento del MCT se describió por London et al. en 2009. Se trata de un estudio multicéntrico doble ciego, en el que se emplea toceranib en casos de recaída de MCT local por recidiva o a distancia por metástasis en perros con MCT cutáneo de alto grado. El principal objetivo de este estudio fue determinar la respuesta al tratamiento con toceranib y, de forma secundaria, la tasa de respuesta, la duración de la respuesta, la seguridad del fármaco y la calidad de vida aportada. El 42.8 % de los pacientes presentaron respuesta objetiva (remisión parcial o remisión completa), con una duración media de 12 semanas y un tiempo libre de progresión de 18 semanas. Además, se demostró buena calidad de vida en los pacientes que respondieron al tratamiento, con efectos adversos leves que se pudieron controlar sin excesivas complicaciones (Figura 2).
En años posteriores, se ha descrito la combinación de toceranib con otros antineoplásicos con acción frente al MCT. A continuación, se describen los protocolos más comunes:
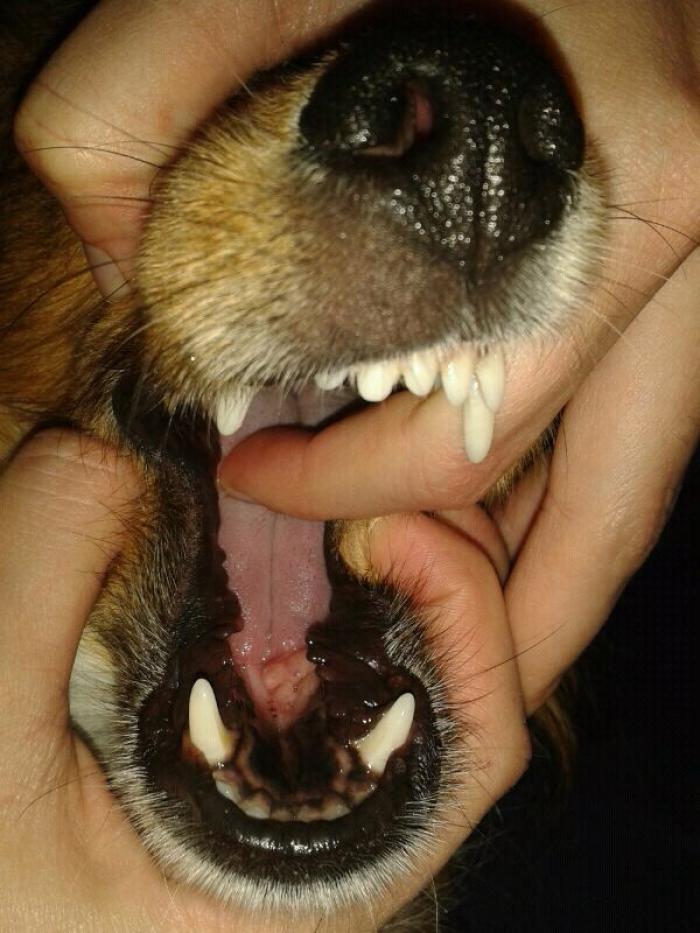
Figura 2. Mastocitomas tratados con inhibidores de la tirosina cinasa, antes del tratamiento y dos semanas después del inicio de este. (A, B) Toceranib fosfato. (C, D) Masitinib.

Toceranib + vinblastina
La combinación de este protocolo muestra una buena respuesta, tanto en MCT macroscópicos como en enfermedad microscópica. La tolerancia normalmente es buena, siendo la neutropenia el principal factor limitante para continuar el tratamiento. La tasa de respuesta es del 70-91 % y los tiempos medios de supervivencia oscilan entre 893 y 218 días, en pacientes con tratamiento posquirúrgico adyuvante y enfermedad macroscópica, respectivamente. Se han descrito varios protocolos; diversos autores, como Johanna E. Todd et al., 2021, refieren una dosis inicial de vinblastina de 2 mg/m2 la primera semana y después se disminuye a 1.6 mg/m2, combinada con toceranib fosfato a 2.75 mg/kg, 3 veces por semana; sin embargo, otros autores, como Olsen et al., 2018, recomiendan administrar vinblastina a 1.6 mg/m2 cada 2 semanas, 8 dosis, junto con toceranib a 2.5 mg/kg, 3 veces por semana, para prevenir neutropenias severas.
Toceranib + lomustina
Varios estudios describen su uso combinado, a pesar de que, en ocasiones, la toxicidad es más elevada en comparación con la que se desarrolla en otros protocolos, describiéndose neutropenias más severas, hepatotoxicidad y pancreatitis. La respuesta al tratamiento es muy variable, con un intervalo libre de enfermedad que oscila de 35 a 613 días. El protocolo más frecuente se basa en la administración de toceranib a dosis de 2.75 mg/kg cada 48 h, junto con lomustina a 60 mg/m2, por vía oral, cada 3 semanas, repitiendo la pauta un total de 6 veces.
Por lo tanto, toceranib, en líneas generales, es un fármaco bien tolerado por los pacientes y con buena respuesta para el tratamiento de los MCT cutáneos caninos de alto grado, y, en ocasiones, se puede usar de forma combinada con otros fármacos sin que aumenten potencialmente los efectos adversos de estos.
El masitinib está registrado para el tratamiento posquirúrgico de MCT de alto grado y según varios estudios, muestra una mejor respuesta en pacientes que presentan mutación en c- kit, con supervivencias entre 12 y 24 meses, con un 62 % y 39.8 % de los pacientes vivos, respectivamente, en comparación con el grupo placebo. El tiempo medio de supervivencia fue de 630 días en los pacientes que respondieron al tratamiento frente a los 137 días en los que no respondieron. Se ha descrito toxicidad en el 61.5 % de los perros tratados, pero en la mayoría de los casos, leve y autolimitante. El masitinib también ha demostrado ser eficaz frente a MCT macroscópicos. Según J. Grant et al., 2016, el 82 % de los perros mostraron respuesta clínica, de los cuales, en el 38.5 % se observó una respuesta completa y en el 43 % respuesta parcial, siendo los efectos adversos similares a los descritos anteriormente. Por otro lado, masitinib suele emplearse como monoterapia; su uso se ha descrito frente a MCT macroscópico y microscópico.
Se ha descrito mejor respuesta a masitinib en pacientes con mutación en KIT. Sin embargo, toceranib y vinblastina tienen una respuesta similar, independientemente de si hay mutación KIT o no (Weisharr et al., 2018).
¿Y qué hay del uso de inhibidores de la tirosina cinasa en tumores no mastocíticos caninos?
Debido a la similitud entre toceranib y sunitinib (un ITK) ampliamente utilizado en medicina humana) se ha extrapolado el uso de la molécula veterinaria (toceranib) en neoplasias no mastocitoma (es decir, fuera del registro del fármaco). Así, aunque hay muchas publicaciones que hacen referencia al empleo de este ITK en casos clínicos aislados, también existen referencias bibliográficas que describen su uso como terapia médica para determinados tumores, como las neoplasias neuroendocrinas, los tumores del estroma gastrointestinal (GIST, por sus siglas en inglés) y los adenocarcinomas del saco anal en el perro.
La acción del toceranib sobre otros receptores, además de c-kit, que participan en la angiogénesis (VEGF o factor de crecimiento endotelial vascular, PDGF o factor de crecimiento derivado de las plaquetas) y que han sido identificadas en las neoplasias neuroendocrinas (como el carcinoma tiroideo o el insulinoma) ha justificado investigar su uso en este tipo de tumores. Aunque no supone la primera línea de tratamiento para neoplasias neuroendocrinas, puede ser una opción en el caso de tumores inoperables o metastásicos, aportando beneficio clínico en muchas ocasiones; es decir, enfermedad estable, remisión parcial o, en contadas ocasiones, remisión completa.
Distintas publicaciones describen un beneficio clínico aproximado del 80 % en perros con diagnóstico de carcinoma tiroideo tratados con toceranib, aunque su beneficio en enfermedad microscópica (es decir, tras el tratamiento quirúrgico) no está demostrado. Existen pocas referencias al respecto, pero, en líneas generales, se elige el uso de toceranib en enfermedad macroscópica, y algunos autores también describen su uso tras cirugía cuando la radioterapia no es una opción o cuando existen factores pronóstico negativos como un tamaño mayor a 5 cm, invasión de tejidos, elevado índice mitótico o afección de más de un lóbulo tiroideo. Sheppard-Olivares y col. (2021), describen un tiempo de progresión de 206 días y una supervivencia de 563 días para los perros tratados con toceranib (n=26).
De igual forma, se ha sugerido el empleo de sunitinib en medicina humana en el caso de feocromocitomas inoperables o metastásicos, por lo que, debido a la semejanza de esta molécula con toceranib, existen algunas publicaciones, con datos retrospectivos, que sugieren su uso en situaciones similares en medicina veterinaria, describiendo beneficio clínico (enfermedad estable, remisión parcial) en la mayoría de los casos, con tiempos de supervivencia de hasta más de 12 meses.
Los tumores del estroma gastrointestinal (GIST) son neoplasias poco frecuentes en el perro (y en el gato) que derivan de las células de Cajal y suelen afectar con más frecuencia al ciego. El tratamiento de este tipo de tumores en medicina humana incluye el uso de inhibidores de la tirosina cinasa, por lo que, de igual forma, se ha probado su uso en medicina veterinaria, tanto en enfermedad macroscópica como tras tratamiento quirúrgico. Berger y col. (2018), describen remisión completa en el 71 % de los tumores macroscópicos tratados (n=3), remisión parcial y enfermedad estable (es decir, beneficio clínico); con un tiempo de progresión de 110 semanas. También se describe beneficio en los casos con metástasis o con un elevado índice mitótico tras el tratamiento quirúrgico.
Los insulinomas son las neoplasias más frecuentes del páncreas y no siempre es factible el tratamiento quirúrgico, además, su potencial metastásico es elevado. Es por ello por lo que, además del control de los signos clínicos, son necesarias terapias que controlen la evolución de la enfermedad. Se trata de tumores quimiorresistentes, en los que toceranib parece aportar beneficio clínico y mayores supervivencias, tanto en lesiones macroscópicas inoperables, como tras el tratamiento quirúrgico. Del Castillo y col. (ECVIM, 2020), describen una supervivencia de 557 días en perros tratados con cirugía y toceranib (n=10), y de 984 días en perros tratados solo con toceranib (n=10).
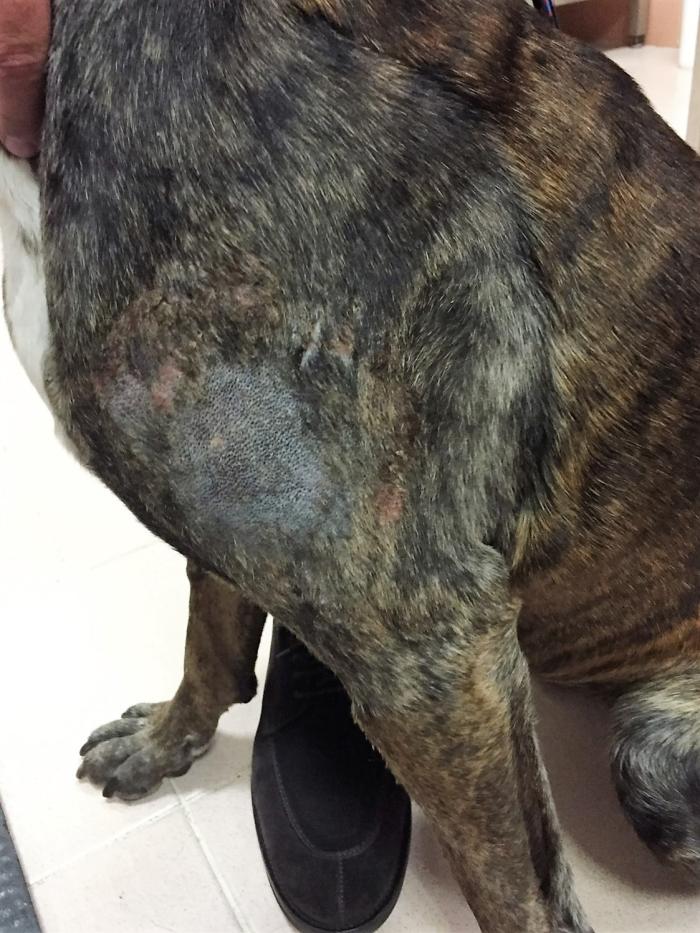
Los adenocarcinomas apocrinos del saco anal en el perro (AGASACA, por sus siglas en inglés) son neoplasias con un comportamiento biológico similar a los tumores neuroendocrinos, en los que, en estadios iniciales, la cirugía (combinada o no con radioterapia) es el tratamiento de elección, pero, cuando esta no es posible o existen factores pronóstico negativos, las opciones terapéuticas son limitadas. Se ha descrito el uso de toceranib en este tipo de neoplasias, tanto en enfermedad macroscópica, como tras tratamiento quirúrgico. Aunque no existe consenso acerca de si debe emplearse o no tras cirugía, sí parece suponer un beneficio clínico en animales con estadios clínicos avanzados, aportando enfermedad estable y aumentando los tiempos de supervivencia. Elliot (2019) publica el uso de toceranib en perros con AGASACA en estadio IV (metástasis a distancia) (n=15) obteniendo una supervivencia de 356 días; y Heaton y col. (2020), describen tiempos libres de progresión de 313 días y supervivencias de 827 día (Figura 3).
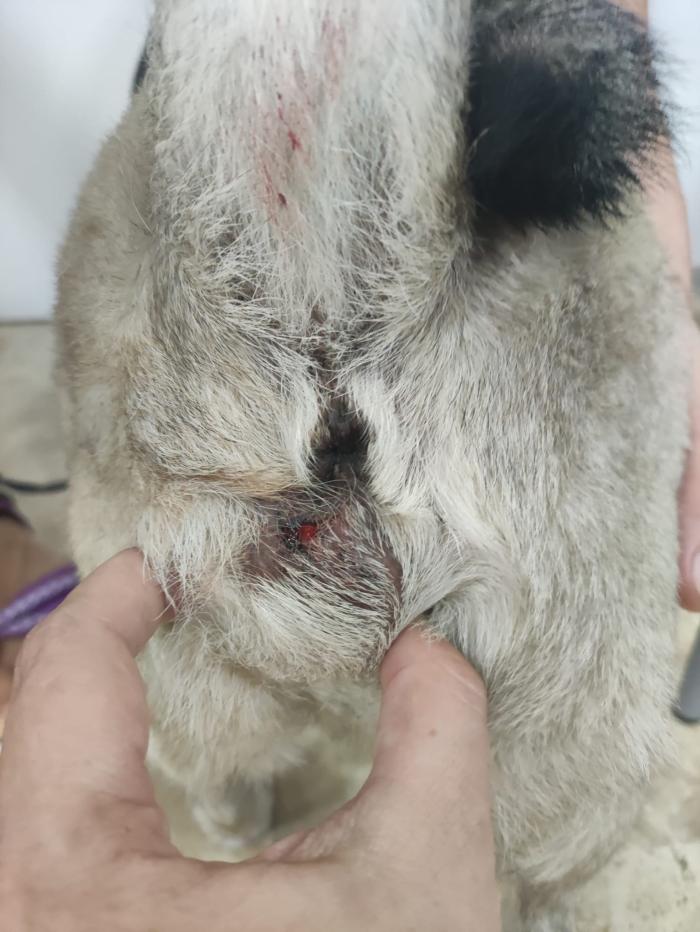
Figura 3. Adenocarcinoma del saco anal en un perro mestizo.
De lo descrito hasta ahora, se puede concluir que, aunque la evidencia científica es limitada y las publicaciones describen los resultados de estudios retrospectivos o casos aislados, la investigación del empleo de toceranib como opción terapéutica en estas neoplasias está justificada.
En relación con el otro ITK disponible en medicina veterinaria, masitinib, las publicaciones relativas a su uso en tumores no mastocitoma, son escasas y anecdóticas, probablemente por su acción frente a una menor cantidad de tirosinas cinasas. Se ha descrito su uso en dermatitis atópica, con resultados satisfactorios, en enfermedad crónica intestinal como tratamiento de rescate, y en el manejo del linfoma epiteliotropo, con respuestas parciales (n=5, durante 60 días) y totales (n=2, durante 85 días), aunque los perros que habían recibido otros tratamientos previos no demostraron respuesta (n=3).
¿Y qué se sabe de los gatos?
En la actualidad no hay ningún ITK cuyo uso esté registrado en la especie felina; si a esto le unimos que los gatos tienen menos neoplasias y con menos frecuencia, las publicaciones relativas a su uso, fuera de registro, en esta especie son escasas.
Los primeros datos respecto a la seguridad de su uso en gatos datan de 2011, acerca del empleo de masitinib en gatos sanos, y de 2013 en adelante, sobre el uso de toceranib y su tolerancia. Estas escasas publicaciones indican que la tolerancia de estas moléculas en esta especie es buena, presentando menos efectos adversos que en el perro y, en el caso del toceranib, tolerando dosis más altas (aproximadamente de 3 mg/kg cada 48 h, para poder ajustar la administración de la terapia a la presentación comercial de los comprimidos) sin que aparezcan neutropenias ni toxicidad digestiva significativas. Así, aunque los datos son escasos, se ha sugerido el uso de toceranib combinado con AINE como terapia antiangiogénica, y su empleo como terapia alternativa en diferentes neoplasias.
En 2018, Berger y col., describen el empleo de toceranib fosfato en gatos con MCT. Se trata de un estudio retrospectivo multiinstitucional, en el que se incluyen gatos con MCT cutáneo (n=22), visceral (n=10) y alimentario (n=17), combinado normalmente con corticoterapia. La mayoría de los gatos toleraron el tratamiento (dosis 1.6-3.5 mg/kg, media 2.5 mg/kg) que se administró, en la mayor parte de los casos, 3 veces por semana. Se observó beneficio clínico en el 86 % de los gatos con MCT cutáneo, 80 % de los MCT viscerales y 76 % de los alimentarios (Figura 4). El resto de los datos acerca del uso de inhibidores tirosina cinasa en MCT felino hacen referencia a casos aislados o estudios in vitro, sugiriendo eficacia tanto de masitinib como de imatinib.

Figura 4. (A) Mastocitoma con atipias citológicas significativas en un gato Común europeo. (B) Evolución de la lesión 3 semanas después del tratamiento con toceranib fosfato y una sesión de electroquimioterapia.

En relación con el manejo de otros tumores felinos, existen algunos datos acerca del sarcoma asociado al punto de inyección (SAPI), el carcinoma de células escamosas (CCE) y los tumores mamarios (TMF) con metástasis a distancia (estadio IV).
Holterman et al. (2017), no aprecian respuesta en 15 gatos con SAPI macroscópico (no sometido a cirugía) en un estudio prospectivo, indicando la ausencia de efectos adversos significativos.
Existen varios artículos acerca de la eficacia de toceranib en el manejo del CCE oral felino, aunque la mayor parte se centra en la tolerancia de este. Wiles et al. (2017), describen que los gatos que muestran respuesta a toceranib con/sin AINE presentan beneficio clínico y supervivencias de 23 días.
Su uso también parece justificado en determinados TMF, Petrucci et al. (2021), comparan distintas opciones terapéuticas en gatos con metástasis a distancia (estadio IV). Según el grupo investigado, las gatas sin sintomatología clínica y sin efusión pleural presentaron mejor respuesta a las diferentes terapias, con una media de supervivencia de 63 días para el grupo tratado con toceranib, y algunos individuos presentando supervivencias mayores.
Aunque el carcinoma pancreático es una neoplasia muy poco frecuente, es el tumor más común en el páncreas del gato. En un estudio retrospectivo reciente (Rosario et al., 2023) que incluye 26 gatos con carcinoma de páncreas (tanto con enfermedad macroscópica como después de la cirugía) se concluye, igualmente, que la tolerancia al tratamiento es buena y que, los gatos que muestran respuesta al tratamiento podrían verse beneficiados por esta terapia.
Por lo tanto, es generalmente aceptada la buena tolerancia de los inhibidores de la tirosina cinasa en la especie felina, pero aún son necesarios estudios que aclaren su papel como terapia en las neoplasias del gato.
Bibliografía
- Feo Bernabe, Luis, Roberta Portela, Sandra Nguyen, William C. Kisseberth, Michael Pennell, Mark F. Yancey, and Cheryl A. London.Evaluation of the Adverse Event Profile and Pharmacodynamics of Toceranib Phosphate Administered to Dogs with Solid Tumors at Doses Below the Maximum Tolerated Dose.
- London, C.Kinase Inhibitors in Cancer Therapy.
- London, Cheryl A. 2013.Kinase Dysfunction and Kinase Inhibitors. Vol. 24 Wiley. doi:10.1111/j.1365-3164.2012.01081.x.
- London, Cheryl A.. 2009.Tyrosine Kinase Inhibitors in Veterinary Medicine. Vol. 24 Elsevier BV. doi:10.1053/j.tcam.2009.02.002.
- London, Cheryl A., Phyllis B. Malpas, Stacey L. Wood-Follis, Joseph F. Boucher, Anthony W. Rusk, Mona P. Rosenberg, Carolyn J. Henry, et al. 2009.Multi-Center, Placebo-Controlled, Double-Blind, Randomized Study of Oral Toceranib Phosphate (SU11654), a Receptor Tyrosine Kinase Inhibitor, for the Treatment of Dogs with Recurrent (either Local Or Distant) Mast Cell Tumor Following Surgical Excision. Vol. 15 American Association for Cancer Research (AACR). doi:10.1158/1078-0432.ccr-08-1860.
- Tjostheim, S. S., R. L. Stepien, L. E. Markovic, and T. J. Stein. 2016.Effects of Toceranib Phosphate on Systolic Blood Pressure and Proteinuria in Dogs. Vol. 30 Wiley. doi:10.1111/jvim.13951.
- Yancey, Mark F., D. A. Merritt, S. P. Lesman, J. F. Boucher, and G. M. Michels. 2009a.Pharmacokinetic Properties of Toceranib Phosphate (Palladia™, SU11654), a Novel Tyrosine Kinase Inhibitor, in Laboratory Dogs and Dogs with Mast Cell Tumors. Vol. 33 Wiley. doi:10.1111/j.1365-2885.2009.01133.x.
- Burton, J. H., R. O. Venable, D. M. Vail, L. E. Williams, C. A. Clifford, S. M. Axiak‐bechtel, A. C. Avery, and D. H. Thamm. 2015.Pulse‐Administered Toceranib Phosphate Plus Lomustine for Treatment of Unresectable Mast Cell Tumors in Dogs. Vol. 29 Wiley. doi:10.1111/jvim.13573.
- Garrett, Laura D. 2014.Canine Mast Cell Tumors: Diagnosis, Treatment, and PrognosisInforma UK Limited. doi:10.2147/vmrr.s41005.
- Grant, J., S. North, and D. Lanore. 2016.Clinical Response of Masitinib Mesylate in the Treatment of Canine Macroscopic Mast Cell Tumours. Vol. 57 Wiley. doi:10.1111/jsap.12480.
- Hahn, K. A., G. Oglivie, T. Rusk, P. Devauchelle, A. Leblanc, A. Legendre, B. Powers, et al. 2008.Masitinib is Safe and Effective for the Treatment of Canine Mast Cell Tumors. Vol. 22 Wiley. doi:10.1111/j.1939-1676.2008.0190.x.
- Hahn, Kevin A., Alfred M. Legendre, Neil G. Shaw, Brenda Phillips, Gregory K. Ogilvie, Deborah M. Prescott, Stephen W. Atwater, et al.Median Inhibitory Concentration MCT Mast Cell Tumor TKI Tyrosine Kinase Inhibitor TTP Time to Progression WT Wild Type.
- Olsen, Jaime A., Maurine Thomson, Kathleen O'connell, and Ken Wyatt. 2018.Combination Vinblastine, Prednisolone and Toceranib Phosphate for Treatment of Grade II and III Mast Cell Tumours in Dogs. Vol. 4 Wiley. doi:10.1002/vms3.106.
- Smrkovski, O. A., L. Essick, B. W. Rohrbach, and A. M. Legendre. 2013.Masitinib Mesylate for Metastatic and Non‐resectable Canine Cutaneous Mast Cell Tumours. Vol. 13 Wiley. doi:10.1111/vco.12053.
- Todd, Johanna E., Sandra M. Nguyen, Joanna White, Veronika Langova, Penelope M. Thomas, and Sophia Tzannes.Combination Vinblastine and Palladia for High-Grade and Metastatic Mast Cell Tumors in Dogs.
- Weishaar, K. M., E. J. Ehrhart, A. C. Avery, J. B. Charles, R. E. Elmslie, D. M. Vail, C. A. London, C. A. Clifford, J. C. Eickhoff, and D. H. Thamm. 2017.c‐Kit Mutation and Localization Status as Response Predictors in Mast Cell Tumors in Dogs Treated with Prednisone and Toceranib Or Vinblastine. Vol. 32 Wiley. doi:10.1111/jvim.14889.
- Alonso-Miguel D, García-San José P, González S, et al. Evaluation of palliative therapy, alone or in combination with toceranib phosphate, in dogs diagnosed with metastatic or recurrent beta-cell neoplasia. N Z Vet J. 2021. 69(4):234-239. DOI:10.1080/00480169.2021.
- Berger EP, Johannes CM, Jergens AE, et al. Retrospective evaluation of toceranib phosphate (Palladia©) use in the treatment of gastrointestinal stromal tumors of dogs. J Vet Inter Med. 2018. 32(6):2045-2053. DOI: 10.1111/jvim.15335.
- Domingo V, Ruano R, Martínez de Merlo E, et al. Clinical response and avdverse effects assessment in dogs bearing non-mast cell tumours treated with toceranib. ESVONC Congress. 2013.
- Domingo V, Ruano R, Martínez de Merlo E, et al. Toceranib and COX2 inhibitor as palliative treatment or adjuvant to conservative surgery in dogs with oral melanoma. ESVONC Congress. 2014.
- Del Castillo N, de la Riva C, Rayón N, et al. Toceranib phosphate in the management of insulinoma in dogs. Poster. ECVIM Congress. 2020.
- Frezoulis P, Harper A. The role of toceranib phosphate in dogs with non-mast cell neoplasia. A systematic review. 2021. Journal Veterinary Comparative Oncology. DOI: 10.1111/vco.12799.
- Heaton CM, Fernandez AF, Jark PC, Pan X. Evaluation of toceranib for treatment of apocrine gland anal sac adenocarcinoma in dogs. J Vet Intern Med. 2020. 34(2): 873-881. DOI: 10.1111/jvim.15706.
- Holterman N, Kiupel M, Kessler M, et al. Masitinib monotherapy in canine epitheliotropic lymphoma. Vet Comp Oncol. 2016. 14(1): 127-35. DOI: 10.1111/vco.12157.
- Musser ML, Taikowski KL, Johannes CM, Bergman PJ. Retrospective evaluation of toceranib phosphate (Palladia©) use in the treatment of inoperable, metastatic, or recurrent canine pheochromocytomas: 5 dogs (2014-2017). Veterinary Research. 2018. 14:772. DOI: 10.1186/s12917-018-1597-7.
- Sheppard- Olivares S, Bello NM, Wood E. Toceranib phosphate in the treatment of canine thyroid carcinoma: 42 cases (2009-2018). Vet Comp Oncol. 2020. 18(4):519-527. DOI:10.1111/vco.12571.
- Sheppard-Olivares S, Bello NM, Johanes CM, et al. Toceranib phosphate in the management of canine insulinoma: A retrospective multicenter study of 30 cases (2009-2019). Vet Record. 2021. DOI: 10.1002/vro2.27.
- Yamazaki H, Tanaka T, Mie K, et al. Assessment of postoperative adjuvant treatment using toceranib phosphate against adenocarcinoma in dogs. J Vet Inter Med. 2020. 34(3): 1272-1281.
- Berger EP, Johanes CM, Post G, et al. Retrospective evaluation of toceranib phosphate (Palladia) use in cats with mast cell neoplasia. J Feline Med Surg. 2018. 20(2): 95-102. DOI: 10.1177/1098612X17695898.
- Daly M, Sheppard S, Cohen N, et al. Safety of masitinib mesylate in healthy cats. J Vet Intern Med. 2011. 25(2): 297-302.
- Harper A, Blackwood L. Toxicity, and response in cats with neoplasia treated with toceranib phosphate. J Feline Med Surg. 2017. 19(6): 619-623. DOI: 10.1177/1098612X16643124.
- Holtermann N, Kiupel M, Hirschberger J. The tyrosine inhibitor toceranib in feline injection site sarcoma: efficacy and side effects. Vet Comp Oncol. 2017. 15(2): 632-640. DOI: 10.1111/voc.12207.
- Keepman SJ, Pellin MA. Low dose meloxicam is safe and tolerable when combined with toceranib phosphate in cancer-bearing cats. J Feline Med surg. 2022. 24(12): 1187-1194. DOI: 10.1177/1098612X211067023.
- Lara A, Vilar-Saavedra P, Martínez-Rizafa I, et al. Assesment of adverse effects and response to tyrosine kinase inhibitors in cats with malignant neoplasia. ESVONC Congress. 2013.
- Leo C, Stell A, Borrego J, et al. Evaluation of low-dose metronomic (LDM) cyclophosphamide toxicity in cats with malignant neoplasia. J Feline Med Surg. 2014. 16(8): 671-8. DOI:10.1177/1098612X13518938.
- Merrick CH, Pierro J, Schleis E, et al. Retrospective evaluation of toceranib phosphate (Palladia©) toxicity in cats. Vet Comp Oncol. 2017. 15(3):710-717. DOI: 10.1111/vco.12211.
- Olmsted GA, Farrelly J, Post G, Smith J. Tolerability of toceranib phosphate (Palladia) when used in conjunction with other therapies in 35 cats with feline oral squamous cell carcinoma: 2009-2013. J Feline Med Surg. 2017. 19(6): 568-575. DOI: 10.1177/1098612X16638118.
- Ortiz C, Musser ML, Yuan L, et al. Retrospective evaluation of toceranib phosphate (Palladia) use in the treatment of feline pancreatic carcinoma. Can Vet J. 2023. 64(12): 1143-1148.
- Petrucci G, Henriques J, Gregorio H, et al. Metastatic feline mammary cancer: prognostic factors, outcome and comparison of different treatment modalities – a retrospective multicenter study. J Feline Med Surg. 2021. 23(6): 549-559. DOI: 10.1177/1098612X20694416.
- Wiler V, Hohenaus A, Lamb K, et al. Retrospective evaluation of toceranib phosphate (Palladia) in cats with oral squamous cell carcinoma. J Fel Med Surg. 2017. 19(2): 185-193. DOI: 10.1177/10986612X1562237.
 by Multimédica
by Multimédica