Leucemia linfocítica crónica de linfocitos B: a propósito de un caso
Resumen breve
Se presenta un caso clínico de leucemia linfocítica crónica de linfocitos B en una perra de 13 años, de raza Pastor alemán. Se describe la presentación y evolución de la enfermedad, el diagnóstico de esta y el tratamiento empleado, basado en la combinación del fármaco quimioterápico clorambucilo administrado a dosis pulsátiles cada 2 semanas y prednisona. El tratamiento con clorambucilo a dosis pulsátiles fue efectivo, consiguiendo un recuento de linfocitos normal al sexto ciclo de administración.Índice de contenidos

Resumen
La leucemia linfocítica crónica (LLC) es una proliferación clonal de linfocitos pequeños y maduros, manifestada como una linfocitosis periférica persistente. La LLC es más prevalente que la leucemia linfocítica aguda (LLA) en perros. Existen tres subtipos: la de células T (LLC-T) la de células B (LLC-B) y LLC atípica. La LLC-B se diagnostica comúnmente en perros mayores y generalmente es asintomática.
El tratamiento con quimioterapia no siempre es necesario. Se recomienda monitoreo con exámenes físicos y hemogramas seriados. El clorambucilo es el tratamiento más efectivo administrado de forma diaria combinado con prednisona. El pronóstico es generalmente bueno, con una supervivencia que puede alcanzar los 3 años.
Se presenta un caso clínico de leucemia linfocítica crónica de linfocitos B en una perra de 13 años, de raza Pastor alemán. Se describe la presentación y evolución de la enfermedad, el diagnóstico de esta y el tratamiento empleado, basado en la combinación del fármaco quimioterápico clorambucilo administrado a dosis pulsátiles cada 2 semanas y prednisona. El tratamiento con clorambucilo a dosis pulsátiles fue efectivo, consiguiendo un recuento de linfocitos normal al sexto ciclo de administración.
Introducción
La leucemia linfocítica crónica (LLC) es una proliferación clonal neoplásica de linfocitos pequeños y maduros que se manifiesta como una linfocitosis periférica persistente (≥3 meses). Las leucemias linfocíticas son más prevalentes que las leucemias mieloides en los perros y la leucemia linfocítica crónica (LLC) es más frecuente que la leucemia linfocítica aguda (LLA). La causa de la LLC aún es desconocida, pero se ha identificado un componente genético1,2.
Se identifican tres subtipos de LLC que se diferencian en la inmunofenotipificación: la LLC de linfocitos T (LLC-T), que es la forma más común, con linfocitos CD3+/ CD8+, la LLC de linfocitos B (LLC-B) (CD21+), que es el siguiente subtipo más común, y la LLC atípica, que representa una combinación de inmunofenotipos (CD3-, CD8+; CD3+, CD4-, CD8-; CD3+, CD4+, CD8+ y CD3+ + CD21+)3.
La leucemia linfocítica de células B suele diagnosticarse en perros de mediana a avanzada edad, estableciéndose la edad media de diagnóstico en los 11 años4,5.
Generalmente no suelen aparecer signos clínicos; de hecho, muchas veces es un hallazgo casual en los controles rutinarios o chequeos geriátricos. A veces, puede detectarse letargo, apatía, hiporexia, pérdida de peso y vómitos. En la exploración, puede detectarse linfadenopatía leve, palidez de las mucosas, esplenomegalia y, en menor medida, hepatomegalia. Estos signos se deben a la acumulación de linfocitos neoplásicos en la médula ósea, los ganglios linfáticos y otros tejidos, así como a las alteraciones inmunológicas que supone el proceso2,5,6.
Con el transcurso de la enfermedad, algunos perros pueden desarrollar lo que se conoce como síndrome de Richter (SR), que consiste en el desarrollo de un linfoma agresivo. Los datos de incidencia en veterinaria todavía son limitados, pero en medicina humana, ocurre en un 2 - 20 % de los casos. Existe un estudio en veterinaria que incluye 153 perros con LLC y se demostró el desarrollo de SR en ocho casos (un 5.2 % del total), dos de ellos con inmunofenotipo de células T (2.2 % de LLC-T) y seis con inmunofenotipo de células B (10.9 % de LLC-B)7.
En el diagnóstico diferencial, deben descartarse otras causas de linfocitosis persistente, como la estimulación antigénica por enfermedades infecciosas (p. ej., E. canis, S. lupi, L. infantum, T. gondii), enfermedades autoinmunes (como la anemia hemolítica inmunomediada), enfermedades endocrinas (como el hipoadrenocorticismo e hipertiroidismo), linfocitosis posvacunación, timoma y trastornos linfoproliferativos (como LLA y linfoma en estadio V) o menos frecuentemente, trastornos congénitos de inmunodeficiencia8.
El diagnóstico en veterinaria se lleva a cabo por la información morfológica, inmunofenotípica y genética molecular en sangre, médula ósea y otros órganos infiltrados. No obstante, la historia clínica, la exploración del paciente y la evaluación laboratorial son de suma importancia. La demostración de clonalidad en el análisis genético molecular puede llevar al diagnóstico de neoplasia. La inmunofenotipificación con citometría de flujo permite obtener el diagnóstico definitivo e identificar proliferaciones de linfocitos B y T1,2.
El hallazgo más significativo que puede detectarse en el hemograma es una linfocitosis persistente de más de 3 meses, que puede ir acompañada de citopenias de otras líneas celulares, a menudo una anemia normocítica, normocrómica y no regenerativa leve. En casos graves, la anemia puede ser moderada a grave, y puede ir acompañada de neutropenia y/o trombocitopenia, la mayoría de los casos leve. Además, en el proteinograma puede detectarse una gammapatía monoclonal y en la bioquímica, hipercalcemia5,6. No hay un rango de linfocitosis absoluta establecido, pero se considera entre 6000 a más de 200000 linfocitos/μl2.
En el análisis morfológico de la sangre periférica, se obtiene una población de linfocitos pequeños de aspecto maduro, con núcleos redondos pequeños, cromatina condensada, sin nucléolos aparentes y bordes de citoplasma basofílico9 (Figura 1).
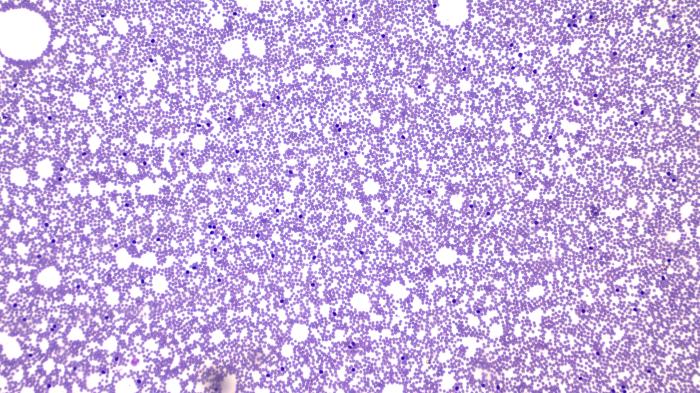
Figura 1. (A) frotis sanguíneo de un caso de LLC de linfocitos T en el que a pocos aumentos (10x) puede observarse una franca linfocitosis. (B, C) (40x) se aprecia la morfología de los linfocitos maduros con núcleos de cromatina condensada y citoplasmas con ligera basofilia.
El diagnóstico definitivo de la LLC se obtiene en algunos casos mediante la punción de la médula ósea y la realización del correspondiente mielograma. En el aspirado de médula ósea e histopatología de tejidos afectados se observa una proliferación significativa (>30 %) de linfocitos pequeños y maduros2,6.
La citometría de flujo es una herramienta útil para establecer un diagnóstico y un pronóstico, evaluando el tamaño de las células, la complejidad citoplasmática y la expresión de proteínas de superficie celular e intracelular. La identificación de antígenos de superficie en linfocitos permite su tipificación y determinar el grado de maduración celular6,9. La utilidad de esta herramienta radica en su capacidad para detectar la expresión de múltiples antígenos en la superficie de los linfocitos, lo cual permite caracterizar los linfocitos circulantes. Los anticuerpos disponibles permiten reconocer CD3 y CD5 caninos (asociados a los linfocitos T), CD4 (subconjunto de linfocitos T), CD8 (subconjunto de linfocitos T), CD21 (linfocitos B), CD34 (células precursoras) y CD45 (antígeno común de leucocitos)10,11.
En aquellos casos en los que la citología, histología e inmunofenotipificación no pueden proporcionar un diagnóstico definitivo de malignidad, se puede recurrir al estudio de la clonalidad mediante PCR para detectar reordenamientos del receptor de antígeno (PARR). La linfocitosis causada por leucemia o linfoma se caracteriza por una expansión homogénea de células con un solo fenotipo, mientras que las expansiones reactivas de linfocitos asociadas a una respuesta inflamatoria son heterogéneas. Por lo tanto, el hallazgo de una población clonal de linfocitos mediante el ensayo PARR, junto con la expansión homogénea de linfocitos basada en la inmunofenotipificación, es una evidencia sólida de neoplasia8.
El tratamiento con agentes quimioterápicos no siempre es una opción para la leucemia linfocítica crónica. En muchos casos, se recomienda monitorización con exámenes físicos mensuales y realización de hemogramas seriados. Se establece la afectación de órganos, la presencia de citopenias, linfadenopatía o esplenomegalia como criterios para el inicio de quimioterapia5.
El clorambucilo es la terapia más efectiva para la LLC. Se recomienda una dosis de 0.2 mg/kg de peso (o 6 mg/m²), por vía oral, cada 24 horas durante 7 a 14 días, seguido de 0.1 mg/kg (o 3 mg/m²) por vía oral, cada 24 horas. Para el mantenimiento a largo plazo, se puede usar 2.0 mg/m² cada dos días3,5. Existe la posibilidad de la administración pulsátil a dosis de 20 mg/m2 cada 2 semanas12. Se recomienda ajustar la dosis de clorambucilo en función de la respuesta clínica del paciente y la tolerancia de la médula ósea. Se suele combinar con prednisona oral con una dosis inicial de 1 mg/kg por vía oral, cada 24 horas durante 7 a 14 días, seguida de 0.5 mg/kg por vía oral, cada 48 horas3,5.
En etapas avanzadas o en pacientes refractarios, se puede sustituir la prednisona por vincristina o el clorambucilo por ciclofosfamida5. Los protocolos de linfoma de alto grado también se han utilizado en animales con LLC que no responden al tratamiento convencional2. Incluso se ha publicado un reciente estudio con resultados prometedores en el que se propone el imatinib como una buena opción como terapia adyuvante junto con el tratamiento con prednisona y clorambucilo en perros sin respuesta al tratamiento. Además, surgen terapias dirigidas novedosas para la LLC humana como los inhibidores del receptor de células B, inhibidores de la fosfatidilinositol-4,5-bifosfato 3-quinasa, anticuerpos monoclonales anti-CD20 y antagonistas de Bcl-2, pero no hay evidencia de su uso en medicina veterinaria1.
El pronóstico de la enfermedad es bueno, con una supervivencia que puede alcanzar los 3 años6. Incluso se ha descrito supervivencias de un año sin tratamiento. En un 70 % de los casos tratados, se consigue normalizar el recuento de linfocitos3. Existe un estudio que asocia la raza Bóxer y un alto Ki67 con tiempos medios de supervivencia (TMS) menores de 178 días y 173 días respectivamente13. El inmunofenotipo de LLC parece que tiene valor pronóstico y se establecen los TMS de 930 días, 480 días y 22 días para LLC-T, LLC-B y LLC atípica, respectivamente3.
Caso clínico
Se presenta en consulta una hembra canina esterilizada de 13 años, de raza Pastor alemán con peso de 31 kg con historial de artrosis, acuden porque presenta vómitos esporádicos, sin otro signo clínico asociado.
En el examen físico se detecta linfadenopatía generalizada leve y dolor articular, el resto de la exploración física se encuentra dentro de la normalidad. Se toma una muestra de sangre para realizar hemograma y bioquímica, obteniéndose un hemograma con una leucocitosis de 130.85 K/μl, linfocitosis de 121.26 K/μl y monocitosis de 4.19 K/μl. En la bioquímica y el urianálisis no se encuentran alteraciones relevantes.
Se realiza también una ecografía abdominal, evidenciando engrosamiento de pared vesical, ganglios linfáticos abdominales aumentados de tamaño e hipoecoicos y patrón esplénico multinodular (patrón en panal de abeja).
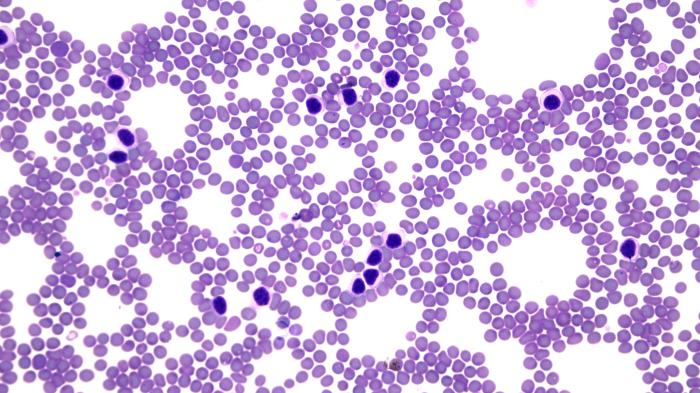
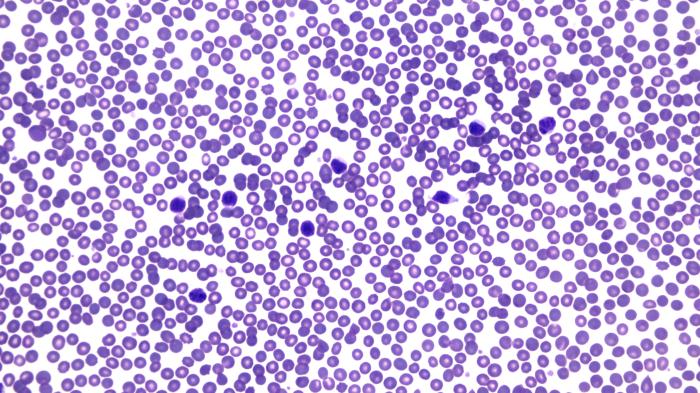
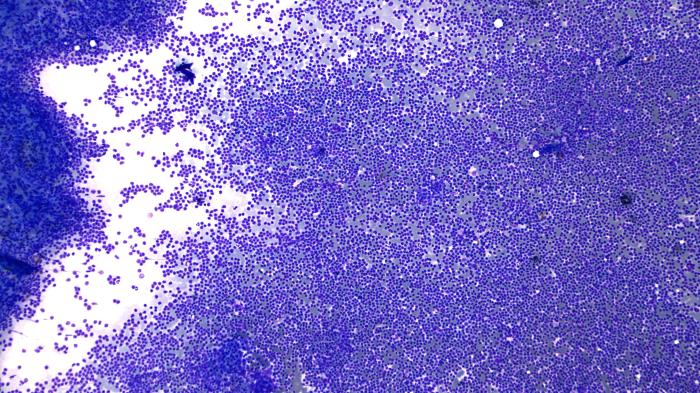
Dado los hallazgos obtenidos, se decide realizar un frotis sanguíneo y una punción de un ganglio poplíteo y del bazo. En el frotis sanguíneo se evidencia presencia de abundantes linfocitos maduros coincidente con la linfocitosis circulante (Figura 2).
Figura 2. (A) Imagen del frotis sanguíneo del caso descrito (LLC-B) a pocos aumentos (10x). Puede observarse que la inmensa mayoría de los leucocitos son linfocitos. (B, C) (40x) la morfología linfocitaria no difiere de la del caso de la figura 1 aunque el inmunofenotipo es diferente.
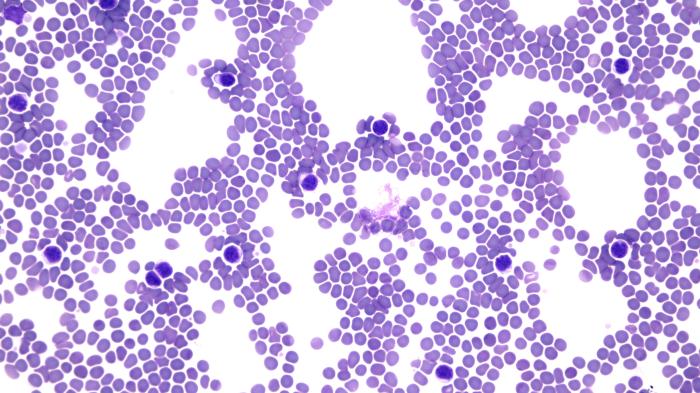
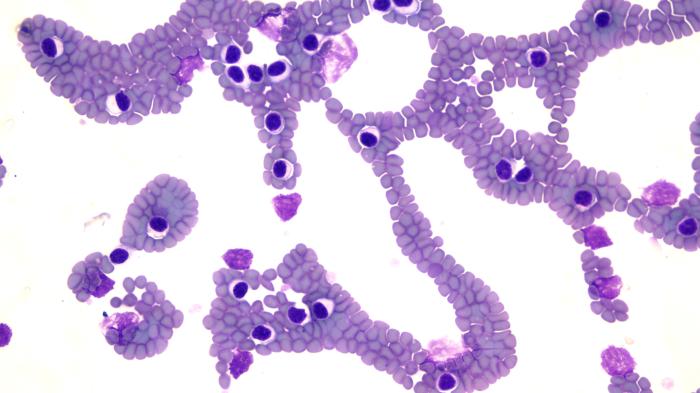
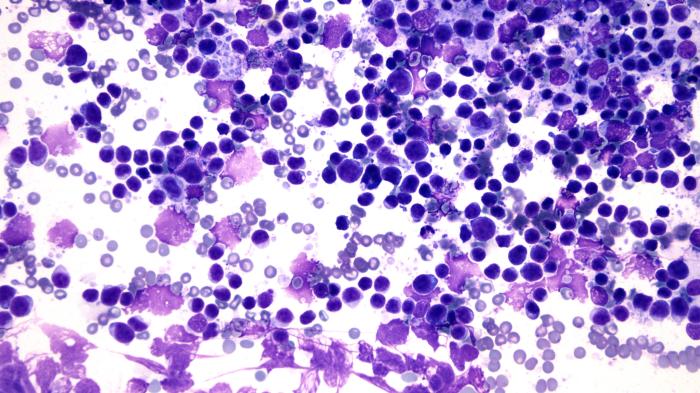
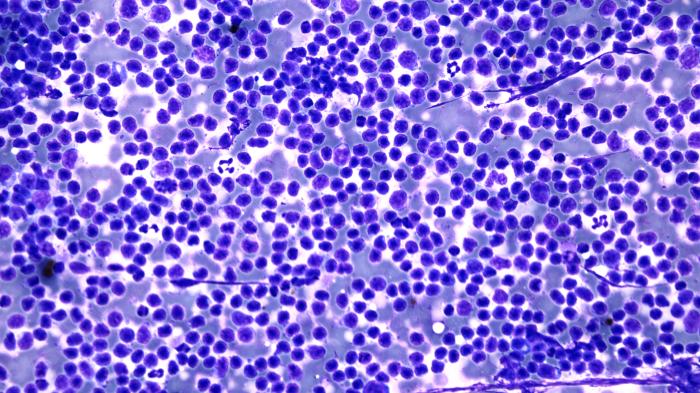
En la citología del ganglio y bazo se observa abundante celularidad formada por una población linfoide discretamente heterogénea con predominio de linfocitos pequeños (Figura 3).
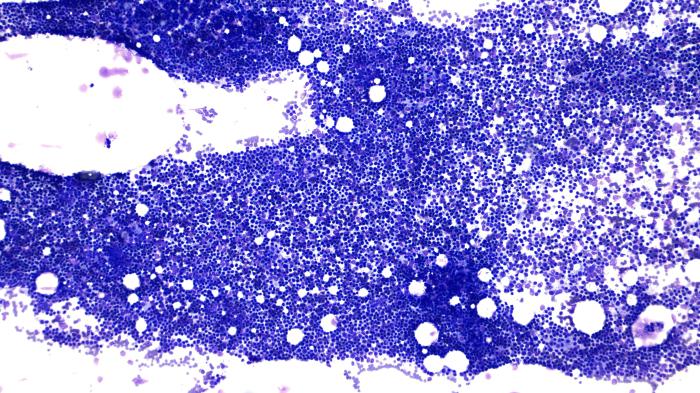
Figura 3. (A) Imagen citológica del ganglio poplíteo a pocos aumentos (10x) en la que se observa abundante celularidad y puede intuirse cierto monomorfismo en las células linfoides. (B, C) (40x) población linfoide discretamente heterogénea con predominio de linfocitos pequeños. (D) Imagen citológica del bazo a pocos aumentos (10x) en la que se observa abundante celularidad formada por una población linfoide homogénea. (E) (40x) se aprecia el predominio de linfocitos pequeños en la población linfoide.
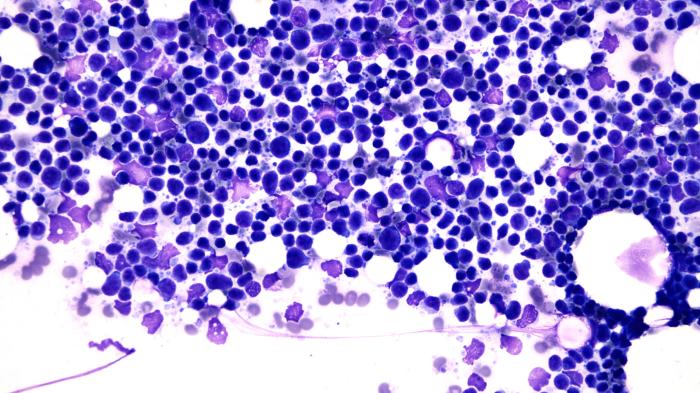
El diagnóstico presuntivo se establece como una imagen citológica compatible con leucemia linfocítica crónica o linfoma de bajo grado en estadio V.
Se propone citometría de flujo para diagnosticar el linfoma o descartar la leucemia linfocítica crónica, establecer así un pronóstico y plantear el tratamiento. Los resultados de dicha prueba indican un proceso compatible con una leucemia linfocítica crónica de células B con baja tasa proliferativa. La población celular predominante en la muestra son células maduras (CD34-), de tamaño pequeño, que expresan marcadores propios de linfocitos B (CD45+/CD21+/CD3-/CD5-), con una baja tasa de proliferación celular y una expresión del MHCII disminuida respecto a un linfocito normal. Estos hallazgos son indicativos de una leucemia linfocítica crónica de células B (Tabla 1, Figura 4).
| Viabilidad | 93.7 % |
| Porcentaje de células CD45+ | 98.6 % |
| Porcentaje de células CD45+/CD21+ | 90.9 % |
| Porcentaje de células CD45+/CD3+ | 2.3 % |
| Porcentaje de células CD45+/CD5+ | 2.3 % |
| Porcentaje de células CD45+/CD21+/CD3-/CD5-/CD34+ | 6.5 % |
| Valor medio de la fluorescencia del MHCII en CD21- | 1217 RFUs |
| % Linfocitos CD45+/CD3-/CD5-/CD21- que expresan Ki67 | 14.8 % |
| Relación tamaño B/T | 0.88 |
Tabla 1. Inmunofenotipaje sangre periférica.
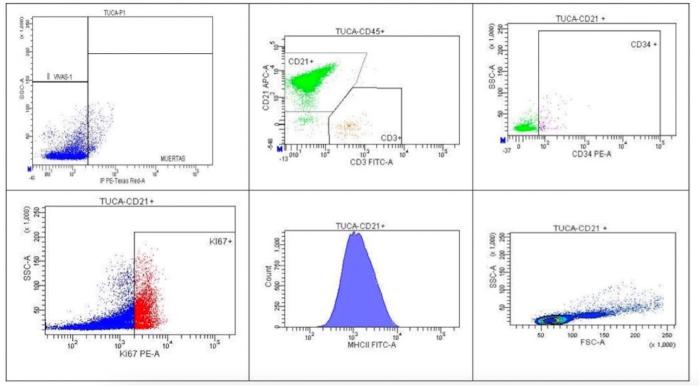
Figura 4. Resultados del imnunofenotipaje de la sangre periférica mediante citometría de flujo compatible con leucemia linfocítica crónica de células B.
Además, se realiza un proteinograma en el que se detecta un pico con base estrecha en la región beta compatible con una gammapatía monoclonal en esta región (Tabla 2, Figura 5).
| Análisis | Resultado | Unidades | Valores de referencia |
|---|---|---|---|
| Albúmina | 38.8 % | 2.7 g/dl | (2.6 - 3.3) |
| Alfa 1 | 4.30 % | 0.3 g/dl | (0.2 - 0.5) |
| Alfa 2 | 15.12 % | 1.1 g/dl | (0.3 - 1.1) |
| Beta | 32.61 % | 2.3 g/dl | (0.9 - 1.6) |
| Gammaglobulina | 9.90 % | 0.7 g/dl | (0.3 - 0.8) |
| Proteínas totales | 7.0 | g/dl | (5.4 - 7.1) |
Tabla 2. Proteinograma y bioquímica.
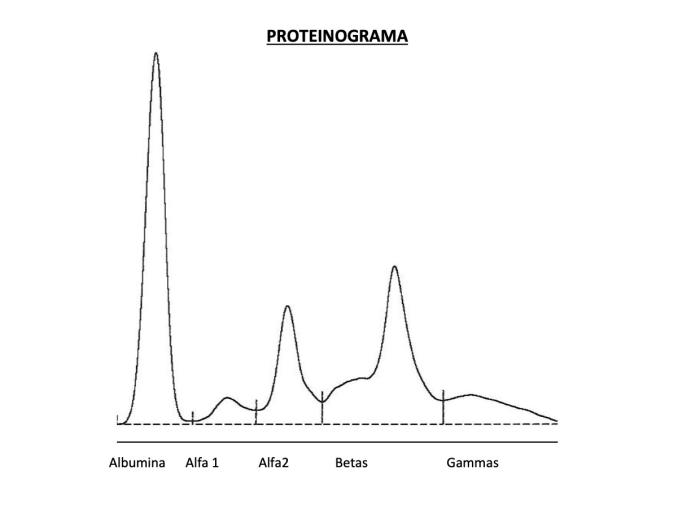
Figura 5. Proteinograma compatible con gammapatía monoclonal en región beta. Valores de betaglobulinas aumentados, en 2.3 g/dl (rango de referencia 0.9 - 1.6).
Se realiza una revisión pasados 20 días desde el diagnóstico para valorar evolución y plantear inicio de tratamiento. En este momento, el paciente presenta vómitos con mayor frecuencia y anorexia. Se realiza otro hemograma, obteniéndose una leucocitosis 280.74 K/μl, con linfocitosis de 264.59 K/μl, monocitosis de 9.16 K/μl, comienza a aparecer anemia no regenerativa con hemoglobina en 12.2 g/dl y trombocitopenia de 122 K/μl.
Dada la rápida evolución, el grado de leucocitosis y la presencia de trombocitopenia, se propone un protocolo de tratamiento en el que se combina clorambucilo, administrado a pulsos en dosis de 20 mg/m² cada 2 semanas, con prednisona a 1 mg/kg/24 h durante 1 semana, después a 0.5 mg/kg/48 h. Además, se añade metoclopramida para paliar los síntomas digestivos.
Se plantean revisiones cada 2 semanas inicialmente. Las dos primeras revisiones se realizan por vía telefónica por incompatibilidad de horarios del tutor. No obstante, el tutor indica que el paciente mantiene buena actitud y se han resuelto los síntomas iniciales. Las siguientes revisiones se realizan de forma presencial en cada ciclo, previas a la administración del clorambucilo, para realización de hemograma y exploración clínica del animal.
Los resultados del hemograma en el tercerciclo muestran una linfocitosis de 28.72 K/μl, con neutrofilia de 20.74 K/μl, linfocitosis de 5.77 K/μl, monocitosis de 2.17 K/μl, los valores de la serie roja se han normalizado, presentando trombocitopenia de 139 K/μl.
A los 2 meses de tratamiento se normaliza el recuento de linfocitos (2.41 K/μl), pero debido a que el animal en este momento presenta episodios de diarreas que se alternan con tenesmo y hematoquecia, se decide retrasar el 7º ciclo durante 2 semanas tratando de forma sintomatológica hasta que el proceso digestivo cesa. Sin embargo, los problemas articulares siguen avanzando.
Tras 8 ciclos de quimioterapia, la analítica se normaliza por completo y el tutor decide suspender el tratamiento e ir revisando para controlar la evolución. A los 7 meses del diagnóstico y 3 sin tratamiento el animal sigue presentando parámetros analíticos normalizados, aun así, se decide la eutanasia humanitaria por los problemas articulares y de movilidad. La Tabla 3 resume los hemogramas seriados que se realizaron al paciente durante la evolución de la leucemia y su tratamiento.
| Hemograma | 1º | 2º | 3º | 4º | 5º | 6º | 7º | 8º | 9º |
|---|---|---|---|---|---|---|---|---|---|
| HCT (37.3 % - 61.7 %) | 46 % | 39.3 % | 39 % | 36 % | 35 % | 34 % | 30 % | 41.3 % | 40.2 % |
| Leucocitos (5.05 K/μl - 16.76 K/μl) | 130.85 K/μl | 280.74 K/μl | 28.72 K/μl | 16.77 K/μl | 17.06 K/μl | 20.64 K/μl | 12.21 K/μl | 5.92 K/μl | 6.61 K/μl |
| Neutrófilos (2.95 K/μl - 11.64 K/μl) | 4.94 K/μl | 6.57 K/μl | 20.74 K/μl | 12.89 K/μl | 7.28 K/μl | 15.74 K/μl | 7.91 K/μl | 4.08 K/μl | 4.65 K/μl |
| Linfocitos (1.05 K/μl - 5.10 K/μl) | 121.26 K/μl | 264.59 K/μl | 5.77 K/μl | 2.53 K/μl | 5.93 K/μl | 2.41 K/μl | 2.06 K/μl | 0.42 K/μl | 0.63 K/μl |
| Plaquetas (148 K/μl - 484 K/μl ) | 148 K/μl | 122 K/μl | 139 K/μl | 197 K/μl | 256 K/μl | 272 K/μl | 251 K/μl | 216 K/μl | 227 K/μl |
Tabla 3. Hemogramas seriados.
Discusión
Las leucemias suponen un reto diagnóstico y terapéutico para el clínico veterinario. Las leucemias agudas cursan de manera rápida y agresiva y tienen muy mal pronóstico mientras que las crónicas tienen un curso lento y progresivo y un pronóstico generalmente bueno. En cuanto al origen celular ambas pueden ser tanto linfoides como mieloides. Como ya hemos señalado, las leucemias linfoides crónicas son patologías de progresión lenta, la mayoría de los casos pueden ser asintomáticos y solo detectarse en un examen hematológico de rutina, y en otros, los signos que se presentan son típicos de enfermedad leve y progresiva, con signos poco específicos. En nuestro caso, el paciente presentaba vómitos esporádicos y en la exploración se detectó linfadenopatía leve. La linfadenopatía periférica aparece en un 50 % de los casos de LLC, un 50 % tienen esplenomegalia, un 30 % hepatomegalia, un 23 % linfadenopatía visceral y un 3 % masa mediastínica3. En el caso que se describe también se encontró afectación del bazo y adenopatía abdominal. El hemograma se caracteriza por linfocitosis persistente que puede ir acompañada de otras citopenias. En un primer momento, en el hemograma de nuestro paciente no se detectaron citopenias en otras líneas celulares y la sintomatología empeoró coincidiendo con la aparición de una anemia no regenerativa y trombocitopenia.
Es importante la realización de pruebas complementarias como un perfil bioquímico, además del hemograma, en el que se puede detectar alteraciones paraneoplásicas como la hipercalcemia, la hiperproteinemia o un fallo orgánico por la infiltración neoplásica. En nuestro caso no hubo hiperproteinemia, aunque sí incremento monoclonal de betaglobulinas. La realización de un urianálisis también puede estar indicada en casos de hipercalcemia o hiperproteinemia. Además, pueden ser útiles pruebas de imagen, radiografía o ecografía, para evaluar posibles metástasis/implicación de otros órganos, especialmente hígado, bazo o ganglios linfáticos10, así como la realización de citología de estos últimos tal y como se llevó a cabo en el caso expuesto. La imagen ecográfica que se encontró en nuestro paciente, llamada comúnmente patrón en panal de abeja se asocia en la mayoría de los casos con trastornos linfoproliferativos. Entre ellos, la mayor parte de las veces corresponde con una hiperplasia linfoide y a linfoma. También puede detectarse en caso de esplenitis, hematopoyesis extramedular y de forma menos común, en el sarcoma histiocítico14.
En relación con la citología, y según lo evidenciado en el caso clínico presentado, el examen citológico saguíneo, de órganos linfoides y de médula ósea es un componente importante en el diagnóstico de leucemias y neoplasias linfoides y permite una buena primera aproximación a este9. En el caso de la leucemia aguda, en la que se incluye la leucemia linfoblástica aguda (LLA) y leucemia mieloide aguda (LMA), se encuentra >30 % de células blásticas en la médula ósea, normalmente acompañado por células con características similares en la sangre periférica. Para diferenciar entre una y otra, se debe recurrir a tinciones específicas o inmunofenotipificación. Por otro lado, la LLA se diferencia del linfoma en estadio V porque produce una linfadenopatía más leve y una infiltración más severa en la médula ósea, que da lugar a citopenias graves en las otras líneas celulares. En estos casos la citometría de flujo es muy útil pues la CD34 es expresada por células en la LLA, pero no en el linfoma10. Las leucemias agudas representan un <10 % de todas las neoplasias hematopoyéticas y aparecen típicamente en animales jóvenes o de mediana edad que muestran sintomatología inespecífica pero grave con una progresión agresiva y rápida10.
En cuanto a las leucemias crónicas, la leucemia mieloide crónica (LMC) se caracteriza por una leucocitosis neutrofílica, la médula ósea es hipercelular con células granulocíticas en maduración, con mayor número de células inmaduras, aunque los mieloblastos no superan el 20 % y puede ser muy difícil de distinguir de la hiperplasia granulocítica con neutrofilia extrema asociada a causas inflamatorias o infecciosas10. Por otro lado, en el caso de la LLC se observa >30 % de pequeños linfocitos en la médula ósea, usualmente acompañado por células de características similares en la sangre periférica. En nuestro caso, la linfocitosis y las imágenes citológicas obtenidas de los órganos linfoides podían ser compatibles con leucemia linfocítica crónica o con linfoma de bajo grado en estadio V. Por esta razón se prefirió recurrir a la citometría de flujo y no a la obtención de una muestra de médula ósea. La citometría confirmó el diagnóstico de LLC y caracterizó el inmunofenotipo B.
La respuesta al tratamiento de la LLC suele ser buena. En la mayoría de los protocolos, se suele usar el clorambucilo a las dosis que se han comentado con anterioridad de forma diaria. El clorambucilo en dosis pulsátiles a 20 - 30 mg/m2 cada 2 semanas se ha utilizado de forma anecdótica para la LLC en algunos casos, pero no se han publicado estudios sobre la efectividad de este protocolo3. En nuestro caso se administró de esta forma pulsátil para facilitar la administración al tutor. La respuesta fue buena, consiguiendo la normalización en el recuento de linfocitos al sexto ciclo. El tratamiento siempre se debe ir ajustando en función de la respuesta clínica y la tolerancia de la médula ósea. En el caso que presentamos, se suspendió uno de los ciclos de quimioterapia por sintomatología digestiva y se decidió descansar en otro por aparición de linfopenia. Durante el curso del tratamiento se detectaron anemia leve y trombocitopenia, por ello debe ajustarse el protocolo según la tolerancia del paciente y en nuestro caso algunas tomas se retrasaron por este motivo.
Según la bibliografía, el pronóstico de la LLC en el perro es bueno y el inmunofenotipo B tiene un TMS de 480 días3. En el caso descrito se logró un período de supervivencia prolongado, 210 días, y la decisión de la eutanasia del paciente no estuvo relacionada con el diagnóstico de la leucemia.
Bibliografía
- Lee GW, Kang MH, Jeon JH, Song DW, Ro W Bin, Kim HS, et al. Case Report: Long-Term Survival of a Dog With Chronic Lymphocytic Leukemia Treated With Chlorambucil, Prednisolone, and Imatinib. Front Vet Sci. 2022 Jan 17;8.
- Workman HC, Vernau W. Chronic lymphocytic leukemia in dogs and cats: The veterinary perspective. Vol. 33, Veterinary Clinics of North America - Small Animal Practice. W.B. Saunders; 2003. p. 1379–99.
- Vail DM, Pinkerton M, Young KM. Tumores hematopoyéticos. En:Withrow y MacEwen. Oncología clínica de pequeños animales. 6a. 2022. Zaragoza (España)
- Leifer CE, Matus RE. Lymphoid leukemia in the dog. Acute lymphoblastic leukemia and chronic lymphocytic leukemia. Veterinary Clinics of North America - Small Animal Practice. 1985;15(4):723–39.
- Calvert J. Student Paper Communication étudiante B-cell chronic lymphocytic leukemia in a miniature American Eskimo dog. Vol. 60, Can Vet J. 2019.
- Sánchez-Solé R, Pedreira G, Venzal JM, Serdio PP, Fonseca-Alves CE. The use of flow cytometry for diagnosis and immunophenotyping in chronic lymphocytic leukemia in a dog: Clinical case report. Open Vet J.2022;12(6):868–76.
- Comazzi S, Martini V, Riondato F, Poggi A, Stefanello D, Marconato L, et al. Chronic lymphocytic leukemia transformation into high-grade lymphoma: a description of Richter’s syndrome in eight dogs. Vet Comp Oncol. 2017 Jun 1;15(2):366–73.
- Avery AC, Avery PR. Determining the Significance of Persistent Lymphocytosis. Vol. 37, Veterinary Clinics of North America - Small Animal Practice. 2007. p. 267–82.
- Rout ED, Avery PR. Lymphoid Neoplasia: Correlations Between Morphology and Flow Cytometry. Vol. 47, Veterinary Clinics of North America - Small Animal Practice. W.B. Saunders; 2017. p. 53–70.
- Dobson J, Villiers E, Morris J. Diagnosis and management of leukaemia in dogs and cats. In Pract. 2006;28(1):22–31.
- Harris RA, Gary EB, Rout ED, Avery AC, Moore AR. Detection and Characterization of Paraproteinemia in Canine Chronic B-cell Lymphocytic Leukemia Using Routine and Free Light Chain Immunofixation. Vet Clin Pathol. 2022 Dec 1;51(4):551–9.
- Couto G, Moreno N. Leucemias. En: Oncología canina y felina, de la teoría a la práctica. 2013. Ed. Grupo Asis Biomedica S.L. Zaragoza.
- Rout ED, Labadie JD, Yoshimoto JA, Avery PR, Curran KM, Avery AC. Clinical outcome and prognostic factors in dogs with B-cell chronic lymphocytic leukemia: A retrospective study. J Vet Intern Med. 2021 Jul 1;35(4):1918–28.
- Quinci M, Sabattini S, Agnoli C, Bettini G, Diana A. Ultrasonographic honeycomb pattern of the spleen in cats: correlation with pathological diagnosis in 33 cases. J Feline Med Surg. 2020 Aug 1;22(8):800–4.
 by Multimédica
by Multimédica