Intoxicación con etilenglicol en un perro
Resumen breve
La intoxicación por etilenglicol es un accidente toxicológico ampliamente descrito en Medicina Veterinaria. En Colombia el contacto tóxico con etilenglicol para humanos y mascotas es poco reportado debido a los usos específicos de este compuesto químico, de uso común en zonas geográficas con climas que requieran materiales anticongelantes para las actividades cotidianas del ser humano. La toxicidad se relaciona con la producción de diferentes metabolitos mediados por la enzima lactato deshidrogenasa.…Índice de contenidos
Resumen
La intoxicación por etilenglicol es un accidente toxicológico ampliamente descrito en Medicina Veterinaria. En Colombia el contacto tóxico con etilenglicol para humanos y mascotas es poco reportado debido a los usos específicos de este compuesto químico, de uso común en zonas geográficas con climas que requieran materiales anticongelantes para las actividades cotidianas del ser humano. La toxicidad se relaciona con la producción de diferentes metabolitos mediados por la enzima lactato deshidrogenasa. Estos metabolitos son los responsables de las diferentes manifestaciones clínicas que incluyen ataxia, depresión del sistema nervioso central, poliuria y polidipsia, fracaso renal agudo oligo-anúrico y eventualmente la muerte. El diagnóstico se basa principalmente en la evidencia histórica de acceso al tóxico, los signos clínicos relacionados, en particular azotemia, acidosis metabólica con anión GAP elevado y la presencia de cristales de oxalato de calcio en el sedimento urinario. En este reporte se describe el caso de un canino con intoxicación aguda por anticongelante, haciendo particular énfasis en la utilidad de la interpretación de las pruebas paraclínicas para llegar al diagnóstico en ausencia de una historia inicial que hubiera sugerido la etiología.
Introducción
El etilenglicol (EG), es un glicol soluble en agua, inodoro e incoloro, es un líquido viscoso, no volátil, higroscópico, de sabor dulce y se utiliza principalmente como anticongelante, líquidos de frenos y productos industriales domés-ticos1. Se absorbe rápidamente en el tracto gastrointestinal y alcanza concentraciones pico entre 30 y 60 minutos después de su ingesta2. En perros la dosis mínima letal de etilenglicol puro es de 6.6 ml/kg y en gatos es de 1.5 ml/kg3.
El etilenglicol posee una baja afinidad por proteínas plasmáticas debido a su hidrosolubilidad, esto beneficia una alta tasa de distribución tisular, su volumen de distribución similar al agua corporal (0.5 a 0.8 L/kg)4; presenta un metabolismo principalmente hepático (80 %) con vida media corta de tres a ocho horas5. En su excreción renal, es filtra-do por el glomérulo y reabsorbido pasivamente; cerca del 20 % es filtrado por los riñones, esta vía es lenta, por lo cual su vida media es de 18-20 horas2. Tiene un pronóstico grave a menos que se diagnostique temprano y se inicie el tratamiento adecuado dentro de las 8 horas posteriores a la ingestión3.
El etilenglicol genera una intoxicación discreta, pero cuando este alcanza un metabolismo hepático, los productos resultantes (ácidos orgánicos y aldehídos) pueden ser considerablemente tóxicos6, y causar un síndrome de disfunción cardiológica, pulmonar y nefrológica, también afecta los sistema nerviosos central y periférico7; El EG y los raticidas figuran entre las intoxicaciones accidentales más frecuentemente vistas en animales domésticos8.
En 1986, Bobbitt y colaboradores, describen la manifestación clínica de la toxicidad por EG en humanos sin haber sido tratados, esta consta de tres etapas: en la primera etapa se puede evidenciar alteraciones metabólicas y síntomas del sistema nervioso central que generalmente comienzan 30 minutos después de la ingestión; la segunda etapa puede ocurrir de 12 a 36 horas después de la ingestión donde se presenta un compromiso cardiopulmonar; y la ter-cera puede iniciar entre las 36 y 48 horas después de la ingestión, donde predomina la insuficiencia renal oligúrica o anúrica9.
En perros también se han descrito 3 etapas, en la primera etapa, los perros presentan signos como poliuria y polidipsia graves, por el aumento agudo de la osmolalidad sérica, ataxia, vómito e hipotermia, que es secundaria a la de-presión del sistema nervioso central y a hipoperfusión10, esto ocurre 30 minutos a 12 horas después de la intoxica-ción, en esta etapa los principales cambios de laboratorio que se pueden evidenciar son: cristaluria de oxalato de calcio, azotemia prerrenal, desequilibrio osmolar, desequilibrio aniónico y una acidosis metabólica normoclorémi-ca11, la segunda etapa se caracteriza por presentar manifestaciones cardiopulmonares, se presenta entre las 12 y 24 horas después de la exposición al EG, y en la tercera se presenta la lesión renal aguda o insuficiencia renal aguda oligoanúrica, entra las 24 y 72 horas de exposición, se puede evidenciar en el laboratorio azotemia renal e hipercale-mia3,10.
Esta intoxicación usualmente se acompaña de una acidosis metabólica, con alto desequilibrio aniónico y una elevación del Gap osmolar6; En estudios antiguos Jacobsen y colaboradores (1982), sugieren que el aumento de la brecha aniónica puede ser un marcador útil para la intoxicación por etilenglicol12.
Farmacocinética
El etilenglicol se absorbe fácil y rápidamente en el intestino delgado proximal, su dosis letal es 1.4 a 4.4 ml/kg. Una vez logra llegar a los sinusoides hepáticos se oxida inicialmente a glicoaldehído por la enzima alcohol deshidroge-nasa (ADH), esta reacción depende de la enzima nicotinamida adenina dinucleótido (NAD+), que la reduce a NADH, el glicoaldehído se oxida posteriormente a ácido glicólico por la enzima aldehído deshidrogenasa, después, el ácido glicólico puede transformarse en ácido glicólico, que a su vez es convertido a ácido glioxílico por la glicolato oxida-sa o lactato deshidrogenasa, y el ácido glioxílico es convertido a ácido oxálico principalmente por la DHL, pero tam-bién en algún grado por la glicolato oxidasa4,13.
El ácido glicólico es el responsable de la acidosis metabólica y se ha evidenciado en este tipo de intoxicación la for-mación extensa de cristales que se han identificado como de oxalato de calcio, la sal de calcio no soluble de ácido oxálico, estos son visibles por microscopia de luz en varios tejidos, como túbulos renales, cerebro, hígado, bazo, entre otros, y se forman en soluciones acuosas de ácido oxálico en presencia de iones de calcio2,7.
Los ácidos glicólico, glioxílico y oxálico provocarán una acidosis metabólica con un aumento de la brecha aniónica, causada por la acumulación de ácido glicólico, estos metabolitos pueden afectar la respiración celular provocando una acidosis láctica tipo B. En el riñón, las células tubulares desarrollan una necrosis tubular aguda tóxica3, denomi-nada también nefrosis química. En un medio ácido, el oxalato precipita fuertemente al calcio produciendo hipocal-cemia y depósitos tisulares en el riñón, corazón, cerebro y pulmón, produciendo la falla renal aguda, disfunción miocárdica y alteraciones neurológicas14.
Diagnóstico
Los efectos adversos de la intoxicación pueden desarrollarse rápidamente, por lo tanto la importancia de un diagnóstico urgente radica en realizar un tratamiento rápido y eficaz12,15; el diagnóstico de la intoxicación se determina con un posible reporte de la ingesta del tóxico, la existencia de una acidosis metabólica con brecha aniónica amplia, aumento de la osmolaridad sérica, cristaluria de monohidrato de oxalato de calcio y lesión renal aguda7,11,12. La medición de niveles de etilenglicol o sus metabolitos en plasma es posible, sin embargo requiere técnicas de cromatografía líquida que reducen su utilidad práctica.
Diagnóstico por imagen
La radiología usualmente no provee datos llamativos debido a que los cambios en la radio densidad de los tejidos suele ser discreta, por tanto, los riñones pueden parecer normales. Cuando se observan cambios pueden corresponder a nefromegalia y/o incremento difuso en la opacidad de los riñones, lo cual, es resultado de la deposición de minerales oxalocálcicos16.
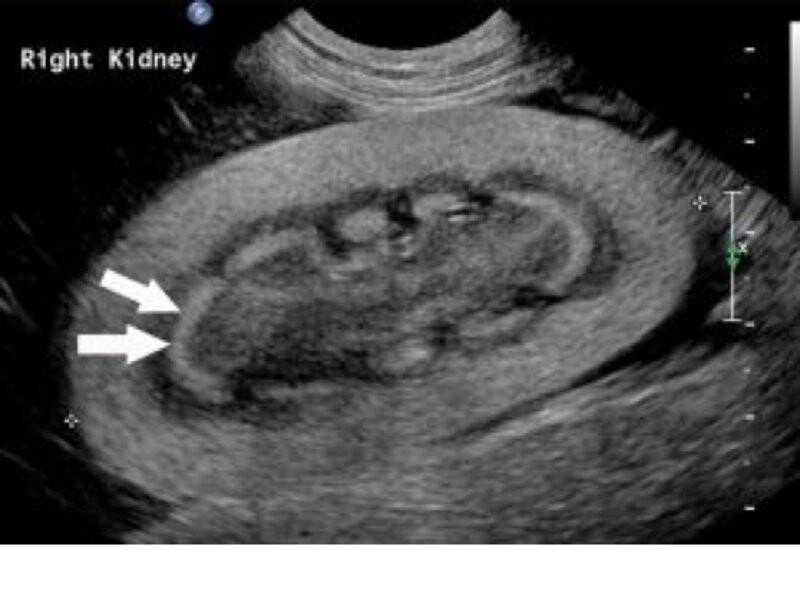
El ultrasonido puede ofrecer datos importantes y relevantes en cuanto al diagnóstico presuntivo y estimación de la severidad del daño. El desarrollo de hiperecogenicidad cortical se suele encontrar tan pronto como 4 horas post ingestión del tóxico, el cual es seguido de un aumento en la ecogenicidad medular. La ecogenicidad puede igualar o exceder a la del bazo. También puede encontrarse signo de borde o anillo medular hiperecogénico, que, si se acompaña de un halo hipoecogénico en la unión cortico-medular es indicativo de mal pronóstico (Figura 1)17.
Importancia del Anion Gap
La determinación de los mecanismos que rodean los disturbios ácido-base ha sido un objetivo de importancia clínica por más de 100 años. Los avances más importantes en el diagnóstico clínico y tratamiento de los disturbios ácido-base tanto en medicina humana como veterinaria incluyen la ecuación de Henderson-Hasselbach en 1916, el concepto del exceso de base en 1960, el cálculo de la brecha aniónica en 1970 (Anion GAP), la introducción del abordaje de iones fuertes de Stewart en la década del 80 y el desarrollo del concepto de la brecha de iones fuertes18.
Los dos principales objetivos del abordaje ácido-base son identificar y cuantificar la magnitud de un disturbio ácido-base y determinar el mecanismo que llevó al disturbio mediante la identificación de cambios en las variables de los distintos abordajes existentes19.
Independiente del pH del líquido extracelular el número total de cationes en este fluido siempre iguala al número total de aniones en los seres vivos, con el fin de mantener el medio interno cercano a la electroneutralidad necesaria para los procesos biológicos, sin embargo, no todos los aniones y cationes pueden ser medidos. Esto significa que, en un panel bioquímico típico, hay una brecha aparente, o diferencia, entre el número de cationes y el número de aniones y esta brecha se refiere a la brecha aniónica o Anion GAP20.
En cualquier situación en la cual hay un incremento en los aniones no medidos (lactato, cetoaniones) o elevación del cloro, las concentraciones de bicarbonato disminuyen para mantener la electroneutralidad. Si la reducción en el bicarbonato es equilibrada por un incremento en el cloro, el anión gap no cambia y la acidosis puede ser clasificada como hiperclorémica o “acidosis con anión gap normal”12.
Si la acidosis es secundaria a la adición de aniones no medidos, la disminución en el bicarbonato no se acompaña por un incremento en las concentraciones de cloro. De esta manera, el anión gap se incrementa, resultando en la de-nominada “acidosis con anión gap elevado”, que es el típico caso de la toxicidad por etilenglicol y otros compuestos20.
Este abordaje es muy útil en esta condición, pero es necesario enfatizar que es un abordaje incompleto del paciente críticamente enfermo, ya que el anión gap en perros y gatos normales mayormente es el resultado de la carga neta negativa de las proteínas, y por esta razón está fuertemente influenciado por la concentración de la albúmina, que al verse alterada en diversas condiciones del paciente críticamente enfermo puede impactar fuertemente en su valor. La hipoalbuminemia es la única causa clínicamente importante de un bajo anión gap12,20. Adicionalmente, más disturbios no evaluados en este abordaje probablemente acompañan la causa del desequilibrio ácido – base y se reco-mienda analizarlos.
Tratamiento
Maniobras como lavado gástrico, la emesis inducida y el uso de carbón activado, solo son útiles si se realizan en los primeros 60 minutos después de la ingestión del tóxico15. El tratamiento de emergencia debe iniciarse en un plazo de 8 horas posintoxicación para así poder evitar que esta progrese a lesión renal aguda3.
Se aconseja la administración de antídotos farmacológicos específicos, para retardar la formación de los ácidos tóxicos, se emplea el etanol y fomepizol, estos poseen una mayor afinidad por la enzima alcohol deshidrogenasa (ADH) hepática, al saturar la ADH con estos sustratos, se metaboliza menos y a una velocidad menor el EG, evitando la generación de ácidos tóxicos, el EG se excreta sin alteración por los riñones21, debe considerarse que el etanol puede causar una grave depresión respiratoria y del SNC11. La afinidad del fomepizol hacia la enzima ADH es 500 a 1.000 veces superior al etanol y sin toxicidad asociada, desafortunadamente este fármaco es de baja disponibilidad4.
La terapia con estos inhibidores no detiene completamente la generación de productos tóxicos, el EG y sus metaboli-tos tóxicos son moléculas pequeñas, estas pueden ser dializables, por esto se debe considerar la hemodiálisis como una opción de tratamiento altamente eficaz, para remover el compuesto original y los metabolitos tóxicos2,3.
La expansión del volumen intravascular aumenta la excreción urinaria de etilenglicol mediante la inducción de poliuria y además, previene la precipitación de oxalato cálcico22; La administración de bicarbonato de sodio será necesaria en casos de acidosis metabólica severa, además este inhibe la unión de oxalato y calcio, pero solo se deberá implementar basándose en la determinación de concentraciones del bicarbonato en suero, porque, podrá producir o empeorar una hipocalcemia, el objetivo de adicionar bicarbonato es mantener el pH del paciente mayor a 7,2 y así, reducirá el riesgo de complicaciones hemodinámicas, que pueden ser potencialmente mortales23. El gluconato de calcio puede administrarse en animales que presenten convulsiones o espasmos tetánicos secundarios a hipocalcemia21, se recomienda colocar una sonda urinaria para la medición del debito urinario, algunas veces es necesario contemplar incluir soporte ventilatorio si es necesario11.
La hemodiálisis es una terapia de reemplazo renal que ya se ha consolidado en medicina veterinaria, es una técnica que se basa principalmente en el principio de Fick para la difusión de solutos a través de una membrana semi-permeable, esta membrana artificial se encuentra dentro del filtro de hemodiálisis o “riñón artificial” y posee características específicas de permeabilidad, grosor y tamaño de poros. La máquina emplea una bomba que succiona la sangre desde el acceso vascular central del paciente y la conduce hasta el filtro a través de líneas hemocompatibles y un sistema de anticoagulación, en donde interactúa con un líquido dializante de características fisiológicas para equilibrar los componentes del plasma a medida que recorre la anatomía del filtro. Debido a que las moléculas en suspensión libre son las que pueden interactuar con la membrana semipermeable, es determinante que la molécula a dializar no esté ligada a proteínas y que su volumen de distribución sea cercano al agua corporal total. Aunque en el mercado hay diversos tipos de filtros de hemodiálisis la membrana de filtración posee poros que usualmente permiten el paso de moléculas pequeñas entre 3000 y 15000 Daltons24.
Ahora, teniendo en cuenta que el etilenglicol tiene un peso molecular de 62.07 Daltons y que su unión a proteínas es mínima, es un excelente candidato para ser removido de forma muy eficiente mediante hemodiálisis, así como otros tóxicos como el metaldehído (Figura 2), mientras se encuentre en su forma alcohólica primaria sin haber pasado por biotransformación hepática. Schweighauser & Francey han sugerido que esta terapia extracorpórea implementada de forma temprana en el tratamiento (antes de 6 horas posingestión) puede prevenir el síndrome tóxico y eventualmen-te la muerte del paciente. Adicionalmente se sugiere realizar un clearance del tóxico a la par de la administración de etanol o metil pirazol para contrarrestar el metabolismo inevitable de parte del etilenglicol ingerido3.
El pronóstico dependerá de la cantidad de tóxico ingerida y del tiempo transcurrido desde la ingestión, Keller y Goddard, en el 2005, reportaron que pacientes que se presentaron al servicio de urgencias y fueron diagnosticados con intoxicación con EG, con menos de 5 horas de ingerido, tuvieron un pronóstico magnífico con el tratamiento con fomepizol, pero los pacientes con oliguria y azotemia tienen un pronóstico fatídico11.
Caso clínico
El día 2 de noviembre de 2020 se reciben muestras de sangre y orina en el laboratorio clínico veterinario, con la siguiente reseña: Nombre: Ralph; Especie: canina; Raza: Setter Irlandés; Género: Macho; Edad: 3 años; Estado reproductivo: Entero; Procedencia: Enviado, Antioquia. La médica veterinaria tratante solicita Hematología, Bioquímica sérica (Creatinina, BUN, ALT, PPT, Albúmina, Snap Lipasa específica Canina, MAT Leptospira 9 serovares) y análisis citoquímico de orina. Los resultados obtenidos en el procesamiento de las muestras son los siguientes:
- Hematología sin particularidades.
- Bioquímica sérica: Creatinina: 4.5 mg/dL (v.r: 0.5 – 1.4 mg/dL); BUN: 98 mg/dL (v.r: 8 -28 mg/dL); ALT: 116 U/L (v.r: 18 – 80 U/L); FAS: 108 U/L (v.r: 20 – 100 U/L); PPT: 7.6 g/dL; Albúmina: 3.9 g/dL.
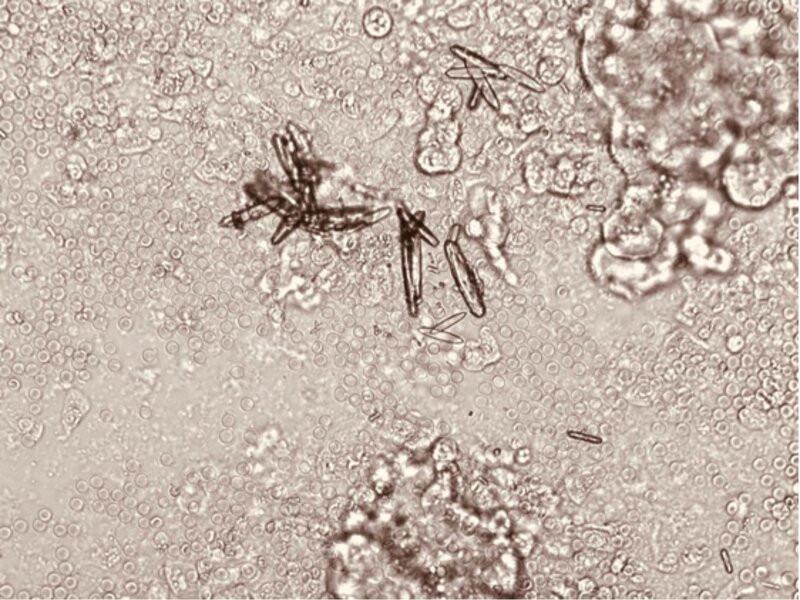
- Uroanálisis: Volumen: 7 ml; Muestra por sondaje uretral; Color: amarillo pálido; Apariencia: traslúcida; Gravedad específica: 1020; pH: 5; Glucosa: +; Bilirrubina: negativo; Proteína: trazas; Sangre: ++; Leucocitos: +; Eritrocitos: 15 – 20/c.a.p.; Leucocitos: ocasionales; Cilindros: granulosos burdos 2-4 p.p.; Cristales: Oxalato de calcio monohidrato en moderada cantidad (Figura 3). Células epiteliales altas: 2-4/ c.a.p y acúmulos.
Debido a la presencia de azotemia importante y de cristales de oxalato de calcio en un paciente juvenil se considera un caso de interés y al día siguiente se consulta con la médico tratante por mayor información para la correlación de los hallazgos laboratoriales y plantear sugerencias para continuar con el proceso diagnóstico. La información sobre el caso reporta que la mascota hace aproximadamente 48 horas desarrolló súbitamente decaimiento, excesiva sed y producción de orina, durante el día manifestó signos de ansiedad y durante el día siguiente desorientación, ataxia y vómito.
Consultaron al centro médico veterinario 36 horas después de iniciados los síntomas donde inmediatamente se inicia manejo médico de soporte con hidratación endovenosa con Ringer lactato a 2 ml/kg/h, Omperazol 0.7 mg/kg EV SID, Maropitant 1 mg/kg SCT SID, ceftriaxona 25 mg/kg EV BID, tramadol 2 mg/kg EV BID y la médico tratante envía muestras de sangre y orina para la analítica ya reportada bajo los diferenciales de leptospirosis aguda, pancreatitis aguda e intoxicación inespecífica. Se realiza ultrasonido abdominal que reporta vejiga sin contenido visible, riñones de tamaño adecuado para el tamaño del animal (6.6 cm de longitud y relación riñón/aorta 7.8), bordes lisos, baja diferenciación corticomedular, con hiperecogenicidad cortical muy marcada y signo de banda medular definido. Inmediatamente el laboratorio sugiere hemogasometría para soportar un posible diagnóstico de toxicidad por etilenglicol. Esa tarde se realiza análisis de hemogasometría y estado ácido base con analizador EPOC, tomado de la arte-ria femoral y procesamiento inmediato. Los resultados encontrados son los descritos en la Tabla 1.
| Tabla 1. Hemogasometría. |
| Variable | Valor | Rango de referencia |
| pH | 7.12 | 7.35 - 7.45 |
| PCO2 | 30 mmHg | 35 - 45 |
| PO2 | 82 mmHg | 80 - 85 |
| SO2% | 96.4% | >95 |
| Htc | 41%td> | 39 - 55 |
| Hb | 14 g/dL | 13 - 19 |
| Na | 143 mmol/L | 137 - 155 |
| K | 7.6 mmol/L | 3.5 – 5.0 |
| CI | 109 mmol/L | 95 - 125 |
| iCa | 0.7 mmol/L | 1.10 – 1.45 |
| Gluc | 119 mg/dL | 75 - 120 |
| Lactato | 0.6 mmol/L | 0.5 – 2.0 |
| HCO3 | 11 mmol/L | 18 - 23 |
| AGAP | 29.7 mmol/L | 8 - 20 |
| Osm | 294.4 mOsm/kg | 290 - 320 |
| BE | -12 | -4.0 – 4.0 |
Para este momento han transcurrido 48 horas desde el inicio de los síntomas y 10 horas desde el manejo médico intrahospitalario, el paciente no ha producido ningún volumen de orina en estas horas (anuria) ni bajo la expansión volémica agresiva con cristaloide (5 ml/kg EV en 10 minutos en 2 ocasiones), ni bajo estímulo diurético (furosemida 2 mg/kg EV y segunda dosis a 4 mg/kg EV a las 2 horas). Debido a la alta sospecha de intoxicación con etilenglicol se realiza una encuesta minuciosa al tutor sobre posibles fuentes de exposición listando una a una las alternativas, es entonces cuando surge la información de un equipo de aire acondicionado desperfecto en casa que gotea líquido refrigerante. Debido a la alta probabilidad de ser un caso de intoxicación avanzada por etilenglicol, con la evo-lución desfavorable evidente del caso, los familiares de la mascota optan por la eutanasia. Los tutores declinan la necropsia para la confirmación del diagnóstico presuntivo.
Discusión
El procesamiento de los análisis de laboratorio de cualquier paciente va claramente ligado a la correlación que implica el hallazgo de un analito fuera de rango de referencia versus los signos y perfil clínico del individuo. En este caso, por ejemplo, la azotemia encontrada (creatinina 4.5 mg/dL) sugiere que hay una disfunción renal severa como posible foco de interés diagnóstico. La azotemia y oligoanuria del paciente se clasifica en la actualidad como una in-juria renal en clasificación IRIS 416, y la baja producción de orina en perros y gatos se ha correlacionado altamente con pobres índices de sobrevida. Sin embargo, la creatinina es un biomarcador de función que no habla de la causa del problema y se sugirió tomar como punto de partida para el diagnóstico de posibles causas del cuadro patológico presente.
La presencia de glucosa en orina, células epiteliales altas y cilindros granulosos burdos son evidencia de daño tubular estructural, que puede catalogarse como necrosis tubular aguda, sería entonces un indicio de mayor daño en esta zona de las nefronas y orientar a diagnósticos diferenciales de nefrosis. En este caso, la presencia de azotemia y cristales de oxalato de calcio en la orina de un canino juvenil llamó mucho la atención del personal del laboratorio, ya que esta cristaluria es poco frecuente de forma natural en caninos en este rango etario25.
El procesamiento oportuno de las muestras de orina para evaluación del sedimento es fundamental para prevenir los sesgos diagnósticos principalmente los falsos negativos, ya que la orina provee un ambiente hostil y cambiante para los elementos en suspensión. Lulich y Albassan reportaron cambios en los hallazgos citológicos urinarios tan pronto como 30 minutos post colecta de las muestras, y mayor margen de falsos positivos a cristaluria cuando las muestras fueron refrigeradas. El mayor efecto reportado en los análisis de estas muestras fueron la desaparición de elementos biológicos como cilindros o células y la aparición de cristales de estruvita. En el caso de Ralph, la aparición de cristales de oxalato de calcio monohidrato se ha relacionado con alteraciones importantes en la excreción de sus precursores (oxalato y calcio iónico), un desorden metabólico que rara vez es de origen natural en un paciente sano y joven.
La acidosis metabólica con ligera reducción de bicarbonato y anion GAP elevado sugieren la presencia de elementos metabólicos que alteran el pH sanguíneo. Ahora, la combinación de acidosis metabólica, hipocalcemia iónica y anion GAP elevado sin hiperlactatemia sugiere ampliamente un disturbio por la presencia de ácidos orgánicos y un factor quelante de calcio extracelular que cierran las opciones etiológicas principalmente a toxicidad por alcoholes, que en su mecanismo fisiopatológico pueden cursar con este tipo de disturbios, siendo el etilenglicol el principal agente compatible.
En los diferentes reportes de literatura sobre casos de intoxicación por etilenglicol sobresalen marcadores claves tanto para el diagnóstico como para la toma de decisiones, a saber: curso agudo de enfermedad, azotemia, cristaluria oxalo cálcica, acidosis metabólica, hipocalcemia, brecha aniónica elevada, alteraciones renales a nivel ecográfico, débito urinario y presencia de signos neurológicos. Desafortunadamente esos reportes también indican que la aparición de varios de estos parámetros anormales se asocia ampliamente con fatalidad, por lo que la historia de acceso al tóxico y tal vez signos tempranos (PU/PD, desorientación y ataxia) sigue siendo la mejor forma de llegar al diagnóstico oportuno, donde el manejo médico y la hemodiálisis son las mejores alternativas para la terapia de eliminación del compuesto sin llegar a producir daño letal en los tejidos3.
Después de la experiencia vivida en este caso en particular se considera vital realizar perfiles hematológicos, urinarios, bioquímicos y ácido base en todos los pacientes con enfermedad crítica, ya que en los diferentes resultados posibles puede encontrarse una orientación determinante para encontrar una etiología desconocida.
La interacción del personal del laboratorio clínico con los médicos tratantes resulta muy útil en la resolución de varias situaciones clínicas. En este caso, la mirada objetiva de los análisis de laboratorio de la mano con el seguimiento clínico permitió emitir sugerencias que resultaron en el descubrimiento de la patología de base, que de des-conocerse pudo haber derivado en mayores intentos de manejo médico que eventualmente hubieran fracasado y llevado al paciente al sufrimiento físico y mayor impacto negativo en sus tutores.
Bibliografía
- Loriaux, D., Bergin, S. P., Patel, S. M., Tucker, J., & Barkauskas, C. E. (2019). Ethylene Glycol Toxicity in the Setting of Recurrent Ingestion: A Case Report and Literature Review. Cureus, 11(4). https://doi.org/10.7759/cureus.4375
- Cacelín-Garza, J. R., & Cacelín-Miranda, R. S. (2017). Intoxication due to ethylene glycol. Medicina Interna de Mexico, 33(2), 259–284.
- Schweighauser, A., & Francey, T. (2016). Ethylene glycol poisoning in three dogs: Importance of early diagnosis and role of hemodialysis as a treatment option. Schweizer Archiv Fur Tierheilkunde, 158(2), 109–114. https://doi.org/10.17236/sat00051
- Sepulveda, R., Selamé, E., Roesseler, E., Rodrigo, T., & Andrés, V. (2019). Intoxicación por etilenglicol, fisiopatología y enfrentamiento clínico. Red. Med. Chile, 147, 1572–1578.
- Kraut, J. A. (2015). Diagnosis of toxic alcohols: Limitations of present methods. Clinical Toxicology, 53(7), 589–595. https://doi.org/10.3109/15563650.2015.1056880
- Khawaja, A., & Heckerling, P. S. (1996). Ethylene Glycol Poisoning With a Normal Anion Gap Caused by. American Journal of Kidney Diseases, 27(1), 130–133.
- Leon, M., & Graeber, C. (1994). Absence of High Anion Gap Metabolic Acidosis in Severe Ethylene Glycol Poisoning: A Potential Effect of Simultaneous Lithium Carbonate Ingestion. American Journal of Kidney Diseases, 23(2), 313–316. https://doi.org/10.1016/S0272-6386(12)80989-9
- Doty, R. L., Dziewit, J. A., & Marshall, D. A. (2006). Antifreeze ingestion by dogs and rats: Influence of stimulus concentration. Canadian Veterinary Journal, 47(4), 363–365.
- Bobbitt, W. H., Williams, R. M., & Freed, C. R. (1986). Severe ethylene glycol intoxication with multisystem failure. The Western Journal of Medicine, 144(2), 225–228.
- García-ortuño, L. E., & Bouda, J. (2006). Clinical-pathological diagnosis of ethylene glycol poisoning: A case report. Vet. Méx, 37(4), 503–512.
- Keller, N., & Goddard, A. (2005). First report of suspected ethylene glycol poisoning in 2 dogs in South Africa. Journal of the South African Veterinary Association, 76(2), 116–119. https://doi.org/10.4102/jsava.v76i2.409
- Jacobsen, D., Bredesen, J. E., Eide, I., & Østborg, J. (1982). Anion and Osmolal Gaps in the Diagnosis of Methanol and Ethylene Glycol Poisoning. Acta Medica Scandinavica, 212(1–2), 17–20. https://doi.org/10.1111/j.0954-6820.1982.tb03162.x
- Coulter, C. V., Farquhar, S. E., McSherry, C. M., Isbister, G. K., & Duffull, S. B. (2011). Methanol and ethylene glycol acute poisonings predictors of mortality. Clinical Toxicology, 49(10), 900–906. https://doi.org/10.3109/15563650.2011.630320
- Sutter, M. E., Al-Khameess, W. A., Abramson, J. L., & Morgan, B. W. (2012). Predictors of Ethylene Glycol Ingestion Cases Called into a Regional Poison Center. Journal of Medical Toxicology, 8(2), 130–134. https://doi.org/10.1007/s13181-011-0206-y
- Kraut, J. A., & Kurtz, I. (2008). Toxic alcohol ingestions: Clinical features, Diagnosis, and management. Clinical Journal of the American Society of Nephrology, 3(1), 208–225. https://doi.org/10.2215/CJN.03220807
- Elliott, J., Grauer , G., & Westropp, J. (2018). Manual de Nefrología y Urologia de Pequeños Animales. Barcelona: Lexus.
- Adams WH, Toal RL, Breider MA. Ultrasonographic findings in dogs and cats with oxalate nephrosis attributed to ethylene glycol intoxication: 15 cases (1984-1988). J Am Vet Med Assoc. 1991 Aug 15;199(4):492-6. PMID: 1917665.
- Bernal, L., & Pineda, D. (2013). Valores de gases arteriales y electrolitos en 50 cininos sanos en la sabana de Bogotá medidos con el sistema de análisis de sangre EPOC. 2(SGEM2016 Conference Proceedings, ISBN 978-619-7105-16-2 / ISSN 1314-2704), 1–39.
- de Morais, H. A., & Constable, P. D. (2012). Strong Ion Approach to Acid-Base Disorders. In Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice (4th ed.). Elsevier Inc. https://doi.org/10.1016/B978-1-4377-0654-3.00020-2
- Kaae, J., & de Morais, H. A. (2008). Anion Gap and Strong Ion Gap: A Quick Reference. Veterinary Clinics of North America - Small Animal Practice, 38(3), 443–447. https://doi.org/10.1016/j.cvsm.2008.01.022
- Connally HE, Thrall MA, Forney SD, Grauer GF, Hamar DW. Safety and efficacy of 4-methylpyrazole for treatment of suspected or confirmed ethylene glycol intoxication in dogs: 107 cases (1983-1995). J Am Vet Med Assoc. 1996 Dec 1;209(11):1880-3. PMID: 8944802.
- Bestic, M., Blackford, M., & Reed, M. (2009). Therapeutic review: Fomepizole: A critical assessment of current dosing recommendations. Journal of Clinical Pharmacology, 49(2), 130–137. https://doi.org/10.1177/0091270008327142
- Kohen, C. J., Hopper, K., Kass, P. H., & Epstein, S. E. (2018). Retrospective evaluation of the prognostic utility of plasma lactate concentration, base deficit, pH, and anion gap in canine and feline emergency patients. Journal of Veterinary Emergency and Critical Care, 28(1), 54–61. https://doi.org/10.1111/vec.12676
- Teichmann-Knorrn, S., Doerfelt, S., & Doerfelt, R. (2020). Retrospective evaluation of the use of hemodialysis in dogs with suspected metaldehyde poisoning (2012–2017): 11 cases. Journal of Veterinary Emergency and Critical Care, 30(2), 194–201. https://doi.org/10.1111/vec.12934
- Albasan, H., Lulich, J. P., Osborne, C. A., Lekcharoensuk, C., Ulrich, L. K., & Carpenter, K. A. (2003). Effects of storage time and temperature on pH, specific gravity, and crystal formation in urine samples from dogs and cats. Journal of the American Veterinary Medical Association, 222(2), 176–179. https://doi.org/10.2460/javma.2003.222.176
 by Multimédica
by Multimédica