Síndrome de diarrea hemorrágica aguda canina: actualización
Resumen breve
El síndrome de diarrea hemorrágica aguda (ADHS), anteriormente denominado como gastroenteritis hemorrágica, puede estar asociado con daño en la barrera intestinal y riesgo de sepsis. Aunque el origen es idiopático, algunos estudios relacionan las toxinas NetF de Clostridium perfringens con este cuadro. El diagnóstico es presuntivo tras descartar otras causas de enteritis hemorrágica.Índice de contenidos
Resumen
La diarrea aguda es una afección frecuente en consulta de pequeños animales, sobre todo en pacientes caninos, con episodios generalmente autolimitantes. El síndrome de diarrea hemorrágica aguda (ADHS), anteriormente denominado como gastroenteritis hemorrágica, puede estar asociado con daño en la barrera intestinal y riesgo de sepsis. Aunque el origen es idiopático, algunos estudios relacionan las toxinas NetF de Clostridium perfringens con este cuadro. El diagnóstico es presuntivo tras descartar otras causas de enteritis hemorrágica. La gravedad varía desde deshidratación hasta shock hipovolémico, con una mortalidad que puede alcanzar el 10 %.
Introducción
La diarrea aguda es una de las consultas más frecuentes en consulta de pequeños animales1. En perros, los cuadros de diarreas no hemorrágicas suelen ser autolimitantes2, requiriendo tratamiento de soporte en caso de deshidratación. El uso de antibioterapia en estos pacientes es controvertido, ya que estudios recientes demuestran que su uso provoca disbiosis intestinal, prolongando así la recuperación3.
Los cuadros de diarreas hemorrágicas como el síndrome de diarrea hemorrágica aguda (Acute diarrhoea haemorrhagic syndrome, ADHS, por sus siglas en inglés), suelen ser más graves. La presencia de sangre indica que se ha interrumpido la barrera mucosa intestinal, con riesgo de sepsis por posible translocación bacteriana2 (Figura 1).

Figura 1. Hematoquecia de paciente con ADHS.
El ADHS se define como la aparición de forma brusca de diarrea hemorrágica con una pérdida importante de fluidos hacia la luz intestinal, asociada frecuentemente con vómitos4,5. En estos pacientes, el sobrecrecimiento de bacterias clostridiales y la liberación de toxinas que producen, pueden ser responsables de la necrosis del epitelio intestinal6. El diagnóstico, una vez descartadas las causas más frecuentes de diarreas hemorrágicas (como el parvovirus canino), suele ser presuntivo, ya que los cultivos fecales que detectan Clostridium spp u otros patógenos entéricos no suelen ser diagnósticos, al encontrarse muchas de estas bacterias en heces de perros sanos7. La severidad de los signos clínicos es variable, desde deshidratación moderada hasta shock hipovolémico, sepsis e hipoproteinemia severa. La mayoría de los pacientes se recuperan en un plazo de 24-72 h con fluidoterapia y tratamiento sintomático4,5, aunque la mortalidad puede alcanzar hasta un 10 % a pesar de un tratamiento adecuado. El 30 % de los pacientes pueden desarrollar diarrea crónica posteriormente4,5,8.
Etiopatogenia
Aunque la etiología es desconocida y se clasifica en muchos textos el ADHS como idiopático, se ha postulado puede ser secundario a una reacción de hipersensibilidad de tipo I a componentes del alimento o toxinas de Clostridium perfringens9. A pesar de que esta bacteria pertenece a la flora normal del colon, usualmente no se cultiva desde el intestino delgado ni se puede observar en muestras de histopatología tanto en perros saludables como en los que padecen trastornos intestinales (como enteropatías crónicas o infección por parvovirus canino).
Varios estudios han demostrado una mayor prevalencia de Clostridium perfringens en muestras fecales de perros con ADHS en comparación con perros sanos y/o con otras enfermedades intestinales10. En perros con ADHS se han cultivado cepas clostridiales codificadoras de la toxina NetF, a partir de muestras de biopsia del duodeno. Esta toxina es formadora de poros en células susceptibles, destruyendo la membrana plasmática, lo que conduce a la lisis osmótica de la célula. Por lo tanto, NetF es probablemente el principal factor de virulencia en las cepas de Clostridium perfringens implicadas en el ADHS. Además de las toxinas NetF, Clostridium perfringens produce otras enzimas y toxinas, como colagenasas, neuraminidasas, caseinasa, deoxiribonucleasa, hialurinonada y ureasa, que se liberan durante la fase de proliferación de la bacteria y pueden contribuir al daño en la mucosa intestinal10. La principal característica histopatológica en estos pacientes es una inflamación neutrofílica y necrotizante, que puede afectar a todo el intestino11. Las lesiones más severas se detectan en el colon, y las más leves en la parte proximal del intestino delgado (presentan puntuaciones histológicas más bajas en muestras histopatológicas). Sin embargo, la mucosa del estómago no suele verse afectada11, por lo que se ha hipotetizado que el crecimiento excesivo de clostridios y la liberación de toxinas comienza en el intestino grueso, afectando posteriormente al delgado, aunque en los casos en los que el paciente fallece, sí que se ha descrito la presencia de Clostridium perfringens en la superficie de la mucosa gástrica5,12.
El ADHS es más frecuente en perros de razas pequeñas5,13, aunque algunas razas grandes como los Labrador pueden estar predispuestos14. La incidencia suele ser mayor en perros de mediana edad13 y no se ha documentado una predilección por sexo.
Signos clínicos
Los perros con ADHS suelen acudir a consulta con signos gastrointestinales de menos de 24 horas de duración2,4,5,14. Aproximadamente la mitad de los pacientes acuden con vómitos como primer signo clínico. Algunos perros con ADHS grave no tienen deposiciones en el momento de la aparición del cuadro digestivo, debido a que el tracto gastrointestinal suele estar vacío y la motilidad intestinal está reducida por la inflamación aguda. La diarrea puede estar presente durante días, debido a que la mucosa intestinal se encuentra seriamente dañada y suele necesitar unos días para recuperarse por completo5. El curso clínico y la gravedad de la enfermedad puede monitorizarse mediante el índice de ADHS(Tabla 1).
| Parámetro | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Disminución de la actividad | No | Leve | Moderada | Grave |
| Disminución del apetito | No | Leve | Moderada | Grave |
| Vómitos (veces/día) | 0 | 1 | 2-3 | > 3 |
| Consistencia fecal | Normal | Blandas | Muy blandas | Líquida |
| Defecaciones (veces/día) | 1 | 2-3 | 4-5 | > 5 |
| Deshidratación (%) | 0 | < 5 | 5-10 | > 10 |
| Índice AHDS | 0-3 | 4-5 | 6-8 | 9 o más |
| Importancia clínica de la enfermedad | Sin importancia clínica | AHDS leve | AHDS moderado | AHDS grave |
Tabla 1. Criterios a valorar para el cálculo del íncide de AHDS, que permite valorar la gravedad y la evolución del cuadro (modificado de Unterer, S. y Busch, K4.).
Si los signos clínicos son muy severos, los pacientes pueden acudir en shock hipovolémico, con alteración del estado mental, debilidad, taquicardia, hipotensión, etc. (Figura 2).
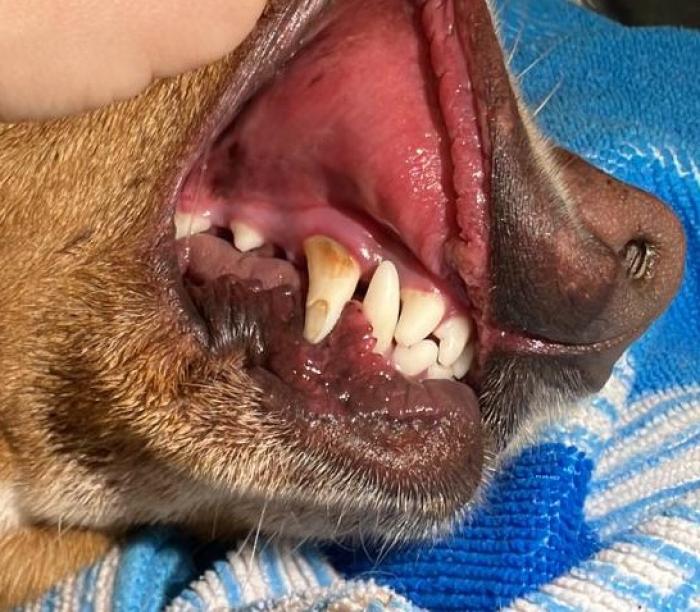
Figura 2. Congestión de membranas mucosas en paciente con shock hipovolémico por ADHS.
La taquicardia puede ser también secundaria a las náuseas y al dolor abdominal2,13,14. Generalmente los pacientes con ADHS presentan una temperatura rectal normal o baja, por lo que si presentan hipertermia pueden existir otros agentes infecciosos implicados (como por ejemplo Salmonella spp), septicemia por translocación bacteriana desde el tracto gastrointestinal a circulación sistémica o reacción inflamatoria que afecte a otros órganos (por ejemplo, pancreatitis). A pesar de las lesiones severas que presentan estos pacientes, no suelen presentar un dolor abdominal importante13,14.
Debido a las grandes pérdidas de líquidos por las diarreas, estos perros suelen presentar policitemia relativa en el momento de la presentación clínica, ya que la pérdida de sangre no es tan grave como la pérdida de líquidos5,15. Se ha sugerido que estos pacientes con ADHS pueden diferenciarse así de los perros con hemorragia intestinal (por ejemplo, alteraciones en la hemostasia, úlceras, neoplasias, etc.), en los que sí que suelen presentar anemia inicialmente.
Las formas no complicadas de ADHS no suelen presentar cambios en el leucograma. Por el contrario, los animales con sospecha de septicemia presentaran leucocitosis o leucopenia, con neutrofilia significativa o neutropenia, y un número elevado de neutrófilos en banda9. La neutropenia puede presentarse también en pacientes con infección por parvovirus canino, por lo que debe sospecharse de esta enfermedad especialmente si el perro es joven y/o no está vacunado adecuadamente16.
Algunos perros pueden tener hipoalbuminemia severa tras las diarreas profusas y reanimación con fluidos4,5. En estos casos, debe de controlarse el nivel de albúmina sanguínea, así como la aparición de edemas periféricos o derrames en terceros espacios, para valorar la necesidad de soporte coloidal4,5. A pesar de la deshidratación, solo se observará azotemia generalmente en aquellos pacientes en shock hipovolémico por enfermedad prerrenal. Por otro lado, la actividad de la fosfatasa alcalina suele ser normal en perros con ADHS, mientras que la actividad de la alanina aminotransferasa aumenta en aproximadamente el 20 % de los casos. Esto probablemente se deba a un daño hepatocelular secundario causado por una disminución de la perfusión hepática durante la hipovolemia. La elevación del lactato sérico refleja la gravedad de la hipovolemia y la reducción de la perfusión periférica y, por lo tanto, es un hallazgo inespecífico4,5.
Diagnóstico
En los perros que se presentan con ADHS es fundamental conocer su historia clínica. Se deben de reseñar los antecedentes clínicos recientes, como hipotensiones graves durante una cirugía previa, historia de golpes de calor, tratamientos con antiinflamatorios no esteroideos, etc., ya que son causas potenciales de diarrea hemorrágica2,5. Aunque el historial de vacunación y desparasitación sea adecuado, se incluirán en la lista de diagnósticos diferenciales causas infecciosas como el parvovirus canino y coronavirus, además de etiología parasitaria como por ejemplo Giardia. Para descartar estas patologías, se aconseja la recogida de muestras fecales para análisis coprológico, así como la realización de pruebas in-house inmunocromatográficas o ELISA que incluyan parvovirus y coronavirus canino12,17.
La analítica sanguínea suele presentar hallazgos inespecíficos, generalmente con hemoconcentración y azotemia renal prerrenal. Pueden realizarse otras pruebas complementarias adicionales como niveles de cortisol basal para descartar hipoadrenocorticismo en pacientes con sintomatología compatible. La medición de proteína C reactiva puede señalar la gravedad del cuadro clínico, pero no tiene relación con la mortalidad o la duración de la hospitalización14.
La ecografía abdominal es útil para identificar otras causas de signos digestivos, como pancreatitis aguda, presencia de cuerpos extraños, obstrucción intestinal, etc.2,5,18.
Para confirmar la implicación de Clostridium perfringens en el ADHS, el diagnóstico más fiable se realizaría mediante endoscopia y biopsias gastrointestinales, donde podría observarse la bacteria en la superficie necrótica12,17. Al tratarse de una prueba diagnóstica invasiva, no se realiza a causa del riesgo anestésico en un paciente inestable, el coste económico y la ausencia de beneficio para el abordaje terapéutico. Debido a que las pruebas no invasivas tienen múltiples limitaciones para el diagnóstico de Clostridium spp., en la mayoría de los pacientes el diagnóstico de ADHS se basa en observaciones clínicas y el descarte de otras enfermedades12,17.
El cultivo fecal positivo para Clostridium spp. no es diagnóstico para el ADHS, ya que en heces de perros sanos pueden encontrarse numerosas cepas clostridiales7. Las PCR fecales para genes de toxinas clostridiales tampoco son útiles para el diagnóstico de ADHS por el mismo motivo19.
Los resultados positivos en PCR para las cepas de Clostridium perfringens tipo A (que codifican la toxina formadora de poros NetF), apoyan el diagnóstico de ADHS10. La limitación existente en esta prueba diagnóstica es que la expresión de la toxina NetF fecal disminuye rápidamente, por lo que los perros en los que la toma de muestras se realiza cuando el curso de la enfermedad es avanzado, pueden ser negativos20.
Tratamiento
El tratamiento en estos pacientes es principalmente de soporte. La deshidratación grave secundaria a los vómitos, anorexia y diarrea generalmente requiere fluidoterapia intravenosa21. El inicio hiperagudo y grave de la enfermedad, y la presencia frecuente de íleo paralítico, que puede secuestrar grandes volúmenes de líquido, pueden llevar a una subestimación de la pérdida o los requerimientos reales de líquidos4,5. Por lo tanto, es esencial reevaluar con frecuencia (cada 2-6 horas) los parámetros clínicos y ajustar la fluidoterapia. Además, los pacientes con presentación hiperaguda de la enfermedad pueden desarrollar un shock hipovolémico que requiera resucitación con fluidoterapia, tanto en el momento del ingreso como durante la hospitalización21. Debido a las pérdidas digestivas y al plan de fluidoterapia administrado, la monitorización de electrolitos debe ser frecuente (cada 8, 12 o 24 horas en función de la evolución)21.
A consecuencia de la destrucción de la barrera intestinal, algunos pacientes sufren una pérdida grave de proteínas plasmáticas, disminuyendo la presión oncótica. Por ello, se aconseja medir la albúmina sérica inicialmente y después de la rehidratación. En pacientes con hipoalbuminemia grave que comiencen a desarrollar signos clínicos (edema en extremidades, ascitis, derrame pleural), debe considerarse la administración de coloides sintéticos, albúmina o plasma4,5,21.
En el tratamiento sintomático se incluirán antieméticos como el maropitant (1 mg/kg/24 h IV/SC) o metoclopramida (0.2-0.5 mg/kg/8 h IV/SC)4,5,21. Los analgésicos de elección suelen ser los opiáceos en pacientes con dolor de moderado a severo. En ADHS, los opiáceos agonistas puros del receptor µ son muy efectivos, pero pueden producir íleo paralítico y favorecer la regurgitación, por lo que se utilizará preferentemente un agonista parcial del receptor µ, como la buprenorfina (5-20 mg/kg/8 h IV/SC) 4,5,21. Otros autores describen el uso de metamizol (20-35 mg/kg/8 h IV/SC) como analgésico, mediante su efecto inhibidor de COX-34,5. Por otro lado, el uso de otros antiinflamatorios no esteroideos (AINE) están totalmente contraindicados, debido a su propensión a causar más lesiones gastrointestinales4,5,21. La administración de inhibidores de la bomba de protones como el omeprazol es controvertida; estos pacientes no suelen tener sangrado gástrico y su administración pueden representar un factor adicional responsable de la disbiosis intestinal22.
Actualmente, existe cierta controversia sobre la necesidad administrar de forma sistemática de antibióticos en estos pacientes (Tabla 2).
| Historia clínica |
|
| Examen físico al ingreso |
|
| Examen físico tras la rehidratación y control del dolor |
|
| Alteraciones analíticas |
|
Tabla 2. Parámetros sugerentes de adición de antibioterapia de amplio espectro en perros con patologías intestinales.
La incidencia de bacteriemia verdadera en perros con ADHS es baja (11 %) y parece no diferir de perros sanos23. Aunque puede existir traslocación bacteriana, el hígado elimina las bacterias y sus toxinas mediante la circulación portal, por lo que, si la función hepática no está comprometida y el paciente es inmunocompetente, el riesgo de septicemia y sepsis es bajo23. El uso rutinario de antibióticos no solo no tiene beneficios, sino que puede tener efectos perjudiciales en la microbiota intestinal, lo que favorece la disbiosis y promueve el desarrollo de bacterias multirresistentes21,24. Debido a que aproximadamente un tercio de los perros con ADHS desarrollan signos gastrointestinales crónicos, la disbiosis inducida por antibióticos podría representar un factor importante en el desencadenamiento de la cronicidad4,5,21. Por todo ello, la terapia antibiótica debe de restringirse a pacientes con signos clínicos de sepsis, inmunocomprometidos o con capacidad reducida para eliminar bacterias de la circulación portal (por ejemplo, en shunt portosistémicos, alteraciones de la funcionalidad hepática, etc.)4,5.
Respecto a la alimentación de estos pacientes, es importante destacar la necesidad de proporcionar nutrición enteral de forma temprana con una dieta altamente digerible, ya que promueve la proliferación de enterocitos y mejora la integridad de la barrera intestinal (Figura 3)21,25.

Figura 3. Paciente hospitalizado con ADHS con sonda de alimentación nasoesofágica para nutrición enteral.
El uso de otros tratamientos como la administración de probióticos o el trasplante de microbiota fecal puede considerarse, aunque no se ha descrito que presenten un efecto significativo en los tiempos de hospitalización o en los signos clínicos26-28.
Bibliografía
1. Candellone A, Cerquetella M, Girolami F, Badino P, Odore R. Acute diarrhea in dogs: Current management and potential role of dietary polyphenols supplementation. Vol. 9, Antioxidants. MDPI; 2020. p. 1–17.
2. Hall E. Dealing with haemorrhagic diarrhoea in dogs. In Pract. 2023 Nov 1;45(9):516–31.
3. Singleton DA, Noble PJM, Sánchez-Vizcaíno F, Dawson S, Pinchbeck GL, Williams NJ, et al. Pharmaceutical prescription in canine acute diarrhoea: A longitudinal electronic health record analysis of first opinion veterinary practices. Front Vet Sci. 2019 Jul 2;6(JUL).
4. Unterer S, Busch K. Acute Hemorrhagic Diarrhea Syndrome in Dogs. Vol. 51, Veterinary Clinics of North America - Small Animal Practice. W.B. Saunders; 2021. p. 79–92.
5. Busch K, Unterer S. Update on Acute Hemorrhagic Diarrhea Syndrome in Dogs. Advances in Small Animal Care. 2022 Nov;3(1):133–43.
6. Leipig-Rudolph M, Busch K, Prescott JF, Mehdizadeh Gohari I, Leutenegger CM, Hermanns W, et al. Intestinal lesions in dogs with acute hemorrhagic diarrhea syndrome associated with netF-positive Clostridium perfringens type A. Journal of Veterinary Diagnostic Investigation. 2018 Jul 1;30(4):495–503.
7. Marks SL, Rankin SC, Byrne BA, Weese JS. Enteropathogenic Bacteria in Dogs and Cats: Diagnosis, Epidemiology, Treatment, and Control. J Vet Intern Med. 2011 Nov;25(6):1195–208.
8. Kaufmann ME, Koch H. Studiengangsentwicklung als soziale Praxis – Anregungen aus dem Bachelorstudiengang Kulturwissenschaft. In: Forschendes Lernen als Studiengangsprofil. Wiesbaden: Springer Fachmedien Wiesbaden; 2020. p. 67–89.
9. Dolan C, Santo-Domingo NE. Retrospective evaluation of the incidence and outcome of neutropenia in dogs with acute hemorrhagic diarrhea syndrome (2017–2022): 54 cases. Journal of Veterinary Emergency and Critical Care. 2025 Jan 1;
10. Sindern N, Suchodolski JS, Leutenegger CM, Mehdizadeh Gohari I, Prescott JF, Proksch AL, et al. Prevalence of Clostridium perfringens netE and netF toxin genes in the feces of dogs with acute hemorrhagic diarrhea syndrome. J Vet Intern Med. 2019 Jan 1;33(1):100–5.
11. Leipig-Rudolph M, Busch K, Prescott JF, Mehdizadeh Gohari I, Leutenegger CM, Hermanns W, et al. Intestinal lesions in dogs with acute hemorrhagic diarrhea syndrome associated with netF-positive Clostridium perfringens type A. Journal of Veterinary Diagnostic Investigation. 2018 Jul 1;30(4):495–503.
12. Unterer S, Busch K, Leipig M, Hermanns W, Wolf G, Straubinger RK, et al. Endoscopically visualized lesions, histologic findings, and bacterial invasion in the gastrointestinal mucosa of dogs with acute hemorrhagic diarrhea syndrome. J Vet Intern Med. 2014;28(1):52–8.
13. Mortier F, Strohmeyer K, Hartmann K, Unterer S. Acute haemorrhagic diarrhoea syndrome in dogs: 108 cases. Veterinary Record. 2015 Jun 13;176(24):627.
14. Dupont N, Jessen LR, Moberg F, Zyskind N, Lorentzen C, Bjørnvad CR. A retrospective study of 237 dogs hospitalized with suspected acute hemorrhagic diarrhea syndrome: Disease severity, treatment, and outcome. J Vet Intern Med. 2021 Mar 1;35(2):867–77.
15. Leipig-Rudolph M, Busch K, Prescott JF, Mehdizadeh Gohari I, Leutenegger CM, Hermanns W, et al. Intestinal lesions in dogs with acute hemorrhagic diarrhea syndrome associated with netF-positive Clostridium perfringens type A. Journal of Veterinary Diagnostic Investigation. 2018 Jul 1;30(4):495–503.
16. Parrish CR, Sykes JE. Canine Parvovirus Infections and Other Viral Enteritides. In: Greene’s Infectious Diseases of the Dog and Cat. Elsevier; 2021. p. 341–51.
17. Leipig-Rudolph M, Busch K, Prescott JF, Mehdizadeh Gohari I, Leutenegger CM, Hermanns W, et al. Intestinal lesions in dogs with acute hemorrhagic diarrhea syndrome associated with netF-positive Clostridium perfringens type A. Journal of Veterinary Diagnostic Investigation. 2018 Jul 1;30(4):495–503.
18. Yang S Il, Kim JH, Jeong SW, Han HJ. Acute hemorrhagic diarrhea syndrome associated with contaminated foreign bodies (Used feminine hygiene products) in a golden retriever dog. Journal of Veterinary Medical Science. 2018 Apr 1;80(4):629–33.
19. Busch K, Suchodolski JS, Kühner KA, Minamoto Y, Steiner JM, Mueller RS, et al. Clostridium perfringens enterotoxin and Clostridium difficile toxin A/B do not play a role in acute haemorrhagic diarrhoea syndrome in dogs. In: Veterinary Record. British Veterinary Association; 2015. p. 253.
20. Ziese AL, Suchodolski JS, Hartmann K, Busch K, Anderson A, Sarwar F, et al. Effect of probiotic treatment on the clinical course, intestinal microbiome, and toxigenic Clostridium perfringens in dogs with acute hemorrhagic diarrhea. PLoS One. 2019 Jul 1;13(9).
21. Odunayo A. Acute gastroenteritis. In: Small Animal Critical Care Medicine. Elsevier; 2023. p. 680–4.
22. König J, Wells J, Cani PD, García-Ródenas CL, MacDonald T, Mercenier A, et al. Human intestinal barrier function in health and disease. Clin Transl Gastroenterol. 2016 Oct 1;7(10).
23. Unterer S, Lechner E, Mueller RS, Wolf G, Straubinger RK, Schulz BS, et al. Prospective study of bacteraemia in acute haemorrhagic diarrhoea syndrome in dogs. Veterinary Record. 2015 Mar 21;176(12):309.
24. Werner M, Suchodolski JS, Straubinger RK, Wolf G, Steiner JM, Lidbury JA, et al. Effect of amoxicillin-clavulanic acid on clinical scores, intestinal microbiome, and amoxicillin-resistant Escherichia coli in dogs with uncomplicated acute diarrhea. J Vet Intern Med. 2020 May 1;34(3):1166–76.
25. Freilich L, Jugan MC. Retrospective evaluation of enteral nutrition supplementation in 295 hospitalized dogs and cats (2014–2023). J Am Vet Med Assoc. 2025 Mar 1;263(3).
26. Ziese AL, Suchodolski JS, Hartmann K, Busch K, Anderson A, Sarwar F, et al. Effect of probiotic treatment on the clinical course, intestinal microbiome, and toxigenic Clostridium perfringens in dogs with acute hemorrhagic diarrhea. PLoS One. 2019 Jul 1;13(9).
27. Sharp CR, Kim M, Jugan MC, Freilich L. Clinical response in dogs with acute hemorrhagic diarrhea syndrome following randomized probiotic treatment or fecal microbiota transplant.
28. Reisinger A, Stübing H, Suchodolski JS, Pilla R, Unterer S, Busch K. Comparing treatment effects on dogs with acute hemorrhagic diarrhea syndrome: fecal microbiota transplantation, symptomatic therapy, or antibiotic treatment. J Am Vet Med Assoc. 2024 Aug 2;1–9.
 by Multimédica
by Multimédica
