Síndrome diarreico hemorrágico agudo. Una revisión práctica
Resumen breve
Es bastante frecuente en la clínica diaria un cuadro agudo de diarrea sanguinolenta (disentería) y vómitos en perros adultos, conocida genéricamente como gastroenteritis hemorrágica del perro adulto. Se caracteriza por vómitos de inicio agudo que progresan a hematemesis, diarrea severa, maloliente, hemorrágica, anorexia y letargo. En los últimos 40 años se han investigado causas genéticas, alérgicas, inmunitarias e infecciosas. Sin embargo, el fenómeno sigue siendo en rigor, idiopático.…Índice de contenidos
Resumen
Es bastante frecuente en la clínica diaria un cuadro agudo de diarrea sanguinolenta (disentería) y vómitos en perros adultos, conocida genéricamente como gastroenteritis hemorrágica del perro adulto. Se caracteriza por vómitos de inicio agudo que progresan a hematemesis, diarrea severa, maloliente, hemorrágica, anorexia y letargo. En los últimos 40 años se han investigado causas genéticas, alérgicas, inmunitarias e infecciosas. Sin embargo, el fenómeno sigue siendo en rigor, idiopático. Este síndrome solía llamarse gastroenteritis hemorrágica hasta que un estudio reciente mostró que el estómago no está involucrado en el proceso de la enfermedad y que existe escasa inflamación en la mucosa digestiva. Por lo general, se observa una mejoría clínica rápida con la terapia sintomática: la terapia intensiva con fluidos es la base del tratamiento. Sin embargo, si no se trata con prontitud, la enfermedad puede progresar rápidamente hasta la muerte.
Introducción
Con frecuencia se atienden perros con cuadros digestivos agudos de origen indeterminado la mayoría de los cuales presenta un cuadro autolimitado incluso sin hospitalización. Sin embargo, no es inusual evaluar pacientes con un tipo particular de indigestión caracterizado por una diarrea hemorrágica súbita que, si bien responde a terapia médica, algunos pacientes pueden presentar un cuadro fulminante que sin la reposición de volumen intravenoso puede ser mortal. Este cuadro digestivo hemorrágico, conocido como gastroenteritis hemorrágica del adulto se denomina actualmente síndrome diarreico hemorrágico agudo, desde que Unterer y col., descartaran compromiso gástrico y observaran escasa inflamación luego de estudiar un cohorte de más de 10 perros1. Se caracteriza por vómitos de inicio agudo que progresan a hematemesis, diarrea severa, maloliente, hemorrágica, anorexia y letargo2. Se han discutido diferentes etiologías, incluida la reacción de hipersensibilidad intestinal tipo 1 a los componentes alimentarios o a endotoxinas bacterianas, producidas por algunos Clostridium. Sin embargo, la patogénesis exacta se desconoce.
Epidemiología y clínica
Es más frecuente en adultos jóvenes de razas pequeñas. En el trabajo de Mortier y cols., los perros con SDHA tenían un peso corporal significativamente menor (mediana de 9.8 kg) y edad (mediana de cinco años) en comparación con el grupo control (P <0.001)3.
Es muy poco frecuente en edades extremas. La aparición de los signos es per aguda y en ocasiones las pérdidas hipertónicas intestinales provocan una hipovolemia profunda que amenaza la vida rápidamente. En estudio retrospectivo de Mortier (2015) los perros habían sido sintomáticos durante una mediana de 17 horas antes de la consulta (rango de 2 a 72 horas).
El primer signo clínico fue vómito (80 % de los casos), y en la mitad de estos, se observó hematemesis. La diarrea hemorrágica siguió a la aparición de vómitos después de un tiempo medio de 10.5 horas (rango 0-52 horas) (Figuras 1 y 2).
La mayoría de los pacientes no tienen información relevante en la anamnesis y tienen un adecuado estado de salud previo al evento. Cuando el paciente cae de manera muy rápida en falla circulatoria y no presenta un Hct > 60 %, es importante considerar como diferencial un shock anafiláctico.


La policitemia en el contexto del sangrado fecal severo es una característica de este cuadro. En un estudio retrospectivo que reviso más de 100 perros con SDHA mostró un Hct promedio de 59 %3. El síndrome puede ser leve, moderado a muy severo y per agudo. En ocasiones una trombocitopenia inmunomediada grave puede manifestarse de manera similar. Sin embargo, no habrá un Hct inesperadamente alto.
Diagnóstico
La conducta diagnóstica se orienta básicamente al descarte de otros diferenciales, tanto en la historia como en el examen físico y las analíticas. El SDHA es un diagnóstico de exclusión, descartando otras enfermedades a través de la historia (p. ej., administración de AINE, intoxicación), examen físico (p. ej., dolor abdominal en pancreatitis), recuento sanguíneo completo (p. ej., trombocitopenia, falta de leucograma de estrés en la enfermedad de Addison), bioquímica (p. ej., azotemia, cambios en los parámetros de la función hepática, alteraciones electrolíticas en la enfermedad de Addison), tiempos de coagulación, diagnóstico por imagen (p. ej., neoplasia, intususcepción, cuerpo extraño, pancreatitis) y examen fecal.
Cuando no se puede encontrar una causa subyacente de la diarrea hemorrágica aguda, se realiza un diagnóstico presuntivo de SDHA. Las publicaciones que estudian este síndrome los principales criterios de exclusión son falla renal, hepática, pancreatitis aguda, hipocortisolismo, enteritis crónica, neoplasia GI, intususcepción, Giardia, parvovirus, intoxicación con rodenticidas y consumo de AINEs/corticoides.
No es frecuente que patologías extraintestinales se manifiesten con este perfil clínico tan clásico, sin embargo, es importante no hacer visión de túnel. Si el paciente tiene melena, es poco probable que se trate de este síndrome. Lo mismo ocurre si el paciente presenta otros signos hemorrágicos como hematuria, dermatorragia y/o derrames hemorrágicos.
Es importante indagar sobre la presencia de signos digestivos crónicos recurrentes. En ocasiones una enfermedad intestinal inflamatoria (IBD) o un Addison puede hacer una crisis aguda similar al SDHA. Clásicamente el perfil bioquímico y el panel de coagulación son normales.
Es característico una policitemia considerable, que en ocasiones puede alcanzar un hematocrito de hasta un 70 % con sólidos totales normales. Un hemograma ayudará a descartar trombocitopenia como causa de la disentería y neutropenia, que podría sugerir más un cuadro séptico por Salmonella sp, Campilobacter sp, E. Coli o Costridium sp. El 20 % de los perros con SDHA presenta leucocitosis.
La leucopenia es muy inusual. En el trabajo de Mortier (2015), sólo dos perros tuvieron neutropenia3. En el estudio de Unterer (2011) donde se evaluaron 60 perros con SDHA el nivel promedio de leucocitos fue de 11000 (rango 2.400-22.550 cél/µl).
El perfil bioquímico ayudará a descartar una hepatitis aguda e insuficiencia renal como causantes del cuadro o para evaluar compromiso sistémico de pacientes que desarrollaron falla circulatoria grave y falla multiorgánica. Es raro que ocurra azotemia. Los niveles más altos de creatinina reportados son de 3.13 mg/dl en menos del 5 % de los pacientes3,4.
También es muy rara la hiperbilirrubinemia, sólo un 9 % de los perros con SDHA presentan bilirrubinas tan altas como 1.2 mg/dl. Este tipo de hallazgos junto con trombocitopenia y necesidad de vasopresores podría verse en una minoría de los casos que son los que evolucionan a falla multiorgánica.
En los gases sanguíneos es frecuente la hiponatremia y la acidosis metabólica hiperclorémica con hiperlactatemia en casos graves. Ante la sospecha de Addison típico o atípico según la historia y los hallazgos electrolíticos es razonable un análisis de cortisol sérico basal; >2 mg/dl lo descarta.
La ecografía abdominal por lo general muestra cambios inflamatorios leves. Ayuda en el descarte de otros diferenciales. No se recomienda el estudio histopatológico ni endoscópico de manera rutinaria en estos pacientes, a menos que haya sospecha de IBD o neoplasia.
Patogénesis
En el trabajo de Unterer y cols., (2014) no se observaron lesiones endoscópicas en esófago ni estómago4. En los 3 perros que tuvieron hematemesis sólo se detectó hiperemia y edema en estómago. Ningún perro presentó úlceras ni erosiones en estómago.
Se realizó duodenoscopia en 10/10, colonoscopia en 8/10, ileoscopia en 6/10 perros. Los hallazgos macroscópicos más importantes en el tracto intestinal observados en todos los perros incluyeron hiperemia, aumento de friabilidad de la mucosa, hemorragia y erosiones.
En comparación con las lesiones macroscópicas en el colon, las lesiones en el duodeno parecían ser más prominentes. A nivel histológico los cambios más importantes en el intestino incluyeron necrosis mucosa aguda e infiltración neutrofílica.
Un estudio observacional de cohorte tuvo como objetivo describir en detalle la distribución, el carácter y el grado de las lesiones microscópicas, para investigar la etiología de SDHA. Se tomaron muestras de biopsia de estómago, duodeno, íleon y colon por vía endoscópica de 10 perros.
Todas las biopsias incluyeron mucosa y submucosa. Las secciones del intestino se evaluaron inmunohistoquímicamente usando anticuerpos contra Clostridium sp y parvovirus canino. Se realizó inmunohistoquímica (IHC) contra antígenos clostridiales para detectar la distribución del antígeno, en particular en las partes más profundas de la lámina propia, donde las bacterias no podían detectarse histológicamente.
A pesar de la exclusión de una infección por parvovirus por un ELISA o PCR de antígeno fecal, también se realizó IHC de parvovirus porque las lesiones en el intestino delgado se parecían a las de una infección por parvovirus. En aislamientos de C. perfringens de 5 perros con SDHA, se intentó detección específica de los 4 genes principales de toxina (alfa [cpa], beta [cpb], epsilon [etx] e iota [itx]), el gen de enterotoxina (cpe) y el gen de la toxina beta2 (cpb2) mediante PCR multiplex.
Además, se buscó los genes que codifican la toxina netF formadora de poros, utilizando una PCR patentada en tiempo real. Edema y necrosis en grado variable en duodeno, íleon y colon. Se detectó el antígeno de Clostridium sp. en los 10 perros con SDHA en al menos 1 lugar. Se detectó antígeno en el duodeno de 4 de los 8 perros examinados, en el íleon de 5 de 6 perros y en el colon de los 9 perros.
Se localizó una señal positiva en la superficie de la mucosa necrótica, en la superficie de los restos necróticos y dentro del moco en la luz intestinal, donde también se detectaron bacterias histológicamente. No se detectaron partículas parvovirales.
Según la detección del gen CPE se aisló C. perfringens. La principal toxina aislada fue nefF, una toxina formadora de poros5. Un trabajo más reciente que buscó la toxina netF en más de 150 perros (54 perros con SDHA, 54 con parvovirus y 66 perros sanos de control). Encontró una diferencia significativa entre los 3 grupos en la prevalencia de los genes de toxinas formadoras de poros netE y netF.
Perros con SDHA: 26 de 54 (48.1 %); perros con infección por parvovirus canino (CPV): 0 de 54 (0 %); y perros sanos: 8 de 66 (12.1 %; P <0.001)6. Se necesitan más trabajos para evaluar el rol de la toxina clostridial y cuales son los factores determinantes de su expresión.
Tratamiento
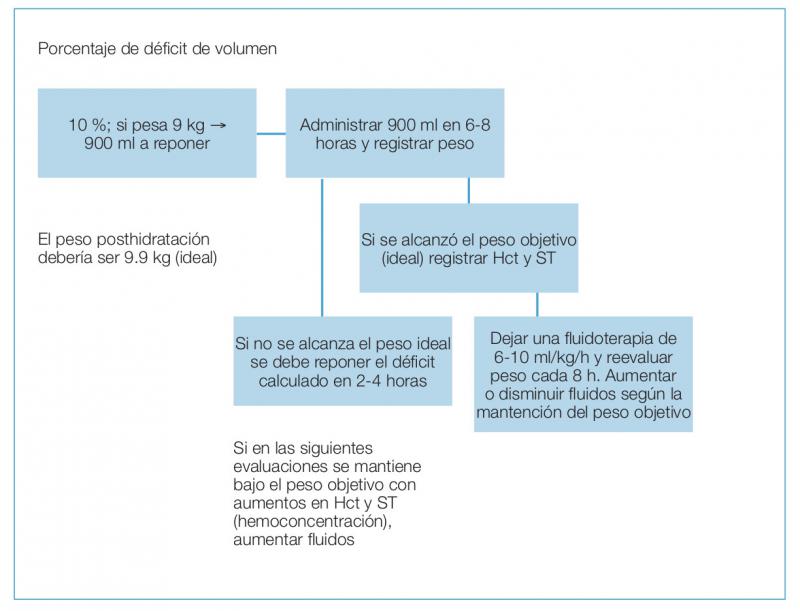
Estos pacientes deben ser hospitalizados, ya que las pérdidas pueden causar una hipovolemia grave rápidamente. El reposo digestivo y la reposición de fluidos son los pilares del tratamiento. Debido a que es fácil subestimar las pérdidas y las necesidades de mantención pueden variar desde 10 a 20 ml/kg/h entre pacientes, se debe evitar dejar una fluidoterapia empírica estática. Se aconseja una terapia racional basada en metas de peso y el seguimiento de hematocrito, sólidos totales y diuresis.
Con evaluación al menos cada 8 horas durante las primeras 48 horas. La mayoría de los pacientes con SDHA muestran mucha diarrea y compromiso general durante las primeras horas, por lo general evolucionan de manera positiva y al tercer día los signos son mínimos3.
Los cristaloides isotónicos como Ringer lactato y salino normal son de elección, suplementado con cloruro de potasio a necesidad. Se recomienda vigilar a estos pacientes de manera frecuente durante las primeras 24 horas. Si bien la etiopatogenia se relaciona más con la producción de toxina CPE de Clostridium perfringens 6, la terapia antimicrobiana en la actualidad es un tema de controversia.
La mayoría de los textos que actualmente no recomiendan el uso de antibióticos de manera rutinaria en estos pacientes se basan en el estudio prospectivo de Unterer y col., (2011)4 en donde no observaron diferencias en mortalidad entre pacientes que recibieron amoxicilina clavulánico y los que sólo recibieron fluidos y terapia sintomática.
Sin embargo, el estudio no fue aleatorizado ni controlado por placebo. Más aún, hubo 7 perros que fueron retirados del estudio, 6 del grupo control (sin antibiótico) y uno del grupo con antibiótico. 5 pacientes del grupo control fueron sacados por mala evolución clínica, y otro por fiebre. Los dos pacientes que murieron y uno que fue eutanasiado fueron del grupo control.
Debido a que la mayoría de los pacientes presenta una buena evolución sólo con fluidos, se aconseja iniciar antimicrobianos frente a deterioro clínico persistente luego de las primeras horas de reanimación o presencia de estigmas sépticos como hipoglucemia, trombocitopenia, hipotensión pese a volumen, fiebre, leucopenia, azotemia y/o colestasis.
La mayoría de los autores utiliza amoxicilina ácido clavulánico con o sin metronidazol. En 2018, el grupo de Ortiz evaluó, un cohorte de 34 perros con SDHA en donde comparó el uso de amoxicilina clavulánico (14 perros aleatorizados) contra amoxicilina clavulánico más metronidazol (20 perros aleatorizados). Además del tratamiento aleatorizado, los casos también recibieron fluidoterapia intravenosa, con la tasa determinada por el médico tratante según cada caso individual, y evaluada durante todo el período de hospitalización.
Se administró una dosis de analgesia de 0.02 mg/kg de buprenorfina a todos los casos al ingreso y se continuó según lo requerido cada 6 a 8 horas. Los casos también recibieron una dosis de 1 mg/kg de omeprazol IV una vez al día como estándar. Si había vómito o parecía tener náuseas (hipersalivación, lamer los labios) mientras estaba hospitalizado, se administraba una dosis de 1 mg/kg de maropitant una vez al día.
No hubo diferencias significativas en el tiempo de hospitalización entre los grupos de tratamiento (la media para los perros que recibieron metronidazol fue de 29.6 horas y para los controles fue de 26.3 horas [p = 0.2]) ni en las puntuaciones clínicas diarias.
En el trabajo de Mortier (2015), que a la fecha es el más representativo en cuanto a número de pacientes, el tratamiento consistió en fluidoterapia (cristaloides; cantidad de líquido dependía de la deshidratación, las demandas de mantenimiento y la magnitud de las pérdidas), terapia antiemética (maropitant 1 mg/kg subcutáneo cada 24 horas), antiácidos gástricos (ranitidina 2 mg/kg intravenoso cada 8 horas u omeprazol 1 mg/kg intravenoso cada 24 horas) y una dieta gastrointestinal.
Sólo la mitad (53/108 perros) recibió antibióticos (amoxicilina/ácido clavulánico 7 mg/kg por vía subcutánea cada 24 horas durante la hospitalización, seguidos de 12.5 mg/kg por vía oral cada 12 horas administrados por los propietarios en el hogar). Los analgésicos (buprenorfina 0.01 mg/kg intravenoso cada 6 horas o cada 8 horas) se administraron a criterio del médico.
La fluidoterapia promedio fue de 12 ml/kg/h (6-20 ml/kg/h) durante las primeras 24 horas. Sólo un estudio ha evaluado el rol de los probióticos en perros con SDHA. Anna-Lena y cols., (2018) en ensayo clínico prospectivo ciego, aleatorizaron 25 perros con SDHA sin signos de sepsis en un grupo probiótico (PRO; Visbiome, ExeGi Pharma) y otro placebo (PLAC)7. Además, se realizaron estudios de microbiota y de expresión de toxina netF clostridiana.
Ambos grupos mostraron una rápida mejoría clínica. En PRO se observó una recuperación clínica significativa en el día 3 (p = 0.008), mientras que en PLAC se observó en el día 4 (p = 0.002) en comparación con el día 0.
La abundancia de Blautia (p <0.001) y Faecalibacterium (p = 0.035) fue significativamente mayor en PRO el día 7 en comparación con el día 0, mientras que en PLAC la abundancia de Faecalibacterium no fue significativamente mayor en ningún día de estudio y Blautia (p = 0.016) solo fue significativamente mayor el día 21 en comparación con el día 0.
La abundancia de C. perfringens fue significativamente menor en el día 7 (p = 0.011) en comparación con el día 0 en el grupo PRO, pero no en el grupo PLAC. Los genes de enterotoxina fueron significativamente más bajos en el grupo que recibió probióticos (p = 0.028) en comparación con PLAC.
Las muestras fecales del 57 % de todos los perros fueron positivas para los genes de toxina netF en el día 0 y la abundancia fue significativamente menor en el día 7 en comparación con el día 0 en el grupo probiótico (p = 0.016) y PLAC (p = 0.031). Se necesita un estudio con mayor número de pacientes para valorar si el uso de probióticos se asocia a una mejora clínica relevante.
Pronóstico
El cuadro es autolimitante. En la gran mayoría de los casos una adecuada fluidoterapia asegura buenos resultados. En el estudio de Mortier (2015) 105 perros (97.2 %) se recuperaron con una media de tiempo de hospitalización de 3 días (rango 1-8 días). Después de un día, la temperatura corporal aumento (P = 0.046) y la frecuencia cardíaca disminuyó (P = 0.006) significativamente en comparación con el tiempo de presentación y ambos parámetros ya no diferían significativamente del grupo control. Tres perros murieron durante la hospitalización (2.8 %). Sus edades eran 8, 10 y 12 años. Su edad media (10 años) fue significativamente mayor que la de los sobrevivientes (media 6 años) (P = 0.019).
Bibliografia
- Unterer S et al. Endoscopically Visualized Lesions, Histologic Findings, and Bacterial Invasion in the Gastrointestinal Mucosa of Dogs with Acute Hemorrhagic Diarrhea Syndrome. J Vet Intern Med 2014; 28: 52–58.
- Triolo, A. & Lappin, M. R. Diseases of the small intestine. In Handbook of Small Animal Gastroenterology 2003. 2nd ed. Ed T. R. TAMS. Philadelphia, PA.; [Londres]: Saunders. pp 195–210.
- Mortier F, Strohmeyer K, Hartmann K, Unterer S. Acute haemorrhagic diarrhoea syndrome in dogs: 108 cases. Vet Rec. 2015; 176(24): 627.
- Unterer S et al. Treatment of Aseptic Dogs with Hemorrhagic Gastroenteritis with Amoxicillin /Clavulanic Acid: A Prospective Blinded Study. J Vet Intern Med 2011; 25: 973–979.
- Leipig-Rudolph M, et al. Intestinal lesions in dogs with acute hemorrhagic diarrhea syndrome associated with netF-positive Clostridium perfringens type A. J Vet Diagn Invest. 2018; 30(4): 495-503.
- Sindern N, Suchodolski JS, Leutenegger CM, et al. Prevalence of Clostridium perfringens netE and netF toxin genes in the feces of dogs with acute hemorrhagic diarrhea syndrome. J Vet Intern Med. 2019; 33(1): 100-105.
- Anna-Lena Ziese, Jan S. Suchodolski, Katrin Hartmann, et al. Effect of probiotic treatment on the clinical course, intestinal microbiome, and toxigenic Clostridium perfringens in dogs with acute hemorrhagic diarrhea. PLoS One. 2018; 13(9): e0204691.
- Ortiz V, Klein L, Channell S, et al. Evaluating the effect of metronidazole plus amoxicillin-clavulanate versus amoxicillin-clavulanate alone in canine haemorrhagic diarrhoea: a randomised controlled trial in primary care practice. J Small Anim Pract. 2018; 59(7): 398-403.
- Sasaki J, Goryo M, Asahina M, et al. Hemorrhagic enteritis associated with Clostridium perfringens type A in a dog. J Vet Med Sci 1999; 61: 175–177.
- Trotman T. Gastroenteritis. En: Small animal critical care medicine. Silverstein D & Hopper K (Eds). Segunda edición. Elsevier, St Louis. Pp 622-626.
 by Multimédica
by Multimédica