Miocardiopatía secundaria a la sepsis en veterinaria. Revisión bibliografía a partir de un caso clínico
Resumen breve
El objetivo del trabajo es poner en evidencia una entidad descripta en medicina humana que creemos es subdiagnosticada en medicina veterinaria. La miocardiopatía secundaría a la sepsis (MSS) es una entidad multifactorial, compleja que reviste un desafío diagnóstico y terapéutico. Se pretende acercar a los/las colegas un resumen bibliográfico que evidencie la MSS.Índice de contenidos
Resumen
El objetivo del trabajo es poner en evidencia una entidad descripta en medicina humana que creemos es subdiagnosticada en medicina veterinaria. La miocardiopatía secundaría a la sepsis (MSS) es una entidad multifactorial, compleja que reviste un desafío diagnóstico y terapéutico. Se pretende acercar a los/las colegas un resumen bibliográfico que evidencie la MSS. A partir de este reporte se insta a la búsqueda de la MSS en felinos para estimular la documentación y registro. Además, sin dejar de lado que según el conocimiento de los/las autores/as es la primera vez que se aborda la MSS en un felino, con documentación ultrasonográfica de la misma.
Introducción y revisión bibliográfica
La sepsis, un síndrome grave desencadenado por la invasión de microorganismos y que puede poner en peligro la vida del paciente, se caracteriza por una respuesta inflamatoria descontrolada en el cuerpo1,2. Durante este proceso, el sistema inmunológico se ve comprometido, lo que resulta en una liberación excesiva de mediadores inflamatorios. Esta desregulación inmunitaria puede conducir a una disfunción orgánica, dando lugar al síndrome de disfunción orgánica múltiple (SDMO), una complicación común y mortal en unidades de cuidados intensivos3. La relación entre la sepsis y el SDMO se ha redefinido recientemente como "la disfunción orgánica potencialmente mortal causada por una respuesta desregulada del huésped a la infección" 2-4. Estudios en perros han demostrado que la progresión de la sepsis a SDMO aumenta significativamente el riesgo de mortalidad5.
En medicina humana, la miocardiopatía secundaria a la sepsis (MSS) se asocia con un aumento significativo de la mortalidad y es una complicación común en pacientes con falla multiorgánica debido a la sepsis. La fisiopatología de la MSS implica una combinación de alteraciones en la circulación sanguínea del corazón, la función contráctil del miocardio y el rendimiento de las mitocondrias. Esta afección se caracteriza por una reducción en el flujo sanguíneo hacia el corazón, asociado con disfunción microvascular, daño endotelial y desequilibrio entre la función ventricular y arterial.
Los mecanismos detrás de la depresión miocárdica secundaria a la sepsis consisten en la regulación negativa de los receptores β adrenérgicos y varios supresores del miocardio (como las citocinas y el óxido nítrico)6. Se estima una tasa de mortalidad de hasta el 70 % en humanos con esta condición. El conocimiento de su patogénesis y la identificación de posibles enfoques terapéuticos pueden reducir la tasa de mortalidad de los pacientes con MSS y conducir a mejoras clínicas, pero es una entidad que aún no cuenta con un tratamiento específico más allá del soporte y resolución de la condición inicial7.
La MSS se caracteriza clínicamente por una función sistólica del ventrículo izquierdo defectuosa e hipertrofia ventricular compensatoria, y es de esperar además afección diastólica. Según las estadísticas de principios de 2018, hasta dos tercios de los pacientes con shock séptico experimentan MSS7.
Actualmente, en medicina veterinaria, se están realizando esfuerzos por llevar a un consenso internacional sobre las definiciones de pacientes sépticos y en shock séptico3. Puntualmente, la sepsis en la especie felina es un problema grave que puede ser desencadenado por diversas patologías, como peritonitis séptica, absceso hepático, piotórax, neumonía, endocarditis, pielonefritis y piometra. Aunque menos documentada en gatos en términos de frecuencia y manifestaciones clínicas en comparación con otras especies como son los caninos, su tasa de mortalidad reportada es significativamente alta, entre un 29 % y el 79 %8. Se han explorado varios biomarcadores, como la metarubrocitosis, las altas actividades de enzimas musculares circulantes (como el aspartato transaminasa y la creatina quinasa), el porcentaje elevado de neutrófilos en banda y las concentraciones séricas elevadas de amiloide A9,10. Aunque se han hecho avances en la identificación de estos biomarcadores, aún hay una falta de estudios que caractericen las disfunciones específicas de los órganos en gatos con sepsis, y son escasas las investigaciones que evalúen sistemáticamente el desarrollo del síndrome de disfunción multiorgánica (SDMO) en el curso de la sepsis felina.
Los criterios para definir la disfunción orgánica en felinos se adaptaron de la literatura humana y canina que ha sido publicada con anterioridad11. En los felinos, la disfunción respiratoria se definió en presencia de SpO2 <95 % en aire ambiente, o si la oxigenoterapia o la ventilación mecánica eran necesarios debido al grado de hipoxemia sin respuesta los métodos convencionales. La disfunción hepática se definió como bilirrubinemia >0.7 mg/dl en ausencia de hemólisis u obstrucción biliar. La lesión renal aguda (IRA) se definió como creatininemia (Crs) >1.8 mg/dl y/o aumento de Crs de ⩾ 0.3 mg/dl desde el inicio y/u oliguria (diuresis <1 ml/kg/h durante 6 h), y clasificación (I-V) según la Sociedad Internacional de Interés Renal (IRIS). La disfunción cardiovascular se definió como hipotensión (presión arterial sistólica <90 mmHg) en pacientes no respondedores a fluidoterapia (precarga independencia) que requieren terapia con vasopresores. La disfunción hemostática se definió como TP >15 s, y/o PTT activado (PTTa) >20 s y/o recuento de plaquetas <100.000/mm3 en ausencia de agregación plaquetaria evaluado con frotis sanguíneo. El SDMO se definió como la presencia de al menos dos órganos disfuncionales simultáneamente9.
En medicina veterinaria, hay una escasez de estudios sobre marcadores de disfunción miocárdica en pacientes críticos en comparación con la investigación disponible en medicina humana. Un estudio analizó el aumento de los niveles séricos de troponina (cTnI) en felinos gravemente enfermos con criterios de SIRS, y evidenció que estos valores eran considerablemente más altos en comparación con un grupo de felinos sanos sometidos a cirugías electivas de baja complejidad, como castraciones. Además, este estudio registró simultáneamente las alteraciones electrocardiográficas en los felinos gravemente enfermos, lo que respalda la teoría de que el corazón sufre afectaciones secundarias a la presencia de SIRS y a la gravedad de la enfermedad subyacente12. En el ámbito de la medicina veterinaria, la información sobre marcadores de disfunción miocárdica en pacientes críticos es escasa en comparación con la abundante literatura disponible en medicina humana. Por ejemplo, en medicina humana, se ha observado que el aumento de la creatina quinasa (CPK) sérica está asociado con disfunción miocárdica en pacientes con criterios de sepsis, quienes previamente fueron evaluados mediante ecocardiografía en unidades de terapia intensiva13. Además, se ha investigado el uso de varios biomarcadores, como el péptido natriurético cerebral (BNP), la troponina cardiaca I (cTnI) y la proteína de unión a ácidos grasos de tipo cardiaco (h-FABP), en un estudio con 147 pacientes sépticos evaluados dentro de las 6 horas posteriores al ingreso. Este estudio reveló que la combinación de estos biomarcadores mejoraba la sensibilidad y especificidad en el diagnóstico del síndrome de respuesta inflamatoria sistémica (SIRS)14.
La utilización de forma rutinaria de la ultrasonografía en el contexto del paciente critico o en terapia intensiva, en medicina humana y veterinaria, ha permitido una detección mucho más precoz de esta entidad. Como se expuso anteriormente, en general la miocardiopatía relacionada con la sepsis puede reconocerse como una disminución abrupta de la contractilidad del ventrículo izquierdo (VI), posiblemente acompañada de dilatación del VI con o sin insuficiencia ventricular derecha, todos estos hallazgos pueden ser evidenciados en ecocardiografías transtorácicas15. Se demostró también que la medición de MAPSE (Mitral Annular Plane Systolic Excursion/Excursión Sistólica del Plano del Anillo Mitral) cuando se combina con el APACHE II (Score de gravedad utilizado en terapia intensiva) fue un buen predictor de mortalidad. Entre los parámetros ecocardiográficos, el MAPSE por sí solo fue un buen predictor de mortalidad16. Se informa el caso de un cachorro de 5 meses diagnosticado con síndrome metabólico del corazón (MSS) en medicina veterinaria. El cachorro presentó fiebre aguda, edema en las extremidades y se encontró pus en las articulaciones, positivo para bacterias específicas. Desarrolló una grave afectación con fallo multiorgánico. A pesar de la sospecha inicial de endocarditis, se encontró dilatación ventricular grave y disminución en la función cardiaca en la ecocardiografía. Sin embargo, respondió favorablemente al tratamiento con antibióticos y se recuperó completamente en 5 días. Un seguimiento posterior mostró que el corazón volvió a la normalidad después de 3 meses, sin dilatación ni disfunción17.
En 1989, se llevó a cabo un estudio experimental utilizando gatos como modelo para investigar el impacto de los leucotrienos (LT) en la disfunción cardiopulmonar en pacientes sépticos. El estudio consistió en inducir el estado séptico en gatos anestesiados mediante la infusión de la bacteria Escherichia coli. Los resultados concluyeron que los leucotrienos desempeñan un papel crucial en el desarrollo de la insuficiencia miocárdica en el shock séptico bacteriémico experimental18. Recientemente, fue publicado un trabajo acerca del manejo de la fluidoterapia en caninos y felinos sépticos donde mencionan que la disfunción miocárdica secundaria a la sepsis es una posibilidad real que hay que considerar sobre todo a la hora de realizar resucitación hemodinámica de estos pacientes19.
Hay poca evidencia para guiar el tratamiento de pacientes con función sistólica deprimida en este contexto. Es una cuestión no resuelta si la disfunción es perjudicial o protectora y, en consecuencia, con qué agresividad deben intervenir los médicos para mejorar la función sistólica en el contexto agudo, en lugar de tratar la sepsis subyacente y permitir que la función se recupere con el tiempo. En pacientes con disfunción miocárdica inducida por sepsis e hipoperfusión continua después de una reanimación con volumen de forma adecuado, las pautas de la Campaña Sobreviviendo a la Sepsis sugieren terapia inotrópica, ya sea con la adición de dobutamina a la norepinefrina o epinefrina sola. La terapia con dobutamina se ha asociado con mejoras en los parámetros de la función cardiaca. Sin embargo, numerosos estudios, incluidos metanálisis, muestran resultados variables en cuanto a su efecto en la mortalidad. Se ha observado que el intento de alcanzar un índice cardiaco supranormal con dobutamina puede ser perjudicial. Los estudios previos se realizaron en una población heterogénea de pacientes con shock séptico, sin una clasificación ni selección basada en ecocardiografía. Por lo tanto, es posible que haya un subgrupo de pacientes con disminución en la contractilidad cardiaca que se beneficiarían del tratamiento con inotrópicos, mientras que otros no. Actualmente, se está llevando a cabo un ensayo clínico que evalúa el uso de dobutamina en el tratamiento de pacientes con shock séptico y miocardiopatía séptica con fracción de eyección del ventrículo izquierdo reducida, lo que podría aportar claridad a esta cuestión20.
La sepsis también puede provocar una relajación ventricular anormal (disfunción diastólica) debido a niveles elevados de catecolaminas, taquicardia y anomalías en la absorción de calcio en el retículo sarcoplásmico, lo que altera el proceso de relajación activa en los miocitos cardiacos. En el corazón sano, durante la taquicardia se observa una aceleración de la relajación dependiente de la frecuencia para mantener el llenado ventricular. En el contexto de la sepsis, los desequilibrios en los niveles de calcio pueden tener un profundo impacto en el funcionamiento del corazón, comprometiendo su capacidad para llenarse adecuadamente y en consecuencia cae el gasto cardiaco19. Además, la rápida infusión de líquidos, una medida común en el tratamiento de la sepsis puede exacerbar esta disfunción cardiaca. La disminución en la relajación del ventrículo contribuye a una disminución en el volumen de sangre expulsado por el corazón y a una reducción en la perfusión de los tejidos, lo que agrava aún más la situación.
En medio de este escenario desafiante, surge el levosimendan como una opción terapéutica prometedora. Este fármaco, al actuar como un sensibilizador del calcio en las células cardiacas, mejora la capacidad contráctil del corazón sin aumentar su demanda de oxígeno, lo que lo convierte en un aliado valioso en el manejo de la insuficiencia cardiaca asociada a la sepsis.
Estudios clínicos han revelado que el levosimendán puede ejercer efectos beneficiosos en pacientes que experimentan disfunción cardiaca durante un episodio de shock séptico. Además de mejorar la función del corazón, este medicamento ha mostrado la capacidad de reducir la resistencia vascular sistémica, lo que contribuye a una mejor circulación sanguínea en el organismo sin comprometer la estabilidad de la presión arterial22.
El levosimendán muestra una capacidad prometedora para ofrecer apoyo cardiovascular en momentos críticos, lo que representa un avance crucial en el tratamiento de pacientes con esta compleja condición médica. Aunque se requieren más investigaciones para respaldar su uso, el levosimendán se perfila como una opción promisoria. Sin embargo, es importante destacar que, en la práctica clínica, el pimobendan también se emplea con frecuencia como alternativa en situaciones similares.
Fue publicado un trabajo experimental en caninos donde se evaluó el efecto comparado de levosimendán, pimobendan y milrinona. Los resultados indicaron que levosimendan, pimobendan y milrinona aumentaron la contractilidad miocárdica, produciendo vasodilatación venosa y arteriolar, y mejoraron el acoplamiento arterial-ventrículo izquierdo y la eficiencia mecánica en perros23.
Se expone a continuación, brevemente, el caso clínico que despertó el interés en reportar e investigar acerca de la MSS en veterinaria. Según el conocimiento de los autores no hay hasta el momento reportes de dicha condición en felinos.
El caso clínico que despertó el interés en la MSS
Se recibió en el Hospital Veterinario de Gualeguaychú de Entre Ríos, Argentina, un paciente felino, Común europeo, macho, de 1 año. Al ingreso el paciente estaba severamente disneico con hundimiento de intercostales, reclutamiento de ollares y músculos accesorios, respirando con la boca abierta de forma intermitente. Presentaba bradicardia (120 lpm), taquipnea (50 rpm), hipertermia (40 °C), mucosas rosadas pálidas, tiempo de lleno capilar no evaluable, pulso metatarsiano débil, femoral presente. Se realizó una ultrasonografía pleuropulmonar de urgencia (TFAST/VETBLUE/POCUS). Se evidenció severa cantidad de efusión pleural de aspecto muy celular, campos pulmonares con signos ecográficos de colapso (Video 1 y 2), presencia de síndrome alveolointersticial grave en varios cuadrantes. Dichos cuadrantes presentaron la pleura irregular, signos de fragmentación y escalón pleural, consolidaciones pulmonares (Videos 3 y 4);
Video 1. Ecografía torácica POCUS donde se evidenció severa cantidad de efusión pleural de aspecto muy celular con una dilatación y disfunción contráctil global del corazón evaluada de forma subjetiva al ingreso del paciente. Se utilizó un transductor microconvexo.
Video 2. Ecografía pleuropulmonar realizada con un transductor lineal. Se evidencia disminución de la cantidad de efusión pleural ya que la misma fue evacuada. Se aprecia un síndrome alveolo intersticial con pleura irregular y presencia de fragmentación de la pleura. Además, se aprecia una porción de lóbulo pulmonar con signos de atelectasia donde se puede ver interacción de aire y líquido (broncograma aéreo).
Video 3. Con un transductor lineal se aprecia la presencia de síndrome alveolo intersticial y fragmentación pleural. Además, al inicio del video se aprecia el estómago en el abdomen en total vacuidad, “rueda de carro”, la paciente venia con anorexia total hace días.
Video 4. Se aprecia una porción lobar atelectasiada y se evidencia flujo de aire y líquido, además se puede ver la circulación de dicho lóbulo afectado pasando por la mitad del parénquima. Todos hallazgos que sugiere que dicha porción pulmonar perdió toda ventilación, no así perfusión.
se advierte que el corazón presentaba una dilatación global con disfunción contráctil, hipoquinesia miocárdica, separación del punto de septum e hipertensión pulmonar con presencia de contraste ecográfico espontáneo dentro de las distintas cámaras cardiacas (Vídeo 5, Figura 1 - 4).
Video 5. Se evaluó con un transductor lineal el corazón en un eje largo de cuatro cámaras por momento se oblicua la imagen y se ve el tracto de salida del ventrículo izquierdo. Sobre todo, en las cámaras cardiacas izquierdas puede verse la presencia de contraste ecográfico espontáneo sutil que sugiere estasis sanguínea en dichas cámaras. Y el mismo se lo aprecia saliendo de la aorta. Aún se aprecia efusión pleural.
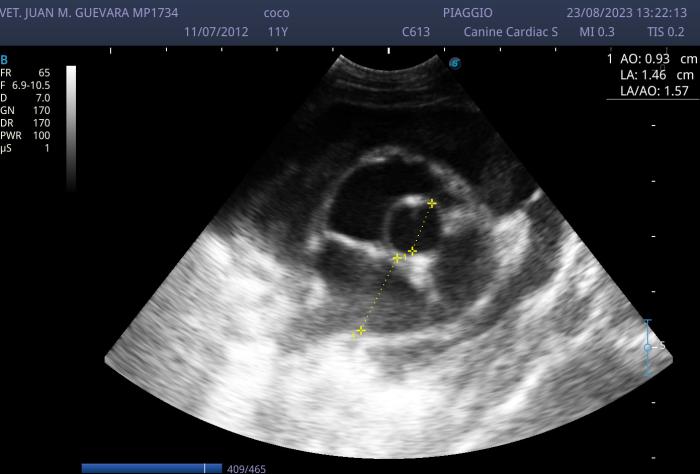
Figura 1. Se evidencia un eje corto a la altura de la base cardiaca evaluando la relación Ai/Ao arrojando un aumento de dicha relación.
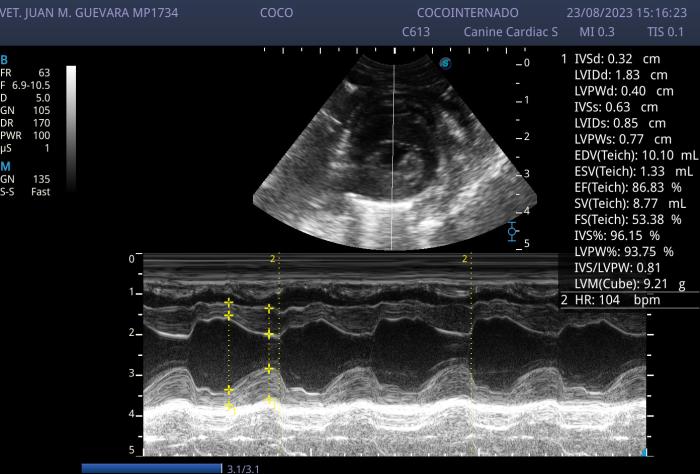
Figura 2. Se parecía un modo M realizado a la altura de los músculos papilares en eje corto utilizando la formula Teichholz para el análisis de la función ventricular. Se puede apreciar un aumento en el diámetro en sístole y diástole del ventrículo izquierdo. Se aprecia además marcada bradicardia. Y espesores parietales en límite inferior.
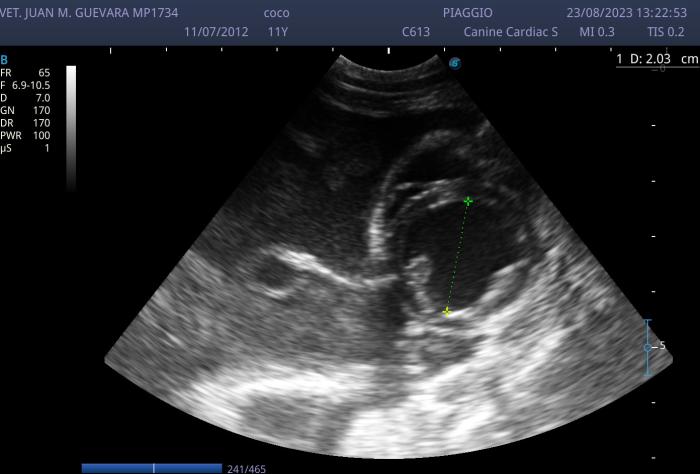
Figura 3. Se aprecia una imagen bidimensional en eje corto a la altura de los papilares evidenciándose un aumento marcado del diámetro el ventrículo izquierdo al fin de la diástole con adelgazamiento de paredes y e evidencia además la presencia de una gran cantidad de efusión pleural de aspecto muy celular. Subjetivamente se aprecia además aumento del ventrículo derecho.
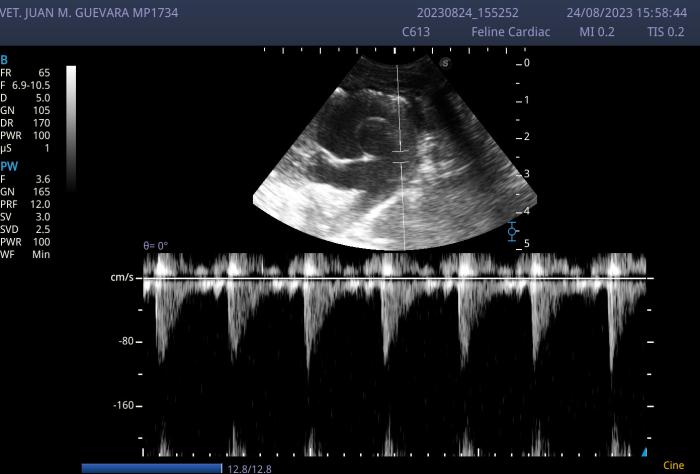
Figura 4. En la imagen se puede apreciar la realización de la evaluación Doppler espectral (Doppler pulsado) del tracto de salida del ventrículo derecho a la altura de las válvulas pulmonares con el volumen de muestra clocado en dicha posición. Se evaluó de esta manera el flujo de la arteria pulmonar. El mismo adoptó una conformación de tipo “aortizado” lo que es compatible con hipertensión pulmonar, se aprecia por momentos la presencia de un de una “muesca” mesosistólica, lo que sugiere un alto grado de hipertensión. Por último, se puede ver la marcada dilatación de las ramas pulmonares. Todas alteraciones presentes en hipertensión pulmonar.
Se colocan tubos de drenaje en ambos hemitórax. Se obtiene material de color blanco opaco maloliente, compatible con pus (empiema torácico) (Figura 5).

Figura 5. Se evidencia la evacuación del empiema torácico. Utilizando un “mini tubo torácico” que consiste en un catéter 14 G una sonda K-35 de calibre necesario para poder ser enhebrada a través del teflón del catéter. Luego a través de conectar una llave de 3 vías en el extremo del tapón de la sonda se utiliza una jeringa de 10 ml para obtener la efusión purulenta del espacio pleural. Luego por esa misma sonda se realizarán los lavados pleurales correspondientes.
Una muestra de lo recolectado es enviada a laboratorio para cultivo y antibiograma. Se coloca sonda nasal para oxigenación (oximetrías promedio de 95 % con mejora de frecuencia respiratoria y patrón respiratorio). Se protocolizan lavajes cada 4 h con solución fisiológica al 0.9 % heparinizada (500 ml de NaCl 0.9 % con 0.5 ml de heparina), 10 ml/kg en cada hemitórax en cada ciclo. La antibioticoterapia usada fue ampicilina-sulbactam 20 mg/kg cada 8 h E.V. y enrofloxacino 5 mg/kg cada 24 h intramuscular, pimobendam 1.25 mg cada 12 h, clopidogrel 18.75 mg cada 24 h, enoxaheparina 1 mg/kg S.C. cada 12 h y sildenafilo 0.5 mg/kg cada 12 h. Se sumó al protocolo omeprazol 0.8 mg/kg cada 24 hendovenoso, tramadol 2 mg/kg y dipirona 15 mg/kg. Se tomó una muestra de sangre para enviar al laboratorio. A las 12 h de realizada la maniobra el paciente había presentado una notable mejora clínica, ya estaba alimentándose por sus propios medios con alimento húmedo y el patrón y frecuencia respiratoria habían mejorado (44 mpm de FR). A las 24 h se quita la sonda nasal de oxígeno y no se recoloca la misma ya que la saturación se mantenía entre 94-95 % con FiO2ambiental y un buen patrón respiratorio. La temperatura normalizó con la tercera administración de antibióticos. El laboratorio arrojó una leve anemia (33 % hto), glóbulos blancos dentro de valores normales, leve hipoalbuminemia (2.2 g/dl) y las mayores alteraciones estuvieron en el coagulograma. El T.P. fue de 10 segundos (valor normal hasta 8 segundos) y el KPTT en 19 segundos, valor máximo. Las plaquetas estaban en 35 mil, pero con presencia de escasas macroplaquetas. El paciente no tenía indicios clínicos de trombocitopenia (petequias). Se establecieron controles seriados de ultrasonografía torácica (pulmón, pleura y corazón). La cantidad y aspecto del líquido fue mejorando con el pasar de los días. La disfunción miocárdica a los 2 días había corregido y ya no había presencia de contraste ecográfico positivo, la hipertensión pulmonar demoró unos días más en corregir del todo (Video 6; Figura 6 - 8).
Video 6. Podemos ver una ecocardiografía control donde se ve una contractilidad y frecuencia cardiacas normales. Se comienza en un eje largo de 4 a 5 cámaras y luego se procede a un eje corto a la altura de los papilares para continuar hacia la base y realizar una relación Ai/Ao. El estudio muestra una notable mejora funcional y un aspecto ecocardiográfico normal. Además, tampoco se aprecia efusión pleural.
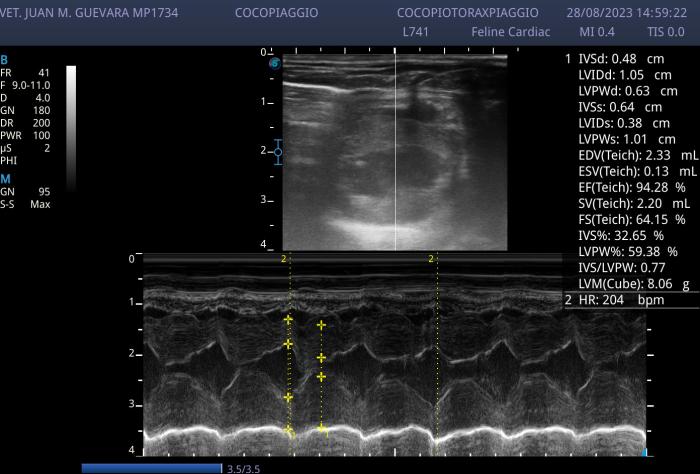
Figura 6. Realización de nueva función ventricular esta vez con un transductor lineal, donde puede verse la mejora notable en los espesores parietales, diámetros ventriculares sistólicos y diastólicos. Además, con una frecuencia cardiaca normal.
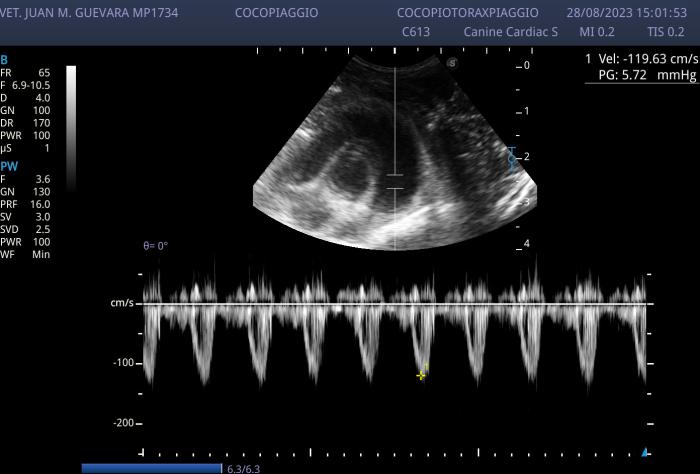
Figura 7. Control del flujo pulmonar con Doppler pulsado. En esta oportunidad se evidencia un perfil Doppler simétrico normal. Lo que sugiere normalización de la presión pulmonar.
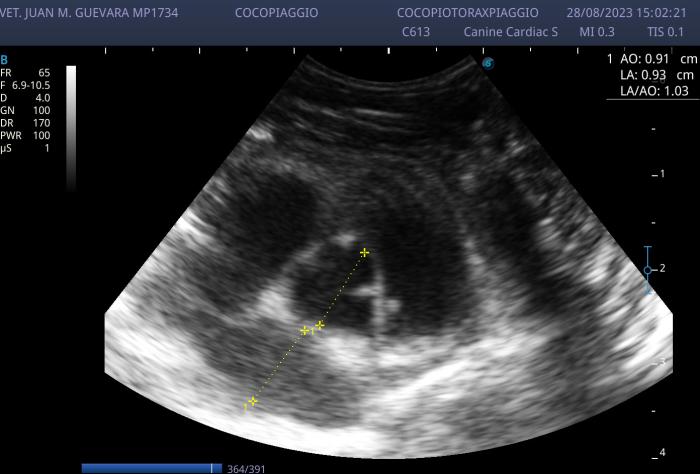
Figura 8. Control ecocardiográfico de la relación Ai/Ao. Se evidencia una normalización de la relación.
A los 7 días del ingreso se obtuvo el resultado del cultivo que arrojó la presencia de un Staphylococcus sensible a la penicilina, por lo cual se continuó con el mismo protocolo establecido de inicio. El paciente ya estaba siendo manejado de forma ambulatoria concurriendo a la veterinaria 2 veces al día para los lavajes y las medicaciones. Como la mejora ecocardiográfica fue notable se procedió a suspender sildenafilo, clopidogrel y enoxaheparina, solamente permaneció con pimobendan. Debido a que el paciente estaba bien clínicamente, comiendo, sin fiebre y había escasa cantidad de efusión pleural. Se continua solamente con amoxicilina-clavulánico vía oral. Luego de 25 días de tratamiento ya sin tubos, solamente con amoxicilina-clavulánico y pimobendan, el paciente concurre a control ultrasonográfico donde no se evidencia efusión hay sutiles alteraciones pleurales en algunos pocos cuadrantes, sin disfunción miocárdica, función sistodiastólica normal, sin hipertensión pulmonar, sin fiebre (38 °C), comiendo, bebiendo normalmente y muy activo en el hogar. Se propone una semana más y luego suspender toda la medicación. Pasado ese tiempo se deja al paciente sin medicación por 10 días y se realiza control clínico y ecográfico. La evaluación clínica fue sin alteraciones; la ultrasonografía arrojó sutiles alteraciones pleurales sin efusión y corazón normal. El paciente continúa normal, sin recaídas clínicas hasta el día de hoy.
Conclusión, discusión y reflexiones
La sepsis, un desafío complejo en la medicina veterinaria, a menudo pasa desapercibida, subestimada y subdiagnosticada. Sin embargo, con la evolución tecnológica, en especial la introducción de la ultrasonografía como una herramienta de diagnóstico cada vez más accesible, se comienza a vislumbrar a una comprensión más profunda de las complicaciones asociadas, como la miocardiopatía séptica (MSS).
Este escrito busca no solo alertar a la comunidad veterinaria sobre la importancia de considerar la MSS en pacientes con sepsis, SDMO y shock séptico, sino también impulsar una reflexión sobre la necesidad de un enfoque más amplio e integrativo en el manejo de estos casos críticos. Reconocer la disfunción cardiaca como un componente significativo del cuadro clínico, y priorizar la evaluación continua de la función cardiaca, podría marcar la diferencia en el pronóstico y la recuperación de estos pacientes.
Además, es esencial destacar la relevancia de la colaboración interdisciplinaria y el intercambio de conocimientos entre profesionales veterinarios para avanzar en la comprensión y el manejo de la MSS. La creación de redes de trabajo que incluyan la participación de especialistas en cuidados intensivos, cardiólogos veterinarios y patólogos, entre otros, podría facilitar un abordaje más completo y efectivo de esta compleja condición médica.
Aunque aún quedan interrogantes por resolver, como el tratamiento óptimo de la MSS, y es necesario continuar con la investigación para llenar estos vacíos de conocimiento, el énfasis en la vigilancia activa de la función cardiaca y el uso de herramientas diagnósticas avanzadas como la ultrasonografía son pasos importantes hacia el futuro.
En resumen, la identificación temprana y el manejo adecuado de la MSS en pacientes sépticos representa un desafío y una oportunidad para mejorar la atención y los resultados clínicos en la práctica veterinaria. Al integrar el conocimiento científico actualizado, la tecnología de vanguardia y el trabajo en equipo, podemos aspirar a ofrecer el más alto nivel de cuidado médico a nuestros pacientes, brindándoles la mejor oportunidad posible de recuperación y bienestar.
Bibliografía
Bibliografía
- Evans, Laura; Rhodes, Andrew; Alhazzani, Waleed; Antonelli, Massimo; Coopersmith, Craig M.; French, Craig; Machado, Flávia R.; Mcintyre, Lauralyn; Ostermann, Marlies; Prescott, Hallie C.; Schorr, Christa; Simpson, Steven; Wiersinga, W. Joost; Alshamsi, Fayez; Angus, Derek C.; Arabi, Yaseen; Azevedo, Luciano; Beale, Richard; Beilman, Gregory; Belley-Cote, Emilie; Burry, Lisa; Cecconi, Maurizio; Centofanti, John; Coz Yataco, Angel; De Waele, Jan; Dellinger, R. Phillip; Doi, Kent; Du, Bin; Estenssoro, Elisa; Ferrer, Ricard; Gomersall, Charles; Hodgson, Carol; Hylander Møller, Morten; Iwashyna, Theodore; Jacob, Shevin; Kleinpell, Ruth; Klompas, Michael; Koh, Younsuck; Kumar, Anand; Kwizera, Arthur; Lobo, Suzana; Masur, Henry; McGloughlin, Steven; Mehta, Sangeeta; Mehta, Yatin; Mer, Mervyn; Nunnally, Mark; Oczkowski, Simon; Osborn, Tiffany; Papathanassoglou, Elizabeth; Perner, Anders; Puskarich, Michael; Roberts, Jason; Schweickert, William; Seckel, Maureen; Sevransky, Jonathan; Sprung, Charles L.; Welte, Tobias; Zimmerman, Janice; Levy, Mitchell. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021. Critical Care Medicine 49(11):p e1063-e1143, November 2021.
- Delano MJ and Ward PA. The immune system's role in sepsis progression, resolution, and long‑term outcome. Immunol Rev 274: 330‑353, 2016.
- Stefano Cortellini , Amy E. DeClue, Massimo Giunti, Robert Goggs , Kate Hopper, Julie M. Menard, Rodrigo C. Rabelo, Elizabeth A. Rozanski, Claire R. Sharp, Deborah C. Silverstein, Virginia Sinnott-Stutzman, Giacomo Stanzani. Defining sepsis in small animals. J Vet Emerg Crit Care. 2024;1–13.
- Pablo Donald Villegas-Cruz. El síndrome de disfunción multiorgánica. La necesidad de su diagnóstico basado en los criterios. REVISTA EXPERIENCIA EN MEDICINA 2019. Vol.5 Núm.1.
- Kenney EM, Rozanski EA, Rush JE, deLaforcade-Buress AM, Berg JR, Silverstein DC, Montealegre CD, Jutkowitz LA, Adamantos S, Ovbey DH, Boysen SR, Shaw SP. Association between outcome and organ system dysfunction in dogs with sepsis: 114 cases (2003-2007). J Am Vet Med Assoc. 2010 Jan 1;236(1):83-7.
- Reverien Habimana, Insu Choi, Hwa Jin Cho, Dowan Kim, Kyoseon Lee, Inseok Jeong. Sepsis-induced cardiac dysfunction: a review of pathophysiology. Acute and Critical Care 2020 May 35(2):57-66.
- Jiayu Song, Xiaolei Fang, Kaixuan Zhou, Huiwei Bao y Lijing Li. Sepsis‑induced cardiac dysfunction and pathogenetic mechanisms (Review). MOLECULAR MEDICINE REPORTS 28: 227, 2023.
- Maíra Fernanda Gonçalves Koiyama, Alessandra Tammy Hayakawa Ito De Sousa, Tarcísio Ávila Dos Santos, Marisol Alves De Barros, Lorena Tavares de Brito Nery Jaworski, Pedro Eduardo Brandini Néspoli, Adriane Jorge Mendonça, Edson Moleta Colodel, Valéria Dutra, Valéria Régia Franco Sousa. Commensal and multidrug-resistant Neisseria spp. sepsis in feline. J Infect Dev Ctries. 2022 Sep 30;16(9):1517-1523
- Roberta Troìa, Giulia Mascalzoni, Stefano Calipa, Ilaria Magagnoli, Francesco Dondi and Massimo Giunti. Multiorgan dysfunction síndrome in feline sepsis: prevalence and prognostic implication. Journal of Feline Medicine and Surgery 2019, Vol. 21(6)559–565.
- Estefania Laborde, César Villalta Riesco, Maistruarena Celeste, Juan Ignacio Rodera, Anais Caurapan, Oscar Barrientos. Amiloide sérico y relación con el outcome del paciente felino crítico, resultados preliminares. Multimédica-Clinvet-Clinurgevet-Núm 23. Octubre 2023.
- Osterbur K, Mann FA, Kuroki K, DeClue A. Multiple organ dysfunction syndrome in humans and animals. J Vet Intern Med. 2014 Jul-Aug;28(4):1141-51. Epub 2014 Apr 28.
- Pugliese, M.; Napoli, E.; La Maestra, R.; Or, M.E.; Bilgiç, B.; Previti, A.; Biondi, V.; Passantino, A. Cardiac Troponin I and Electrocardiographic Evaluation in Hospitalized Cats with Systemic Inflammatory Response Syndrome. Vet. Sci. 2023, 10, 570.
- Salomão R, Ferreira BL, Salomão MC, Santos SS, Azevedo LCP and Brunialti MKC. Sepsis: Evolving concepts and challenges. Braz J Med Biol Res 52: e8595, 2019
- Chen et al. Multi-biomarker strategy for prediction of myocardial dysfunction and mortality in sepsis. J Zhejiang Univ-Sci B (Biomed & Biotechnol) 2020 21(7):537-548.
- Tullo, G.; Candelli, M.; Gasparrini, I.; Micci, S.; Franceschi, F. Ultrasound in Sepsis and Septic Shock—From Diagnosis to Treatment. J. Clin. Med. 2023, 12, 1185.
- Amarja Ashok Havaldar. Evaluation of sepsis induced cardiac dysfunction as a predictor of mortality. Havaldar Cardiovascular Ultrasound (2018) 16:31.
- Dickinson, Elizabeth A. Rozanski, and John E. Rush. Reversible Myocardial Depression Associated with Sepsis in a Dog Amy E. J Vet Intern Med 2007;21:1117–1120.
- Schützer KM, Haglund U, Falk A. Cardiopulmonary dysfunction in a feline septic shock model: possible role of leukotrienes. Circ Shock. 1989 Sep;29(1):13-25.
- Federico Montealegre y Bridget M. Lyons. Fluid Therapy in Dogs and Cats With Sepsis. Front. Vet. Sci. 25 February 2021.
- Tatyana Shvilkina y Nathan Shapiro. Sepsis-Induced myocardial dysfunction: heterogeneity of functional effects and clinical significance. Front. Cardiovasc. Med. 10:1200441. 14 July 2023.
- Nagueh SF, Smiseth OA, Appleton CP, Byrd BF 3rd, Dokainish H, Edvardsen T, Flachskampf FA, Gillebert TC, Klein AL, Lancellotti P, Marino P, Oh JK, Popescu BA, Waggoner AD. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016 Apr;29(4):277-314.
- Yang F, Zhao LN, Sun Y, Chen Z. Levosimendan as a new force in the treatment of sepsis-induced cardiomyopathy: mechanism and clinical application. J Int Med Res. 2019 May;47(5):1817-1828. Epub 2019 Apr 8.
- Pagel PS, Hettrick DA, Warltier DC. Comparison of the effects of levosimendan, pimobendan, and milrinone on canine left ventricular-arterial coupling and mechanical efficiency. Basic Res Cardiol. 1996 Jul-Aug;91(4):296-307.
 by Multimédica
by Multimédica