Reporte de un caso de miastenia gravis (MG) adquirida con megaesófago y neumonía aspirativa.
Resumen breve
En el presente reporte se expone el caso de una paciente que se presentó con signos clínicos de debilidad y sinología respiratoria. Debido a una correcta anamnesis y realización de estudios complementarios combinados se arribó al diagnóstico presuntivo de miastenia gravis (MG).Índice de contenidos
Resumen
En el presente reporte se expone el caso de una paciente que se presentó con signos clínicos de debilidad y sinología respiratoria. Debido a una correcta anamnesis y realización de estudios complementarios combinados se arribó al diagnóstico presuntivo de miastenia gravis (MG). Por falta de métodos complementarios definitivos en la Argentina y para no perder tiempo enviando muestras al exterior se decidió un tratamiento empírico con consentimiento informado de los tutores usando piridostigmina. En primera instancia se propuso la internación de la paciente para manejo hospitalario de la bronconeumonía producida por el megaesófago secundario a la enfermedad de base. Al ver el fracaso en las tomas del fármaco anticolinérgico, por las regurgitaciones, se optó por colocar un tubo de gastrostomía para garantizar el tratamiento y el manejo nutricional evitando así nuevas broncoaspiraciones. Además, se propuso como estrategia de seguimiento y duración de tratamiento del foco infeccioso el apoyo ultrasonográfico, el cual fue, en conjunto con la evolución, quien dictaminó la finalización de la antibioticoterapia. Según los autores es el primer caso de MG que fue manejado con un tubo de gastrostomía para establecer el tratamiento empírico propuesto. Luego de más de 365 días la paciente sigue asintomática con tomas estrictas de piridostigmina cada 12 horas.
Introducción
La MG es una enfermedad inmunológica mediada por las células B. Es considerada la patología neuro inmunológica por excelencia. La misma se caracteriza por la afección de la unión neuro muscular (UNM) producida por anticuerpos contra los receptores colinérgicos nicotínicos de acetilcolina, en la membrana postsináptica del músculo esquelético. Se teoriza que la producción de dichos anticuerpos se produce debido a una alteración a nivel del timo, donde se sintetizan células CD4 T helper (Th) encargadas de producir citoquinas proinflamatorias, anticuerpos de alta afinidad y quimioquinas que predisponen al mantenimiento de la enfermedad en cuestión. Se han propuesto varios modelos experimentales en roedores principalmente, donde se logra reproducir la enfermedad casi por completo con la aplicación de anticuerpos contra la UNM. El término MG hace referencia a una severa debilidad muscular y fue descrito inicialmente en medicina humana por Samuel Wilks en 1877. En los perros se comunicó por primera vez en 1961 por Ormrod y en los gatos en 1970 por Dawson. En la actualidad parece ser la enfermedad neuromuscular más común que puede ser diagnosticada en los perros. Esta entidad tiene una clasificación en MG adquirida y MG congénita (MGc). La diferencia radica en que la adquirida puede expresarse de los 6 meses de vida en adelante con presencia de anticuerpos, y la congénita puede expresarse a las semanas de vida del paciente sin la presencia de anticuerpos. Esta última presentación se cree que expresa más de una alteración hacia la UNM del paciente por lo cual se procedió a llamar síndrome de MGc y se entiende como una entidad separada a la MG adquirida. Dentro de la MG adquirida hay distintas formas de presentación clínicas, la misma puede ser focal, generalizada o una MG aguda fulminante. La MG puede presentarse con o sin la presencia de un timoma. Puntualmente en felinos hay una presentación de MG que sucede luego de la administración de metimazol a altas dosis o de uso crónico, no en todos los felinos con hipertiroidismo tratados con metimazol va a presentarse, pero es una posibilidad factible para tener en cuenta. Fue publicado el caso de un felino raza Rag Doll tratado con metimazol con signos de MG generalizada, con título de AChr altos. Suspendiendo la medicación y sumando piridostigmina el paciente revirtió todos los signos clínicos de MG generalizada y hubo descenso de anticuerpos. La MG focal se caracteriza por la afección de al menos uno de los siguientes órganos sin afectar la musculatura apendicular. Se ven involucrados grupos de músculo esquelético faciales, esofágicos, faríngeos y laríngeos. La generalizada afecta al músculo esquelético apendicular de leve, moderado a grave, pudiendo o no involucrar a los grupos musculares faciales, laríngeos, faríngeos y esofágicos en distintos grados. La presentación fulminante o aguda se define como una generalizada de muy rápido curso y progresión, marcada debilidad muscular súbita pero no necesariamente produciendo fallo respiratorio. En medicina humana esta última clasificación se ha dejado de utilizar por lo difícil que es diferenciar una presentación aguda fulminante de una crisis de MG generalizada, entonces se optó por utilizar el término “crisis miasténica”, ya que en un paciente un MG puede presentar una agudización de los síntomas en cualquier momento de su vida, pudiendo producir un fallo respiratorio agudo y necesidad de intubación y ventilación mecánica hasta reversión y estabilización de los signos clínicos.
La presentación clínica “clásica” de la MG adquirida en el canino es una debilidad muscular generalizada episódica que empeora con la actividad y mejora con el descanso. Al examen neurológico no hay evidencia de alteraciones con el animal en reposo; con el ejercicio la debilidad empeora rápidamente. Este signo es más evidente en los músculos apendiculares de los miembros pelvianos. Se fatigan, desarrollan una marcha hipométrica, pasos cortos y se acuestan a descansar. La fuerza muscular retorna después del reposo. Reflejos espinales y reflejos craneanos están conservados en estadios iniciales, pero después de varias pruebas repetidas pueden mostrar signos de fatiga. El reflejo más sensible para evaluar la fatiga es el palpebral. El megaesófago es un hallazgo habitual en los perros debido a la gran proporción de músculo esquelético que presenta su esófago, y se presenta en el 85 % de los casos. Puede presentarse asociado a la debilidad muscular o ser el único signo clínico. La forma localizada se observa en el 36 % de los perros con MG adquirida seropositiva a anticuerpos. Los pacientes afectados no presentan antecedentes ni evidencia clínica de debilidad muscular apendicular. Pueden presentarse exclusivamente con megaesófago, o con debilidad muscular restringida a grupos específicos de músculos laríngeos, faríngeos, esofágicos o faciales. Los signos clínicos incluyen ptosis palpebral, sialorrea, alteraciones de la fonación o ladrido, estridor inspiratorio cuando la afección laríngea es grave o regurgitaciones a repetición, a causa de la debilidad muscular facial, faríngea, laríngea o esofágica. Además, suelen acompañarse de complicaciones tales como neumonías aspirativas. El diagnóstico de MG se realiza a raíz de los signos clínicos descriptos y con la confirmación de la presencia de anticuerpos anti AChr por inmunoprecipitación y radioinmunoensayo; o por el uso de pruebas farmacológicas que tienen distintos resultados según el caso. El fin del presente reporte es exponer un caso clínico con sospecha de miastenia generalizada que presentó como signos cardinales megaesófago, neumonía aspirativa y depresión del sensorio con debilidad en la deambulación. Debido a la imposibilidad de buscar anticuerpos, se decidió el tratamiento empírico con piridostigmina y evaluar la respuesta clínica, la cual fue categórica. Como la paciente presentaba regurgitaciones a repetición secundarios al megaesófago y ya tenía evidencias radiológicas y ultrasonográficas de presentar un foco bronconeumónico de gran tamaño se propuso como abordaje de nutrición y tratamiento, la colocación de un tubo de gastronomía, y de esta manera poder tratar la MG y alimentar a la paciente sin riesgos de generar falsa vía y múltiples eventos aspirativos. Por otro lado, se pudo seguir a la paciente por más de 365 días sin registrarse ningún efecto secundario al uso de piridostigmina. Al día de la fecha la paciente se encuentra realizando una vida normal, sin megaesófago sin signos de MG, siendo tratada solamente con piridostigmina cada 12 horas. Según los autores es el primer caso de MG que ha sido reportado utilizando un tubo de gastrostomía para manejo medico clínico y uso de ultrasonografía para seguimiento del foco infecciosos pulmonar.
Caso clínico
Se presentó a consulta un canino hembra, no esterilizada, de raza caniche gigante con 5 años. La tutora responsable relata que comenzó con un cuadro respiratorio y pérdida de peso hace aproximadamente 20 días y se le prescribió tratamiento antibiótico a base de amoxicilina y ácido clavulánico. La tutora comentó que también comenzó con vómitos al momento de comenzar con los antibióticos orales. Al ingreso se evidenció un claro deterioro del estado general y del sensorio, score corporal bajo para el estándar de la raza, temperatura 40 ºC, medido con termómetro transrectal de mercurio (termómetro C y E), dificultad respiratoria con murmullo vesicular aumentado a la auscultación pulmonar; y auscultación cardíaca con taquicardia sin soplo, descarga nasal bilateral mucopurulenta, linfadenopatía mandibular, arcadas improductivas, salivación y debilidad muscular generalizada (Video 1).
Vídeo 1. En el siguiente vídeo se puede observar como llego la paciente por primera vez a la consulta. La depresión del sensorio. La debilidad para incorporar la cabeza. Presentaba tos discreta de forma casi constante con sialorrea asociada.
De la anamnesis se interpreta que los supuestos vómitos eran en realidad regurgitaciones por cómo eran descriptos por la tutora, comentó además que hubo inicialmente una alteración del ladrido y posteriormente dejo de vocalizar por completo. También describió una dificultad para la aprehensión de alimentos y la deglución de estos. Se indicó realizar hemograma (Mindray BC-10) y bioquímica sanguínea (Mindray BS-200). Se evidenció como relevante una leucocitosis neutrofílica con desvío a la izquierda. Se realizó radiografía de tórax y cuello digitales (Equipo digital P-max) que revelaron una dilatación del esófago en toda su extensión con signo de banda traqueal.A pesar de no tener una incidencia ventrodorsal de la paciente, debido a la dificultad respiratoria, se pudo visualizar una consolidación pulmonar con broncogramas aéreos asociados en lóbulo medio derecho, signos radiológicos sugestivos de bronconeumonía aspirativa (Figura 1 y 2).
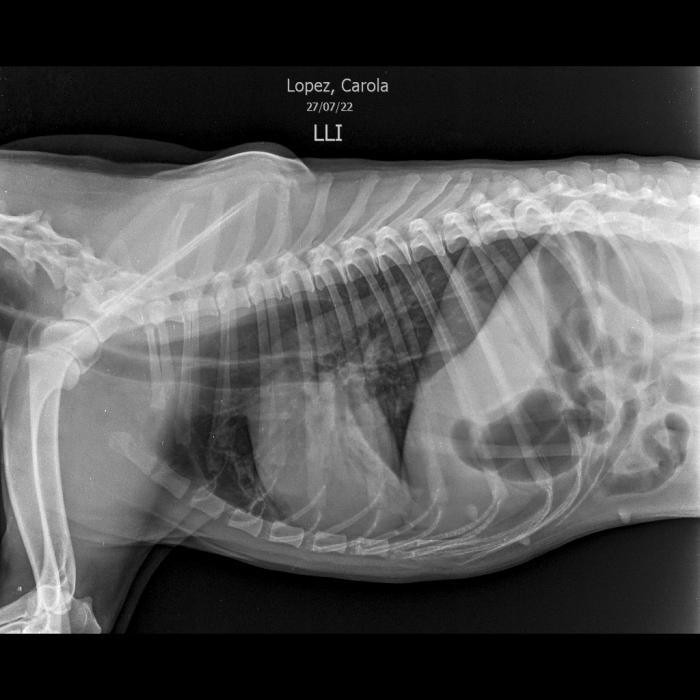
Figura 1. En dicha incidencia latero lateral de tórax se puede evidenciar la dilatación del esófago torácico con signo de banda traqueal. Y puede verse en lóbulo medio derecho una consolidación pulmonar con broncogramas aéreos asociados a dicho lóbulo. Signos radiológicos de megaesófago y de bronconeumonía.
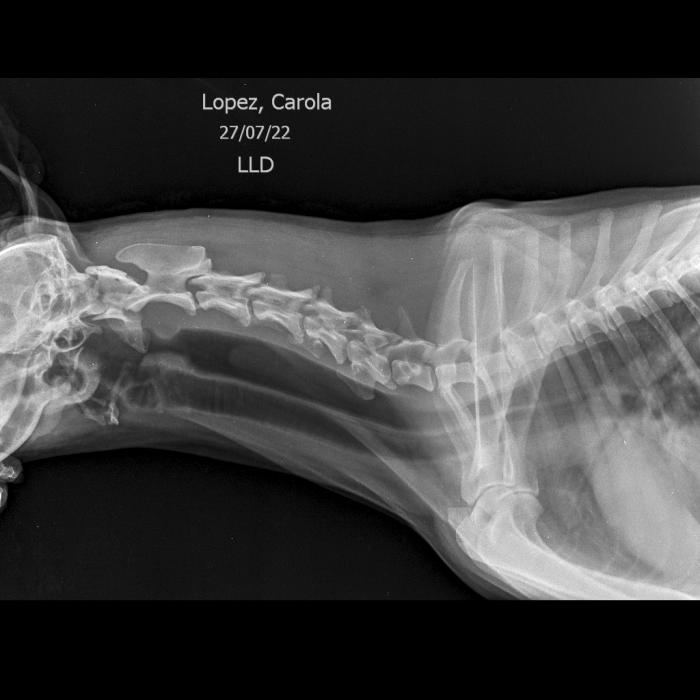
Figura 2. En la incidencia de cuello se observa claramente la dilatación esofágica cervical y se ve como continúa en la proyección intratorácica. Lo cual confirma que el mega esófago era generalizado.
Debido al cuadro clínico de la paciente y la localización de los focos bronconeumónicos se asumió que eran secundarios a fenómenos de aspiración. Se complementan los estudios diagnósticos con un ecocardiograma y ecografía pleuro-pulmonar (Mindray Vetus 7 Veterinary Ultrasound Machine), donde se encontró función cardiaca normal y, una consolidación pulmonar con fragmentación pleural y síndrome alveolo intersticial asociado en la zona apical derecha, previamente descripto en las radiografías, dichas alteraciones confirman la sospecha de bronconeumonía aspirativa vista previamente en las radiografías (Figura 3 y Vídeo 2). El hemitórax izquierdo sin particularidades.
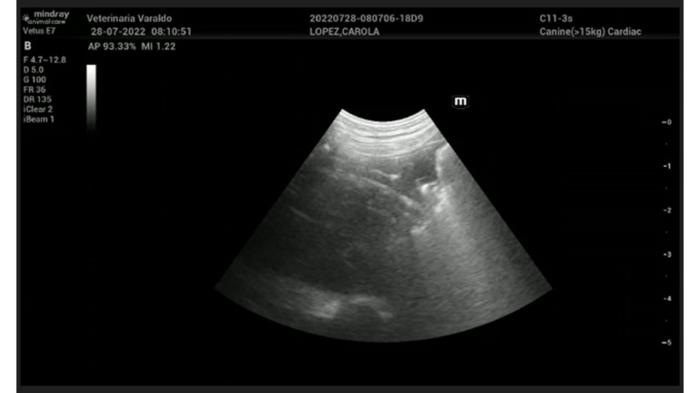
Figura 3. Tanto en la figura como en el video se puede evidenciar la consolidación pulmonar evaluada con ultrasonografía pleuro pulmonar. Se puede ver la presencia de pleura fragmentada con la porción pulmonar consolidada y presencia de aire atrapado en su interior. A su vez presenta una coalescencia de líneas B (síndrome alveolo intersticial) asociadas que acompañan la estructura descripta.
Vídeo 2. Tanto en la figura como en el video se puede evidenciar la consolidación pulmonar evaluada con ultrasonografía pleuro pulmonar. Se puede ver la presencia de pleura fragmentada con la porción pulmonar consolidada y presencia de aire atrapado en su interior. A su vez presenta una coalescencia de líneas B (síndrome alveolo intersticial) asociadas que acompañan la estructura descripta.
Con todos los datos de la anamnesis, los signos clínicos y los resultados de estudios complementarios se planteó la hipótesis de que la bronconeumonía aspirativa era consecuencia de la regurgitación dada por el megaesófago generalizado, y que la causa de este megaesófago y el resto de sus signos clínicos eran debido a una miastenia gravis. Se hospitalizó a la paciente para manejo de la bronconeumonía. Se instauró el tratamiento antibiótico a base de Ceftriaxona 20 mg /kg /IM/Bid (Rocephin, frasco ampolla de 1gramo liofilizado, laboratorio Roche). Se realizaron averiguaciones para poder realizar la determinación de anticuerpos séricos anti-RACh (gold estándar para el diagnóstico de MG), lo que no pudo llevarse a cabo debido a que no había laboratorio disponible que realice la técnica en todo el territorio argentino, y remitir la muestra al exterior era prolongar un diagnóstico con el riesgo de vida de la paciente. Por ende, se decidió instaurar terapia empírica a base de bromuro de piridostigmina 0.5 mg/kg cada 12 horas (agente anticolinesterásico) (Mestinon 60 mg comprimidos, Laboratorio Roemmers). La paciente presentó intolerancia a la administración por vía oral debido al megaesófago, a pesar de las indicaciones de alimentación con dieta semisólida y con la cabeza elevada por 15 minutos, por lo que se intentó mejorar esta situación con la administración de mosapride 0.5 mg/Kg (Mosar 5 mg comprimidos, Laboratorio Phoenix), previo a la administración de la piridostigmina, estrategia que tampoco tuvo éxito. Debido al franco deterioro del estado de salud de la paciente, las altas probabilidades de que continúe realizando fenómenos broncoaspirativos y el riesgo de muerte asociados a los mismos, se decidió internar a la paciente y realizar la colocación de un tubo de gastrostomía para nutrición y para administración de piridostigmina, además de continuar con la administración de la antibioticoterapia por vena. Se preparó a la paciente para cirugía con clorhidrato de maropitant 1 mg/kg S.C. (Cerenia, frasco multidosis 10mg/ml, Laboratorio Zooetis), metoclopramida 0.5 mg/kg S.C. (Pileran, frasco multidosis 50mg/ml, Laboratorio Holliday) y omperazol 1 mg/kg I.M. (Zomepral, frasco liofilizado de 40 mg, Laboratorio Teva) una hora antes de la cirugía. Premedicación con medetomidina 3 mcg/kg (Detor frasco multidosis, 500 mcg/ml, Laboratorio Richmond) endovenoso diluido en 5 ml, se comenzó con pre-oxigenación con máscara con FiO2100 %, luego se administró fentanilo 3 mcg/kg (Fentanilo B. Braun, ampolla de 0.05 mg/ml, Laboratorio Braun) diluido en 5 minutos y por último para perder reflejo laríngeo, Propofol al 2 % (Propofol 2 % MCT Fresenius, frasco ampolla de 20 mg/ml, Laboratorio Fresenius) endovenoso lento a efecto. Una vez intubada con tubo endotraqueal con manguito de neumotaponamiento n° 8, se conectó a un circuito circular (Herlam) con isofluorano al 1.5 % (Inletano, isofluorano al 100 %, Laboratorio Richmond) e infusión continua de Propofol a 0.15 mg/kg/min y remifentanilo a 0.2 mcg/kg/min (Fada Remifentanilo, frasco liofilizado de 5 mg, Laboratorio Fada Pharma) con bombas a jeringa (Adox A22). Monitoreo anestésico con electrocardiograma (Biomedic, ECG veterinario para PC), capnógrafo (Capnógrafo portátil CNU-P1, Ulrason), oxímetro (Monitor M3V) y tensiómetro oscilométrico (Suntech Vet 20). Una vez en plano anestésico se realizó un bloqueo ecoguiado del cuadrado lumbar bilateral utilizando una sonda lineal (Mindray Vetus 7Veterinary Ultrasound Machine) y aguja epidural Tuohy 18gx3,1/2" (Propato) con lidocaína 2 % (Lidocaína 2 % frasco multidosis, Laboratorio Richmond) y bupivacaína 50 % (Bupinex Vet, frasco multidosis, Laboratorio Richmond) a un volumen de 0.4 ml/kg logrando llevar la bupivacaína al 25 %. Una vez realizado el bloqueo se bajó la infusión de remifentanilo a 0.1 mcg/kg/min y se procedió al acto quirúrgico. Se utilizó una sonda tipo Foley 14 French con balón para usar como tubo de alimentación, colocándose la misma por el flanco izquierdo de la paciente (Figura 4, 5 y 6).
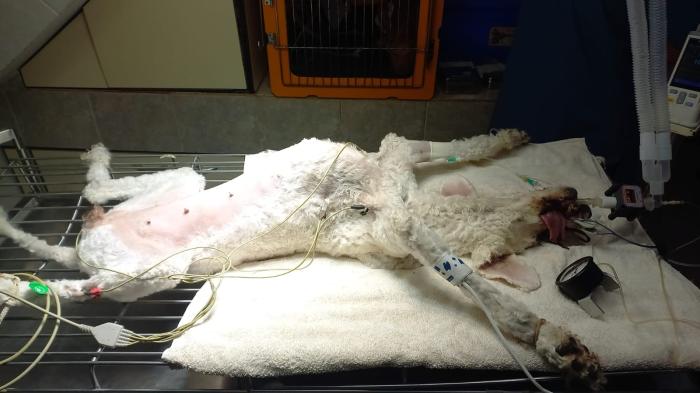
Figura 4. Se puede ver a la paciente ya preparada para la colocación del tubo de gastrostomía. Ya había sido realizado el bloqueo del cuadrado lumbar y se la había posicionado para la colocación del paño de campo correspondiente.
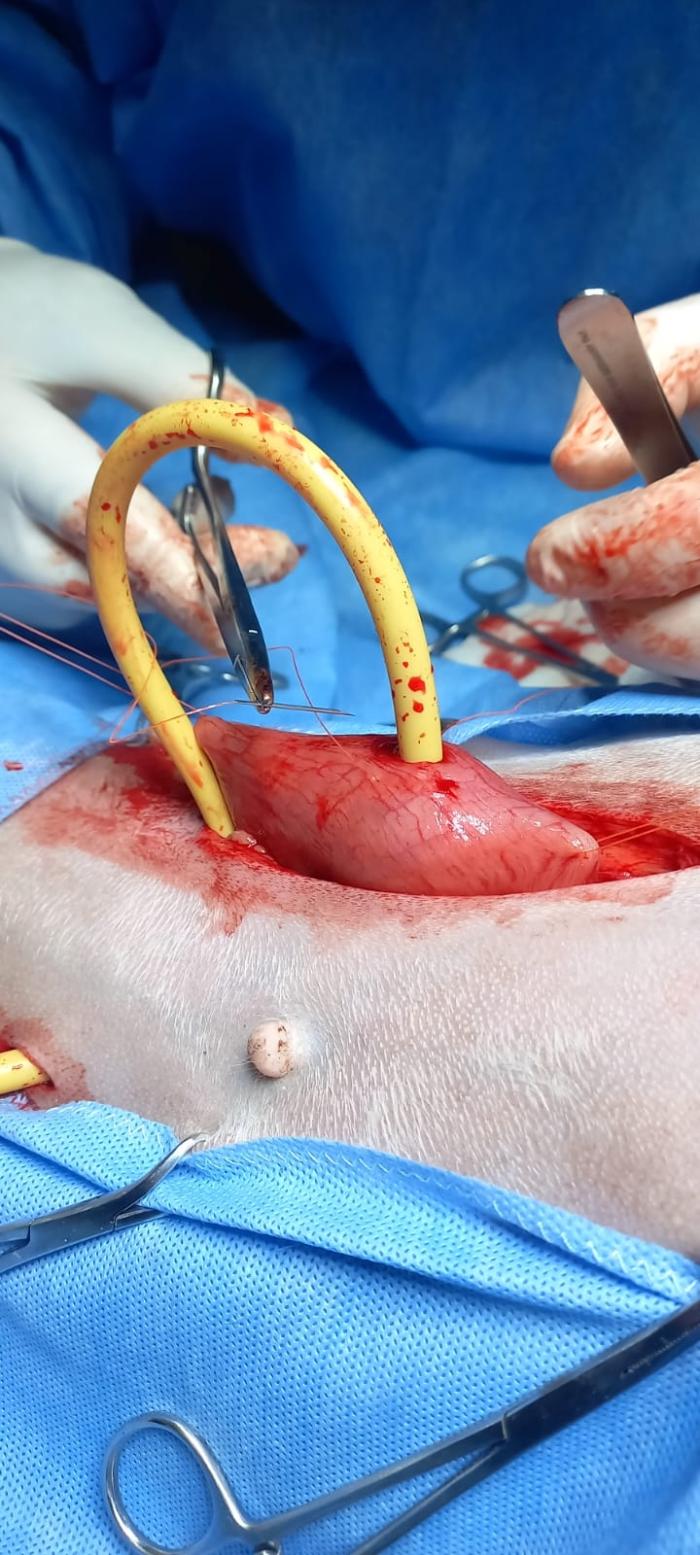
Figura 5. Se puede ver la sonda Foley ya colocada dentro del estómago y como la misma está siendo fijada.
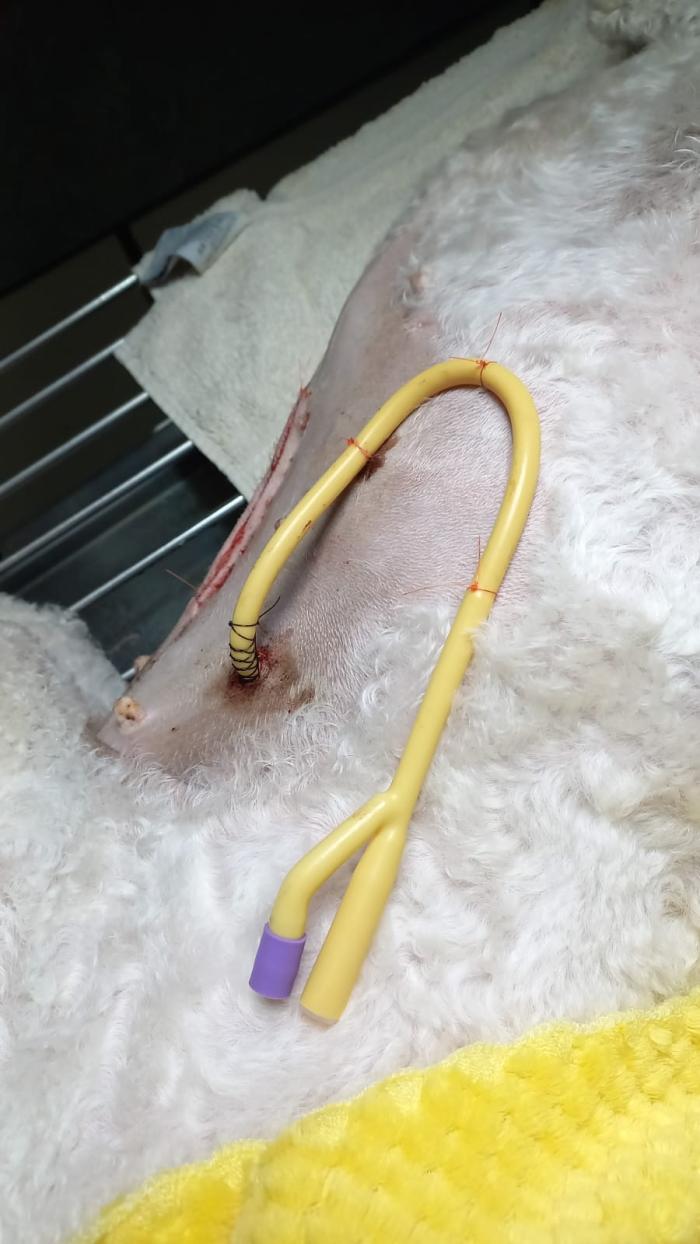
Figura 6. Una vez finalizado el procedimiento quirúrgico podemos ver cómo queda fijado el tubo de gastrostomía para mayor seguridad y mejor manejo por parte de los tutores.
Una vez finalizada la cirugía se realizó un rescate analgésico con meloxicam 0.2 mg/kg. Se cerró el isofluorano, se cortaron las infusiones; la paciente demoró 15 minutos para realizar ventilación espontánea, y demoró 15 minutos más hasta que comenzó a rechazar el tubo endotraqueal, una vez que comenzó con reflejo tusígeno y a deglutir se extubó y colocó máscara de oxígeno con FiO2al 100 %. Requirió 20 minutos más con la máscara hasta que la frecuencia respiratoria fue adecuada para mantener una saturación por encima de 93-94 % con FiO2ambiental (aire), no fue necesario llevarla al canil con sonda nasal de oxígeno.A pesar de presentar un foco bronconeumónico no hubo alteración en los parámetros de oxigenación ni en el monitoreo anestésico en general. A partir de esta decisión médico-quirúrgica la mejoría clínica fue notoria con el paso de los días y la respuesta al tratamiento farmacológico fue categórica. A las 48 horas se externó para continuar con tratamiento ambulatorio. Se realizaron controles ultrasonográficos de la neumonía con una evolución favorable, y la decisión de terminar con la ceftriaxona fue en base a la desaparición del foco evaluado con ecografía pleuro-pulmonar, el tratamiento duró 10 días. Pasados 20 días de comenzado el tratamiento se realizó una radiografía torácica control para evaluar el megaesófago, y se evidenció que el mismo había vuelto a la normalidad con el tratamiento de piridostigmina (Figura 7).
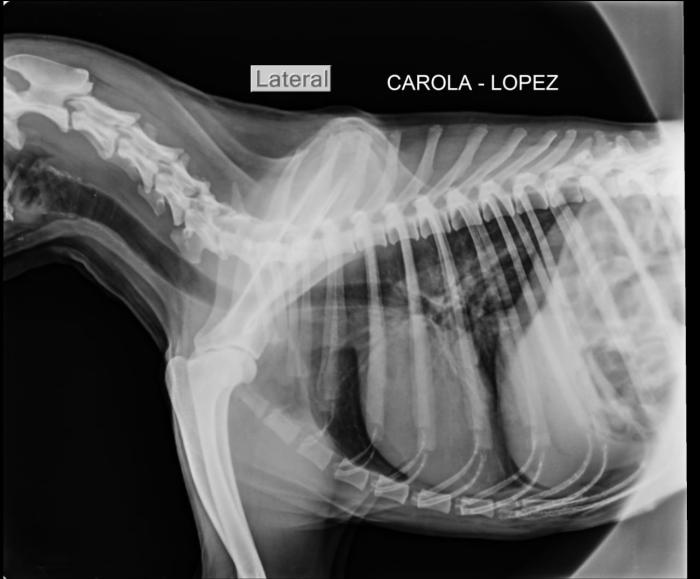
Figura 7. El control radiográfico que evidencia la resolución del megaesófago luego de 20 días de tratamiento.
Por ende, se decidió la extracción del tubo de gastrostomía y se indicó, de todas maneras, comenzar la nutrición por vía oral de forma progresiva en pocas cantidades y varias veces al día. No hubo recaídas con la recuperación de la vía oral.
Se siguió monitorizando a la paciente a lo largo de los meses con controles ecográficos y chequeos sanguíneos mostrando mejoría y estabilización del cuadro. Luego de un año de tratamiento la paciente se encuentre estable y sin efectos secundarios por la medicación haciendo una vida normal Vídeo 3 y 4).
Vídeo 3. Video donde se aprecia la mejora clínica notable de la paciente a los 15 días de tratamiento.
Vídeo 4. Video con 7 meses de tratamiento donde puede verse a la paciente llevar una vida normal. Sin perder fuerzas o energías durante un juego intenso con otro canino. Se puede ver además que no quedaron alteraciones asociadas al tubo de gastrostomía en el flanco utilizado (izquierdo)
Discusión
La MG es sin dudas un desafío médico para arribar a su diagnóstico definitivo. En aquellos países donde el kit serológico está disponible para uso rutinario el diagnóstico de MG no es un desafío tan grande desde lo médico, además en estos países, se demostró que los pacientes que se diagnosticaban de forma precoz con títulos bajos de anticuerpos, pocos signos clínicos y sin megaesófago tenían una remisión de los signos clínicos con el tratamiento farmacológico muy rápido y con mucha estabilidad a lo largo del tiempo. Por un lado, esa es una gran limitante en Argentina, donde para tener una sospecha clínica fuerte de MG se deben juntar muchos signos clínicos y alteraciones en los complementarios. Y esperar a tener un paciente con la enfermedad avanzada, lo que en muchas ocasiones empeora el pronóstico. El uso del tubo de gastrostomía no había sido publicado previamente para el manejo de pacientes con miastenia gravis y megaesófago, se cree que este fue uno de los pilares en el tratamiento de la paciente ya que permitió asegurar una correcta administración del fármaco, hidratación-nutrición y evitar que se sigan produciendo fenómenos de regurgitación y aspiración. Que de otra manera no hubieran permitido que la paciente mejore. Es bien conocida la técnica de alimentación en bipedestación en los pacientes con megaesófago, pero en paciente de porte grande y adultos que no se han educado desde cachorros a alimentarse de dicha manera, como sucede en los megaesófagos congénitos por ejemplo, puede ser un desafío y ser una de las causas de fracaso en la administración del tratamiento, además se pensó como una maniobra de uso a corto plazo la colocación del tubo, debido a que sí la paciente mejoraba iba a poder ingerir sólidos y líquidos de forma normal. Por estos motivos se optó por el uso de un tubo de gastrostomía temporario. La confirmación del foco bronconeumónico fue mediante el uso de ultrasonografía pleuro-pulmonar, debido a que la paciente no se encontraba en condiciones para adoptar el posicionamiento dorso ventral que se requería para realizar el estudio radiológico completo. No es posible asegurar solo con la evaluación ultrasonográfica que la paciente estaba cursando con una bronconeumonía, debido a que hallazgos de consolidación con aire atrapado, pleura irregular fragmentada y síndrome alveolo intersticial asociado pueden darse en otros procesos patológicos pulmonares no infecciosos. Pero al ubicar a la paciente en el contexto de regurgitación, fiebre, secreción mucopurulenta, esto aumenta la sensibilidad y especificidad de la imagen obtenida y apoya el diagnóstico presuntivo de bronconeumonía secundaria a fenómeno de aspiración por las regurgitaciones inducidas por el megaesófago. Se decidió seguir la evolución del foco con la ultrasonografía para establecer el momento exacto de suspensión de los antibióticos para no generar un mal uso de antibióticos tan potentes como la ceftriaxona, ya que es muy frecuente que los mismos sean suspendidos de forma precoz, pudiendo generar resistencias bacterianas o el tratamiento no es lo suficientemente extenso para generar la cura del foco infeccioso. En medicina humana ya se venía utilizando hace varios años la ultrasonografía de esta manera y sin dudas con el COVID 19 tomo mayor relevancia para evaluar el comportamiento del pulmón en los distintos escenarios. En medicina veterinaria también ya ha sido publicado el uso de la ultrasonografía para seguir la evolución del foco pulmonar y fue comparado su efectividad contra las radiografías torácicas y el uso de proteína C reactiva como marcador inflamatorio que aumenta en las infecciones pulmonares, la diferencia en el caso del presente reporte fue que no se realizó dosaje de proteína C reactiva para decidir la finalización del antibiótico, se basó en la evolución clínica, hemograma y evolución ultrasonográfica.
Históricamente se ha propuesto el uso de cloruro de edrofonio, que es una droga anticolinesterasa de efecto ultracorto, como prueba diagnóstica para la MG. Se conoce como la prueba de edrofonio o prueba de “Tensilon”. Se administran 0.1-0.2 mg/kg endovenoso y cuando es positivo hay una mejora clínica categórica de la debilidad muscular que presenta el paciente sospechoso. Siempre se aconseja tener atropina por si la prueba genera una crisis colinérgica en caso de que el paciente no sea miasténico. Debido a que en el 2017 la farmacéutica que se encargaba de la producción de edrofonio a nivel mundial dejó de producir el fármaco ya no existe la posibilidad de su uso como herramienta diagnóstica en el medio veterinario hace tiempo. Así es como se propuso como alternativa farmacológica a la prueba de edrofonio, el uso de neostigmina intramuscular. Dicho fármaco compite directamente con la acetilcolina para unirse a su receptor por eso su acción no es tan potente como lo era el edrofonio. De todas maneras, se busca la misma respuesta de mejora clínica de los signos de debilidad. Debido a la ausencia de edrofonio y neostigmina es que se decidió en esta paciente comenzar con el tratamiento empírico vía oral con prididostigmina, prestando especial atención a los posibles efectos muscarínicos que potencialmente pudieran surgir si no se hubiera estado frente a un caso de MG. Esto fue alertado a los médicos tratantes y a los tutores de la paciente. Debido a que no presentó ningún efecto colateral, sino que todo lo contrario, la mejora fue categórica con tan solo 2 días de tratamiento se interpretó que la decisión terapéutica empírica era la adecuada y que esto apoyaba el diagnóstico presuntivo de MG, que terminó de ser confirmado ya que a los 5 días de tratamiento empírico la paciente volvió a ser una paciente totalmente asintomática, sin debilidades, mejora de sensorio, actividad física sin debilidad ni fatiga, ausencia de regurgitaciones y la confirmación radiológica de la desaparición del megaesófago. En la literatura no es propuesto el uso directamente de una medicación enteral debido a que existen opciones inyectables para saltear la vía oral y confirmar la sospecha, los autores consideran que en escenarios donde no se puedan acceder a las opciones inyectables, pero si se tenga acceso a los fármacos orales, la combinación de tubo de gastrostomía y piridostigmina es una opción diagnóstico-terapéutica de alto valor médico.
Por último, uno de los puntos críticos al momento de la colocación del tubo de gastrostomía fue el protocolo anestésico y la recuperación de la cirugía. Se propuso, como ha sido publicado previamente, utilizar en la preparación preanestésica clorhidrato de maropitant a 1 mg/kg 1 hora antes junto con metolcopramida para poder disminuir el riesgo de regurgitación y nuevo evento de broncoaspiración, se realizó especial atención en todo momento a los parámetros de oxigenación ya que la paciente ingresó con un pulmón enfermo con disminución de su complacencia pulmonar debido al foco infeccioso. Se utilizó una anestesia con bloqueo locorregional del abdomen para poder utilizar drogas endovenosas en bajas dosis y porcentajes bajos de isofluorano para que de ese modo la recuperación sea lo más rápida posible. De todas maneras, la paciente demoró más tiempo del habitual en recuperarse de la intervención debido a su enfermedad de base.
Conclusión
Existen un sinfín de enfermedades que son un desafío diagnóstico en el medio veterinario debido a la ausencia de estudios complementarios gold estándar, ya sea por falta de insumos o por la imposibilidad de acceder a los mismos desde un punto de vista económico. En el caso expuesto se propuso un abordaje medico terapéutico que no ha sido publicado con anterioridad y debido a eso los autores creen que tiene que ser considerado como un posible enfoque en situaciones muy particulares, pero cada vez más frecuentes en Argentina y en otros países del mundo. A su vez nuevamente resaltar la utilidad diagnóstica y de seguimiento médico que tiene el uso de la ultrasonografía pleuro-pulmonar y como la misma aumenta su sensibilidad y especificidad diagnóstica cuando se contextualiza con el cuadro médico del paciente. Considerar fuertemente el uso de métodos de alimentación como el tubo de gastrostomía ya que da seguridad y garantías a la hora de realizar un tratamiento empírico y permite mantener al paciente nutrido e hidratado sin riesgos de generar falsas vías y consecuentes infecciones pulmonares. Por último, los autores quieren remarcar la importancia de una correcta anamnesis, examen clínico y estudios complementarios acordes a la sospecha médica, debido a esta combinación pudieron proponer un diagnóstico presuntivo claro, y ante la imposibilidad de acceder a un diagnóstico de certeza o definitivo se decidió instaurar un tratamiento empírico con éxito terapéutico. El trabajo en equipo y la correcta y constante comunicación con los tutores fueron claves fundamentales para lograr el manejo exitoso de dicha paciente. Es sumamente importante dar apoyo médico profesional constante a los tutores a lo largo de estas enfermedades de diagnóstico oscuro y ser claros con lo que se busca en cada decisión médica.
Bibliografía
- Bell ET, Mansfield CS, James FE. Immune-mediated myasthenia gravis in a methimazole-treated cat. Journal of Small Animal Practice (2012). DOI: 10.1111/j.1748-5827.2012.01273.x. 1-3.
- Cridge H, Little A, López JR, Pancotto T, Michaels JR, Menchetti M, Suñol A, Lipsitz D, Beasley MJ. The clinical utility of neostigmine administration in the diagnosis of acquired myasthenia gravis. J Vet Emerg Crit Care. 2021;1–9. DOI: 10.1111/vec.13097.
- Crowe, D. T. Nutritional support for the hospitalized patient: an introduction to tube feeding. Compendium on Continuing Education for the Practicing Veterinarian 12.12 (1990): 1711-1721
- Dickinson PJ, LeCouteur RA. Feline neuromuscular disorders. Vet Clin Small Anim. 34 (2004) 1307–1359.
- Drachman DB. Myasthenia Gravis. N Engl J Med. June 23, 1994.; 330:1797-1810. DOI: 10.1056/NEJM199406233302507.
- Dickinson PJ, LeCouteur RA. Feline neuromuscular disorders. Vet Clin Small Anim. 34 (2004) 1307–1359.
- Fernandes Rodrigues N, Giraud L, Bolen G, Fastrès A, Clercx C, Boysen S, Billen F, Gommeren K. Comparison of lung ultrasound, chest radiographs, C-reactive protein, and clinical findings in dogs treated for aspiration pneumonia. J Vet Intern Med. 2022; 36:743–752. DOI: 10.1111/jvim.16379.
- Khorzad R, Whelan M, Sisson A, Shelton GD. Myasthenia gravis in dogswith an emphasis on treatment and critical care management. J Vet Emerg Crit Care 2011; 21(3): 193–208) doi: 10.1111/j.1476-4431.2011.00636.x
- Lewis RA. Myasthenia gravis: New therapeutic approaches based on pathophysiology. J Neurol Sci. 2013 Oct 15;333(1-2):93-8. Doi: 10.1016/j.jns.2013.06.018
- Lin CH, Lo PY, Lam MC, Wu HD. Usefulness of Chest Ultrasonography in Predicting Diagnosis in Non-emergency Small Animal Patients with Lung Parenchymal and Pleural Disease. Frontiers in Veterinary Science. December 2020; Volume 7; Article 616882. doi: 10.3389/fvets.2020.616882
- Mantegazza R, Cordiglieri C, Consonni A, Baggi F. Animal models of myasthenia gravis: utility and limitations..International Journal of General Medicine 2016:9 53–64
- Mignan T, Targett M, Lowrie M. Classification of myasthenia gravis and congenital myasthenic syndromes in dogs and cats. J Vet Intern Med. 2020; 34:1707–1717.
- Pelegrino FC. Miastenia gravis adquirida. Revista Argentina de Neurología Veterinaria. 2018; 6(5):1-15.
- Penderis J, Vaquero MP. Junctionopathies. Disorders of the Neuromuscular Junction. Wiley Blackwell; 2016.
- Pérez Pallarés J, Lerenas Bernal F, Cabello Jabalquinto M, Jiménez Romero AA. Usefulness of thoracic ultrasound for diagnosis and follow-up of pneumonia. Rev Esp Quimioter 2022; 35 (Suppl. 1): 21-24.
- Riki Kveraga, MDJohn Pawlowski, MD, PhD. Anesthesia for the patient with myasthenia gravis. UpToDate, Inc. May 25, 2022. Pag. 1-20.
- Roxanne O’Brien. Anaesthesia considerations for a patient with suspected myasthenia gravis. The Veterinary Nurse. December 2020/January 2021, Volume 11 No 10. 474-479.
- Toyka KV, Brachman DB, Pestronk A, et al. Myasthenia gravis: passive transfer from man to mouse. Science. 1975 Oct 24;190(4212):397-9. doi: 10.1126/science.1179220.
- Ward JL, Lisciandro GR, Ware WA, Miles KG, Viall AK, DeFrancesco TC. Lung ultrasonography findings in dogs with various underlying causes of cough. JAVMA. Sep 1, 2019; vol 255, No. 5. 574-583.
- Wendell LC, Levine JM. Myasthenic crisis. Neurohospitalist. 2011;1(1):16-22
- Yoshimoto SK, Marks SL, Struble AL, Riel DL. Owner experiences and complications with home use of a replacement low profile gastrostomy device for long-term enteral feeding in dogs. Can Vet J 2006; 47:144–150.
 by Multimédica
by Multimédica