Trombosis venosa abdominal en pacientes críticos: conceptos básicos, abordaje en ecografía vascular y su estudio con eco Doppler
Resumen breve
La ecografía vascular en modo B y el eco Doppler tienen un rol fundamental en el diagnóstico, caracterización y seguimiento de pacientes con trombosis, ya sean venosas o arteriales, tanto en pacientes estables como en pacientes en estado crítico. Los pacientes con trombosis venosa abdominal suelen ser pacientes con enfermedades crónicas avanzadas, muchas veces sin seguimientos ecográficos, o pacientes en estado crítico que desarrollan un estado de hipercoagulabilidad potencialmente mortal.Índice de contenidos
Introducción a la trombosis venosa abdominal
La enfermedad tromboembólica contribuye en forma importante a la morbilidad y mortalidad de pacientes en estado crítico al restringir el flujo sanguíneo de forma local, liberar factores humorales a la circulación sistémica (con potencial daño terminal en órganos blancos) y eventualmente llevar a un síndrome de insuficiencia multiorgánica (MODS)1. El trombo es un agregado de plaquetas, fibrina y otros elementos de la sangre (glóbulos rojos, neutrófilos) formado sobre el endotelio de un vaso sanguíneo o linfático (trombo mural), una cámara cardiaca (trombo cardiaco) pudiendo encontrarse también libre en un vaso sanguíneo o linfático. La trombosis es la condición médica en la cual se genera una estenosis u oclusión de un vaso sanguíneo, arterial o venoso, por la presencia de un trombo o coágulo sanguíneo. Cuando el trombo genera estenosis vascular en el sitio de formación se denomina trombosis primaria, mientras que si lo hace lejos de su origen se denomina tromboembolismo.
La trombosis puede ser subclínica o presentar signos clínicos diversos dependiendo del sitio y extensión de esta, el grado de circulación colateral y las reservas compensatorias de los órganos afectados. El reconocimiento temprano de la trombosis es fundamental para su tratamiento médico - quirúrgico. La ecografía y el estudio Doppler cuentan con la capacidad de detectar no solo la presencia de la trombosis sino también de mensurar el grado de estenosis de la trombosis, arterial o venosa, y la presencia de colaterales asociadas.
En la trombosis intervienen múltiples tipos celulares(plaquetas, células endoteliales, eritrocitos, etc.) y factores plasmáticos [proteasas de la coagulación, trampas extracelulares de neutrófilos (NET)] así como también la hipofibrinolisis. La triada de Virchow describe tres factores de riesgo para que el paciente desarrolle trombosis: daño o disfunción endotelial, anormalidades en el flujo sanguíneo y estados de hipercoagulabilidad. Generalmente en un solo paciente múltiples anormalidades actúan de forma sinérgica para generar un desbalance en la hemostasia1.
El daño endotelial puede promover la trombosis o ser una consecuencia de esta. En condiciones normales el endotelio mantiene su superficie anticoagulada al liberar vasodilatadores e inhibidores de plaquetas y al estimular la fibrinolisis. El endotelio presenta un glucocálix (matriz de proteoglicanos y glicoproteínas) que repele de forma negativa las células sanguíneas cargadas y una capa de la superficie endotelial (endothelial surface layer - LES) constituida principalmente por agua y nanoburbujas de CO2ó O2 y N2 en venas y arterias respectivamente2. El daño del glucocálix o una interrupción en la LES contribuyen en la naturaleza protrombótica de la sepsis, el trauma, la injuria por isquemia – reperfusión, la diabetes y pancreatitis severa. La disfunción endotelial genera un desequilibrio en la regulación de la homeostasis vascular predisponiendo a la activación plaquetaria y consecuente trombosis.
El flujo sanguíneo alterado puede deberse a estasis (detención del flujo, especialmente en el sistema venoso), flujos turbulentos o aumentos de velocidad circulatoria que alteren el flujo sanguíneo laminar. Suele estar asociado a enfermedad cardiaca, anomalías vasculares, hiperviscosidad y cáncer. Existe una relación entre el flujo sanguíneo y la función endotelial: al circular la sangre se genera una tensión radial en la pared de los vasos, llamado shear stress o estrés friccional, que está determinado por varios factores, como el diámetro del vaso, la pulsatilidad del flujo sanguíneo, la viscosidad de la sangre y la velocidad circulatoria del flujo. Varía de acuerdo con el sitio del lecho vascular: es más alto en arteria y más bajo en venas. Una alteración en el shear stress produce potencialmente disfunción vascular, inflamación y lesiones que inducen a procesos patológicos como trombosis, hipertensión arterial y, en medicina humana, a aterosclerosis3,4. Cuando aumenta el shear stress en el sistema venoso y las cámaras cardiacas aumenta también la interacción entre células endoteliales, plaquetas y proteínas procoagulantes que, finalmente, inducen a la agregación plaquetaria y la formación del trombo. Este proceso está favorecido también por la disminución local en la concentración de fibrina: al alterarse la malla de fibrina, que condiciona la estabilidad del trombo y su susceptibilidad a la fibrinolisis, se facilita la propagación del trombo. Los sitios de estasis venosa representan así lugares donde se reduce el clearence o lavado de factores de la coagulación activados y se produce activación de otros factores de la coagulación.
En la hipercoagulabilidad el balance en la hemostasia se encuentra alterado ya sea por un aumento de los factores de coagulación, una activación inapropiada de plaquetas, una reducción en la disponibilidad de anticoagulantes endógenos o por una escasa fibrinólisis1. La formación de trombos también puede generarse en respuesta a la invasión de un patógeno (inmunotrombosis) donde el sistema inmune innato (neutrófilos, monocitos y células dendríticas) pueden iniciar la formación de fibrina y la activación de plaquetas en un proceso llamado NET o trampas extracelulares neutrofílicas1. El aumento de permeabilidad glomerular de la nefropatía perdedora de proteínas permite la pérdida selectiva de proteínas plasmáticas de bajo peso molecular, incluida la proteína antitrombina (antitrombina III); también ésta puede consumirse en condiciones donde se encuentra incrementada la formación de trombina, como en la coagulación intravascular diseminada (CID) y tromboembolismo masivo. En la sepsis, en pacientes oncológicos, en la falla hepática o cardiaca, en la pancreatitis, CID o en un posquirúrgico se puede generar una deficiencia de proteína C, proteína que junto a la proteína S regulan el proceso de formación de coágulo al inactivar factores de coagulación específicos. En pacientes con hipercolesterolemia puede haber deficiencia adquirida de inhibidor de la vía del factor tisular (tissue factor pathway inhibitor o TFPI) y esto representa un factor de riesgo para tromboembolismo.
En medicina veterinaria las enfermedades más comúnmente asociadas a trombosis, venosa o arterial, son aquellas que predisponen al paciente a un estado de hipercoagulabilidad: la anemia hemolítica inmunomediada, donde el tromboembolismo es la principal causa de mortalidad (trombosis en el sistema pulmonar), la enteropatía y la nefropatía perdedora de proteínas, la pancreatitis, el hiperadrenocorticismo, las neoplasias, la sepsis, la enfermedad cardiaca en caninos (la enfermedad cardiaca felina no representaría un riesgo para el desarrollo de trombosis venosa), la diabetes mellitus y la enfermedad hepatobiliar entre otros (Tabla 1).
| Sitio de trombosis | Caninos | Felinos |
|---|---|---|
| Vena porta | Nefropatía perdedora de proteínas, neoplasia, anemia hemolítica inmunomediada, pancreatitis necrotizante, terapia con corticoides, sepsis. | Neoplasia. Pancreatitis necrotizante. |
| Venas hepáticas | Nefropatía perdedora de proteínas, anemia hemolítica inmunomediada, endocarditis infecciosa, enfermedad cardiaca. | |
| Vena cava | Nefropatía perdedora de proteínas, neoplasia, anemia hemolítica inmunomediada, terapia con corticoides, endocarditis infecciosa, enfermedad cardiaca, sepsis. | |
| Vena esplénica | Nefropatía perdedora de proteínas, neoplasia, anemia hemolítica inmunomediada, hiperadrenocortisismo, terapia con corticoides, endocarditis infecciosa, enfermedad cardiaca, dirofilariasis, aterosclerosis, sepsis, procedimientos quirúrgicos, enteritis parvoviral. | |
| Renal | Nefropatía perdedora de proteinas, anemia hemolítica inmunomediada, endocarditis infecciosa. | |
| Mesentéricas | Nefropatía perdedora de proteínas. |
Tabla 1. Causas más frecuentes de trombosis venosa abdominal en caninos y felinos. Tabla traducida y adaptada de Behling-Kelly, E. and Goggs, R. (2022). Thrombotic Disorders. En Schalm's Veterinary Hematology (eds M.B. Brooks, K.E. Harr, D.M. Seelig, K.J. Wardrop and D.J. Weiss). John Wiley & Sons, Inc: Estados unidos https://doi.org/10.1002/9781119500537.ch91.
El cáncer es una de las causas más comunes de trombosis en caninos5: en caninos con tumores sólidos se reportó una incidencia de 2.6 % de trombosis. Entre las anormalidades hemostáticas de los caninos con cáncer la hipercoagulabilidad es la causa más frecuente pero también están reportada la hipocoagulabilidad y la CID. La CID en el paciente oncológico genera microtrombosis (agregados de plaquetas, fibrina y glóbulos rojos) en pequeños vasos, desarrollando una activación excesiva de la coagulación con consumo de sus inhibidores llevando a cambios hemostáticos con eventual disfunción orgánica y hemorrágica (hemorragias en cavidades). Si bien muchos de los microtrombos son intratumorales, un porcentaje puede encontrarse distal al tumor primario y pueden desarrollar macrotrombos. En medicina humana y en medicina veterinaria es importante para el tratamiento y estadificación del paciente oncológico la diferenciación por medio de métodos complementarios de diagnóstico entre un trombo tumoral y un trombo hemático, entendiendo como trombo tumoral aquel que se forma por la invasión venosa de un tumor y trombo hemático aquel que se forma por una alteración en la hemostasia regional o sistémica.
La evolución en el tiempo de los trombos venosos va a depender de su localización, extensión y tiempo de formación6. El trombo puede:
- Sufrir lisis espontánea o trombolisis.
- Propagarse o embolizar.
- Organizarse e incorporarse a la pared venosa.
- Recanalizarse.
- Ocluir permanentemente la vena.
Los trombos que progresan rápidamente generan mayor detrimento que aquellos que lo hacen lentamente. Un trombo que crece de forma lenta reduce la luz del vaso progresivamente y le da tiempo al organismo para desarrollar circulación colateral. Los trombos pequeños generan menor daño y son más fáciles de resolver por la vía de la trombolisis. Los trombos grandes suelen ocupar la mayor parte de la luz con restricción, en el caso de las venas, del flujo de salida resultando en áreas de isquemia progresiva (la menor oxigenación del tejido puede llevar a fibrosis) o infartos (generados por necrosis del tejido hipóxico) en los tejidos afectados. El enlentecimiento del flujo de salida de un lecho vascular genera así congestión esplácnica que puede afectar el órgano involucrado llevándolo a su falla orgánica.
El trombo a su vez provee una superficie para una continua adhesión de plaquetas y coagulación, lo que reduce progresivamente la luz hasta ocluirla: la superficie del trombo es trombogénica. Esta característica hace que los trombos venosos puedan propagarse en dirección al corazón y llegar a ocupar grandes extensiones6. Las plaquetas involucradas en el trombo reclutan fibroblastos hacia la pared del vaso para resolver el trombo por un proceso similar al que se usa en el daño tisular irreversible. En el trombo se encuentran macrófagos, tejido de granulación y fibrosis para organizar al trombo por la vía de la inflamación crónica. Eventualmente el endotelio recubre la superficie del trombo y disminuye el estímulo para la continua trombosis. En trombos oclusivos de gran tamaño se generan además canales sanguíneos tapizados por endotelio a través de áreas de fibrosis en un proceso llamado recanalización del trombo. Estos canales proveen una ruta alternativa para el flujo sanguíneo y tiene como fin reestablecer el flujo sanguíneo venoso. Otra posible evolución de un trombo venoso es que una porción del trombo, o el trombo completo, puede soltarse de su lugar de anclaje en la pared y entrar a la circulación como un embolo (tromboembolismo) y eventualmente detenerse en un vaso de diámetro pequeño que no permita su paso. Este proceso se llama embolización y en las trombosis venosas generalmente se dirigen a la circulación pulmonar donde pueden generar infartos pulmonares o fallas cardiacas derechas.
A los trombos venosos se los denomina trombos rojos ya que, al estar interpuestos en un flujo sanguíneo de baja velocidad circulatoria, tienen glóbulos rojos incorporados a la red de fibrina y plaquetas6. El aumento de eritrocitos en estas áreas aumenta la viscosidad de la sangre y la marginación de plaquetas y leucocitos. Es por esto por lo que macroscópicamente los trombos venosos suelen ser gelatinosos, suaves, brillantes y oscuros.
Ciertos tumores abdominales pueden invadir las venas adyacentes a través de la membrana basal del endotelio y extenderse hacia su luz reflejando un comportamiento maligno de la tumoración. En el abdomen de los caninos suele verse asociado a ciertas neoplasias hepáticas (carcinoma hepatocelular y la vena porta), neoplasias renales (carcinoma y venas renales) y de glándulas adrenales (carcinoma o feocromocitoma sobre la vena cava caudal)7. Es importante la identificación y diferenciación de la trombosis venosa no maligna de la invasión venosa para la estadificación y planificación del tratamiento del paciente con este tipo de neoplasias.
Trombosis venosa abdominal en caninos: vena porta y vena cava caudal
En caninos la trombosis de vena cava caudal suele ser adquirida y causada por neoplasias, trauma o trombosis. La trombosis maligna más común es la asociada a tumores de las glándulas adrenales y renales, pero puede originarse también por neoplasias retroperitoneales (Figura 1).
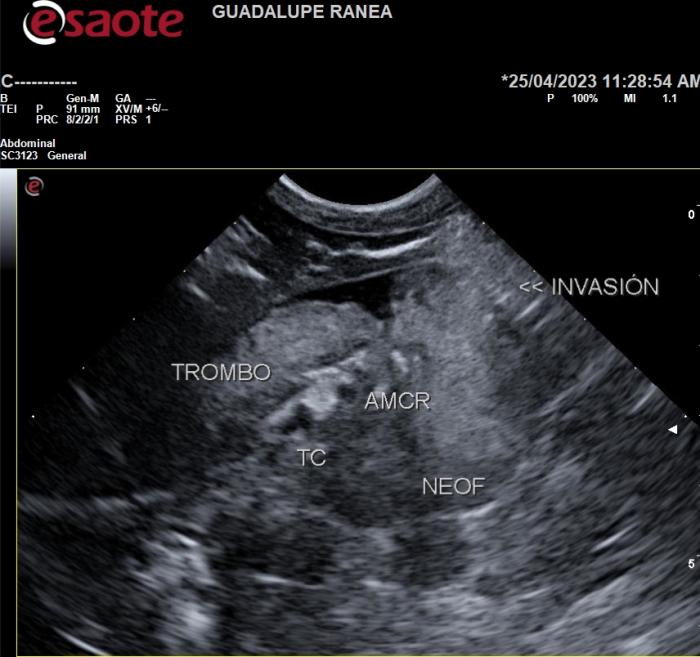
Figura 1. Neoplasia adrenal izquierda vista desde un abordaje coronal derecho. Se observa la neoformación invadiendo la vena vaca caudal y la presencia de un trombo hemático en proximal. AC: arteria celíaca. AMCR: arteria mesentérica craneal.
La ecografía abdominal tiene un 80 % de sensibilidad y 90 % de especificidad para la detección de trombosis en la vena cava caudal8. Los signos clínicos asociados a trombosis de vena cava caudal van a depender del sitio de obstrucción, el grado de estenosis y la presencia de colaterales venosas, así como de la cronicidad del trombo. Puede ser que el paciente no tenga signo alguno o aparezca edema de los miembros pelvianos (principalmente del miembro pelviano derecho)9 o dilatación de venas superficiales de la pared abdominal. Estas venas superficiales dilatadas son parte del sistema de colaterales venosas que permiten la llegada de la sangre al atrio derecho cuando hay oclusión venosa y son consecuencia del aumento de la presión venosa de la vena cava caudal10,11. Se observan con un grado variable de distensión y con flujo normal o reverso. Cuando se obstruye la porción poshepática de la vena cava caudal se produce una hipertensión portal poshepática con signos que incluyen hepatomegalia, ascitis y disconfort abdominal en un síndrome llamado Budd Chiari like syndrome. La obstrucción de la vena cava desde su porción prerenal a la prehepática resulta en el desarrollo de múltiples vías colaterales. En caninos existen cuatro vías derivativas principales: la vía superficial (vasos subcutáneos que drenan sangre de la vena circunfleja ilíaca profunda a la 11° vena intercostal y finalmente en la vena ácigos derecha o a través la vena epigástrica caudal o epigástrica caudal superficial hacia las venas torácicas internas ) (Figura 2), la vía intermedia (drenan sangre de la porción preobstructiva de la VCC por la vena iliaca a través de venas gonadales y periureterales que drenan hacia la vena renal izquierda y la vena cava caudal – shunt cavo caval), la vía de la vena porta a través del plexo rectal o hemorroidal donde se comunica la VCC (vena iliaca) con la vena porta (vena mesentérica craneal y vena cólica izquierda) y la vía profunda donde venas lumbares o vertebrales se dilatan y llevan sangre a la vena ácigos derecha a través del plexo venoso vertebral12-14.
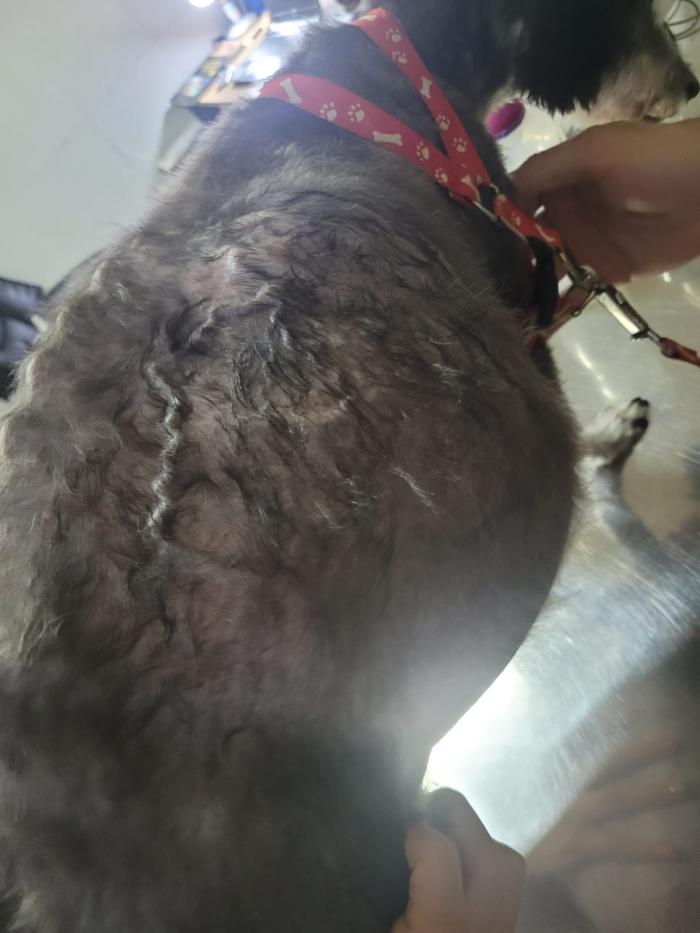
Figura 2. Vía derivativa superficial de la oclusión de vena cava caudal. Dilatación un vaso venoso subcutáneo en un paciente con una invasión de vena cava caudal y venas renales (imagen cedida por el médico veterinario especialista Gonzalo Valdez Jaén).
La trombosis en la vena porta puede ser parte de la descompensación en la enfermedad hepática o hepatobiliar crónica o puede estar originada por afecciones inflamatorias o infecciosas locales o sistémicas. Puede desarrollarse en el tronco principal de la vena porta con extensión hacia sus ramas hepáticas, venas mesentéricas o vena esplénica. Si bien en medicina humana la enfermedad hepática crónica es la causa más común de trombosis portal, en caninos la pancreatitis aparenta ser la causa más frecuente. Las altas concentraciones de glucocorticoides (endógenos o exógenos), neoplasias (neoplasias hepáticas), cirugías abdominales previas (esplenectomías), vasculitis, enfermedad cardiaca, enfermedades perdedoras de proteínas (nefropatía/enteropatía perdedora de proteínas), anemia hemolítica autoinmune, coagulación intravascular diseminada (CID) y síndrome de respuesta inflamatoria sistémica (SIRS) pueden ser también causales de trombosis portal. Si bien no está claro aún la etiopatogenia de la trombosis portal, el aumento de la resistencia vascular intrahepática y la reducción del flujo sanguíneo portal se consideran de alto riesgo para el desarrollo de ésta. En felinos los reportes de trombosis portal son pocos y se asocian a enfermedad hepática, shunt portosistémicos congénitos, neoplasia hepática y colangitis11. En el caso de una oclusión de la vena porta se desarrolla circulación colateral como en la trombosis oclusiva de la vena cava caudal. Estas colaterales pueden ser portoportales, mediante una transformación cavernomatosa de la vena porta, o portosistémicas a través de circulación portal colateral (shunt adquiridos) o de la redirección de flujo de afluentes de la vena porta. Los shunt portosistémicos adquiridos son comunicaciones entre el sistema venoso portal y la circulación sistémica que desvían la sangre portal del hígado a través de vasos de neoformación o conectores venosos embrionarios. Son parte de mecanismo de compensación para descomprimir la presión en el sistema venoso portal y su presencia está relacionada con el desarrollo de encefalopatía hepática. En los mamíferos existen al menos tres conexiones de la vida embrionaria entre la circulación portal y la sistémica que, si bien no se pueden observar macroscópicamente, tienen la posibilidad de recanalizarse y desviar así sangre: vena cólica izquierda – vena pudenda, la vena gástrica izquierda – vena cardioesofágicas y conectores de la vena porta con la vena frénica12-15. Las colaterales venosas de la hipertensión portal pueden dividirse en shunt adquiridos de gran tamaño (esplenogonadal y esplenofrénico) y de pequeño diámetro (várices esofágicas, gastrofrénicas y cólicas), coexistiendo ambas en el mismo paciente. La transformación cavernomatosa de la vena porta ocurre cuando se abren colaterales portoportales alrededor del sitio de trombosis portal que cruzan el ligamento hepatoduodenal para terminar en las ramas portales intrahepáticas.
La extensión de un proceso inflamatorio abdominal puede generar trombosis venosa portal al generar una inflamación de la pared, denominada flebitis, que predispone a su vez a la trombosis. Dicha entidad se la conoce como tromboflebitis portal y puede desarrollarse tanto en el tronco principal de la vena porta como en la vena esplénica. Suele estar asociada a cuadros de pancreatitis aguda por la íntima relación anatómica del parénquima pancreático y el sistema venoso portal. La pileflebitis es la tromboflebitis portal de origen infeccioso que se origina por el drenaje portal de un foco infeccioso en un territorio distal (intestinal, pancreático, gástrico, hepático). Si la trombosis portal se extiende hacia las venas mesentéricas se puede generar una oclusión de estas con una isquemia mesentérica fatal16. Cuando la trombosis ocurre únicamente en la vena esplénica, y se produce una estenosis crítica u oclusión de esta, se genera un aumento regional de presión portal conocido como hipertensión portal izquierda17. En esta condición la presión venosa en el tronco principal de la vena porta está conservado pero aumentada en la vena esplénica, lo que lleva a la apertura de colaterales venosas. Si bien la hipertensión portal izquierda también puede verse en pacientes con torsión esplénica, está asociada principalmente a afecciones pancreáticas como las pancreatitis crónicas, los pseudoquistes y el carcinoma pancreático (Figura 3, Tabla 2).
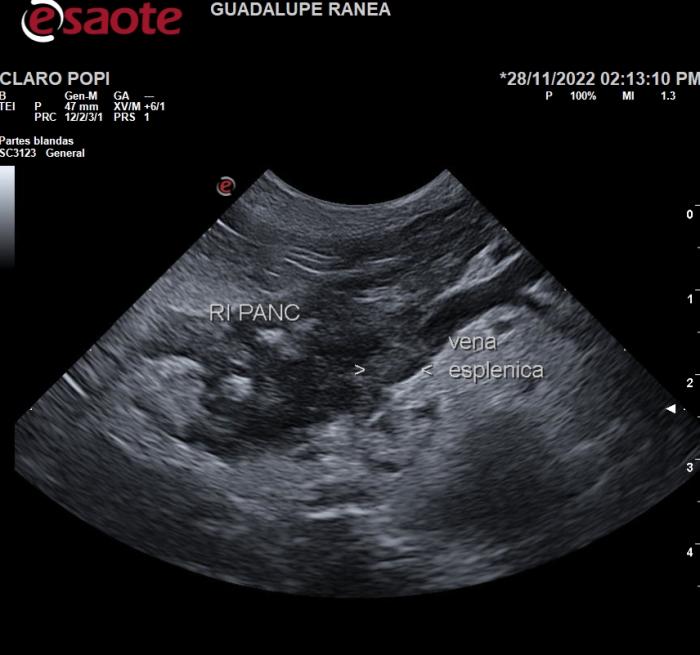
Figura 3. Tromboflebitis de la vena esplénica en un paciente con pancreatitis aguda. Se observa la vena esplénica con aumento del espesor mural (flebitis) y la presencia de un trombo endoluminal (trombosis venosa subaguda).
| Factores predisponen a la trombosis hemática | Invasión venosa maligna | Vías derivativas en la oclusión o estenosis crítica | |
|---|---|---|---|
| Vena cava caudal | Alteraciones sistémicas de la hemostasia en pacientes con enfermedades sistémicas crónicas, pacientes en estado crítico con sepsis/CID y pacientes oncológicos. | Neoplasias renales y adrenales. Tumores retroperitoneales. | • Vía superficial: drenan sangre a las ramas subcutáneas de la vena circunfleja ilíaca superficial y luego a la vena ácigos derecha a través de las venas intercostales. • Vía intermedia: drenan sangre a la vena cava caudal o vena renal a través de las venas gonadales o periureterales. • Vía profunda: drena la vena ácigos derecha a través del plexo venoso vertebral. • Vía portal (o cavoportal) drena sangre a la vena porta a través de ramas de las venas mesentéricas. • Obstrucción de VCC hepática o poshepática: desarrollo de hipertensión portal poshepática. Y del Síndrome Budd Chiary Like. |
| Vena porta | Enfermedad hepatobiliar crónica, estados de hipercoagulabilidad (hiperadrenocortisismo, enfermedades mieloproliferativas, inflamaciones locales por contigüidad (tromboflebitis portal en pancreatitis), enfermedades inflamatorias o infecciosas a través del drenaje venoso portal (enfermedad inflamatoria/infecciosa intestinal, pancreática, esplénica, etc.). | Invasión por neoplasias hepáticas o pancreáticas. | • Vías derivativas portoportales: transformación cavernomatosa de la vena porta. • Vías derivativas portosistémicas largas: el shunt esplenogonadal es el principal representante en medicina veterinaria. También esplenofrénico. • Vías derivativas portoportales cortas: varices para esofágicas, varices gastroesofágicas, varices frénicas, varices colónicas. |
Tabla 2. Factores predisponentes a la trombosis hemática y a la invasión venosa de la vena cava caudal y vena porta junto a las principales vías derivativas adquiridas. Cuadro elaborado en base al estudio de la Dra. Bertolini Giovanna. (2017). Body MDCT in Small Animals: Basic Principles, Technology, and Clinical Applications. 10.1007/978-3-319-46904-1.
Recordatorio anatómico de la ecografía vascular venosa del abdomen
Para reconocer la ubicación de las trombosis venosas abdominales por ecografía es fundamental tener un acabado conocimiento de la anatomía vascular. En el abdomen existen dos sistemas venosos: el sistémico y el portal. El sistémico drena directamente en la vena cava caudal mientras que el sistema porta lleva sangre al hígado. La sangre venosa portal es drenada hacia los sinusoides hepáticos, un tipo especializado de capilar sanguíneo, para luego abocar en las venas hepáticas y finalmente a la vena cava caudal18-20. La vena porta drena la porción abdominal del tracto gastrointestinal (desde el esófago abdominal hasta la porción craneal del recto), el bazo, páncreas y la vesícula biliar. Se forma por la confluencia de la vena mesentérica caudal, la vena mesentérica craneal y la vena esplénica; luego de un pequeño recorrido hacia craneal y a la derecha del plano medio, recibe la vena gastroduodenal para luego llegar al hilio hepático y dividirse en las ramas derecha e izquierda (que se arborizan sucesivamente hasta formar múltiples vénulas que dan origen al sinusoide hepático). En la mayoría de los pacientes la vena esplénica recibe a la vena gástrica izquierda como afluente y ambas forman un vaso corto denominado tronco o vena gastroesplénica, tributaria de la VP. Cuando la vena gástrica izquierda no se une a la vena esplénica, es un afluente directo de la vena porta (Figura 4).
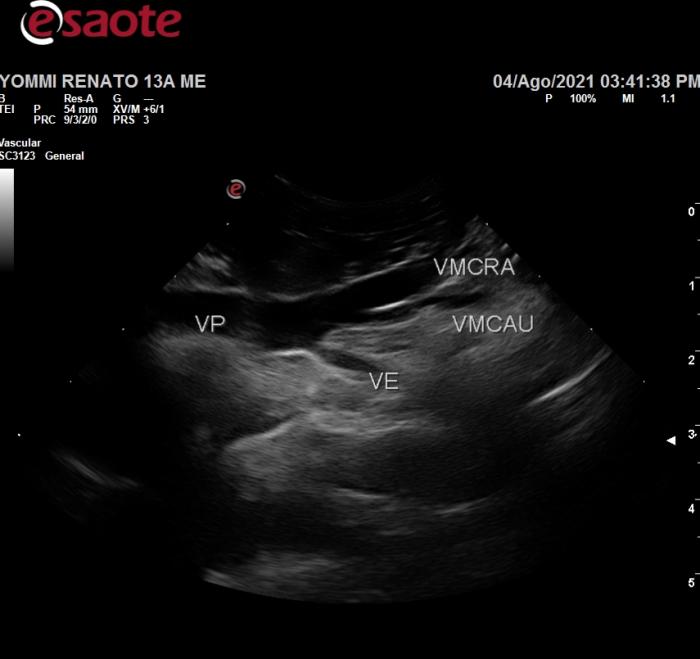
Figura 4. Porción caudal de la vena porta extrahepática desde un abordaje coronal derecho. Se observa la porción inicial de la vena porta (VP) conformada por la vena mesentérica craneal (VMCRA), la vena mesentérica caudal (VMCAU) y el tronco o vena gastroesplénica (VE).
La tributaria esplénica drena las regiones irrigadas por el tronco celíaco: porción final del esófago, parte del duodeno, el páncreas y el bazo. Las venas mesentéricas craneal y caudal drenan las vísceras irrigadas por las arterias homónimas. La vena gastroduodenal recibe sangre de la vena pancreático duodenal, vena gástrica derecha y vena gastro epiploica21.
La vena cava caudal se forma cerca de la entrada de la pelvis por la unión de las venas ilíacas comunes derecha e izquierda. Estas a su vez se forman por la confluencia de las venas ilíacas externas derecha e izquierda (que drenan sangre del miembro pelviano correspondiente) y de las venas ilíacas internas derecha e izquierda (que drena la pared pélvica y gran parte de los órganos pelvianos como la porción final del recto y la región anal). En su recorrido intraabdominal la vena cava caudal recibe múltiples tributarias: las venas circunflejas ilíacas profundas, múltiples venas lumbares, la vena esplenogonadal derecha, las venas renales (a su vez la vena renal izquierda recibe la vena gonadal izquierda), las venas hepáticas y finalmente las venas frénicas antes de atravesar el foramen propio del diafragma y entrar al tórax (donde aboca en el atrio derecho).
Diagnóstico ecográfico de trombosis crónicas y subagudas
Como los signos clínicos de la trombosis venosa son muy variables y al no existir un sistema de score clínico estandarizado en medicina veterinaria, los métodos de diagnóstico por imágenes cumplen un rol fundamental en el diagnóstico y seguimiento de esta patología.
Para la exploración ecográfica de la trombosis venosa abdominal se deben utilizar transductores microconvexos de frecuencia intermedia y una configuración del equipo adecuada para la exploración vascular, donde la luz del vaso se vea anecoica y las paredes tengan una excelente definición en el modo B de la ecografía. El vaso por explorar se coloca en el tercio central de la pantalla, a noventa grados respecto al haz de ultrasonido, y con el foco inmediatamente distal. Cuando las venas exploradas sean relativamente superficiales y/o el paciente tenga un tamaño pequeño a intermedio, se pueden utilizar también transductores lineales de alta frecuencia. La maniobra de compresión con el transductor permite confirmar la permeabilidad de la luz venosa y diferenciarla de una arteria contigua. Las venas sanas colapsan cuando se aplica presión directa pero no las arterias, debido a la histoarquitectura de sus paredes. Si dentro de la luz de una vena se encuentra un trombo agudo que no genere una oclusión de su luz, al presionarla con el transductor la vena se colapsará parcialmente, si el trombo, agudo o subagudo, ocluye la luz venosa no se logra generar una deformación de esta. Cuando el trombo no está totalmente adherido a la pared vascular se lo puede observar flotando libremente en la luz del vaso; en estos casos se debe evitar generar presión con el transductor por su posible desprendimiento. La compresión se debe aplicar con el vaso en su plano transversal para evitar el desplazamiento de este durante la maniobra. Si bien los vasos en el modo B de la ecografía, ya sea arteriales o venosos, se deben ver con luz anecoica (sin ecos en su interior), ocasionalmente se puede registrar flujo espontáneo como ecos puntiformes que se desplazan siguiendo la dirección del flujo sanguíneo. Esto sucede especialmente en los nuevos equipos ecográficos de alta definición de imagen, o HD (high definition). También se puede observar en la confluencia de venas que drenan diferentes territorios o, de forma patológica, por un aumento en la agregación de los elementos formes de la sangre, por un aumento del shear rate (o fuerza de rozamiento entre las capas de fluido en un flujo laminar), por un aumento del hematocrito, del fibrinógeno o en situaciones de hipertermia22. Al observar este contraste espontáneo o smoke se debe evaluar la dirección que describen los ecos: si mantienen un flujo laminar normal o si describen movimientos erráticos o arremolinados, propios de un flujo turbulento. En estos casos se puede considerar la imagen como un estado pretrombótico.
Los trombos en su fase aguda de formación pueden verse hipoecoico o casi anecoicos, siendo muchas veces indistinguibles de la sangre circundante. Aumentar la ganancia del estudio puede ser útil para su identificación, sin embargo, hay que estar advertidos sobre la generación de artefactos de reverberación dentro de la luz que podrían confundirse con material trombótico (seudotrombosis). En el momento agudo de la trombosis la vena puede estar distendida o conservar su diámetro normal; al realizar la maniobra de compresión se puede deformar parcialmente o no cambiar su diámetro. Con el paso del tiempo (dos semanas en medicina humana) los trombos se vuelven más ecogénicos; esto se debe a la reorganización del trombo que adquiere gradualmente una matriz más fibrosa y por ende mayor ecogenicidad. La ecografía muchas veces es incapaz de diferenciar una trombosis subaguda de una trombosis crónica ya que el proceso de formación y lisis del trombo puede ser irregular y asincrónico, causando un aspecto heterogéneo indiferenciable del paso del tiempo.
Los trombos tumorales suelen expandir la vena que ocupan y estar adyacentes al tumor que les dio origen. Pueden invadir uno o más segmentos de la vena cava caudal, e incluso tener una ecogenicidad similar al tumor primario y coexistir con trombos de origen hemático. Los tumores renales pueden invadir directamente la vena cava caudal o primero la vena renal correspondiente. Los tumores de glándulas adrenales pueden también invadir directamente la vena cava caudal o primero la vena frénico abdominal o la vena renal adyacente23.
Los shunts adquiridos se observan en el modo B de la ecografía como vasos venosos que en situaciones normales no son detectables o como vasos venosos nativos con un diámetro mayor al normal. En el caso de la oclusión de la vena cava caudal las colaterales se pueden observar, dependiendo de la vía derivativa recanalizada, como vasos venosos próximos al sitio de obstrucción en el retroperitoneo o como venas nativas dilatados ya sea en abdomen (mesocolon, periureterales, etc.) o en el subcutáneo de la pared ventrolateral del abdomen o de la región del dorsolomo. En el caso que la trombosis portal genere un aumento de presión se pueden observar colaterales venosas como vasos que cruzan el abdomen de craneal a caudal y que involucran a la vena renal izquierda, a la vena mesentérica craneal o a la vena mesentérica caudal. Estas colaterales podrán verse en el modo B de la ecografía como vasos en forma de ovillos en los mesos o vasos de diámetro intermedio que cruzan el abdomen de craneal a caudal a la izquierda del plano medio o en el ligamento hepatoduodenal, así como también alrededor de la vesícula biliar, o del conducto colédoco o del conducto cístico. En la hipertensión portal izquierda el shunt adquirido esplenogonadal es el primero que se abre, tiene un gran diámetro y comunica la vena esplénica con la vena gonadal izquierda quien finalmente lleva la sangre a la vena renal izquierda y la VCC. Se lo observa como un vaso venoso que contacta con la cara caudal del cuerpo del bazo, cruza entre la pared abdominal y la valva lateral del riñón izquierdo para luego girar y conectarse con la vena gonadal izquierda (Figura 5).
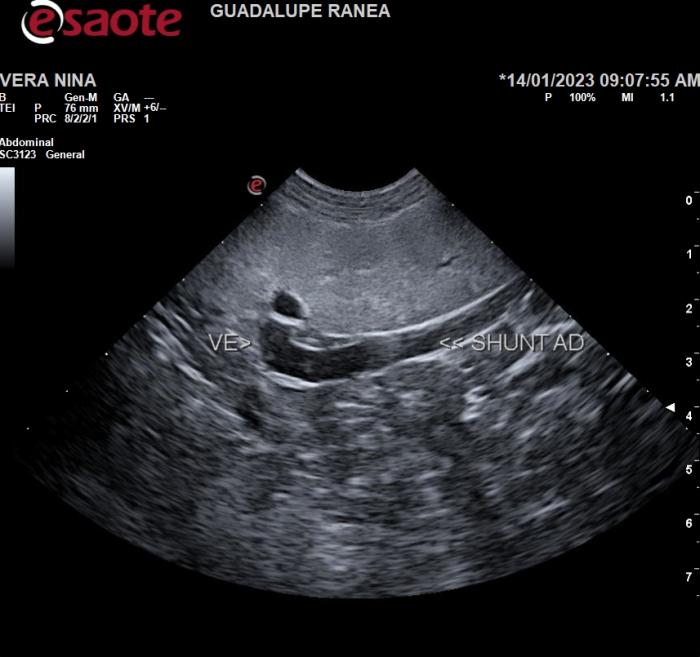
Figura 5. Apertura del shunt adquirido esplenogonadal izquierdo (vía derivativa portal) en un paciente con hipertensión portal. Se observa un vaso que se origina de la vena esplénica y que conecta con la vena gonadal izquierda.
Diagnóstico Doppler de trombosis venosas abdominales
Al explorar con Doppler color las venas sanas presentan un flujo venoso espontáneo que según su orientación respecto al transductor codificará de color rojo (la sangre venosa se acerca al transductor) o azul (la sangre venosa se aleja del transductor). Para realizar un estudio Doppler vascular es fundamental tener previamente una imagen en modo B de excelente calidad y orientar el vaso en la pantalla de manera tal que quede inclinado, mejorando así el ángulo de insonación del ultrasonido para el estudio Doppler. Por la baja velocidad circulatoria de las venas se debe usar una configuración del equipo con una frecuencia de repetición de pulsos (PRF) baja y un filtro de pared bajo. La ganancia del Doppler color debe ser tal como para que el color se registre en toda la luz del vaso sin artefactos de mosaico (o aliasing) o áreas exentas de color. En el Doppler espectral del flujo venoso se debe elegir un PRF lo suficientemente bajo como para poder evaluar las características del espectro y tomar también las velocidades circulatorias. Para esto último es imperativo tener una buena angulación del vaso respecto al haz de ultrasonido y que el ángulo de corrección de Doppler (ubicado paralelo a las paredes del vaso) no supere los 60° de inclinación. Cuando se utilice el Doppler espectral para la evaluación venosa se debe tener la cautela de no generar una presión tal con el transductor para generar un aumento de velocidad circulatoria por una compresión extrínseca iatrogénica.
La porción de la vena cava caudal prerenal (región lumbar) presenta un flujo venoso laminar sin fases (entendiendo por fases la cantidad de veces que la onda espectral atraviesa la línea de base) y anenflexional (entendiendo por inflexión la altura de la onda en la misma fase del espectro). A medida que el flujo se aproxima al diafragma, por la influencia de la presión intratorácica, se puede registrar un flujo venoso fásico con inflexiones de diferentes velocidades producto de la transmisión de la actividad cardiaca derecha en el flujo venoso. Las velocidades circulatorias de la vena cava caudal están estimadas en perros Beagle24 y son:
- Segmento prerenal: velocidad circulatoria máxima 26.6 ± 5.6 cm/s
- Segmento renal: velocidad circulatoria máxima 39.95 ± 10.6 cm/s
- Segmento hepático: velocidad circulatoria máxima 52 ± 13.36 cm/s
En la vena porta, sus afluentes y ramas parenquimatosas se observa un flujo venoso laminar y espontáneo que se dirige hacia el hígado (también conocido como flujo hepatópeto). Al explorar con Doppler color su flujo presenta la misma dirección que aquel que describe la arteria hepática común tanto a la altura del hilio como en sus ramificaciones parenquimatosas. En el Doppler espectral el flujo siempre es monofásico (no cruza la línea de base), parabólico y con cambios de velocidad circulatoria relacionados con los movimientos respiratorios del diafragma (oscilación respiratoria). La velocidad circulatoria portal estimada en medicina veterinaria es la velocidad circulatoria media evaluada en pacientes en ayuno. Para los caninos el valor normal de velocidad circulatoria media portal es de 10 a 25 cm/s, mientras que en felinos es de 10 a 18 cm/s.
Al explorar una oclusión venosa, aguda o subaguda, se observará ausencia de señal Doppler, color y espectral, en el sitio de obstrucción y una dilatación del segmento venoso distal. Cuando el trombo no es oclusivo genera una estenosis de la luz. Si esta estenosis no es crítica las características del flujo venoso no se alteran y no se observarán cambios en el Doppler color o espectral. Cuando la estenosis sea crítica se producirá un aumento de velocidad circulatoria en el sitio de estenosis que se registrará como un aumento de velocidad circulatoria en el Doppler color (área de mosaico color) y en el Doppler espectral (Figura 6).
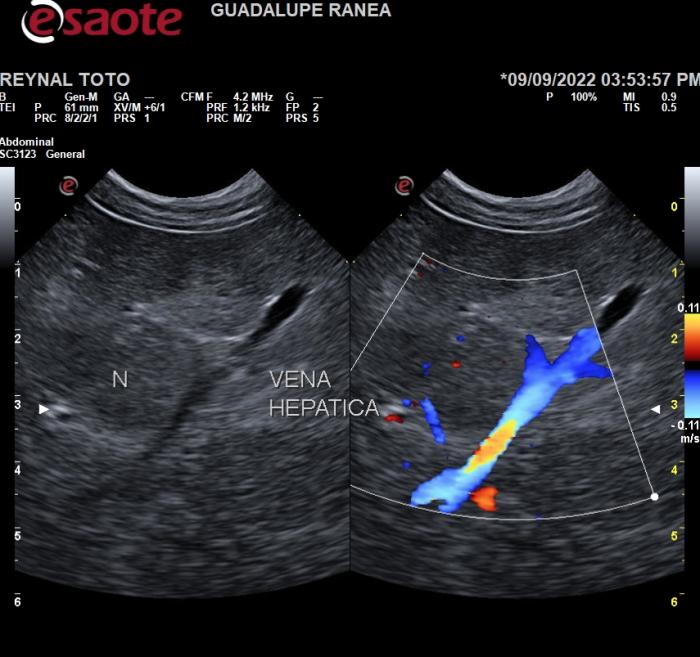
Figura 6. Estenosis hemodinámica significativa de una vena hepática por la presencia de una lesión nodular hepática (N). En el sitio de compresión extrínseca se observa un aumento de velocidad circulatoria, producto de la estenosis, como un área.
Por el desarrollo de colaterales venosas es posible detectar flujo en la porción proximal a la oclusión venosa: estos vasos llevan sangre desde el segmento distal de la oclusión hacia un segmento proximal asegurando un flujo venoso continuo hacia el corazón. El Doppler color demuestra muchas veces el desarrollo de colaterales en la región de la oclusión, demostrando flujo venoso en la luz de los vasos próximos al sitio de oclusión venosa. En el caso de la recanalización y redirección de flujo en vasos venosos prexistentes, como la vía derivativa esplenogonadal de la vena porta, se puede demostrar con Doppler la dirección inversa o hepatófugo, de la sangre venosa producto del aumento de presión venosa.
Con el paso del tiempo la vena puede recanalizarse completamente y presentan un aspecto ecográfico normal. Cuando la recanalización es parcial se observa señal Doppler dentro de los trombos venosos con un patrón de flujo espectral venoso. Sin embargo, cuando el trombo sea tumoral con Doppler espectral se encontraráflujo arterial de baja resistencia dentro del mismo, producto de la neoangiogénesis promovida por factores angiogénicos humorales acantonados en el trombo23 (Tabla 3).
| Características USG - Doppler | Trombo hemático | Trombo tumoral |
|---|---|---|
| Expande la vena | Sí o no | Sí |
| Ecogenicidad similar al tumor primario | No | Sí |
| Contiguo al tumor primario | No | Sí |
| Flujo arterial en el trombo | No | Sí |
Tabla 3. Caracterización mediante ecografía y eco Doppler de los trombos hemáticos y tumorales. Traducido y adaptado de Jordan D. LeGout, Ryan E. Bailey, Candice W. Bolan, Andrew W. Bowman, Frank Chen, Joseph G. Cernigliaro, and Lauren F. Alexander. Multimodality Imaging of Abdominopelvic Tumors with Venous Invasion. RadioGraphics 2020 40:7, 2098-2116
En la tromboflebitis de la vena porta o esplénica se observa un engrosamiento circunferencial de la pared venosa asociado a signos de esteatitis peritoneal local (aumento de ecogenicidad de los mesos con líneas hipoecoicas en su interior). El uso de Doppler en estos pacientes es necesario para identificar la presencia de trombosis venosa aguda, evaluar el grado de estenosis o posible oclusión venosa y la apertura de colaterales venosas en el caso de desarrollar hipertensión portal izquierda.
Conclusión
Una vez más la ecografía y el eco Doppler demuestran ser de extremada utilidad para la asistencia de pacientes en cuidados críticos por su capacidad de detectar, evaluar y acompañar el tratamiento de patologías vasculares de caninos y felinos. El conocimiento de las patologías vasculares y su estudio ecográfico debería incorporarse a la rutina de la exploración abdominal, tanto en pacientes aparentemente sanos como en aquellos en situación de internación ya que la trombosis no siempre es sospechada clínicamente. Dentro de las afecciones vasculares del abdomen más frecuentes, y menos diagnosticadas, encontramos la trombosis de las venas que conforman los dos grandes sistemas venosos del abdomen: el sistema venoso sistémico, representado por la vena cava caudal, y el sistema porta, representado por la vena porta, sus afluentes y ramificaciones parenquimatosas. En pacientes con enfermedades sistémicas, infecciosas, inflamatorias u oncológicas, que alteren la hemostasia del paciente a favor de la coagulación podemos encontrar trombosis venosas subclínicas que, de no diagnosticar en tiempo y forma, pueden causar un daño irreversible en los órganos abdominales y así en el estado general del paciente, aumentando la tasa de mortalidad. La ecografía y el eco Doppler, si bien son operador dependiente, tienen una alta capacidad de detectar, evaluar y acompañar al paciente con trombosis venosa abdominal. Es por esto por lo que la ecografía sigue siendo el método de elección dentro de la evaluación primaria del paciente, en los consultorios de los especialistas así como en los centros de internación – atención de pacientes críticos.
Bibliografía
- Behling-Kelly, E. and Goggs, R. Thrombotic Disorders. En Schalm's Veterinary Hematology (eds M.B. Brooks, K.E. Harr, D.M. Seelig, K.J. Wardrop and D.J. Weiss).7ma ed. Estados Unidos: John Wiley & Sons, Inc; 2022. (91) Pp 821 -36
- Reines, B., & Ninham, B. (2019). Structure and function of the endothelial surface layer: Unraveling the nanoarchitecture of biological surfaces.Q Rev Biophys,52, E13. doi:10.1017/S0033583519000118
- Chatterjee, Shampa. (2018). Endothelial Mechanotransduction, Redox Signaling and the Regulation of Vascular Inflammatory Pathways. Frontiers in Physiology. 9. 10.3389/fphys.2018.00524.
- Meng F, Cheng H, Qian J, Dai X, Huang Y, Fan Y. In vitro fluidic systems: Applying shear stress on endothelial cells. Medicine in Novel Technology and Devices [Internet]. 2022 Sep 1 [cited 2023 Jul 30];15:100143.
- Pazzi P, Fosgate GT, Rixon A, Hanekom J, Kristensen AT, Goddard A. A prospective evaluation of the prevalence of thromboemboli and associated hemostatic dysfunction in dogs with carcinoma or sarcoma. J Vet Intern Med. 2023 Sep-Oct;37(5):1848-1863. doi: 10.1111/jvim.16828. Epub 2023 Aug 7. PMID: 37548637; PMCID: PMC10473004
- Mosier DA, Vascular Disorders and thrombosis. En: Zachary JF; Pathology basis of veterinary disease.7ma ed. Missouri: Elsevier; 2022; p. 2 74 – 103
- Gilson SD, Withrow SJ, Wheeler SL, Twedt DC. Pheochromocytoma in 50 dogs. J Vet Intern Med. 1994 May-Jun;8(3):228-32. doi: 10.1111/j.1939-1676.1994.tb03222.x. PMID: 8064661.
- Specchi S, d’Anjou MA, Carmel EN, Bertolini G. Computed tomographic characteristics of collateral venous pathways in dogs with caudal vena cava obstruction. Veterinary radiology & ultrasound : the official journal of the American College of Veterinary Radiology and the International Veterinary Radiology Association; 2014; Vol 55 (5): pp 531-8
- Whelchel, BD,Palerme, J-S,Tou, SP,Ward, JL.Retrospective evaluation of the etiology and clinical characteristics of peripheral edema in dogs.J Vet Intern Med.2023;37(5):1725-1737. doi:10.1111/jvim.16815
- Specchi, S, d'Anjou, M-A. Diagnostic imaging for the assessment of acquired abdominal vascular diseases in small animals: A pictorial review. Vet Radiol Ultrasound. 2019; 60: 613–632. https://doi.org/10.1111/vru.12780
- Dröes FC, Suchodolski JS, Steiner JM, Lidbury JA. Prevalence of portal vein and splanchnic venous thrombosis in dogs with chronic hepatitis. J Small Anim Pract. 2023 Jun;64(6):375-383. doi: 10.1111/jsap.13597. Epub 2023 Mar 27. PMID: 36973881
- Bertolini G. Anomalies of the Portal Venous System in Dogs and Cats as Seen on Multidetector-Row Computed Tomography: An Overview and Systematization Proposal. Vet Sci. 2019 Jan 22;6(1):10.
- Ricciardi M, Lanci M. Acquired collateral venous pathways in a dog with cranial vena cava obstruction. J Vet Med Sci. 2017 Nov 10;79(11):1772-1775. doi: 10.1292/jvms.17-0283. Epub 2017 Sep 15. PMID: 28924100; PMCID: PMC5709550.
- Maruyama H, Shiina S. Collaterals in portal hypertension: anatomy and clinical relevance. Quant Imaging Med Surg. 2021 Aug;11(8):3867-3881. doi: 10.21037/qims-20-1328. PMID: 34341755; PMCID: PMC8245950.
- Sakamoto, Y., Ishikawa, C., Nakayama, T. and Sakai, M. (2022), Computed tomographic features of portal vein thrombosis in two cats with splenosystemic shunts. J Small Anim Pract, 63: 563-568.https://doi.org/10.1111/jsap.13470
- Fusaro L, Di Bella S, Martingano P, Crocè LS, Giuffrè M. Pylephlebitis: A Systematic Review on Etiology, Diagnosis, and Treatment of Infective Portal Vein Thrombosis. Diagnostics (Basel). 2023 Jan 25;13(3):429. doi: 10.3390/diagnostics13030429. PMID: 36766534; PMCID: PMC9914785.
- Specchi S, Bertolini G. CT angiography identifies collaterals in dogs with splenic vein obstruction and presumed regional splenic vein hypertension. Vet Radiol Ultrasound. 2020 Nov;61(6):636-640. doi: 10.1111/vru.12914. Epub 2020 Sep 29. PMID: 32996204
- Singh B, KM Dyce, SackWO,Wensing CJG. The cardiovascular system. En Dyce, Sacks and Wensgin’s Textbook of veterinary anatomy. 2018. Elsevier. 5ta Edicion. China. (7) Pp 210 – 251
- Bertolini G. The abdominal vasculature. En. Bertolini, Giovanna. Body MDCT in Small Animals: Basic Principles, Technology, and Clinical Applications. 2017. Suiza: Springer. Pp 55 – 94
- Schaller O. Nomenclatura anatómica veterinaria. España: Acribia; 1992.
- Das Ruchira, Chambers James, Arora Ankur. Anatomy of the Portal Vein System.En Qi X, Xie W. Portal Vein Thrombosis. Springer; 2021. Singapur; 1 - 22
- Thrush A, Hartshorne T; Ecografía vascular. Cómo, por qué y cuándo; 3° ed; Barcelona: Elsevier; 2011
- LeGout JD, Bailey RE, Bolan CW, Bowman AW, Chen F, Cernigliaro JG, and Alexander LF. Multimodality Imaging of Abdominopelvic Tumors with Venous Invasion. Radio Graphics 2020; 40(7):2098-16.
- Pidal G, Oribe G, Arrayago I, Curra Gagliano F, D´Anna E, Rodríguez S. Caracterización de la vasculatura venosa hepática a través de la ultrasonografía Doppler en caninos sanos de raza Beagle. Invet. 2013; 25(1):57 -64.
 by Multimédica
by Multimédica