Evaluación y tratamiento del dolor agudo en la especie felina (Parte 1)
Resumen breve
En el pasado, la estimación y tratamiento del dolor asociado a procesos agudos como traumatismos, procesos infecciosos o inflamatorios, enfermedades sistémicas, así como a aquellas inherentes al periodo posoperatorio, resultaba un handicap en la especie felina, fundamentalmente ante la falta de escalas de evaluación de la nocicepción, el desconocimiento de la farmacología analgésica y la ausencia de protocolos específicos para su manejo y tratamiento.Índice de contenidos
Resumen
En el pasado, la estimación y tratamiento del dolor asociado a procesos agudos como traumatismos, procesos infecciosos o inflamatorios, enfermedades sistémicas, así como a aquellas inherentes al periodo posoperatorio, resultaba un handicap en la especie felina, fundamentalmente ante la falta de escalas de evaluación de la nocicepción, el desconocimiento de la farmacología analgésica y la ausencia de protocolos específicos para su manejo y tratamiento.
Esta serie de artículos pretende realizar una revisión en la evaluación del dolor y de la terapéutica farmacológica del dolor agudo, ante los importantes avances que se han producido en el campo de la analgesia felina en los últimos años, habida cuenta de las consecuencias que este puede generar sobre el animal, entre las que destacan el incremento del trabajo miocárdico y del consumo de oxígeno, la activación del sistema renina-angiotensina-aldosterona (SRAA) y del sistema nervioso simpático, el incremento de infecciones secundarias, o el retraso en la cicatrización asociados a la presencia de dolor, así como al desarrollo de efectos adversos relacionados con los principales principios activos tales como la excesiva sedación, hipotermia, depresión cardiorrespiratoria o íleo asociado 1-3 .
Introducción
El estudio de la fisiopatología y tratamiento del dolor en la especie felina ha adquirido una importancia exponencial desde mediados del siglo pasado4, si bien en la actualidad continúa considerándose como un desafío no solo ante la creciente popularidad del gato como animal de compañía -con un censo de casi 60 millones de gatos en Europa y 69 millones en Estados unidos y una población mundial de unos 600 millones5,6-, sino ante la dificultad relativa a la hora de valorar el dolor ante los comportamientos inespecíficos asociados a este, que no solo pueden pasar desapercibidos por el propietario, si no que pueden resultar tenues durante la consulta o el periodo de hospitalización por lo que es clave la correcta instrucción del personal veterinario, que ha de familiarizarse con el uso de escalas que permitan llevar a cabo una evaluación objetiva del paciente7.
Las carencias en estos sistemas de evaluación del dolor han sido una de las principales razones por las cuales se ha subestimado la administración de analgesia en gatos. No obstante, esta situación ha mejorado notablemente con la investigación en lo que respecta a los patrones de comportamiento, los obstáculos, condicionantes y limitaciones en su aplicación y los factores inherentes al reconocimiento del dolor8-11, dado el desarrollo de métodos validados para la determinación, cuantificación y calificación acorde al estudio de los criterios anteriormente citados, al considerarse el control de este una parte fundamental en la clínica felina ya que se encuentra íntimamente relacionado con la disminución de la morbilidad, la mejora de los plazos y calidad de la recuperación.
El correcto manejo analgésico de los pacientes resulta importante desde el punto de vista ético para garantizar los principios de bienestar animal, eliminando la respuesta excesiva al estrés y la liberación de catecolaminas endógenas, ya que este produce efectos tales como la disminución del apetito y el acicalamiento, la alteración de los ritmos circadianos, los patrones conductuales y etológicos, la alteración de la interacción social con otros gatos y/o propietarios o la disminución de la motilidad gastrointestinal (Tabla 1).
| Tabla 1. Efectos fisiológicos del manejo inadecuado del dolor en la especie felina. |
| Disminución | Motilidad gastrointestinal |
| Incremento | Frecuencia cardíaca Frecuencia respiratoria Consumo de oxígeno trabajo miocárdico Tono bronquial Resistencia vascular sistémica |
Además, el conocimiento y la versatilidad en el uso de la farmacología analgésica y las técnicas adyuvantes que forman parte de protocolos de manejo del dolor resultan esenciales, ya que un manejo deficiente del mismo puede generar sensibilización central con el consecuente desarrollo de dolor crónico o maladaptativo12, conllevando a la disminución de la calidad de vida13 y pudiendo ocasionar efectos deletéreos para el animal.
No obstante, aún queda un largo camino por recorrer ya que solo el 85 % de los gatos con dolor de curso agudo asociado a cirugía de tejidos blandos que reciben el alta hospitalaria lo hacen con una pauta analgésica adecuada14, mientras que en el caso de procesos ortopédicos más del 90 % de los pacientes reciben un tratamiento analgésico acorde a sus necesidades15, por lo que puede afirmarse que aún a día de hoy existen situaciones de oligoanalgesia o bien un vacío analgésico tras la hospitalización16, lo que puede deberse al desafío que constituye el reconocimiento y evaluación del dolor, a la falta de entrenamiento específico en la materia, a la ausencia durante décadas de escalas analgésicas adecuadas en esta especie y a que aún existen ciertas ideas equívocas por parte del clínico veterinario sobre ciertos analgésicos (p. ej., opioides), cuya administración genera preocupación especialmente en lo que respecta a los efectos adversos.
Reconocimiento y evaluación del dolor en la especie felina
La evaluación de la intensidad, duración y localización del dolor, así como de sus componentes sensorial, cognitivo, emocional y social17, debe establecerse como una rutina a la hora de realizar la exploración clínica, ya que este se considera el quinto signo vital, por lo que su valoración es fundamental a la hora de plantear la pauta de analgesia.
La domesticación de la especie felina ha generado cierta tolerancia a la proximidad del ser humano, favoreciendo la aparición de comportamientos para enmascarar el dolor18, habiendo de tomarse como una entidad clínica individual con una respuesta a la farmacoterapia específica y variable en base a factores como la edad, raza o genética.
Del mismo modo, en ocasiones se aprecian cambios muy sutiles de comportamiento que pueden dificultar su evaluación, habiendo de tener en cuenta elementos como la ansiedad, el miedo y estrés a la hora de realizar el examen clínico, ya que son factores que dificultan la detección de los procesos nociceptivos, especialmente durante el periodo de hospitalización19,20.
En la mayoría de los casos se producen cambios en la frecuencia cardíaca y/o respiratoria, la presión arterial21, así como otros inespecíficos como la midriasis22 que pueden verse alterados por situaciones estresantes como la hospitalización o el transporte23.
Estos se pueden acompañar de otras alteraciones en el patrón respiratorio, junto anomalías posturales, disconfort, disminución de la actividad, respuesta dolorosa a la palpación de la herida, lamido o mutilación de esta, así como alteraciones en el apetito (hiporexia o anorexia), reticencia al contacto físico o vocalizaciones.
En aquello que respecta a los niveles de glucosa, β-endorfinas, catecolaminas y cortisol en sangre, su uso es cuestionable dado que sus concentraciones pueden verse alteradas por múltiples factores tales como el estrés quirúrgico o anestésico, la hospitalización o los procesos mórbidos concomitantes21-23.
Algunos de los indicadores de dolor agudo son la disminución del apetito, postura encogida, cabeza por debajo de la línea media o una alteración en los patrones del acicalamento17, así como la presencia de ciertas expresiones faciales24-26, mientras que la reticencia al movimiento y las anomalías en la locomoción pueden ser evidencias de dolor a nivel musculoesquelético, aunque no es específico de este. En aquellos casos en los que el dolor es severo los gatos pueden además resultar agresivos y difíciles de manejar (Tabla 2).
| Tabla 2. Principales limitaciones en la valoración y uso de las escalas del dolor. |
| La tolerancia al dolor es propia de cada individuo, siendo la respuesta a la analgesia individual Los signos de dolor pueden ser tenues o el animal puede enmascarar el dolor, por lo que en algunas ocasiones puede ser necesario tiempo hasta su reconocimiento La ausencia de ciertos patrones de comportamiento asociados a los procesos nociceptivos de curso agudo no significa que el animal no presente dolor Ningún signo clínico per se es patognomónico de dolor El componente subjetivo de las escalas de dolor puede ser problemático, generando variabilidad entre observadores. El conocimiento del comportamiento habitual del paciente resulta primordial para valorar el grado de dolor del animal por parte del propietario. El estrés inducido por la hospitalización puede generar dificultades notables a la hora de evaluar el grado de dolor del animal. Algunos comportamientos asociados al dolor pueden verse alterados por fármacos como la ketamina o la dexmedetomidina, por lo que la valoración del dolor puede ser deficiente o imprecisa. |
Estos cambios no deben ser los únicos recursos en los que el clínico veterinario se apoye a la hora de determinar la presencia o ausencia de dolor22, por lo que se debe realizar una evaluación sistemática mediante el uso de escalas del dolor ya que resultan fundamentales para valorar la presencia de dolor, discernir el componente sensorial, fisiológico y emocional de este y categorizar su intensidad, duración y frecuencia, así como para establecer el punto de corte para la administración de un rescate analgésico adecuado.
Además, el uso de escalas validadas tiene como objetivo adquirir resultados similares, fiables y reproducibles regularmente, aportando información en tiempo real sobre aquellas modificaciones o cambios relevantes que se produzcan al respecto, con la finalidad de disminuir la variabilidad en la interpretación y evitar las valoraciones subjetivas, siendo herramientas de monitorización eficaz y fiable10, si bien siempre puede darse cierto grado de disparidad entre observadores, especialmente ante la diferencia de experiencia clínica entre el personal que hace uso de estas.
En un cuestionario en Reino Unido menos del 10 % de las clínicas veterinarias realizaban la valoración del dolor mediante escalas, aunque más del 75 % de los veterinarios creían que evaluar el grado del dolor mediante estos medios podría resultar de utilidad27.
Además, la frecuencia con la que se debe estudiar el curso y evolución del dolor dependerá del estado y las necesidades del paciente, considerándose íntimamente relacionada con el tipo y grado de dolor, e inherente al tipo de patología o intervención quirúrgica, habiendo de ser la exploración sistemática y exhaustiva en todos los casos.
En los últimos años, el almacenamiento de datos en video con la finalidad de realizar un análisis del comportamiento y la evolución del animal se ha convertido en una herramienta de utilidad28, ya que permite apreciar cambios temporales y sutiles, si bien aún se requieren mejoras en su investigación y desarrollo que permitan mejorar su eficacia y aplicación clínica.
Principales escalas de evaluación del dolor
Escalas unidimensionales
Las escalas unidimensionales como la escala numérica, la escala simple descriptiva o la escala analógica visual consideran el dolor como una experiencia única, simple y lineal por lo que se enfocan exclusivamente en la intensidad de este. Aunque son relativamente fáciles de usar, presentan numerosas desventajas respecto a las escalas multidimensionales validadas como la acusada variabilidad dada la interpretación subjetiva del observador, por lo que aportan información sesgada al no dar importancia alguna a la naturaleza multisensorial del dolor (Tabla 3).
| Tabla 3. Principales ventajas y desventajas del uso de escalas unidimensionales en la especie felina. |
| Ventajas | Fáciles de completar y adaptables a las necesidades y al personal del centro. Requieren de mínima formación y poco tiempo. Alta versatilidad para su utilización durante el periodo de hospitalización. Reproducibles por parte del propietario durante la estancia del animal en el hogar. |
| Desventajas | Alto componente subjetivo. Gran variabilidad entre observadores. No son escalas validadas. No consideran el dolor como una experiencia multisensorial, sino lineal. Presentan una baja sensibilidad en casos de variaciones poco acusadas en la intensidad del dolor. No incluyen un trigger para la administración de analgesia de rescate. |
Dichas razones establecen la necesidad de combinar estas en conjunción a otros sistemas de evaluación, ya que los resultados generalmente se ven afectados por factores intrínsecos o extrínsecos, lo que junto a la carencia de un punto de corte preciso para la intervención analgésica generan inexactitud y ambigüedad durante su aplicación clínica.
Escala simple descriptiva
La escala simple descriptiva es una de las primeras escalas adaptadas a animales, extrapolada de aquellas que se usaban en pediatría humana. Inicialmente constaba de tres puntos de calificación basados en la descripción del animal, que categorizaban el dolor como leve, moderado o severo y lo trasladaban a una puntuación numérica (Tabla 4)
| Tabla 4. Ejemplo de escala simple descriptiva. Uso en la especie felina. |
| Calificación |
| 0 | Sin dolor. Sin signos de disconfort evidentes. El animal está clínicamente normal en lo que respecta a apetito, actitud y actividad |
| 1 | Dolor leve. Signos de disconfort ausentes o leves, apetito normal o ligeramente disminuido. Sensibilidad en la zona quirúrgica. |
| 2 | Dolor moderado. Reducción notable del apetito y la actividad. Incremento de las vocalizaciones. Signos de dolor durante la exploración del lecho quirúrgico. |
| 3 | Dolor severo. Reducción drástica del apetito y la actividad con vocalizaciones constantes y gruñidos. Reacción severa a la palpación de la zona incisional. Incremento de la agresividad. |
Este método de clasificación asigna descriptores numéricos para valorar la intensidad del dolor (desde versiones básicas a detalladas), si bien genera discrepancias entre observadores, ya que sus términos están sujetos a la libre interpretación al presentar un alto componente subjetivo, hecho por el cual se considera en desuso en la actualidad, habiendo sido desplazada por escalas más avanzadas y validadas.
Escala numérica
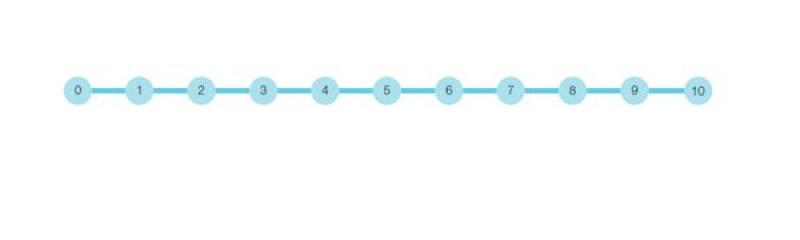
En estas escalas de tipo unidimensional se asignan valores numéricos arbitrarios a una escala lineal para simplificar y organizar la evaluación del dolor, cuyo valor indica la severidad del dolor. Generalmente tienen 10 puntos que van en función de la severidad del dolor, considerándose 0 la ausencia de dolor y 10 el dolor de mayor intensidad (Figura 1)
Escalas analógico visual (AV)
Dicha escala, ideada por Scott Huskinson en 1976 y posteriormente adaptada para su uso en pequeños animales, tiene como base una línea horizontal de 100 mm que representa el dolor existente, en cuyos extremos aparecen los calificativos de “ausencia de dolor” y “el peor dolor imaginable” (Figura 2).
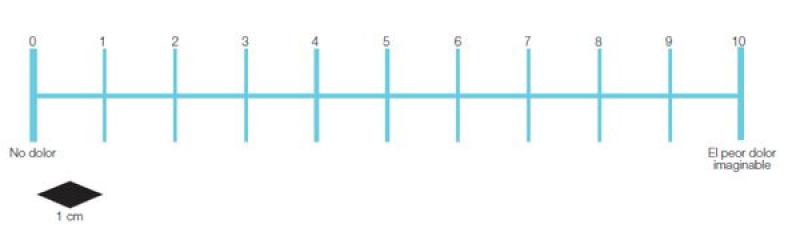
La escala analógico visual se creó para mejorar el reconocimiento y clasificación ante cambios sutiles o matices en el dolor ya que permiten el uso de términos descriptivos para incrementar su sensibilidad29.
Estas escalas son simples de utilizar, permitiendo incluir parámetros y descripciones con la finalidad de ofrecer una clasificación más concreta que en el caso de las escalas numéricas subjetivas, aunque persiste una variabilidad significativa, generalmente debida a la diferente experiencia entre observadores.
Escalas multidimensionales
Las escalas compuestas o multidimensionales resultan más sensibles, objetivas y reproducibles ya que consideran el dolor como una entidad con un espectro complejo y multifactorial, por lo que incorporan parámetros cualitativos basados en los comportamientos asociados a este, estableciendo una interacción normativa del animal con el observador (p. ej., respuesta a la palpación de zonas dolorosas y no dolorosas), que permite mejorar la valoración dinámica del dolor espontáneo o evocado, aunque en estos casos también existe cierta variabilidad entre observadores, si bien esta es menor.
En la especie felina, hay numerosas escalas validadas que caracterizan, agrupan y aúnan las interpretaciones del equipo veterinario en lo que respecta al dolor, contribuyendo las variables fisiológicas y relacionadas con el comportamiento animal a su correcta determinación. No obstante, a pesar de la validación de algunas de estas escalas, aún hay ciertas limitaciones presentes tales como los estadios de disforia, la administración de ketamina, o estadios de agresividad o miedo.
Además, se han desarrollado numerosas escalas no validadas como la escala para la valoración del dolor agudo de la universidad de Colorado o la de la Universidad de Melbourne, no habiéndose establecido valores de corte para la administración de analgesia, y que no se consideran alternativas en la actualidad, dada su baja capacidad de reproducir resultados entre observadores.
Escala de Glasgow Compuesta para la valoración del dolor felino
La escala de Glasgow compuesta para la evaluación del dolor felino es una herramienta homologada y sensible que incorpora tanto comportamientos espontáneos como aquellos inducidos. Presenta categorías como la vocalización, la actividad, la postura, la atención a la herida y la respuesta a la interacción con la observación/palpación del área dolorosa30, precisándose un menor tiempo para completarla en lo que respecta a otras escalas multidimensionales y que puede aplicarse ante cualquier tipo de dolor agudo (quirúrgico, trauma, médico o de otra índole).
En los últimos años, se ha publicado una versión ampliada que incluye las expresiones faciales31 (p. ej., posición de las orejas y hocico), lo que ha mejorado la capacidad discriminatoria y por tanto su sensibilidad, siendo el valor de corte para la administración de analgesia de rescate mayor o igual a 5/2031, lo cual la convierte en un instrumento óptimo para valorar los procesos nociceptivos con curso agudo. Esta puede utilizarse por observadores con distinta experiencia en este campo, si bien la eficacia en el uso de escala puede verse alterada ante efectos sobre el comportamiento del animal (Tabla 5).
| Tabla 5. Principales característiques de la escala Glasgow CMPS-Feline Scale. |
| Componentes | Validación | Instrucciones de uso | Puntuación para la intervención terapéutica | Limitaciones y comentarios |
| Vocalización Actividad Postura Posición de las orejas Atención a la herida Hocico Respuesta a la interacción con el observador Palpación del área dolorosa Comportamientos cuantitativos | Si | Cada parámetro se puntúa de maera individual El sumatorio de todas las puntuaciones de los 8 campos constituye la calificación final Se ha de prestar especial énfasis en la expresión facial para la evaluación precisa del animal | Mayor o igual a 5/20 | La versión inicial tenía una sensibilidad un 25% menor Práctica, fácil de usar, incluso con poco entrenamiento |
Escala UNESP-Botucacu MCPS
Se trata de una herramienta útil, certificada y traducida a varios idiomas32-34 que incluye tanto un componente comportamental como físico. Aunque inicialmente se utilizó para valorar el dolor tras la cirugía de ovariohisterectomía34, posteriormente fue adaptada para su uso en casos de dolor agudo de cualquier etiología.
La escala UNESP-Botucacu MCPS requiere de un entrenamiento exhaustivo por parte del observador y precisa de más tiempo para llevarla a efecto, lo que puede ser un limitante en aquellas instituciones en las que el personal sea limitado. Esta presenta una capacidad para discernir la presencia o ausencia de dolor agudo, haciendo hincapié en las dimensiones del dolor -las variables fisiológicas (presión arterial y apetito), expresión del dolor (comportamientos misceláneos como movimientos de la cola, contracción y extensión de los miembros pélvicos, atención a la herida y la apertura o cierre de los párpados, la respuesta a la palpación del abdomen, el flanco y del área quirúrgica) y los cambios psicomotores (actitud, actividad, postura y confort)- (Tabla 6).
| Tabla 5. Principales característiques de la escala Glasgow CMPS-Feline Scale. |
| Componentes | Validación | Instrucciones de uso | Puntuación para la intervención terapéutica | Limitaciones y comentarios |
| Expresión del dolor
Cambios psicomotores.
Variables fisiológicas
| Si | Cada parámetro se puntúa de manera individual de 0 a 3. El sumatorio de todas las puntuaciones de los 10 campos constituye la calificación final. | Mayor o igual a 7/30 o mayor o igual a 6/27 si la presión arterial no se incluye. | Requiere más tiempo para completarse que otras escalas de valoración del dolor. Incluye la valoración de la presión arterial y el apetito. Puede verse influenciada por regímenes analgésicos basados en la ketamina. Presenta numerosos vídeos online para mejorar la precisión de los observadores (http://animalpain.com.br) Se encuentra disponible en varios idiomas |
En la escala UNESP-Botucacu MCPS, la analgesia de rescate se administra cuando la puntuación es mayor o igual de 6/27 en aquellos casos en los que la presión arterial no se considera durante la exploración32 o mayor o igual de 7/30 cuando se estiman todas las variables incluida la presión arterial32.
No obstante, cabe reseñar que esta herramienta se ve influenciada ante la aparición de disforia, comportamientos agresivos o miedo , así como por la administración de anestésicos disociativos como la ketamina35, que pueden generar confusión en la evaluación psicomotora, generando un error relativo en las puntuaciones del dolor y una evaluación anómala del animal que conlleve la administración equívoca de analgesia de rescate a animales libres de dolor35, por lo que los efectos de este fármaco han de considerarse cuando se evalúa el dolor posoperatorio agudo en gatos y en especial tras el uso de esta escala.
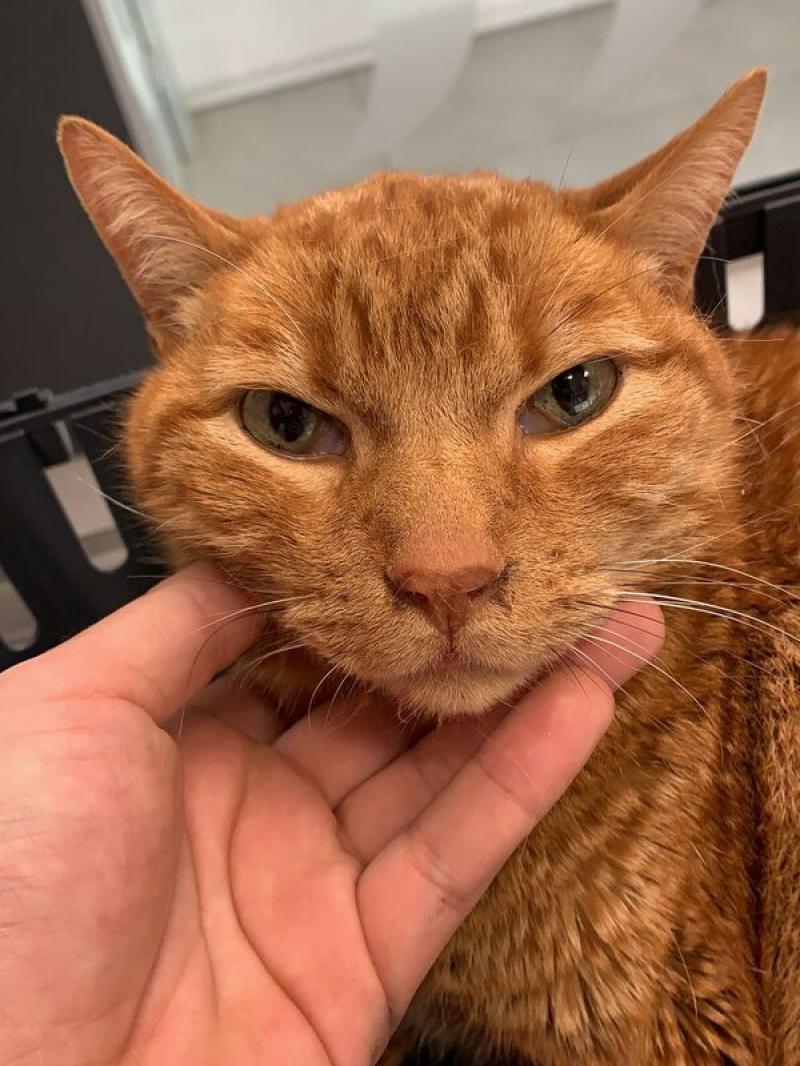
Feline Grimace Scale
La interpretación de la expresión facial es de gran utilidad, ya que tiene el potencial de aplicarse al reconocimiento e interpretación de las experiencias sensoriales y emocionales en pequeños animales36 y por tanto aportan información relevante en lo que respecta al estado general del animal10.
Un estudio de 2014 sentó las bases para la investigación y desarrollo de la Feline Grimace Scale, al determinar que la capacidad visual y cognitiva para diferenciar aquellos gatos que presentaban dolor, frente a aquellos que no lo hacían basándose en la expresión facial presentaba una sensibilidad de aproximadamente el 98 %25.
En los últimos años, se ha extrapolado el uso de las escalas de expresión facial (fuertemente instauradas y contrastadas en el ser humano, ratas, ratón, conejo y caballos) a la especie felina, con el objetivo de incrementar la eficacia en la detección, cuantificación y calificación del dolor, teniendo como consecuencia final el desarrollo de la Feline Grimace Scale, que se considera un método simple, con una eminente capacidad discriminativa y una elevada correlación con otras escalas validadas. Además, resulta rápida, reproducible y práctica, siendo su aplicación clínica primordial para valorar las expresiones faciales que están específicamente relacionadas con el dolor.
En la actualidad, esta herramienta está homologada32, basándose en cinco unidades de acción (la posición de las orejas, tensión del hocico, posicionamiento de los bigotes, estrechamiento de la órbita y posición de la cabeza24,37), habiéndose de combinar las puntuaciones de todos estos valores, estableciéndose la necesidad de analgesia de rescate cuando la puntuación total es mayor de 0.39/1.0 (Tabla 7; Figuras 1-3).
| Tabla 7. Principales característiques de la Feline Grimace Scale para la valoración del dolor en la especie felina. |
| Componentes | Validación | Instrucciones de uso | Puntuación para la intervención terapéutica | Limitaciones y comentarios |
| Unidades de acción:
| Si | Cada unidad de acción puntúa de 0 a 2. El resultado final es el sumatorio de las cinco unidades de acción. | Mayor de 0.39/1.0. | Fácil de usar. Rápida. Alta capacidad para discriminar el dolor. Poca variabilidad entre observadores. |

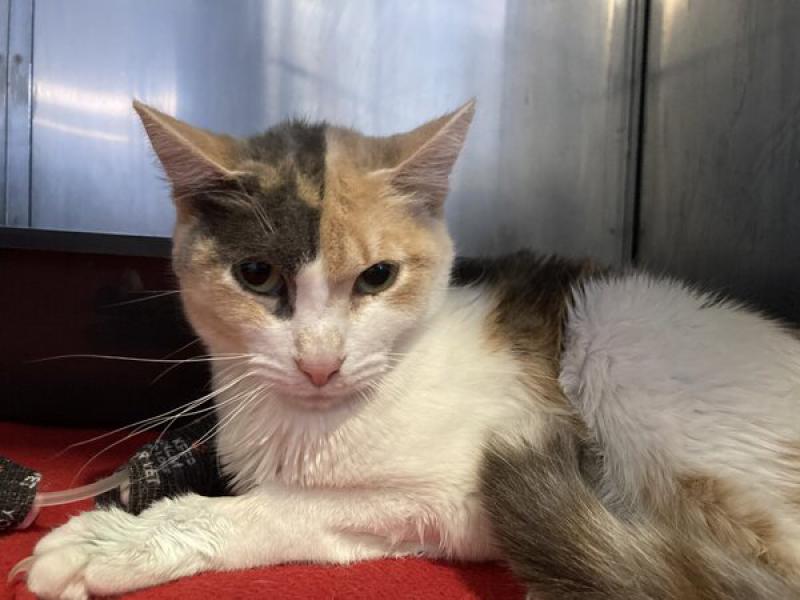
Conclusión
La primera parte de esta serie de artículos trata de describir y poner a disposición del clínico veterinario aquellas herramientas disponibles para la estimación del dolor con curso agudo, ya que su detección y evaluación se ha considerado un desafío en la especie felina hasta la aparición de las denominadas escalas de evaluación analgésica. Estas no solo han permitido la estandarización y valoración objetiva de los procesos nociceptivos, si no que constituyen un punto de partida hacia el progreso en un campo tan relevante como la analgesia felina, cuyo auge comenzó a mediados del pasado siglo y que está experimentando un desarrollo extraordinario en las últimas dos décadas.
Bibliografía
- Mathews K, Kronen PW, Lascelles D, Nolan A, Robertson S, Steagall PV, Wright B, Yamashita K. Guidelines for recognition, assessment and treatment of pain: WSAVA Global Pain Council. Journal of Small Animal Practice. 2014;55(6):E10-68.
- Taylor PM, Robertson SA. Pain management in cats--past, present and future. Part 1. The cat is unique. Journal of Feline Medicine and Surgery. 2004;6(5):313-320
- Robertson SA, Taylor PM. Pain management in cats—past, present and future. Part 2. Treatment of pain—clinical pharmacology. Journal of Feline Medicine and Surgery. 2004;6(5):321-333.
- Davis LE, Donnelly EJ. Analgesic drugs in the cat. Journal of the American Veterinary Medical Association. 1968;153(9):1161-1167.
- Wise JK, Heathcott BL, Gonzalez ML. Results of the AVMA survey on companion animal ownership in US pet-owning households. American Veterinary Medical Association. Journal of the American Veterinary Medical Association 2002; 221: 1572–1573.
- Gunn-Moore D. Considering older cats. Journal of Small Animal Practice 2006; 47: 430–431.
- Brondani JT, Luna SP, Padovani CR. Refinement and initial validation of a multidimensional composite scale for use in assessing acute postoperative pain in cats. American Journal of Veterinary Research. 2011; 72(2):174-183.
- Steagall PV, Benito J, Monteiro BP, Doodnaught GM, Beauchamp G, Evangelista MC. Analgesic effects of gabapentin and buprenorphine in cats undergoing ovariohysterectomy using two pain-scoring systems: a randomized clinical trial. Journal of Feline Medicine and Surgery. 2018;20(8):741-748.
- Benito J, Monteiro BP, Beauchamp G. Evaluation of interobserver agreement for postoperative pain and sedation assessment in cats. Journal of the American Veterinary Medical Association 2017;251(5):544–551.
- Doodnaught GM, Benito J, Monteiro BP. Agreement among undergraduate and graduate veterinary students and veterinary anesthesiologists on pain assessment in cats and dogs: A preliminary study. Canadian Veterinary Journal 2017;58(8):805–808.
- Buisman M, Hasiuk MMM, Gunn M, Pang DSJ. The influence of demeanor on scores from two validated feline pain assessment scales during the perioperative period. Veterinary Anaesthesia and Analgesia. 2017;44(3):646-655.
- Clarke H, Bonin RP, Orser BA, Englesakis M, Wijeysundera DN, Katz J. The prevention of chronic postsurgical pain using gabapentin and pregabalin: a combined systematic review and meta-analysis. Anesthesia and Analgesia. 2012;115(2):428-442.
- Carr DB, Goudas LC. Acute pain. Lancet. 1999;12;353(9169):2051-8
- Hewson CJ, Dohoo IR, Lemke KA. Perioperative use of analgesics in dogs and cats by Canadian veterinarians in 2001. Canadian Veterinary Journal 2001;47, 352–359.
- Lascelles BD, Capner C, Waterman-Pearson A. Current British veterinary attitudes to perioperative analgesia for cats and small mammals. Veterinary Record 1999;145, 601–604.
- Simon BT, Scallan EM, Carroll G, et al. The lack of analgesic use (oligoanalgesia) in small animal practice. Journal of Small Animal Practice 2017;58(10):543–554.
- Merola I, Mills DS. Systematic review of the behavioural assessment of pain in cats. Journal of Feline Medicine and Surgery. 2016;18(2):60-76.
- Lamont LA. Feline perioperative pain management. Veterinary Clinics of North America: Small Animal Practice 2002;32: 747–763
- Waran N, Best L, Williams V, Salinsky J, Dale A, Clarke N. A preliminary study of behaviour-based indicators of pain in cats. Animal Welfare Journal. 2007;16(1):105-108.
- Smith JD, Allen SW, Quandt JE, Tackett RL. Indicators of postoperative pain in cats and correlation with clinical criteria. American Journal of Veterinary Research. 1996;57(11):1674-8.
- Smith JD, Allen SW, Quandt JE. Changes in cortisol concentration in response to stress and postoperative pain in client-owned cats and correlation with objective clinical variables. American Journal of Veterinary Research. 1999;60(4):432-6
- Cambridge AJ, Tobias KM, Newberry RC, Sarkar DK. Subjective and objective measurements of postoperative pain in cats. Journal of the American Veterinary Medical Association. 2000;217(5):685-690.
- Quimby JM, Smith ML, Lunn KF. Evaluation of the effects of hospital visit stress on physiologic parameters in the cat. Journal of Feline Medicine and Surgery. 2011;13(10):733-737.
- Evangelista MC, Watanabe R, Leung VSY, Monteiro BP, O'Toole E, Pang DSJ, Steagall PV. Facial expressions of pain in cats: the development and validation of a Feline Grimace Scale. Scientific Reports. 2019;9(1):119-128.
- Holden E, Calvo G, Collins M, Bell A, Reid J, Scott EM, Nolan AM. Evaluation of facial expression in acute pain in cats. Journal of Small Animal Practice. 2014;55(12):615-621.
- Väisänen MA, Tuomikoski SK, Vainio OM. Behavioral alterations and severity of pain in cats recovering at home following elective ovariohysterectomy or castration. Journal of the American Veterinary Medical Association. 2007;231(2):236-42.
- Coleman DL, Slingsby LS. Attitudes of veterinary nurses to the assessment of pain and the use of pain scales. Veterinary Record 2007;160(16):541-544.
- Noldus, LPJJ.. EthoVision: A versatile video tracking system for automation of behavioral experiments. Behavior Research Methods, Instruments, & Computers 2001;33, 398–414
- Holton LL, Scott EM, Nolan AM, Reid J, Welsh E, Flaherty D. Comparison of three methods used for assessment of pain in dogs. Journal of the American Veterinary Medical Association. 1998;212(1):61-66
- Calvo G, Holden E, Reid J, Scott EM, Firth A, Bell A, Robertson S, Nolan AM. Development of a behaviour-based measurement tool with defined intervention level for assessing acute pain in cats. Journal of Small Animal Practice. 2014;55(12):622-9.
- Reid J, Scott EM, Calvo G, Nolan AM. Definitive Glasgow acute pain scale for cats: validation and intervention level. Veterinary Record. 2017;180(18):449.
- Brondani JT, Mama KR, Luna SP, Wright BD, Niyom S, Ambrosio J, Vogel PR, Padovani CR. Validation of the English version of the UNESP-Botucatu multidimensional composite pain scale for assessing postoperative pain in cats. Veterinary Research 2013;17:143.
- Della Rocca G, Catanzaro A, Conti MB, Bufalari A, De Monte V, Di Salvo A, Tabarelli Brondani J, Pacca Loureiro Luna S. Validation of the Italian version of the UNESP-Botucatu multidimensional composite pain scale for the assessment of postoperative pain in cats. Veterinaria italiana. 2018;54(1):49-61.
- Steagall PV, Monteiro BP, Lavoie AM, Frank D, Troncy E, Luna SP, Brondani JT. Validation de la version francophone d’une échelle composite multidimensionnelle pour l’évaluation de la douleur postopératoire chez les chats. Canadian Veterinary Journal. 2017;58(1):56-64.
- Buisman M, Wagner MC, Hasiuk MM, Prebble M, Law L, Pang DS. Effects of ketamine and alfaxalone on application of a feline pain assessment scale. Journal of Feline Medicine and Surgery. 2016;18(8):643-51.
- Bennett V, Gourkow N, Mills DS. Facial correlates of emotional behaviour in the domestic cat (Felis catus). Behaviour Processes. 2017;141(3):342-350.
- Evangelista MC, Benito J, Monteiro BP, et al. Clinical applicability of the Feline Grimace Scale: real-time versus image scoring and the influence of sedation and surgery. PeerJ. 2020;8:e8967.
 by Multimédica
by Multimédica