Evaluación y tratamiento del dolor agudo en la especie felina (Parte 2)
Resumen breve
En el pasado, la estimación y tratamiento del dolor asociado a procesos agudos como traumatismos, procesos infecciosos o inflamatorios, enfermedades sistémicas, así como a aquellas inherentes al periodo posoperatorio, resultaba un handicap en la especie felina, fundamentalmente ante la falta de escalas de evaluación de la nocicepción, el desconocimiento de la farmacología analgésica y la ausencia de protocolos específicos para su manejo y tratamiento.Índice de contenidos
Resumen
En el pasado, la estimación y tratamiento del dolor asociado a procesos agudos como traumatismos, procesos infecciosos o inflamatorios, enfermedades sistémicas, así como a aquellas inherentes al periodo posoperatorio, resultaba un handicap en la especie felina, fundamentalmente ante la falta de escalas de evaluación de la nocicepción, el desconocimiento de la farmacología analgésica y la ausencia de protocolos específicos para su manejo y tratamiento.
Esta serie de artículos pretende realizar una revisión en la evaluación del dolor y de la terapéutica farmacológica del dolor agudo, ante los importantes avances que se han producido en el campo de la analgesia felina en los últimos años, habida cuenta de las consecuencias que este puede generar sobre el animal, entre las que destacan el incremento del trabajo miocárdico y del consumo de oxígeno, la activación del sistema renina-angiotensina-aldosterona (SRAA) y del sistema nervioso simpático, el incremento de infecciones secundarias, o el retraso en la cicatrización asociados a la presencia de dolor, así como al desarrollo de efectos adversos relacionados con los principales principios activos tales como la excesiva sedación, hipotermia, depresión cardiorrespiratoria o íleo asociado 1-3 .
Principales analgésicos en la especie felina
El tratamiento del dolor agudo en la especie felina resulta un reto no solo ante el metabolismo variable de ciertos fármacos, si no dada su predisposición a determinados procesos mórbidos, así como a circunstancias como la dificultad para administrar medicación oral o la limitada cantidad de principios activos disponibles, considerándose todos ellos factores limitantes a la hora de establecer un protocolo analgésico seguro y efectivo.
En la mayoría de los casos se opta por pautas de analgesia multimodal basadas en el uso de analgésicos con mecanismos de acción diferentes, cuyo objetivo final es establecer sinergia farmacológica y/o efectos aditivos, así como reducir la probabilidad de que se produzcan fenómenos como hiperalgesia, alodinia y sensibilización central, minimizando a su vez los efectos secundarios de dichos fármacos ante su empleo a dosis bajas (figura 1).
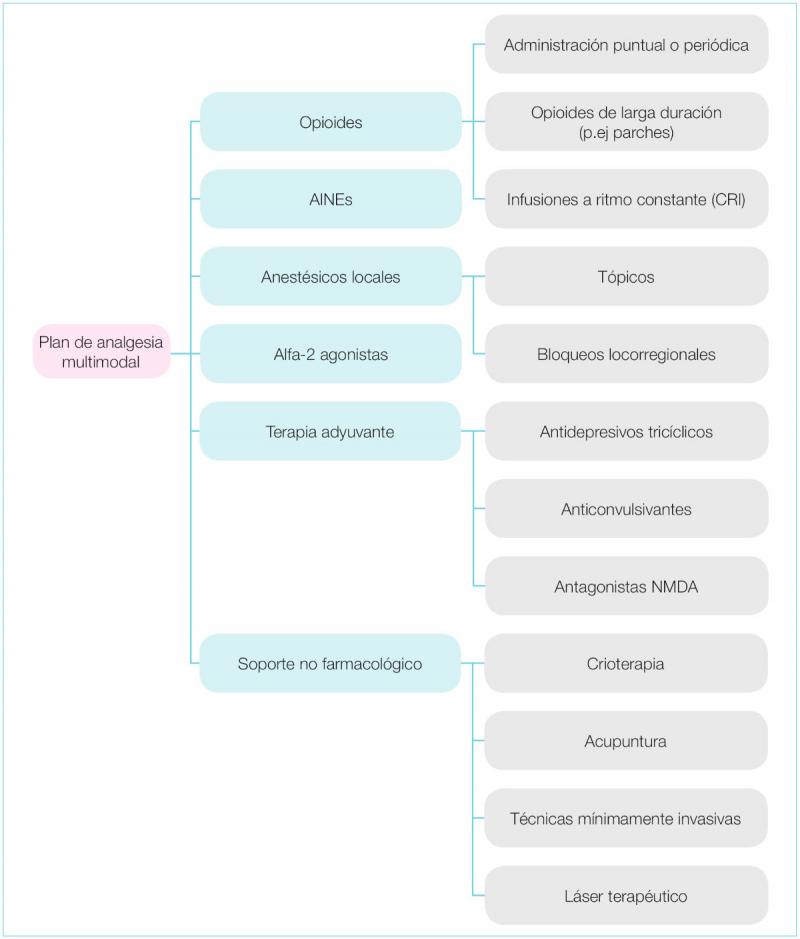
Además la analgesia preventiva juega un papel fundamental en estos pacientes, ya que la administración de fármacos y técnicas adyuvantes previamente al estímulo nociceptivo presenta numerosos beneficios, al disminuir sustancialmente las necesidades analgésicas durante el periodo perioperatorio4-6, si bien la pauta farmacológica ha de resultar efectiva en el control del dolor incisional e inflamatorio que se produce tanto al inicio como durante el acto quirúrgico7,8, resultando los anestésicos locales fundamentales en estos casos dada la posibilidad de reducir tanto la transducción como la transmisión del dolor.
Antinflamatorios no esteroideos
Los antinflamatorios no esteroideos (AINEs) son la piedra angular en el tratamiento del dolor agudo en la especie felina, fundamentalmente ante sus propiedades antiinflamatorias, antipiréticas y analgésicas. Éstos presentan un efecto de hasta 24 horas que se debe a la inhibición reversible de la ciclooxigenasa (COX) (tabla 1).
Los AINEs son metabolizados principalmente por glucuronidación9,por lo que pueden resultar potencialmente tóxicos o presentar una tasa de excreción más lenta en que en perros, lo que podría explicar tanto la mayor duración del efecto farmacológico -que radica no solo en la metabolización, si no en la acumulación a nivel sistémico- como la mayor incidencia de efectos adversos relacionados con su administración en la especie felina, hechos por los que se considera que el margen de seguridad es menor en lo que respecta a fármacos como los opioides o los agonistas α2-adrenérgicos.
| Tabla 1. Principales antinflamatorios no esteroideos aprobados para el tratamiento del dolor agudo en la especie felina. |
| Fármaco | Dosis | Indicaciones | Duración estimada del tratamiento |
| Carprofeno | 4mg/Kg SC o IV | Dolor perioperatorio | Administración única |
| Meloxicam |
|
|
|
| Robenacoxib |
|
|
|
Por norma general, su uso está contraindicado en casos de hipovolemia, enfermedad hepática o daño renal concurrente, así como en procesos gastrointestinales, sospecha de hemorragia o disfunción plaquetar10. No obstante, existe evidencia científica de que los AINEs pueden utilizarse en regímenes terapéuticos adaptados en gatos con enfermedad renal crónica incluso a largo plazo11, si bien siempre se ha de valorar la relación beneficio-riesgo para el paciente, sobre todo en aquellos casos en los que exista enfermedad renal leve, en los que es necesario realizar una monitorización exhaustiva12,13.
En la actualidad, se recomienda la administración de AINEs previamente al procedimiento quirúrgico, si bien en ocasiones se valorará retrasar ésta hasta el periodo de recuperación, especialmente en gatos geriátricos que presenten cierto deterioro en la función renal o en aquellos animales con predisposición a padecer episodios de hipotensión durante la anestesia, en los que tiene sentido su aplicación durante el periodo postoperatorio, una vez restaurada la volemia.
Meloxicam
Se trata de un inhibidor COX-2 preferencial con una vida media mayor que la del robenacoxib, disponible en numerosas presentaciones clínicas, que tiene una alta biodisponibilidad tras la administración oral o subcutánea. Este fármaco se destina al tratamiento del dolor agudo relacionado con procesos quirúrgicos o en casos de dolor inflamatorio agudo, visceral o musculoesquelético y a diferencia de otros inhibidores de la ciclooxigenasa, presenta un metabolismo oxidativo y una eliminación fecal14, habiendo sido aprobado para su administración diaria a largo plazo en la Unión Europea15,16.
| Tabla 2. Fármacos usados en TIVA. |
| Opioide | Inicio de acción | Duración | Dosis | CRI | Comentarios | Referencias |
| Metadona | 5-10mins (IV) | 4-6h | 0.2-0.6mg/kg IV o IM | Precisa de estudios adicionales | Presenta propiedades Anti-NMDA | Ferreira 2011 |
| Morfina | 10-20 mins (IV) | Hasta 4h | 0.1-0.2mg/kg IM | 50-100mcg/kg/h | Su uso por vía endovenosa puede causar liberación de histamina | Bortolami et al 2015 |
| Petidina | 10-30 mins (IV) | 1-2h | 3-5mg/kg IM | No recomendado | Su uso por vía endovenosa puede causar liberación de histamina | Bortolami et al 2015 |
| Fentanillo | 2-5mins (IV) | 15-20mins | 1-5mcg/kg IV o IM | 2-4mcg/kg/h | Dosis elevadas pueden producir disforia | Lamont 2002 |
| Buprenorfina | 30-60 mins | 6-8h | 0,02-0,04mg/kg | Inicio de acción lento hasta el pico de acción | La administración subcutánea produce analgesia errática y variable | Steagall et al 2014 |
Robenacoxib
El robenacoxib es un antinflamatorio no esteroideo con una alta selectividad para la inhibición de la COX-2, que presenta una vida media relativamente corta en sangre -de aproximadamente 3 horas- y cuya actividad sobre el lecho inflamatorio es de al menos 24 horas17. Éste ha demostrado cierta superioridad en lo que respecta al meloxicam a nivel perioperatorio18, contribuyendo a la eficacia del tratamiento del dolor en dicho periodo.
Además, un estudio determinó la seguridad del robenacoxib durante su administración a medio plazo a un rango de dosis de entre 1 y 2,4 mg/Kg PO, no evidenciándose cambios en la bioquímica, el urianálisis o a nivel histopatológico, sin episodios de toxicidad asociada al tratamiento con este principio activo19.
En todo caso, cabe reseñar que los efectos digestivos, hepáticos o renales del robenacoxib son poco frecuentes, incluso en aquellos gatos con enfermedad renal, considerándose la presencia de vómitos como el fenómeno adverso más habitual durante el tratamiento.
Carprofeno
El carprofeno se puede administrar en inyección única por vía subcutánea o intravenosa para el manejo del dolor postoperatorio, considerándose su efecto equivalente al del meloxicam o el ketoprofeno20, si bien su eliminación es significativamente más lenta en gatos que en perros21.
En la especie felina no se recomienda su administración reiterada, si bien se requieren estudios adicionales que garanticen su eficacia y seguridad a corto plazo, dada su potencial toxicidad gastrointestinal, generalmente asociada a las pautas de administración inadecuada o a la presencia de procesos mórbidos concomitantes.
Opioides
Los opioides juegan un papel fundamental en el tratamiento del dolor agudo en la especie felina, especialmente ante su amplio margen de seguridad, la posibilidad de antagonizar su efecto en caso de reacciones adversas y su capacidad analgésica22-24.
Éstos se pueden administrar por numerosas vías -p.ej, transmucosa, subcutánea, intramuscular, intravenosa, epidural, transdérmica o intraarticular- y su clasificación farmacológica se realiza en función del receptor opioide con el que interaccionan, presentando una potencia analgésica variable.
Habitualmente los agonistas puros de los receptores µ como la metadona, la morfina, la petidina o el fentanilo se destinan al tratamiento del dolor moderado a severo, mientras que en procesos menos dolorosos se emplean agonistas parciales como la buprenorfina, habiendo de evaluarse el grado de dolor de manera sistemática para valorar la eficacia y duración del efecto analgésico.
En gatos, los opioides pueden producir anomalías en el comportamiento como euforia leve, disforia y vocalización, eventos gastrointestinales como íleo paralítico, así como efectos estimulantes ante su administración a dosis elevadas25, generando variaciones en la presión arterial, la frecuencia cardiaca o midriasis26 que dura más allá del periodo anestésico. Además pueden producir la liberación de epinefrina, norepinefrina y dopamina, aunque se considera que a dosis adecuadas los efectos sobre el sistema cardiovascular son mínimos.
No obstante, en ciertas ocasiones el incremento del tono vagal puede conducir al desarrollo de bradicardia, aunque generalmente no se producen cambios significativos en la contractibilidad miocárdica, la resistencia vascular periférica o la presión arterial, si bien dichos efectos pueden acentuarse cuando se combinan con agonistas α-2 adrenérgicos o anestésicos generales.
Cabe destacar que estos fármacos han de utilizarse con cautela en pacientes con incremento de la presión intracraneal, dado el potencial desarrollo de vómitos y depresión respiratoria27 que podrían resultar deletéreos para el animal.
Del mismo modo, el uso ciertos principios activos como el butorfanol, la buprenorfina y la morfina puede conducir al desarrollo de hipertermia28 como consecuencia de su acción sobre el umbral del centro termorregulador y la termogénesis29,30, aunque generalmente se trata de un fenómeno autolimitante ya que la temperatura basal se restablece cinco horas después su administración sin necesidad de tratamiento.
Tal y como se describía con anterioridad, los agonistas opioides se pueden antagonizar con naloxona, aunque es imprescindible conocer que la duración de acción de este fármaco podría ser más corta que la del opioide a revertir, por lo que resulta primordial la correcta monitorización del paciente con la finalidad de evitar la aparición de fenómenos como la renarcotización.
Metadona
Es un agonista puro del receptor µ que posee una potencia analgésica similar a la morfina, pero que a diferencia de ésta raramente tiene efectos eméticos, ni genera disforia. Además, presenta propiedades analgésicas relacionadas con el antagonismo no competitivo del receptor NMDA, modulando además las vías descendentes del dolor a través la inhibición de la recaptación de la norepinefrina y la serotonina31.
Presenta una rápida absorción por vía intramuscular, descartándose la utilización de la vía subcutánea al considerarse errática y deficiente. Generalmente tiene un inicio de acción rápido por vía intravenosa, habiéndose comprobado que la ruta de administración de este principio activo puede afectar notablemente a la duración de la analgesia32.
Adicionalmente, la metadona presenta una tasa de eliminación más lenta que en el perro33,34, no generando liberación de histamina por vía intravenosa, mientras que ciertos estudios publicados en la última década han mostrado resultados prometedores cuando se utiliza la vía transmucosa oral35,36.
Morfina
La morfina es un agonista µ puro cuyos efectos analgésicos en la especie humana se deben a los metabolitos morfina-6-glucuronido y morfina-3-glucuronido, pero que en la especie felina se producen en muy pequeñas cantidades37. No obstante, genera un efecto analgésico directo de entre cuatro y seis horas, potenciando la sedación, especialmente cuando se combina con α2-agonistas o acepromacina, siendo su tasa de eliminación similar a la de la especie canina.
La administración de morfina cursa con la aparición de salivación y vómitos, que comprometen el bienestar del animal. Además, dada la posibilidad de liberación de histamina tras su administración endovenosa, -que resulta en vasodilatación, taquicardia e hipotensión-, se considera de elección la vía intramuscular.
Cuando se utiliza por vía epidural (0.1 mg/Kg), se une directamente a los receptores opioides de la asta dorsal de la médula espinal, lo que permite una disminución de la concentración alveolar mínima del 31 %38, con una larga duración de acción (de hasta 24 horas), siendo los principales efectos secundarios el prurito y la retención urinaria, si bien se producen en un número pequeño de casos.
Petidina
Es un agonista puro que en la especie felina que presenta un inicio de acción variable, de 10 a 30 minutos y una duración del efecto analgésico corta, de 1 a 2 horas39.
La vía de elección es la intramuscular, ya por intravenosa produce una liberación de histamina que puede generar consecuencias severas sobre el animal. Además, este principio activo no resulta una opción válida para el tratamiento del dolor postoperatorio, dado que los gatos se muestran poco tolerantes a las inyecciones intramusculares repetidas, si bien se considera como una alternativa óptima en aquellos casos en los que se precisa de una analgesia de corta duración.
Por otro lado, la meperidina tiene propiedades anticolinérgicas y simpaticomiméticas que pueden resultar de ayuda en gatos con bradicardia o pacientes pediátricos en los que la presión arterial y el gasto cardiaco son dependientes de la frecuencia cardiaca y que carecen de capacidad compensatoria mediante cambios en el volumen sistólico.
Fentanilo
El fentanilo es un agonista µ puro potente con rápido inicio de acción40, una duración aproximada de 30 minutos tras su administración aislada y una rápida eliminación. Su plasticidad terapéutica lo convierte en un opioide ideal para su uso durante intervenciones quirúrgicas y en el periodo perioperatorio, especialmente mediante el uso de infusiones a ritmo constante. Su uso permite reducir los requerimientos de anestésicos halogenados durante la anestesia, por lo que resulta de utilidad para disminuir los efectos hipotensivos de los anestésicos inhalatorios, hecho a tener en cuenta en animales inestables.
Los parches de fentanilo constituyen una alternativa en el tratamiento del dolor agudo, especialmente en el periodo postoperatorio, ya que disminuyen la necesidad de sistemas de infusión y como consecuencia mejoran la movilidad del paciente. No obstante, existe cierta variabilidad individual, habiéndose registrado una mayor biodisponibilidad tras la colocación inmediata el parche41. Además, éstos presentan un lapso hasta el inicio de la acción farmacológica de entre 6 y 18 horas, por lo que es necesario adaptar la pauta analgésica durante este tiempo, considerándose que la duración de los efectos analgésicos es de hasta 3 días42, con un efecto sostenido de hasta 8 horas tras su retirada.
La dosis recomendada es de 3 a 5 mcg/Kg/h -parches de 25 mcg/h para un gato de 5 Kg-, siendo los riesgos potenciales la exposición accidental del compuesto al ser humano -p.ej, contacto o ingestión- o la sobredosificación.
En la actualidad, existen dos presentaciones disponibles para su uso en la especie felina. El parche reservorio, compuesto por cuatro capas -adhesiva interior, membrana de control, capa reservorio y capa exterior protectora- no cortable, ante la potencial liberación errática del compuesto con la consecuente sub o sobredosificación, y el parche tipo matrix que tiene un riesgo menor de sobredosificación incluso al dividirlo, ya que el fentanilo se incorpora en gotas de propilenglicol.
Buprenorfina
La buprenorfina está autorizada para el tratamiento del dolor agudo en gatos y permite su administración por vía oral transmucosa, subcutánea, intramuscular, intravenosa o transdérmica, con una amplia variabilidad en la duración de los efectos en función de la dosis y la vía seleccionada.
Ésta no se considera el analgésico de elección en aquellos gatos que requieren de terapia antinociceptiva inmediata, ya que el tiempo desde su administración hasta el inicio de acción farmacológica puede ser de hasta 45 minutos. Por lo general, se considera que su pico de acción se alcanza a los 90 minutos43, presentando una duración de su efecto de hasta 8 horas44.
| Tabla 3. Dosis recomendadas de 2 agonistas para la premedicación, administración de microdosis intraoperatoria o infusión a ritmo constante en la especie felina. |
| Fármaco | Dosis | Microdosis intraoperatoria | CRI | Comentarios |
| Medetomidina | 2-5mcg/kg IV, 5-20 mcg/kg IM | 0.5-1 mcg/kg IV | 0.5-1 mcg/kg/h | Útil en casos de dolor agudo refractario |
| Dexmedetomidina | 2.5mcg/kg IV, 2.5-10 mcg/kg IM | 0.25-0.5 mcg/kg IV | 0.25-1 mcg/kg/h | Útil en casos de dolor agudo refractorio |
Respecto a la administración oral transmucosa (OTM), la absorción de la buprenorfina se debe al estado no ionizado del fármaco, lo que dado el ambiente alcalino de la cavidad oral43 convierte a este principio activo en un analgésico óptimo para el tratamiento del dolor postquirúrgico tras el alta hospitalaria, habiendo de tener en cuenta que hay múltiples situaciones en las que el pH oral fluctúa -p.ej, gingivitis, estomatitis, infecciones orales-, siendo su absorción deficiente en estos casos.
Por añadidura, estudios adicionales mostraron que en aquellas ocasiones en las que se utilizaba la vía transmucosa oral o subcutánea, se requería un rescate analgésico más frecuente que cuando se optaba por la administración intramuscular o intravenosa45, estableciéndose como conclusión que la vía subcutánea podría ser errática y poco efectiva en estos casos46.
En los últimos años, se ha estudiado una formulación de buprenorfina que permite espaciar el intervalo de administración47, habiéndose demostrado además la eficacia ante la administración de dosis elevadas por vía subcutánea de la formulación acuosa de buprenorfina, no apreciándose efectos adversos ni reacciones significativas48.
Butorfanol
Es un agonista de los receptores K y antagonista de los receptores µ que se puede administrar por vía subcutánea, intramuscular o intravenosa, que presenta propiedades sedantes, generando poca depresión respiratoria, aunque su poder analgésico es muy limitado y con una corta duración de acción -de entre una y dos horas tras su administración49,50-, presentando un efecto techo -ceiling point-, por lo que no se considera una opción en el tratamiento del dolor agudo.
Tramadol
El tramadol presenta una actividad mixta como agonista opioide débil e inhibidor de la recaptación de la norepinefrina y serotonina, cuya presentación oral tiene una baja palatabilidad, siendo frecuente la aparición de sialorrea tras su administración.
Dicho principio activo genera una analgesia de calidad51-53, si bien puede producir efectos adversos como sedación, disforia, depresión respiratoria, midriasis, episodios gastrointestinales o síndrome serotoninérgico54, especialmente ante la administración concomitante de antidepresivos tricíclicos, inhibidores de la monoamonoxidasa u otros inhibidores de la serotonina.
A diferencia de los perros, los gatos producen el metabolito M1 -O-desmetiltramadol- en mayores concentraciones55,56, si bien se ha registrado cierta variabilidad entre individuos en la especie felina, por lo que se requiere de una monitorización estricta durante el uso del mismo51.
Alfa 2 agonistas
Presentan efectos, sedantes, analgésicos -tanto a nivel espinal como supraespinal57,58- y relajantes musculares, pudiéndose administrar por vía parenteral, en microdosis a nivel intraoperatorio, en infusiones a ritmo constante, por vía epidural, intratecal o intraarticular, si bien pueden causar depresión cardiovascular -bradicardia, hipertensión/hipotensión, disminución del gasto cardiaco-, por lo que su uso se ha de evitar en caso de enfermedad cardiovascular.(Tabla 3).
| Tabla 4. Principales anestésicos locales utilizados por vía epidural en la especie felina. |
| Fármaco | Dosis | Concentración | Inicio de acción (minutos) | Duración (horas) | Indicaciones | Contraindicaciones y efectos adversos |
| Lidocaína | 0.2ml/kg | 20mg/ml | <10 | 1.5 | Cirugía perineal, de tercio posterior o abdominal caudal | Desórdenes de la coagulación, hipotensión, infección en el lugar de administración, efectos a nivel cardiovascular o neurológico |
| Bupivacaína | 0.2 ml/kg | 5mg/ml | <15 | 2-4 | Cirugía perineal, de tercio posterior o abdominal caudal | Desórdenes de la coagulación, hipotensión, infección en el lugar de administración, efectos a nivel cardiovascular o neurológico |
| Ropivacaína | 0.2ml/kg | 5mg/ml | <15 | 2-4 | Cirugía perineal, de tercio posterior o abdominal caudal | Desórdenes de la coagulación, hipotensión, infección en el lugar de administración, efectos a nivel cardiovascular o neurológico |
Dado el impacto que pueden ocasionar sobre el gasto cardiaco, con la consecuente disminución del transporte de oxígeno a los tejidos, se ha de evitar su uso a pacientes anémicos, así como en caso de procesos mórbidos concurrentes que produzcan émesis, ya que cursa con vómitos en más del 75% de los gatos cuando se dosifica por vía oral transmucosa o intramuscular59 o en los minutos posteriores en el caso de la administración epidural60.
Los agonistas α-2 establecen sinergia farmacológica con otros analgésicos y pueden emplearse en aquellos casos en los que el paciente sea refractario al tratamiento con opioides, si bien generan cierto grado de sedación que puede resultar un obstáculo para la evaluación del dolor.
La dexmedetomidina confiere analgesia en el paciente felino durante aproximadamente 120 minutos61, habiéndose utilizado en gatos conscientes a dosis bajas62 -5-20 mcg/Kg IV- y dosis elevadas59 -40 mcg/Kg IM-, considerándose su poder analgésico menor al de la buprenorfina.
Las propiedades farmacológicas de la dexmedetomidina como su bajo peso molecular, su carácter lipofílico y su pKa de 7.1 frente al pH oral de los gatos de en torno a 8-9, determinan la viabilidad de esta vía dada su elevada biodisponibilidad.
Además, la aplicación oral transmucosa de 40 mcg/Kg de dexmedetomidina utilizando el mismo modelo animal, determinó una analgesia similar a la obtenida por vía intramuscular59
Su administración por vía epidural produce analgesia de mayor duración que en los casos de las vías intravenosa o intramuscular63. No obstante, la absorción sistémica de los agonistas α-2 en el espacio epidural es significativa dado que las dosis y tasa de absorción pueden ser similares a la vía parenteral, por lo que ha de vigilarse ante este hecho.
Además, el uso de α-2 agonistas junto a anestésicos locales parece prolongar la duración de acción del anestésico local ante su acción sobre el receptor α-2 periférico64. Sin embargo, el uso conjunto de bupivacaína y dexmedetomidina durante el bloqueo ciático y femoral no mostró diferencias significativas en comparación al uso de bupivacaína65.
Anestésicos locales
Los anestésicos locales son fármacos que impiden la conducción del impulso nervioso mediante el bloqueo reversible de los canales de sodio, produciendo una pérdida de la sensibilidad, minimizando el riesgo de aparición de dolor maladaptativo, así como de sensibilización periférica y central.
Éstos se pueden administrar perineuralmente como en el caso de los bloqueos anestésicos, a través de catéteres de difusión intralesional -wound soaker catheters- o de catéteres epidural, reduciendo los requerimientos analgésicos durante el periodo perioperatorio, así como los efectos adversos relacionados con la administración de ciertos anestésicos.(Tablas 4 y 5)
| Tabla 5. Principales anestésicos locales destinados a la distribución mediante catéteres de difusión intralesional. |
| Fármaco | Dosis | Concentración | Inicio de acción (minutos) | Duración (horas) | Indicaciones | Contraindicaciones y efectos adversos |
| Bupivacaína | 0.5-1mg/kg cada 6 horas | 2.5mg/ml | <10 | 6 | Amputación, cirugía torácica, osteotomía ventral de la bulla timpánica, heridas de gran dimensión | Infección. No sobrepasar los 4mg/kg/día |
| Tabla 6. Principales técnicas de anestesia locorregionales utilizadas en la especie felina. |
| Área corporal | Técnica de anestesia locorregional |
| Cabeza | Bloqueos selectivos (p.ej, alveolar inferior, mentoniano) |
| Tórax | Bloqueo intercostal Epidural Bloqueo intrapleural |
| Abdomen | Bloqueo transverso abdominal Bloqueo cuadrado lumbar Epidural Splash de bupivacaína intraperitoneal |
| Miembro anterior | Bloqueo paravertebral Bloqueo del plexo braquial RUMM proximal (radial, cubital, mediano, musculocutáneo) RUM distal (radial, cubital, mediano) Inyecciones intraarticulares |
| Miembro posterior | Bloqueos selectivos (p. ej, ciático femoral) Epidural Inyecciones intraarticulares |
| Testículos/Ovario | Bloqueo intraesricular Infiltración del ligamento suspensorio ovárico |
| Heridas | Infiltración Wound soaker catheter Parches transdérmicos |
En los últimos años, los avances en anestesia regional, el uso complementario de las técnicas de imagen y la irrupción de los neuroestimuladores, han permitido mejorar precisión y seguridad de los bloqueos anestésicos, incorporándose no solo durante el acto quirúrgico, sino durante el periodo postoperatorio (Figuras 2 y 3)(Tabla 6).
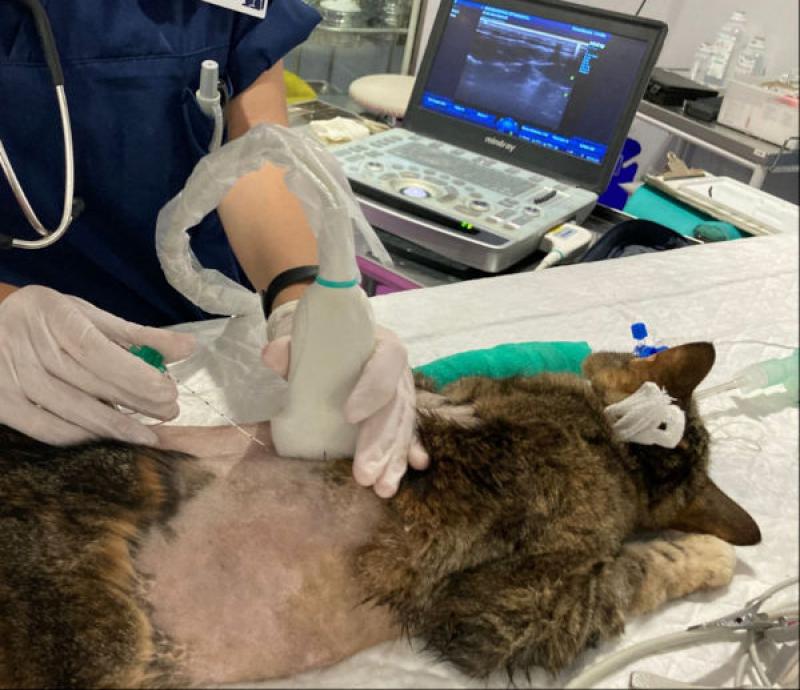
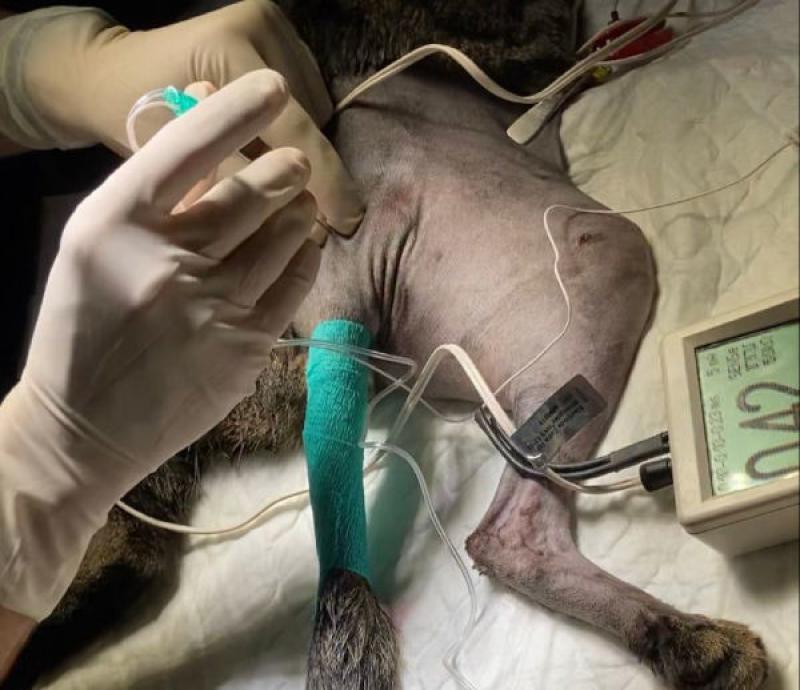
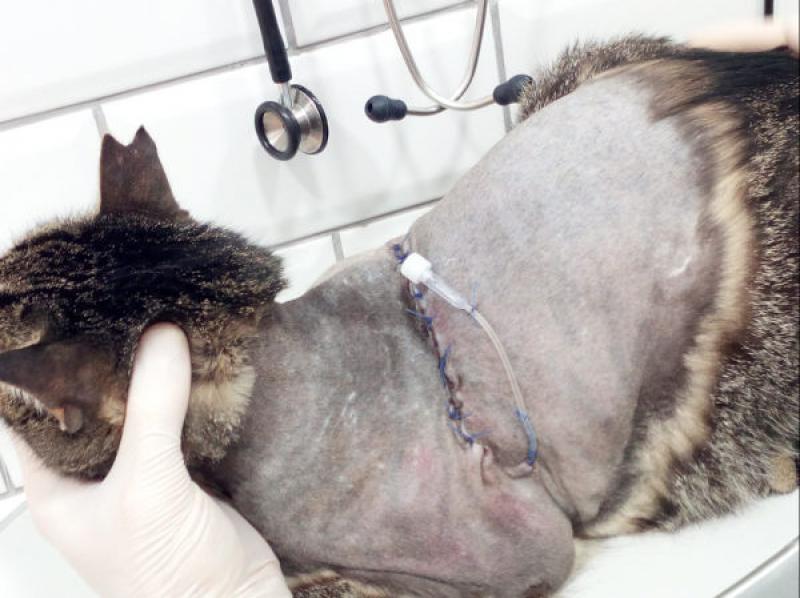
Además, los catéteres de difusión intralesional fenestrados permiten la administración intermitente o constante de anestésicos locales, siendo una opción a tener en cuenta en cirugías tales como mastectomía, exéresis de tumores -p.ej fibrosarcoma-, amputación de extremidades, toracotomía o esternotomía o heridas de gran tamaño66 (Figura 4).
Los anestésicos locales presentan un margen de seguridad estrecho, pudiendo generar reacciones severas a nivel cardiovascular y/o neurológico (arritmias, espasmos musculares, tremores o ataxia), por lo que el cálculo preciso de la dosis y el conocimiento exhaustivo de las técnicas asociadas a su utilización resulta necesario para disminuir la potencial toxicidad sistémica, administración intravenosa errática o el daño neurológico asociado a estos procedimientos.
En la especie felina, los anestésicos locales más utilizados son la lidocaína y la bupivacaina, aunque la ropivacaína se considera una alternativa a la bupivacaína al considerarse menos cardiotóxica, diferiendo todos ellos no solo en su inicio, si no en su duración de acción, por lo que han de seleccionarse en base a las necesidades individuales de cada paciente.
Ketamina
La ketamina es anestésico disociativo y antagonista no específico y no competitivo de los receptores NMDA67,68, aunque también presenta efectos sobre receptores opioides, muscarínicos, monoaminérgicos y receptor GABA, considerándose efectiva contra el dolor agudo somático y visceral69, suprimiendo la producción de citoquinas proinflamatorias y presentando efectos inmunomoduladores, revirtiendo la inmunosupresión inducida por dolor.
Los receptores NDMA juegan un papel fundamental en la sensibilización central y el fenómeno wind-up70, aunque su activación ocurre más en aquellos casos de dolor maladaptativo71.
Las dosis analgésicas son de entre 0.5 y 1 mg/Kg IV, continuando con una CRI de 2-10 mcg/Kg/min mucho menores que cuando se utiliza como anestésico disociativo, considerándose como una opción adecuada en casos de hiperalgesia postquirúrgica72.
Conclusión
La segunda parte de esta serie de artículos trata de realizar un abordaje conciso y detallado sobre los principales principios activos utilizados para el tratamiento del dolor agudo en la especie felina, así como reforzar los conceptos de analgesia multimodal y preventiva que juegan un papel de extrema relevancia a la hora de instaurar una pauta analgésica de calidad. El conocimiento e integración de todos estos factores y variables por parte del clínico veterinario, garantizará una mejora en el tratamiento de los procesos nociceptivos, que tendrá como resultado final la mejora del bienestar animal y de la calidad de vida de nuestros pacientes.
Bibliografía
- Mathews K, Kronen PW, Lascelles D, Nolan A, Robertson S, Steagall PV, Wright B, Yamashita K. Guidelines for recognition, assessment and treatment of pain: WSAVA Global Pain Council. Journal of Small Animal Practice. 2014;55(6):E10-68.
- Taylor PM, Robertson SA. Pain management in cats--past, present and future. Part 1. The cat is unique. Journal of Feline Medicine and Surgery. 2004;6(5):313-320
- Robertson SA, Taylor PM. Pain management in cats—past, present and future. Part 2. Treatment of pain—clinical pharmacology. Journal of Feline Medicine and Surgery. 2004;6(5):321-333.
- Campiglia L, Consales G, De Gaudio AR. Pre-Emptive Analgesia for Postoperative Pain Control. Clinical Drug Investigation. 2010;30, 15–26
- Kissin I. Preemptive analgesia. Anesthesiology. 2000;93(4):1138-43.
- Dahl JB, Kehlet H. Preventive analgesia. Current Opinion in Anesthesiology. 2011;24(3):331-8.
- Hebl JR, Dilger JA, Byer DE, Kopp SL, Stevens SR, Pagnano MW, Hanssen AD, Horlocker TT. A pre-emptive multimodal pathway featuring peripheral nerve block improves perioperative outcomes after major orthopedic surgery. Regional Anesthesia and Pain Medicine. 2008;33(6):510-7.
- Ong CK, Lirk P, Seymour RA, Jenkins BJ. The efficacy of preemptive analgesia for acute postoperative pain management: a meta-analysis. Anesthesia and Analgesia. 2005;100(3):757-73.
- Court MH. Feline drug metabolism and disposition: pharmacokinetic evidence for species differences and molecular mechanisms. Veterinary Clinics of North America Small Animal Practice. 2013;43(5):1039-1054.
- Lascelles BD, Court MH, Hardie EM, Robertson SA. Nonsteroidal anti-inflammatory drugs in cats: a review. Veterinary Anaesthesia and Analgesia. 2007;34(4):228-50.
- Monteiro B, Steagall PVM, Lascelles BDX, Robertson S, Murrell JC, Kronen PW, Wright B, Yamashita K. Long-term use of non-steroidal anti-inflammatory drugs in cats with chronic kidney disease: from controversy to optimism. Journal of Small Animal Practice. 2019;60(8):459-462.
- Gowan RA, Baral RM, Lingard AE, Catt MJ, Stansen W, Johnston L, Malik R. A retrospective analysis of the effects of meloxicam on the longevity of aged cats with and without overt chronic kidney disease. Journal of Feline Medicine and Surgery. 2012 Dec;14(12):876-81.
- Surdyk KK, Brown CA, Brown SA. Evaluation of glomerular filtration rate in cats with reduced renal mass and administered meloxicam and acetylsalicylic acid. American Journal of Veterinary Research. 2013;74(4):648-51
- Grudé P, Guittard J, Garcia C, Daoulas I, Thoulon F, Ebner T. Excretion mass balance evaluation, metabolite profile analysis and metabolite identification in plasma and excreta after oral administration of [14C]-meloxicam to the male cat: preliminary study. Journal of Veterinary Pharmacology and Therapy. 2010;33(4):396-407.
- Carroll GL, Narbe R, Kerwin SC, Taylor L, Peterson K, Hartsfield SM. Dose range finding study for the efficacy of meloxicam administered prior to sodium urate-induced synovitis in cats. Veterinary Anaesthesia and Analgesja. 2011;38(4):394-406.
- Lehr T, Narbe R, Jöns O, Kloft C, Staab A. Population pharmacokinetic modelling and simulation of single and multiple dose administration of meloxicam in cats. Journal of Veterinary Pharmacology. 2010;33(3):277-86.
- Pelligand L, King JN, Toutain PL, Elliott J, Lees P. Pharmacokinetic/pharmacodynamic modelling of robenacoxib in a feline tissue cage model of inflammation. Journal of Veterinary Pharmacology. 2012;35(1):19-32
- Kamata M, King JN, Seewald W, Sakakibara N, Yamashita K, Nishimura R. Comparison of injectable robenacoxib versus meloxicam for peri-operative use in cats: results of a randomised clinical trial. Veterinary Journal. 2012;193(1):114-8.
- King JN, Hotz R, Reagan EL, Roth DR, Seewald W, Lees P. Safety of oral robenacoxib in the cat. Journal of Veterinary Pharmacology. 2012;35(3):290–300.
- Slingsby LS, Waterman-Pearson AE. Postoperative analgesia in the cat after ovariohysterectomy by use of carprofen, ketoprofen, meloxicam or tolfenamic acid. Journal of Small Animal Practice. 2000;41(10):447-50.
- Taylor PM, Delatour P, Landoni FM. Pharmacodynamics and enantioselective pharmacokinetics of carprofen in the cat. Research on Veterinary Science 1996;60(2):144–51.
- Simon BT, Steagall PV. The present and future of opioid analgesics in small animal practice. Journal of Veterinary Pharmacology and Therapy 2017;40(4):315–26.
- Bortolami E, Love EJ. Practical use of opioids in cats: a state-of-the-art, evidencebased review. Journal of Feline Medicine and Surgery 2015;17(4):283–311.
- Steagall PVM, Monteiro-Steagall BP, Taylor PM. A review of the studies using buprenorphine in cats. Journal of Veterinary Internal Medicine 2014;28(3):762–70.
- Gaumann DM, Yaksh TL, Tyce GM. Sympathetic stimulating effects of sufentanil in the cat are mediated centrally. Neuroscience letters 1988;91(1):30–5.
- Wallenstein MC, Wang SC. Mechanism of morphine-induced mydriasis in the cat. American Journal of Physiology. 1979;236(5):R292-6.
- Pazos A, Flórez J. A comparative study in rats of the respiratory depression and analgesia induced by mu- and delta-opioid agonists. European Journal of Pharmacology. 1984 Mar 16;99(1):15-21
- Burkman JM, Posner KL, Domino KB. Analysis of the clinical variables associated with recrudescence after malignant hyperthermia reactions. Anesthesiology 2007;106:1077-8.
- Posner LP, Pavuk AA, Rokshar JL, Carter JE, Levine JF. Effects of opioids and anesthetic drugs on body temperature in cats. Veterinary Anaesthesia and Analgesia. 2010;37(1):35-43.
- Niedfeldt RL, Robertson SA. Postanesthetic hyperthermia in cats: a retrospective comparison between hydromorphone and buprenorphine. Veterinary Anaesthesia and Analgesia. 2006;33(6):381-389.
- Codd EE, Shank RP, Schupsky JJ, Raffa RB. Serotonin and norepinephrine uptake inhibiting activity of centrally acting analgesics: structural determinants and role in antinociception. Journal of Pharmacology and Experimental Therapy. 1995;274(3):1263-70.
- Steagall PVM, Carnicelli P, Taylor PM, Dixon M, Ferreira T. Effects of subcutaneous methadone, morphine, buprenorphine or saline on termal and presure thresholds in cats. Journal of Veterinary Pharmacology and Therapeutics 2006;29:531-537
- Ingvast‐Larsson C, Holgersson A, Bondesson U, Lagerstedt, A. Clinical pharmacology of methadone in dogs. Veterinary Anaesthesia and Analgesia, 2010;37: 48-56
- Slingsby LS , Murrell J, Taylor PM, Sear J. Effect of intramuscular methadone on pharmacokinetic data and thermal and mechanical nociceptive thresholds in the cat. Journal of Feline Medicine and Surgery, 2016;18(11):875-881.
- Pypendop BH, Ilkiw JE, Shilo-Benjamini Y. Bioavailability of morphine, methadone, hydromorphone, and oxymorphone following buccal administration in cats. Journal of Veterinary Pharmacology and Therapy. 2014;37(3):295-300.
- Pypendop BH, Shilo‐Benjamini Y, Ilkiw, JE. Effect of morphine, methadone, hydromorphone or oxymorphone on the thermal threshold, following intravenous or buccal administration to cats. Veterinary Anaesthesia and Analgesi 2016;43: 635-642
- Taylor PM, Robertson SA, Dixon MJ, B, Lascelles BDX. Morphine, pethidine and buprenorphine disposition in the cat. Journal of Veterinary Pharmacology and Therapeutics. 2001;24: 391-398.
- Golder FJ, Pascoe PI, Bailey CS, Ilkiw JE, Tripp LD. The effect of epidural morphine on the mínimum alveolar concentration of isofluorane in cats. Journal of Veterinary Anesthesia. 1998; 25(1):52-57
- Lascelles BD, Butterworth SJ, Waterman AE. Postoperative analgesic and sedative effects of carprofen and pethidine in dogs. Veterinary Record. 1994;134(8):187-91.
- Ambros B, Alcorn J, Duke-Novakovski T, Livingston A, Dowling PM. Pharmacokinetics and pharmacodynamics of a constant rate infusion of fentanyl (5 μg/kg/h) in awake cats. American Journal of Veterinary Research. 2014;75(8):716-21.
- Lee DD, Papich MG, Hardie EM. Comparison of pharmacokinetics of fentanyl after intravenous and transdermal administration in cats. American Journal of Veterinary Research. 2000;61(6):672-7.
- Davidson CD, Pettifer GR, Henry JD Jr. Plasma fentanyl concentrations and analgesic effects during full or partial exposure to transdermal fentanyl patches in cats. Journal of the American Veterinary Medicine Association. 2004;224(5):700-5.
- Robertson SA, Lascelles BDX, Taylor PM, Sear JW. PK-PD modeling of buprenorphine in cats: intravenous and oral transmucosal administration. Journal of Veterinary Pharmacology and Therapeutics. 2005;28(5):453-60.
- Slingsby LS, Murrell JC, Taylor PM. Combination of dexmedetomidine with buprenorphine enhances the antinociceptive effect to a thermal stimulus in the cat compared with either agent alone. Veterinary Anaesthesia and Analgesia. 2010;37(2):162-70.
- Giordano T, Steagall PV, Ferreira TH, Minto BW, de Sá Lorena SE, Brondani J, Luna SP. Postoperative analgesic effects of intravenous, intramuscular, subcutaneous or oral transmucosal buprenorphine administered to cats undergoing ovariohysterectomy. Veterinary Anaesthesia and Analgesia. 2010;37(4):357-66. d
- Steagall PV, Pelligand L, Giordano T, Auberger C, Sear JW, Luna SP, Taylor PM. Pharmacokinetic and pharmacodynamic modelling of intravenous, intramuscular and subcutaneous buprenorphine in conscious cats. Veterinary Anaesthesia and Analgesia. 2013;40(1):83-95.
- Catbagan DL, Quimby JM, Mama KR,. Comparison of the efficacy and adverse effects of sustained-release buprenorphine hydrochloride following subcutaneous administration and buprenorphine hydrochloride following oral transmucosal administration in cats undergoing ovariohysterectomy. American Journal of Veterinary Research. 2011;72:461–466.
- Taylor PM, Luangdilok CH, Sear JW. Pharmacokinetic and pharmacodynamic evaluation of high doses of buprenorphine delivered via high-concentration formulations in cats. Journal of Feline Medicine and Surgery. 2016;18(4):290-302.
- Al-Gizawiy MM, Rude P. Comparison of preoperative carprofen and postoperative butorphanol as postsurgical analgesics in cats undergoing ovariohysterectomy. Veterinary Anaesthesia and Analgesia, 2004;31: 164-174
- Sawyer DC, Rech RH. Analgesia and behavioral effects of butorphanol, nalbuphine and pentazocine in the cat. Journal of the American Animal Association 1987;23(4), 438-446
- Brondani JT, Luna SP, Marcello GC, Padovani CR. Perioperative administration of vedaprofen, tramadol or their combination does not interfere with platelet aggregation, bleeding time and biochemical variables in cats. Journal of Feline Medicine and Surgery. 2009;11(6):503-9.
- Pypendop BH, Siao KT, Ilkiw JE. Effects of tramadol hydrochloride on the thermal threshold in cats. American Journal of Veterinary Research. 2009;70(12):1465-70
- Evangelista MC, Silva RA, Cardozo LB, Kahvegian MA, Rossetto TC, Matera JM, Fantoni DT. Comparison of preoperative tramadol and pethidine on postoperative pain in cats undergoing ovariohysterectomy. BMC Veterinary Research. 2014;10:252.
- Indrawirawan Y, McAlees T. Tramadol toxicity in a cat: case report and literature review of serotonin syndrome. Journal of Feline Medicine and Surgery. 2014;16(7):572-8
- Pypendop BH, Ilkiw JE. Pharmacokinetics of tramadol, and its metabolite O-desmethyl-tramadol, in cats. Journal of Veterinary Pharmacology and Therapy. 2008;31(1):52-9
- Cagnardi P, Villa R, Zonca A, Gallo M, Beccaglia M, Luvoni GC, Vettorato E, Carli S, Fonda D, Ravasio G. Pharmacokinetics, intraoperative effect and postoperative analgesia of tramadol in cats. Research on Veterinary Science. 2011 Jun;90(3):503-9
- Schmitt H, Le Douarec JC, Petillot N. Antinociceptive effects of some a-sympathomimetic agents. Neuropharmacology 1974;13(5):289–94.
- Zhang Z, Ferretti V, Guntan I. Neuronal ensembles sufficient for recovery sleep and the sedative actions of a2 adrenergic agonists. Nature Neuroscience 2015;18(4):553–61.
- Slingsby LS, Taylor PM, Monroe T. Thermal antinociception after dexmedetomidine administration in cats: a comparison between intramuscular and oral transmucosal administration. Journal of Feline Medicine and Surgery 2009;11(10):829–34
- Duke T, Cox AMK, Remedios AM. The analgesic effects of administering fentanyl or medetomidine in the lumbosacral epidural space of cats. Veterinary Surgery 1994;23(2):143–8.
- Granholm M, McKusick BC, Westerholm FC, Aspegrén JC. Evaluation of the clinical efficacy and safety of dexmedetomidine or medetomidine in cats and their reversal with atipamezole. Veterinary Anaesthesia and Analgesia. 2006;33(4):214-23.
- Pypendop BH, Ilkiw JE. Relationship between plasma dexmedetomidine concentration and sedation score and thermal threshold in cats. American Journal on Veterinary Research 2014;75(5):446–52. 35.
- Yaksh TL. Pharmacology of spinal adrenergic systems which modulate spinal nociceptive processing. Pharmacology Biochemistry and Behaviour 1985;22(5):845–58.
- Yoshitomi Y, Kohjitani A, Maeda S. Dexmedetomidine enhances the local anesthetic action of lidocaine via an a-2A adrenoceptor. Anesthesia and Analgesia 2008; 107(1):96–101.
- Evangelista MC, Doodnaught GM, Fantoni DT. Sciatic and femoral nerve blockade using bupivacaine alone, or in combination with dexmedetomidine or buprenorphine in cats. Veterinary Record 2017;180(24):592–7.
- Abelson AL, McCobb EC, Shaw S, Armitage-Chan E, Wetmore LA, Karas AZ, Blaze C. Use of wound soaker catheters for the administration of local anesthetic for post-operative analgesia: 56 cases. Veterinary Anaesthesia and Analgesia. 2009;36(6):597-602.
- Lodge D, Anis NA, Burton NR. Effects of optical isomers of ketamine on excitation of cat and rat spinal neurones by amino acids and acetylcholine. Neuroscience Letters 1982;29:281–6
- Chizh BA, Headley PM. NMDA antagonists and neuropathic pain—multiple drug targets and multiple uses. Current Pharmaceutical Design 2005;11:2977–94.
- Bell RF, Dahl JB, Moore RA, et al. Perioperative ketamine for acute postoperative pain. Cochrane Database Systematic Reviews 2006;(1):CD004603.
- Davies SN, Lodge D. Evidence for involvement of N-methylaspartate receptors in ‘wind-up’ of class 2 neurones in the dorsal horn of the rat. Brain Research 1987;424:402–406.
- Dickenson AH, Sullivan AF. Evidence for a role of the NMDA receptor in the frequency dependent potentiation of deep rat dorsal horn nociceptive neurones following C fibre stimulation. Neuropharmacology 1987;26:1235–8.
- Wagner AE, Walton JA, Hellyer PW, Gaynor JS, Mama KR. Use of low doses of ketamine administered by constant rate infusion as an adjunct for postoperative analgesia in dogs. Journal of the American Veterinary Medicine Association. 2002;221(1):72-5
 by Multimédica
by Multimédica