Hipertensión en anestesia en pequeños animales: fisiología, medición, tipos de hipertensión, diagnóstico diferencial y manejo
Resumen breve
La hipertensión arterial en pequeños animales durante anestesia es mucho menos frecuente que la hipotensión, sin embargo, puede tener consecuencias significativas sobre diversos órganos y sobre el resultado quirúrgico. En este artículo se revisa su fisiología, detección, clasificación, causas subyacentes a través de su diagnóstico diferencial, y se ofrecen opciones de manejo durante la anestesia de pequeños animales.Índice de contenidos
Fisiología de la presión arterial
La hemodinámica vascular comienza con el corazón, que, bombeando sangre, creará una fuerza motora para todo el flujo de sangre en el cuerpo. Los ventrículos se contraen, expulsando la sangre a través de las arterias y venas del cuerpo, creando un caudal de sangre, llamado gasto cardiaco. El gasto cardiaco depende de la frecuencia cardiaca y la fracción de eyección (el volumen inicial del ventrículo después del llenado diastólico menos el volumen final del ventrículo después de la sístole).
Desde el punto de vista físico, la ley de Ohm aplicada al flujo de fluidos establece que el flujo equivale a la diferencia en gradiente de presión dividida por la resistencia vascular sistémica, expresado matemáticamente:
Flujo = ΔPresión/Resistencia1
Si despejamos la presión de la ecuación, tenemos que la presión arterial sistémica es el producto entre flujo sanguíneo y resistencia. Por lo tanto, traducido a términos hemodinámicos, la presión arterial sistémica es el producto del flujo sanguíneo que sale del corazón por minuto (gasto cardiaco) y la resistencia vascular sistémica (Figura 1). A su vez, el gasto cardiaco dependerá del volumen sistólico (volumen de sangre eyectada en cada latido), y el número de contracciones por minuto (frecuencia cardiaca). El volumen sistólico dependerá de cuánto volumen llega al corazón (precarga o retorno venoso), la fuerza de la contracción del corazón (contractilidad) y la resistencia que encuentra el ventrículo izquierdo a la eyección de la sangre por parte del sistema arterial (poscarga).
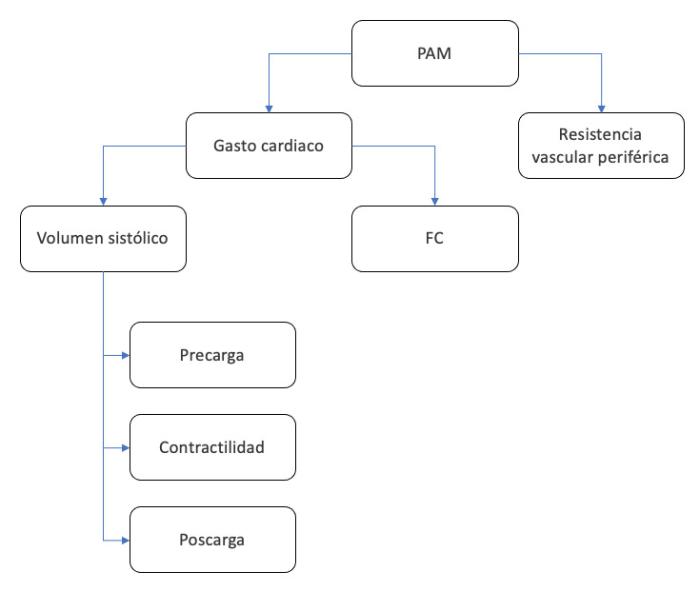
Figura 1. Componentes de la presión arterial. PAM: presión arterial media. FC: frecuencia cardiaca.
Un ejemplo del funcionamiento de estas relaciones fisiológicas serían las activaciones del sistema simpático. En situaciones de estrés (como el miedo o la nocicepción), la liberación de catecolaminas (adrenalina y noradrenalina), aumentan la contractilidad cardiaca, por un lado, lo que aumenta el gasto cardiaco y también provocan vasoconstricción, por otro lado, lo que aumenta la resistencia vascular periférica. Esto da como resultado un aumento en la presión arterial sistémica1.
Esta sangre llegará a los órganos y, dentro de ellos, perfundirá sus células con cierta presión: presión de perfusión. Esta presión de perfusión es la diferencia entre la presión con la que entra la sangre, y la presión con la que sale del órgano. Aunque la presión arterial media sistémica (PAM) se considera normalmente la presión con la que la sangre entra a los órganos, ésta puede tener una ligera variación en cada órgano, por ejemplo, en el hígado, la arteria hepática tiene una resistencia alta, por lo tanto, la presión arterial en esta arteria será 10-30 mmHg menor a la PAM. Tampoco la presión con la que sale la sangre es uniforme en todos los órganos, aunque en general se considere como el valor de presión venosa central (CVP), no siempre es así. Por ejemplo, en el caso del riñón, la presión de perfusión está influenciada por la presión intraabdominal. Si la presión intraabdominal (IAP) está elevada, la presión a la que se perfunde el riñón baja (será la diferencia entre PAMe IAP, en lugar de entre PAMy CVP)2.
Algunos órganos tienen la capacidad de autorregulación (regulan su flujo sanguíneo de forma local) que tiene el objetivo de mantener su flujo de sangre continuo a pesar de cambios en la presión de perfusión. Si, por ejemplo, una arteria que irriga un órgano se ocluye, la presión de perfusión de ese órgano disminuirá, por lo que el flujo de sangre disminuye. Los órganos que poseen autorregulación harán que el flujo sanguíneo vuelva a la normalidad en unos minutos para restaurar la perfusión. Este mecanismo de autorregulación ocurre mediante vasodilatación y vasoconstricción de arteriolas propias de cada órgano, por lo que no necesita de factores neuronales u hormonales sistémicos, aunque puede verse modificada por ellos. Es muy importante saber que este mecanismo de autorregulación solamente es capaz de funcionar en unos rangos de presión arterial sistémica. En general, por debajo de 50-70 mmHg de presión de perfusión, los mecanismos de autorregulación dejan de funcionar y el flujo sanguíneo disminuirá dentro de los órganos. Se cree que los márgenes de presión arterial sistémica entre los que funciona la autorregulación son de 65 a 150 mmHg de presión arterial media (Figura 2), pero pueden variar dependiendo del tejido y de la existencia o no de hipertensión crónica3,4.
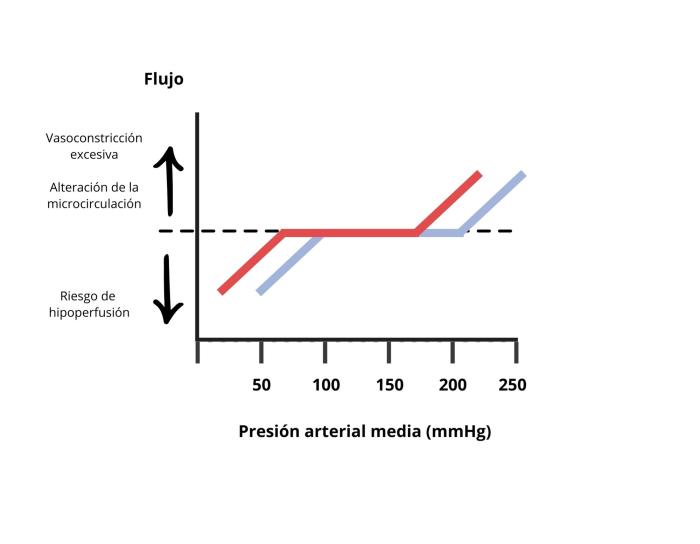
Figura 2. Diagrama que muestra cómo los mecanismos de autorregulación de algunos órganos hacen que su flujo sanguíneo sea constante independientemente de la presión arterial media sistémica (PAM), dentro de unos valores concretos de PAM. Fuera de estos valores, la PAM excesiva hace que aumente el flujo sanguíneo al tejido por la vasoconstricción excesiva, y la microcirculación se vea alterada. La PAM más baja hace que el flujo sanguíneo sea insuficiente, lo que conlleva riesgo de hipoperfusión a los tejidos. En el caso de hipertensión (línea azul) estos valores se ven desplazados a la derecha.
En caso de hipotensión sistémica, el reflejo baroreceptor provocará una vasoconstricción generalizada a través de una activación simpática. Para que esta vasoconstricción no disminuya el flujo de sangre al cerebro y al miocardio, los mecanismos de autorregulación actuarán de forma local en esos órganos. Sin embargo, si la presión arterial sistémica cae por debajo del margen de autorregulación, estos mecanismos no podrán actuar compensando la caída en flujo de sangre y aporte de oxígeno.
Diferentes órganos tienen diferentes grados de autorregulación. La circulación renal, cerebral y coronaria tienen una alta capacidad de autorregulación, mientras el músculo esquelético y la circulación esplácnica tienen una capacidad moderada. La circulación cutánea tiene muy poca, o ninguna capacidad de autorregulación. Estas diferencias se pueden explicar por las diferentes concentraciones en receptores alfa-adrenérgicos presentes en los diferentes tejidos. La piel y el músculo esquelético tienen una concentración alta de estos receptores, por lo que experimentan una vasoconstricción intensa en un shock circulatorio. El intestino tiene menos de estos receptores, y los riñones aún menos. Corazón y cerebro tienen una cantidad mínima. Por lo tanto, en caso de hipotensión sistémica severa, el flujo de sangre se derivará de la piel, los músculos esqueléticos que no se estén ejercitando, y las vísceras abdominales hacia el cerebro, corazón y riñones para asegurar su entrega de oxígeno2.
En el caso de la hipertensión sistémica, también podemos estar fuera de los límites de autorregulación de diferentes órganos. Independientemente de la causa de hipertensión, si se mantiene en el tiempo, sus consecuencias en el cuerpo son importantes. Por un lado, el corazón sufrirá un exceso de carga, ya que intentará eyectar la sangre frente a esta resistencia vascular aumentada, por lo que puede sufrir hipertrofia. Por otro lado, el aumento de presión en los vasos también puede causar accidentes vasculares1.
Hipertensión: definición
En primer lugar, hay que distinguir entre el paciente con hipertensión crónica y el paciente que experimenta un aumento agudo de la presión arterial en el periodo perioperatorio.
- La hipertensión crónica está definida como el aumento de presión arterial sistémica por encima de 160 mmHg, según las guías del Colegio Americano de Medicina Interna veterinaria (ACVIM) publicadas en 20185.
- Con respecto a la hipertensión aguda, no existe un consenso o guía respecto a su definición ni valores. También se ha definido como un aumento agudo de la presión arterial sistólica por encima de los 160 mmHg6,7 o una media por encima de 120 mmHg6. De forma general, está aceptado mantener una presión arterial media de 60 a 140 mmHg durante la anestesia8.
La medición de la presión arterial
La medición de presión arterial es el indicador clínico de perfusión más fiable de los que disponemos habitualmente en clínica, a pesar de que no es un indicador directo de gasto cardiaco. La medición de presión arterial está recomendada en pequeños animales como parte de la monitorización básica durante anestesia en las guías de anestesia y monitorización en perros y gatos de la American Animal Hospital Association (AAHA)7.
La presión arterial puede monitorizarse de forma invasiva (catéter arterial) o no invasiva (oscilometría y Doppler). La medición arterial invasiva es el método más fiable y, a diferencia de los métodos no invasivos, nos ofrece la monitorización continua de la presión arterial, por lo que se pueden apreciar rápidamente cambios cardiovasculares. También pueden ofrecer la opción de medición de indicadores dinámicos de la respuesta a fluidos y tener acceso sencillo a muestras de sangre arterial para gasometría. El uso de presión arterial invasiva está indicado en animales inestables hemodinámicamente, con alto riesgo anestésico, con hipertensión severa, que requieran soporte vasopresor o que estén en ventilación mecánica por largo tiempo.
Los componentes de un sistema de medición de presión arterial invasiva están ilustrados a continuación (Figura 3A). La colocación de un catéter arterial está contraindicada en problemas de coagulación, infección o quemaduras en la zona9. Además, conlleva ciertos riesgos (infección10 como necrosis distal de la extremidad o cola en gatos11,12, inyección accidental de medicación o pérdida de sangre por desconexión13) por lo que no siempre está justificado su uso14.
Para que las mediciones sean fiables, el transductor de presión debe estar colocado a la altura de la base del corazón del animal (Figura 3B), y se debe calibrar (hacer el cero) para descontar la presión atmosférica. Si el transductor no está colocado a la altura adecuada, cada 10 cm por debajo del nivel del corazón añadirán 7.5 mmHg falsamente a la medida de la presión arterial. Para calibrar el transductor se debe colocar la llave de tres vías que acompaña al transductor de presión con la posición cerrada hacia el paciente, dejando la parte que da a la atmósfera sin tapar (Figura 3C), y presionando el botón de cero en el monitor9.
Con respecto a la fiabilidad de la medición, la onda que obtenemos en el monitor puede estar modificada por la atenuación de la energía de la presión del pulso dando lugar a dos artefactos (Figura 4). Cuando se pierde energía en el sistema debido a fricción o resistencia, tenemos como resultado una onda amortiguada u over-damped. Esto ocurre, por ejemplo, con la colocación de llaves de tres vías, burbujas de aire, coágulos, tubos muy largos, cánulas o extensiones dobladas. Esta onda tendrá menos detalle, puede incluso perder el nodo dicrótico y nos dará una infravaloración de la presión arterial sistólica, una valoración falsamente alta de la diastólica, y la media seguirá siendo fiable. En el fenómeno contrario, la onda resonante (under-damped), la presión del pulso gana energía dentro del sistema de medición, con lo cual la presión arterial sistólica está sobreestimada, la diastólica está infraestimada, y la media no se modifica. Las razones más comunes que producen este tipo de onda son transductores defectuosos o conexiones demasiado rígidas15. En situaciones en las que no sabemos cómo de amortiguada está la onda, lo más fiable es guiarnos por la presión arterial media, que no se modifica con la amortiguación.
Para saber si el sistema tiene un nivel óptimo de amortiguación, se utiliza el test de onda cuadrada o test de lavado (fast-flush test), que consiste en hacer flushing del sistema (desde el transductor, ya sea activando el sistema de lavado, o mediante una jeringa en la llave de tres vías), que generará una onda cuadrada en el monitor (Figura 3D). Al volver a mostrar la onda del pulso, aparecerán unas oscilaciones después de la onda cuadrada. Estas oscilaciones pertenecen a las características físicas del sistema. En un sistema adecuadamente amortiguado (donde la onda no está ni muy amortiguada, ni es resonante) deberíamos ver una o dos oscilaciones antes de la vuelta a la línea del pulso (Figura 5). En un sistema amortiguado se ven menos oscilaciones y, en un sistema resonante, se ven más.
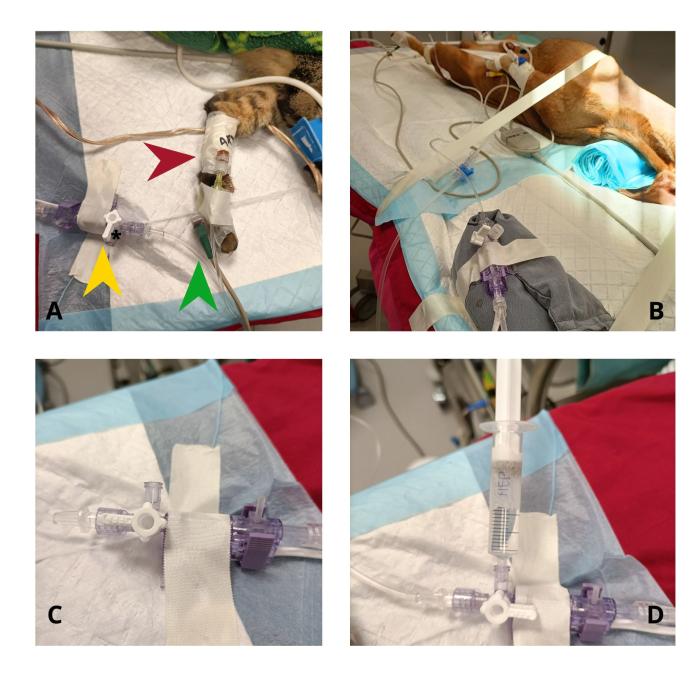
Figura 3. (A) Componentes de un sistema de medición de presión arterial invasiva: catéter arterial (flecha roja), extensión con suero salino (flecha verde) y transductor de presión (flecha amarilla). El transductor puede estar conectado a una jeringa para hacer lavados, o a un sistema de suero con una bolsa de presión que genera un flujo continuo de lavado. (B) Colocación del transductor de presión a nivel de la base del corazón (aproximadamente el nivel del esternón) en un animal en recumbencia dorsal. (C) Posición de la llave de tres vías en el transductor para hacer el cero. (D) Uso de una jeringa con suero para hacer el test de lavado.
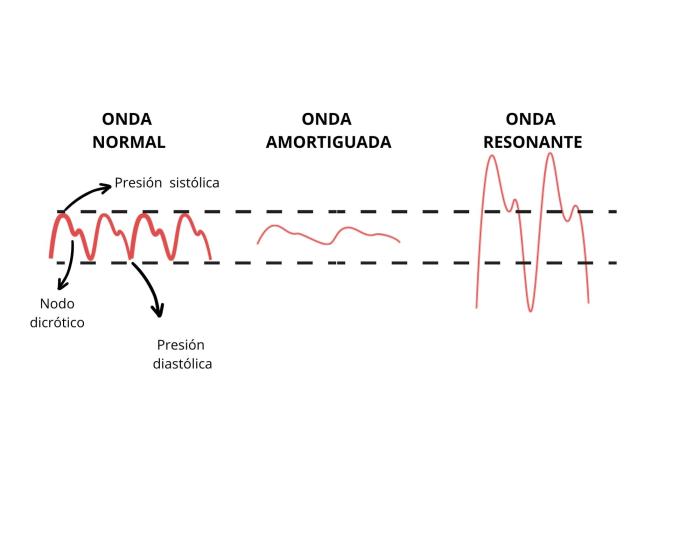
Figura 4. Onda de la presión arterial invasiva cuando sufre amortiguación y resonancia.
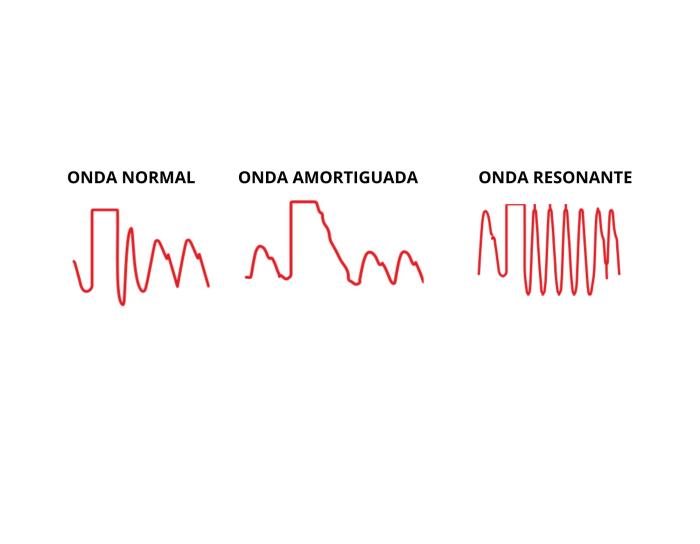
Figura 5. Resultados del test de lavado según si la onda de presión es normal, está amortiguada o es resonante.
Respecto a la oscilometría, para su correcto funcionamiento, el tamaño del manguito en su parte más corta debería ser aproximadamente un 40 % de la circunferencia de la extremidad en el lugar en el que se pone (Figura 6). Un manguito demasiado grande dará lugar a una presión artefactualmente más baja y, al contrario, un manguito demasiado pequeño no podrá ocluir la arteria adecuadamente y dará lugar a mediciones más altas de las reales. La medida más cercana a la de la presión invasiva (el método más fiable) suele ser la PAM, ya que es el parámetro estimado; mientras que la sistólica y la diastólica son calculados a partir de ésta en la mayoría de aparatos14, por el contrario, la oscilometría de alta definición (HDO) estima las tres medidas14, sin embargo, no está claro que sea más precisa que la oscilometría tradicional16.
El Doppler estima generalmente la presión arterial sistólica, pero puede darnos un valor más cercano a la presión arterial media, especialmente, en gatos. Su fiabilidad disminuye en pacientes con vasoconstricción periférica ya que la señal será menos audible14.
A pesar de la potencial inexactitud de los métodos no invasivos, éstos pueden ser útiles para detectar cambios relativos durante la anestesia17. En general, los métodos indirectos son menos fiables en extremos de presión (animales hipotensos o hipertensos)14, por lo tanto, en animales que tienen hipertensión crónica o pueden sufrir extremos de presión, estaría indicado el uso de presión arterial invasiva.
Hipertensión crónica perianestésica
La hipertensión crónica altera los mecanismos de autorregulación de la presión arterial existentes en el cerebro y en el riñón, de manera que van a actuar en un rango de valores de presión arterial media sistémica más altos (Figura 2). Esto ocurre por medio de una disminución de la sensibilidad de los barorreceptores18. Por lo tanto, en personas, se recomienda que la normalización de la hipertensión crónica sea lenta (24-48 h) para permitir un reajuste de estos mecanismos de autorregulación19.
En la medida de lo posible, la hipertensión crónica debe ser investigada y tratada antes de la anestesia. Si no se encuentra una causa subyacente, la hipertensión será clasificada como primaria. La hipertensión secundaria se debe a la presencia de una causa subyacente que provoca un cambio en el gasto cardiaco o en la resistencia vascular sistémica elevando la presión arterial17. Causas comunes de hipertensión secundaria en pequeños animales son: enfermedad renal crónica, hipertiroidismo e hiperadrenocorticismo. Otras causas menos comunes son: feocromocitoma, policitemia, diabetes mellitus, aumento de presión intracraneal e hipercolesterolemia. Hay fármacos que pueden producir aumento en la presión arterial como: corticoides, ciclosporina, fenilpropanolamina, eritropoyetina, agonistas alfa 1 y beta 1. Algunos tóxicos que aumentan la presión arterial son la toxicidad por plomo, por sal y por vitamina D17.
En cualquier animal con hipertensión debe determinarse si existe lesión en órganos diana, principalmente corazón, riñones, ojos y cerebro.
Si anestesiamos un paciente con hipertensión arterial crónica preexistente, deberemos mantener los valores de presión arterial por encima de lo normal, ya que sus mecanismos de autorregulación dejarán de funcionar a presiones más altas que en pacientes normotensos (su rango de presión arterial media para la autoregulación estará desplazado hacia la derecha en la Figura 2). En medicina humana, se recomienda mantener la presión arterial dentro del 20 % de los valores preoperatorios en este tipo de pacientes20. No existen recomendaciones concretas para el manejo anestésico de pacientes veterinarios con hipertensión crónica. En general, en la literatura veterinaria se recomiendan medidas extrapoladas de las guías de tratamiento de medicina humana, como por ejemplo la evaluación de la magnitud de la hipertensión preoperatoria, la evaluación del daño en órganos diana, la administración de tratamiento antihipertensivo y una monitorización exhaustiva de la presión arterial durante anestesia17.
Si el paciente ya está en tratamiento, según las guías de anestesia y monitorización en perros y gatos de la American Animal Hospital Association (AAHA) publicadas en 2020, la administración de inhibidores de la enzima convertidora de angiotensina (enalaprilo y benaceprilo) debe ser cesada el día de la anestesia para evitar hipotensión intraoperatoria al sumarse su efecto con el efecto vasodilatador del isoflurano7.
Hipertensión aguda perianestésica
Un aumento de presión arterial de forma aguda aumenta la carga sobre el corazón, aumentando el consumo de oxígeno por parte del miocardio y alterando la eficiencia con la que lo consume, lo cual puede resultar en isquemia y fallo cardiaco21. La hipertensión intraquirúrgica también aumenta el riesgo de sangrado quirúrgico22 y de accidentes vasculares cerebrales.23
Ante la complicación de hipertensión aguda perianestésica, debemos establecer un diagnóstico diferencial24:
- Nocicepción: es una de las causas más frecuentes. Normalmente la hipertensión está acompañada de un aumento de frecuencia cardiaca y respiratoria, o vemos que el animal lucha contra el ventilador.
- Plano superficial: veremos los mismos signos que en el punto anterior, pero acompañados de un aumento de tono mandibular, reflejo palpebral positivo y/o movimiento del animal.
- Iatrogénico
- Fármacos: dobutamina, dopamina, fenilefrina, adrenalina, noradrenalina, ketamina.
- Sobrecarga de fluidos.
- Activación simpática:
- Hipercapnia.
- Hipoxemia.
- Hipotermia20.
- Manipulación quirúrgica o durante la preparación prequirúrgica: la hipertensión puede resolver tras cesar la manipulación o puede requerir tratamiento.
- Adrenales: liberación de catecolaminas, ya sea de adrenales normales, o de tejido neoplásico (feocromocitomas), que puede incluso ser ectópico25.
- Tiroides: se cree que las hormonas tiroideas aumentan la activación del eje renina-angiotensina-aldosterona26.
- Tormenta tiroidea: expresión extrema de tirotoxicosis que da lugar a una descompensación multiorgánica. Es una entidad bien reconocida en medicina humana, pero en animales sólo ha sido reportada en un gato hipertiroideo durante anestesia para una tiroidectomía27 y en un perro eutiroideo25. En el primer caso, la crisis hipertensiva ocurrió 3 días después de la cirugía y fue manejada con amlodipino. El diagnóstico se hace a partir de los signos clínicos ya que, muy frecuentemente, los análisis laboratoriales, incluyendo hormonales, no están alterados.
- Paragangliomas o quemodectomas: neoplasias de células neuroepiteliales que se encuentran en los cuerpos aórticos y carotídeos, nervio vago y médula adrenal, algunos son capaces de liberar catecolaminas.
- Posoperatoria tras craneotomía: activación simpática, normalmente 10-20 minutos tras cirugías, dura hasta 4 horas. La causa de esta hipertensión no se ha determinado aún28.
Respecto al manejo anestésico de la hipertensión aguda, se recomienda un abordaje sistemático:
- Descartar artefacto:
- Medición invasiva: comprobar si el transductor está bien nivelado con la base del corazón.
- Medición no invasiva: comprobar colocación y tamaño del manguito.
- Mirar frecuencia y ritmo cardiacos:
- Taquicardia: descartar analgesia inadecuada / estimulación simpática.
- Bradicardia:
- Aumento presión intracraneal:
- Manitol: 0.5-2 mg/kg intravenoso (IV) lento en 20 minutos, no recomendado en caso de hemorragia cerebral, fallo cardiaco congestivo o edema pulmonar29.
- Respuesta a alfa-2 agonistas.
- Reflejo baroreceptor por liberación de catecolaminas o manipulación quirúrgica.
- Aumento presión intracraneal:
- Considerar parar y/o antagonizar vasoconstrictores:
- Atipamezol
- Dosis en perros: 5 veces la dosis de medetomidina, 10 veces la dosis de dexmedetomidina administrada30.
- Dosis gato: 2.5 veces la dosis de medetomidina, 5 veces la dosis de dexmedetomidina administrada30.
- Si no se conoce la dosis (por ejemplo, en caso de infusión de alfa 2 agonistas): 100 mcg/kg31.
- Parar infusiones de dobutamina, dopamina, fenilefrina, adrenalina, noradrenalina, ketamina.
- Atipamezol
- Asegurar un plano anestésico adecuado.
- Asegurar analgesia adecuada:
- Fármacos: opioides, lidocaína (en perros). Evitar ketamina por su efecto hipertensivo.
- Posición cuerpo en pacientes geriátricos (codos, cadera).
- Considera administrar vasodilatadores: las infusiones (puntos 6c-6g) tienen la ventaja de un efecto rápido, que se puede controlar variando la velocidad, y que termina rápidamente una vez cesada la administración.
- Aumentar isoflurano espirado deliberadamente.
- Acepromacina 5-10 mcg/kg IV: antagonismo de receptores alfa-1, no reversible y larga duración (4-6 horas).
- Magnesio: efecto vasodilatador directo por antagonismo del calcio, reducción de la sensibilidad a catecolaminas e inhibición de la liberación de catecolaminas por la médula adrenal. Bolos de 40-50 mg/kg en 10 minutos seguidos de infusión a 15 mg/kg/h32.
- Fentolamina: bloqueo de receptores alfa de corta duración. Bolo de carga de 0.1 mg/kg IV seguido de infusión a 1-2 mcg/kg/min33.
- Nitroprusiato: vasodilatador arterial y venoso, reduce precarga y poscarga. Dosis de infusion de 0.1-10 mcg/kg/min IV, fotosensible, proteger de la luz33.
- Labetalol: beta y alfa bloqueante. De elección tras cirugía intracraneal ya que no afecta a la presión intracraneal. Dosis: 0.2 mg/kg-0.4 mg/kg en bolo, seguido de 0.2-3 mg/kg/h en infusión34.
- Urapidilo: bloqueo de receptores alfa y beta. Dosis: 0.35 mg/kg IV, seguida de infusión de 0.05 mg/kg/h a 0.3 mg/kg/h32.
Conclusiones
La comprensión profunda de la fisiología y las causas de la hipertensión durante la anestesia en pequeños animales puede evitar complicaciones graves que afecten a la recuperación. Este artículo destaca la importancia de un enfoque sistemático proporcionando a los veterinarios herramientas prácticas para afrontar este desafío clínico.
Bibliografía
- Pollock JD, Murray IV, Bordes SJ, Makaryus AN. Physiology, cardiovascular hemodynamics. StatPearls Publishing. 2023 Jan.
- Kato R, Pinsky MR. Personalizing blood pressure management in septic shock. Annals of Intensive Care. 2015. 5:41
- Badin J, Boulain T, Ehrmann S, Skarzynski M, Bretagnol A, Buret J, BEnzekri-Lefevre D, Mercier E, Runge I, Garot D, Mathonnet A, Dequin PF, Perrotin D. Relation between mean arterial pressure and renal function in the early phase of shock: a prospective, explorative cohort study. Crit Care.2011. 15(3): R135.
- Antonelli M, Levy M, Andrews PJ, Chastre J, Hudson LD, Manthous C, Meduri GU, Moreno RP, Putensen C, Stewart T, Torres A. Hemodynamic monitoring in shock and implications for management. International Consensus Conference, Paris, France, 27-28 April 2006.Intensive Care Med.2007. 33:575–590.
- Acierno MJ, Brown S, Coleman A et al. ACVIM consensus statement: Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats J Vet Intern Med. 2018;32:1803–1822.
- McMillan; BSAVA Cognitive Aids for Anaesthesia in small animal practice BSAVA 2020, pp 44-45.
- Grubb T, Sager J, Gaynor JS, Montgomery E, Parker JA, Shafford H, Tearney C. 2020 AAHA anaesthesia and monitoring guidelines for dogs and cats. JAAHA. 2020. 56:2 Mar, Apr.
- Chambers D, Huang C, Matthews G. Arterial system. In: Chambers D, Huang C, Matthews G, editors. Basic physiology for anaesthetists, 2nd ed. Cambridge University Press; 2019. pp. 148–54.
- Beard L, Ashton-Cleary D. Blood pressure measurement. In: Maths, Physics and Clinical Measurement for anaesthesia and Intensive Care. Ebrahim H. 1st edn. Cambridge university press, Cambrige, UK, 2020, pag 159-173.
- Barr ED, Clegg PD, Senior JM, Singer ER. Destructive Lesions of the Proximal Sesamoid Bones as a Complication of Dorsal Metatarsal Artery Catheterization in Three Horses. Veterinary Surgery. 2005. 34:159–166.
- Bowlt KL, Bortolami E,Harley R,Murison M,Wallace A. Ischaemic distal limb necrosis and Klebsiella pneumoniae infection associated with arterial catheterisation in a cat. J Feline Med Surg Case Reports. 2013 Dec;15(12):1165-8.
- Mooshian S, Deitschel SJ, Haggerty JM, Guenther CL. Incidence of arterial catheter complications: a retrospective study of 35 cats (2010–2014). Journal of Feline Medicine and Surgery. 2019. Vol. 21(2) 173–177.
- Summerfield N. Arterial lines: why, when, how? The Veterinary Nurse. 2019. March, vol 10, 2.
- Skelding A, Valverde A. Non–invasive blood pressure measurement in animals: Part 1 - Techniques for measurement and validation of non-invasive devices. Can Vet J. 2020. 61:368–374.
- Saugel B, Kouz K, Meidert AS, Schulte-Uentrop, Romagnoli L. How to measure blood pressure using an arterial catheter: a systematic 5-step approach. Critical Care (2020) 24:172.
- Skelding A, Valverde A. Review of non–invasive blood pressure measurement in animals: Part 2 — Evaluation of the performance of non-invasive devices. CVJ 2020. May Vol 61.
- Congdon JM. Chapter 1: cardiovascular Disease in Canine and feline anesthesia and co-existing disease. Editors Johnson RA, Snyder LBC, Schroeder CA. 2nd edition. 2022. Wiley Blackwell. pp 52.
- Foëx P,Sear JW. Hypertension: pathophysiology and treatment, Continuing Education in Anaesthesia Critical Care & Pain, Volume 4, Issue 3, June 2004, Pages 71–75.
- Prisant LM, Carr AA, Hawkins DW. Treating Hypertensive Emergencies. Controlled Reduction of Blood Pressure and Protection of Target Organs. Postgrad Med 1993; 93:92-6, 101-4, 108-10.
- Daabiss MA, Perioperative hypertensive crisis - the anaesthetic implications. A Review of Literature. BJMP. 2016;9(3):a922.
- Laine H,Katoh C,Luotolahti M,Yki-Järvinen H,Kantola I, Jula A,Takala TO,Ruotsalainen U,Iida H,Haaparanta M,NuutilaP, Knuuti J Myocardial Oxygen Consumption Is Unchanged but Efficiency Is Reduced in Patients With Essential Hypertension and Left Ventricular Hypertrophy. Circulation. 1999. 100:2425–243.
- Guay J. Postoperative pain significantly influences postoperative blood loss in patients undergoing total knee replacement. Pain Med. 2006;7(6):476–82.
- Mashour GA, Shanks AM, Kheterpal S. Perioperative stroke and associated mortality after noncardiac, nonneurologic surgery. Anesthesiology. 2011;114(6):1289–96.
- Paix AD, Runciman WB, Horan BF, Chapman MJ, Currie M. Crisis management during anaesthesia: hypertension. Qual Saf Health Care. 2005; 14:12–8.
- Lee A, Won Shin C, Son WG, Kim J, Jo SM, Kim J, Lee I. Anesthesia Case of the MonthJ Am Vet Med Assoc. 2017 Jun 15;250(12):1379-1385.
- Danzi S, Klein I.Thyroid disease and the cardiovascular system.Endocrinol Metab Clin North Am. 2014.43:517–28. 10.1016/j.ecl.2014.02.005
- Potter JJ, Cook J, Meakin LB. Suspected thyroid storm in a cat anaesthetized for bilateral thyroidectomy. Veterinary Record Case Reports 2020;8: e000895.
- Olsen KS, Pedersen CB, Madsen JB, Ravn LI, Schifter S. Vasoactive modulators during and after craniotomy: relation to postoperative hypertension. J Neurosurg Anesthesiol. 2002;14(3):171–9.
- Ian Ramsey. BSAVA small animal formulary. 6a edición. 2008, UK.
- Dugdale appendix A: canine emergency drug doses. In Veterinary Anaesthesia: Principles to Practice. 2nd edition. Dugdale AH, Beaumont G, Bradbrook C, Gurney M. 2020 Wiley.
- Fletcher DJ, Boller M, Brainard BM, Haskins SC, Hopper K, McMichael M, Rozaski EA, Rush JE, Smarick SD. RECOVERevidence and knowledge gap analysis on veterinary CPR. Part 7:Clinical guidelines. Journal of Veterinary Emergency and Critical Care 22(S1) 2012, pp S102–S131.
- Gámez Maidanskaia K,, Spadavecchia C, Vincenti S, MirraA. Anaesthetic Management of a Labrador Retriever Undergoing Adrenalectomy for Phaeochromocytoma Excision, a Case Report Front Vet Sci. Case Reports 2022 Mar 16:9:789101.
- Garcia-Pereira F. Physiology, pathophysiology and anesthetic management of patients with gastrointestinal and endocrine disease. In: Veterinary Anesthesia and Analgesia, the fifth edition of Lumb and Jones. Grimm KA, Lamont LA, Tranquilli W, Greene SA, Robertson SA. Wiley 2015.USA. Pp 627-677.
- Zublena F, de Gennaro C, Corletto F. Retrospective evaluation of labetalol as antihypertensive agent in dogs. 2020. BMC Veterinary Research; 16:256.
 by Multimédica
by Multimédica