Hipoxemiaen el periodo anestésico y perianestésico en pequeños animales
Resumen breve
La entrega de oxígeno a los tejidos es vital para la supervivencia celular. La hipoxemia representa una complicación grave durante la anestesia o periodo perianestésico. Como cualquier signo clínico, se debe instaurar un diagnóstico diferencial para poder llegar a la causa y corregirla, ya que sus consecuencias pueden ser muy graves para la vida del animal. A través de la fisiología se pueden entender los puntos críticos donde se puede producir una disminución anormal de sus niveles, constituyendo…Índice de contenidos
Resumen
La entrega de oxígeno a los tejidos es vital para la supervivencia celular. La hipoxemia representa una complicación grave durante la anestesia o periodo perianestésico. Como cualquier signo clínico, se debe instaurar un diagnóstico diferencial para poder llegar a la causa y corregirla, ya que sus consecuencias pueden ser muy graves para la vida del animal. A través de la fisiología se pueden entender los puntos críticos donde se puede producir una disminución anormal de sus niveles, constituyendo el punto de partida para establecer un diagnóstico diferencial para conocer la causa, y proceder al manejo clínico adecuado para que vuelva a sus niveles fisiológicos.
Introducción
La hipoxemia se define como una disminución de la presión parcial de oxígeno arterial (PaO2) por debajo de 60 mmHg1. Las células necesitan el aporte de oxígeno para su metabolismo, por lo tanto, uno de los objetivos clave del anestesista es asegurar una entrega de oxígeno suficiente a los tejidos durante la anestesia y el periodo perianestésico para minimizar morbilidad y mortalidad.
Recuerdo fisiológico
Es importante distinguirlo de la hipoxia, aunque a veces los términos se utilicen de forma intercambiable:
- Hipoxia: baja concentración de oxígeno en los tejidos, la aportación de oxígeno a los tejidos no es suficiente para el metabolismo celular normal.
- Hipoxemia: se refiere a la presión parcial de oxígeno en sangre arterial (PaO2) específicamente.
El metabolismo aeróbico es la forma más eficiente que tienen las células para producir energía. El viaje que emprende el oxígeno desde la atmósfera a los tejidos tiene varias etapas que pueden seguirse para identificar las causas de hipoxemia. Estas etapas se llaman la cascada del oxígeno, reflejando que el oxígeno sigue su gradiente, de un ambiente con alta presión parcial (atmósfera), a uno de baja presión parcial (los tejidos) (Figura 1).
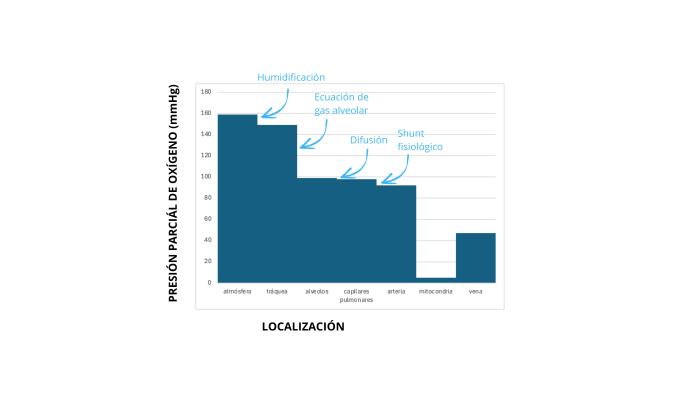
Etapas de la cascada de oxígeno:
1- Aire atmosférico:la presión parcial es la más alta en este punto (dependerá de la altitud con respecto al nivel del mar). La presión dependerá de la FiO2 (fracción inspirada de oxígeno) y de la presión atmosférica.
2- Aire traqueal humidificado:el aire que entra a las vías respiratorias se humidifica, lo que reduce ligeramente la presión parcial de oxígeno.
3- Gas alveolar:en los alvéolos, la presión parcial de oxígeno desciende debido a la presencia de dióxido de carbono (CO2)según la fórmula de gas alveolar. Aun así, el oxígeno difunde hacia los capilares pulmonares a favor de gradiente porque por estos circula sangre desoxigenada (Fórmula 1).
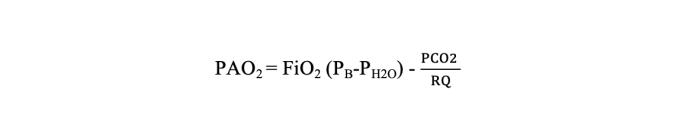
4- Sangre arterial:cuando el oxígeno llega a la sangre arterial desde los alveolos, hay una pérdida fisiológica del 2-5% debido al shunt anatómico (sangre que fluye en la circulación pulmonar desde las arterias hacia las venas sin pasar por los alveolos pulmonares) como la circulación bronquial, las venas de Tebesio o venas cardiacas menores que drenan el miocardio.
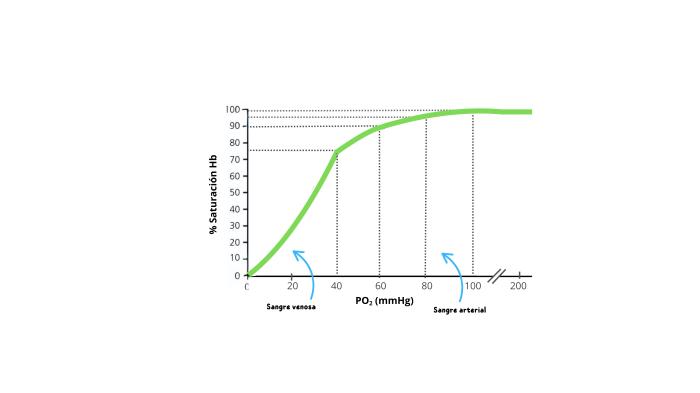
Una vez en la sangre, la mayoría del oxígeno a mayoría se une a la hemoglobina presente en los glóbulos rojos. El resto del oxígeno una vez que la hemoglobina está saturada, viajará disuelto en el plasma. Según la ley de Henry, la cantidad de oxígeno disuelto en el plasma es proporcional a la presión parcial de oxígeno y su coeficiente de solubilidad. Como consecuencia, la saturación de oxígeno de la hemoglobina arterial depende de la presión parcial de oxígeno disuelta (PaO2) en la sangre. Su relación se expresa por la curva de disociación de la oxihemoglobina (Figura 2).
La cantidad de oxígeno presente en la sangre arterial se puede calcular con la fórmula de contenido arterial de oxígeno (Fórmula 2).
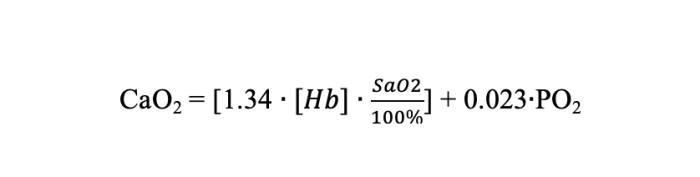
En esta fórmula la cantidad de oxígeno unido a hemoglobina sería la contenida en los corchetes, en situación fisiológica es mayor que la disuelta, que es la que se encuentra fuera de los corchetes.
5- Tejido periférico:desde la sangre arterial, el oxígeno se difunde a los tejidos del cuerpo. Este paso dependerá del gasto cardiaco.
6- Mitocondrias:finalmente, el oxígeno llega a las mitocondrias, donde es utilizado en la respiración aeróbica para generar energía celular, alcanzando la presión de oxígeno más baja de toda la cascada.
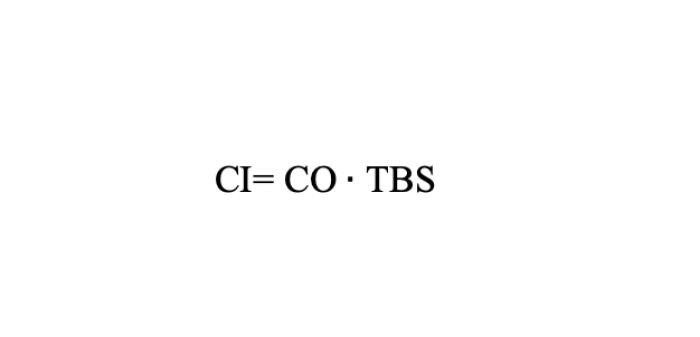
La entrega de oxígeno a los tejidos (DO2) depende de la CaO2 y del gasto cardiaco (índice cardiaco o CI si se tiene en cuenta la superficie corporal) según las siguientes fórmulas 3-4.
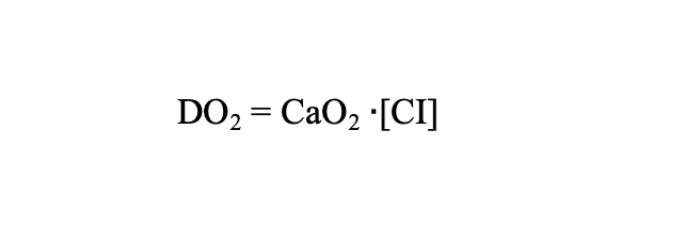
Identificación de la hipoxemia
Evaluación visual
La presencia de mucosas ligeramente grises a azules (cianosis) indican la presencia de sangre desoxigenada en los tejidos. Para que el ojo humano pueda observar cianosis, un mínimo de 5g/dl de hemoglobina desoxigenada debe estar presente lo cual corresponde a niveles menores del 80 % de saturación de la hemoglobina con oxígeno (SaO2), lo cual es un nivel de hipoxemia moderada (Tabla1).
Tabla 1. Grados de severidad de hipoxemia y sus saturaciones de oxígeno correspondientes2. PaO2: presión parcial de oxígeno en sangre arterial. SaO2: porcentaje de saturación de hemoglobina arterial con oxígeno.
| Estado de hipoxemia | PaO2 | SaO2 |
|---|---|---|
| No hipoxemia (normoxemia) | 80-100 mmHg | 95-98 % |
| Hipoxemia leve | 60-80 mmHg | 90-95 % |
| Hipoxemia moderada | 40-60 mmHg | 75-90 % |
| Hipoxemia severa | 20-40 mmHg | 32-75 % |
Es una medida poco sensible de oxigenación ya que depende de la capacidad visual del observador, de la concentración local de hemoglobina desoxigenada y de la luz ambiental. Como depende en gran medida de la concentración de hemoglobina, un animal con anemia puede estar hipoxémico sin mostrar cianosis porque la poca hemoglobina presente estaría saturada con oxígeno incluso si este es escaso. La vasoconstricción periférica (p. ej., la producida por alfa-2 agonistas) puede producir cianosis periférica ya que la sangre periférica disminuye su flujo, dando más tiempo a los tejidos a extraer el oxígeno, resultando en más hemoglobina desaturada en esos capilares3.
Pulsioximetría
Aporta una medida de SpO2 (saturación periférica de oxígeno) en %. Usa la ratio de absorción de luz roja e infrarroja de los elementos pulsátiles del tejido donde se coloca la sonda. Su tecnología combina espectrofotometría con fotopletismografía basándose en las variaciones cíclicas en volumen sanguíneo4 de manera que puede dar también un valor de frecuencia del pulso. La curva pletismográfica que muestra tiene la ventaja de permitir distinguir artefactos, e incluso estados hemodinámicos. Tiene las ventajas de ser una medición no invasiva en tiempo real. Normalmente tienen una precisión del 2 %. Es importante conocer las causas de artefacto:
- Luz ambiental.
- Movimiento.
- Baja perfusión: por enlentecimiento del flujo de sangre en los capilares, que provoca una tasa de extracción más alta de los tejidos, y más presencia de hemoglobina desoxigenada, típico en alfa 2 agonistas5.
- Tejido demasiado grueso.
- Mal ajuste de la sonda (“efecto Penumbra”).
- Extremos de frecuencia cardíaca.
- Especie: más fiable por este orden en perros, caballos, y gatos, por diferencias en reflectancia.
- Gran cantidad de hemoglobina anormal:
- Monóxido de carbono: absorbe la luz roja de forma similar a la oxihemoglobina, por lo que el valor de SpO2 estará falsamente aumentado.
- Metahemoglobina: el valor de SpO2 tenderá a 85 %.
Como limitaciones cabe destacar que puede ser un indicador tardío de hipoxemia si hay alteraciones de pH, temperatura o PCO2 que producirían desplazamiento de la curva de disociación de la hemoglobina. También puede ser un indicador tardío de alteración respiratoria durante la suplementación de oxígeno, debido a la forma sigmoidea de la curva de disociación de la oxihemoglobina, un valor de SpO2 mayor del 97 % podría corresponder a una PaO2 de entre 90 y 600 mmHg3.
Medición de gases arteriales
El análisis de gases arteriales incluye PaCO2 y PaO2. Estas son las presiones parciales que ejercen las moléculas disueltas en el plasma, moléculas libres que no están unidas a hemoglobina (en el caso del oxígeno), ni convertidas a bicarbonato (en el caso del dióxido de carbono). El único parámetro que cuantifica la cantidad de oxígeno en sangre es el CaO2, calculado a partir de SaO2 y PaO2. Algunos analizadores de gases incorporan un co-oxímetro para determinar SaO2, y otros lo calculan a partir de PaO2, asumiendo que no hay tipos anormales de hemoglobina en valores significativos6.
Las mayores limitaciones de este método es que no es un método de medición continua, el coste y el manejo especial de la muestra.
Diagnóstico diferencial de baja saturación de oxígeno
La situación más común antes, durante o después de la anestesia en la que se detecta que puede existir un problema con la saturación de oxígeno es con el uso del pulsioxímetro, por lo tanto, es la situación de la que se partirá para este diagnóstico diferencial, una medición de SpO2 bajo. Para localizar el problema, se puede seguir un orden sistemático, en este caso, desde la fuente de oxígeno hasta los tejidos, una vez descartados los artefactos. Hay que tener en cuenta que pueden coexistir varios problemas a la vez.
- 1. Artefactos:
- Luz ambiental directa.
- Movimiento.
- Baja perfusión.
- Tejido demasiado grueso.
- Mal ajuste de la sonda.
- Extremos de frecuencia cardíaca.
- 2. Aporte insuficiente en la fuente de oxígeno. Por ejemplo: un concentrador de oxígeno produciendo baja fracción de oxígeno (cuando se rompen, o hay mucho calor ambiental), mezcla de oxígeno y aire con flujo alto de aire en máquinas de anestesia que tienen ambos caudalímetros.
- 3. Baja fracción inspirada de oxígeno alcanzando los alveolos:
- Intubación errónea/extubación.
- Fugas (en el circuito, conexión con el paciente o el balón de pneumotaponamiento).
- Obstrucción tubo endotraqueal.
- Intubación endobronquial.
- Broncospasmo: predisposición en animales con asma, durante la toma de muestras en un lavado broncoalveolar.
- Colapso bronquial (pueden ser dinámicos).
- Obstrucción vías aéreas altas (si el paciente no está intubado, o es caudal al tubo).
- 4. Insuficiente expansión alveolar:
- Alteraciones del espacio pleural:
- Pneumotórax.
- Efusión pleural.
- Masas.
- Hipoventilación:
- En ventilación espontánea:
- Farmacológica: opioides, ketamina, bloqueantes. neuromusculares, benzodiazepinas, propofol, alfaxalona.
- Enfermedad neuromuscular.
- Enfermedad neurológica cervical o tronco del encéfalo.
- Alteración nervio frénico (C5-C7 en perros7, C4-C7 en gatos8).
- En ventilación mecánica: volumen tidal o frecuencia respiratoria insuficientes.
- En ventilación espontánea:
- Alteraciones del espacio pleural:
- 5. Alteración de la difusión del oxígeno a través de la pared alveolar en problemas parenquimales:
- Edema pulmonar:
- Cardiogénico (sobredosis de fluidos, fallo de corazón izquierdo).
- No cardiogénico (neurológico, lesión pulmonar aguda relacionada con transfusión, inflamación, edema por electrocución9, edema por presión negativa10, edema por reexpansión11.
- Hemorragia pulmonar (coagulopatías, contusión pulmonar).
- Neumonía (infecciosa, por aspiración, paso de material purulento de un absceso al resto del pulmón).
- Neoplasia difusa o localizada extensa.
- Fibrosis pulmonar: gatos con asma felino crónico, Terriers geriátricos (especialmente el West Highland White Terrier, también detectado en un Staffordshire Bull Terrier12 y un Patterdale Terrier13).
- Edema pulmonar:
- 6. Alteración relación ventilación-perfusión:
- Shunt: típicamente no mejora con suplementación de oxígeno si hay un grado de shunt elevado.
- Pulmonar: hay perfusión en los alveolos, pero no hay ventilación, o parte de la sangre no se oxigena:
- Ventilación unipulmonar.
- Alteración parénquima pulmonar: zonas de baja difusión de oxígeno:
- Atelectasia: predisposición en posición ventro-dorsal, obesidad, distensión abdominal, gestación, FiO2 al 100 %.
- Ver punto 5.
- Cardiovascular: parte de la sangre no recibe oxígeno del pulmón porque no pasa por los alveolos:
- Shunt cardíaco derecho a izquierdo: tetralogía de Fallot, comunicación atrial o ventricular, doble salida de ventrículo derecho, conducto arterioso persistente.
- Fístulas arteriovenosas sistémica-pulmonares14.
- Embolismo vascular 15,16:
- Embolismo pulmonar: provoca vasoconstricción pulmonar e hipertensión pulmonar, con disminución en precarga del corazón izquierdo, provocando hipotensión y colapso vascular. También puede aumentar las presiones del corazón derecho, que puede abrir un foramen ovale patente, u otros defectos cardíacos causando un shunt derecha-izquierda, o apertura de anastomosis arteriovenosas pulmonares.
- Embolismo sistémico (gaseoso, tromboembolismo): obstrucción del tracto de salida del ventrículo derecho17.
- Pulmonar: hay perfusión en los alveolos, pero no hay ventilación, o parte de la sangre no se oxigena:
- Hipotensión: el oxígeno llega a los tejidos de forma insuficiente, los tejidos lo gastan rápidamente, aumentando la cantidad de hemoglobina desoxigenada en sangre.
- Shunt: típicamente no mejora con suplementación de oxígeno si hay un grado de shunt elevado.
- 7. Presencia de hemoglobinas anormales (se detectan por co-oximetría):
- Metahemoglobinemia: baja SpO2 y PaO2 normal por causas genéticas (deficiencia en citocromo b5 reductasa18,19,exposición a benzocaína (especialmente en heridas20), uso de hidroxiurea terapéutica21.
- Monóxido de carbono: se une a la hemoglobina con una afinidad de más de 200 veces la del oxígeno, por lo que la sangre tiene menos capacidad de transporte de oxígeno y caerá la entrega a los tejidos. Esto resulta en hipoxia celular y signos clínicos de esta (neurológicos, taquicardia). El monóxido de carbono también difunde a los tejidos extravasculares, uniéndose a proteínas en el músculo y el corazón, provocando más daño tisular22. Reportado en animales expuestos a humo23 y en anemias hemolíticas (se produce monóxido de carbono cuando se metaboliza la hemoglobina, se ha reportado sobre el 7 % frente al 3 % fisiológico en perros, y puede ser factor predictivo de anemia hemolítica24).
Manejo general de la baja saturación de oxígeno
Primeras acciones
- Comprobar sonda de pulsioximetría: mover la sonda, colocar gasa25.
- Si no mejora: sacar muestra de gases arteriales.
- Administrar FiO2 100 % (o la más alta posible si el animal no está intubado, p.ej., con una mascarilla de oxígeno muy ajustada a la cara), si no se estaba administrando ya, comprobar situación del tubo endotraqueal (inspección visual, capnograma), iniciar ventilación si existe hipoventilación o el animal está en ventilación espontánea.
- Revisar pulso del paciente y presión arterial, si existe hipotensión severa, tratar hipotensión de forma prioritaria.
Revisar fuente de oxígeno
- Comprobar FiO2 si se tiene sensor de oxígeno.
- ¿Funcionan los rotámetros adecuadamente? (no están atascados, la bola o bobina gira sobre su eje).
- Revisar rápidamente si la máquina de oxígeno está dando suficiente flujo (las válvulas se mueven y /o la concertina se mueve, etc.).
Ventilar manualmente al paciente
- ¿Hay una onda de capnograma normal?
- Sí, y el CO2 espirado es mayor que el que marcaba previamente:
- Hipoventilación
- ¿Se mueve el tórax?
- No se mueve o no lo suficiente:
- Sin resistencia aumentada: considerar fuga:
- Escuchar si hay algún silbido en circuito o las conexiones, o mirar si hay pérdida de volumen o presión en el sistema.
- Con resistencia aumentada: considerar obstrucción de la vía aérea o alteración pleural:
- Inspeccionar el tubo endotraqueal y la posición de la cabeza para evaluar si puede haber obstrucciones: escuchar sonidos de gorgoteo o crepitación severa (secreciones mucosas en la vía aérea), los tubos pueden estar doblados (el tubo endotraqueal puede obstruirse al doblarse en la zona del cuello si la posición de la cabeza es de 90º respecto al cuerpo, en ese caso no será visible para el anestesista).
- TFAST o radiografía para evaluar espacio pleural.
- Sin resistencia aumentada: considerar fuga:
- No se mueve o no lo suficiente:
- Auscultar: ¿suena normal cada hemitórax?
- Buscar sonidos de murmullo alveolar en cada hemitórax:
- Sólo sonido de murmullo alveolar en uno de los lados:
- Considerar intubación bronquial
- Sólo sonido de murmullo alveolar en uno de los lados:
- Sonidos de silbido, altas presiones en vía aérea, o capnograma de obstrucción:
- Considerar obstrucción bronquial, obstrucción tubo endotraqueal.
- No se oye nada o no se oyen sonidos anormales:
- Ecografía o radiografía para descartar enfermedad pleural.
- Si se sospecha de atelectasias y buena presión arterial: maniobra de reclutamiento seguida de instauración de presión positiva al final de la espiración (PEEP) y FiO2 del 40 % si es posible26.
- Buscar sonidos de murmullo alveolar en cada hemitórax:
- Sí, y el CO2 espirado es mayor que el que marcaba previamente:
Otros
- Revisar historia o signos clínicos de enfermedad pulmonar o de vías aéreas, bullas pulmonares, tos, lesión traumática, distensión abdominal, disnea, regurgitación o vómito con posible aspiración a la vía aérea1.
- Si se sospecha de enfermedad pulmonar o se han descartado todas las otras opciones:
- Radiografía o ecografía.
- Tomar muestra de gases arteriales:
- La existencia de una discrepancia importante entre el PaO2 esperado según la FiO2 aportada y la PaO2 medida es indicativa de shunt.
- Un grado de shunt significativo hará que no mejore la PaO2 a pesar de aumentar la FiO2.
- Discrepancia entre SpO2 y PaO2 pueden indicar metahemoglobinemia.
Conclusión
La hipoxemia durante la anestesia representa una complicación grave que se debe tratar lo antes posible, para evitar la evolución a una parada cardiorrespiratoria o secuelas durante el periodo postoperatorio. El conocimiento de sus posibles causas, así como el manejo general recomendado si acontece, aumenta las posibilidades de revertir la situación por parte del anestesista.
Bibliografía
- McMillan M. BSAVA Cognitive Aids for Anaesthesia in Small Animal Practice. BSAVA. 2020. Gloucester.
- Kerr CL, Teixeira‑Neto J. Respiratory Physiology and Pathophysiology. Lumb & Jones’ Veterinary Anesthesia and Analgesia.
- Adami C. Monitoring oxygenation in Lumb & Jones’ Veterinary Anesthesia and Analgesia. 6th edn. 2024. New Jersey.
- Bendjelid K. The pulse oximetry plethysmographic curve revisited. Current Opinion in Critical Care. 2008.
- Sinclair MD. A review of the physiological effects of α2-agonists related to the clinical use of medetomidine in small animal practice. *Can Vet J*. 2003 Nov;44(11):885–897.
- Dukić L, Kopčinović LM, Dorotić A, Baršić I. Blood gas testing and related measurements: National recommendations on behalf of the Croatian Society of Medical Biochemistry and Laboratory Medicine. Biochem Med (Zagreb). 2016;26:318-336.
- Sigmund L, Rigamonti D, Nylen E. Long‑term functional restoration of the paralyzed hemidiaphragm in the dog. Experimental Neurology. 1981.
- Chou Y, Davenport P. Phrenic nerve afferents elicited cord dorsum potential in the cat cervical spinal cord. BMC Physiology. 2005.
- Unger K, Martin LG. Noncardiogenic pulmonary edema in small animals. Journal of Veterinary Emergency and Critical Care. 2023.
- Herrería‑Bustillo VJ et al. Retrospective evaluation of negative‑pressure pulmonary edema in dogs (2006‑2018): 35 cases. Journal of Veterinary Emergency and Critical Care. 2021.
- Raptopoulos D, Papazoglou LG, Patsikas MN. Re‑expansion pulmonary oedema after pneumothorax in a dog. Veterinary Record. 1995.
- Corcoran B, Dukes‑McEwan J, Rhind S, French A. Idiopathic pulmonary fibrosis in a Staffordshire bull terrier with hypothyroidism. J Small Animal Pract. 1999.
- Thierry F, Handel I, Hammond G, King L, Corcoran B, Schwarz T. Further characterization of CT and clinical features for staging and prognosis of idiopathic pulmonary fibrosis in West Highland white terriers. Veterinary Radiology & Ultrasound. 2017.
- Claretti M, Pradelli D, Borgonovo S, Boz E, Bussadori CM. Clinical, echocardiographic and advanced imaging characteristics of 13 dogs with systemic‑to‑pulmonary arteriovenous fistulas. Journal of Veterinary Cardiology. 2018.
- Bautista Díaz‑Delgado O, Campagna I. Suspected venous air embolism during thoracic limb amputation in a dog. Journal of Veterinary Emergency and Critical Care. 2020.
- Asorey I, Corletto F. Suspected systemic gas embolism associated with lung tissue perforation caused by a previously inserted chest drain in a dog. Journal of Veterinary Emergency and Critical Care. 2023.
- Austin LS, VanBeek C, Williams GR. Venous air embolism: an under‑recognized and potentially catastrophic complication in orthopaedic surgery. J Shoulder Elbow Surg. 2013.
- Jaffey J, Harmon M, Villani N, Creighton E, Johnson G, Giger U, Dodam J. Long‑term treatment with methylene blue in a dog with hereditary methemoglobinemia caused by cytochrome b5 reductase deficiency. Journal of Veterinary Internal Medicine. 2017.
- Zhou S, Tearle R, Jozani RJ, Winra B, Schaaf O, Nicholson A, Peaston A. Genetic cause for congenital methemoglobinemia in an Australian Pomeranian dog. Journal of Veterinary Internal Medicine. 2019.
- Davis J, Greenfield R, Brewer T. Benzocaine‑induced methemoglobinemia attributed to topical application of the anesthetic in several laboratory animal species. American Journal of Veterinary Research. 1993.
- Rigot M, Bateman S, Yiew X. Clinical methemoglobinemia secondary to administration of hydroxyurea at therapeutic doses in a dog. Journal of Veterinary Internal Medicine. 2024.
- Coburn R. Effects of increases in carboxyhemoglobin percent saturation and tissue hypoxia on carbon monoxide binding to skeletal and heart extravascular tissues. Journal of Applied Physiology. 2021.
- Ashbaugh E, Mazzaferro E, McKiernan B, Drobatz K. The association of physical examination abnormalities and carboxyhemoglobin concentrations in dogs trapped in a kennel fire. Journal of Veterinary Emergency and Critical Care. 2012.
- Nivy R, Sutton G, Bruchim Y. Carboxyhemoglobin as a diagnostic and prognostic biomarker of hemolytic anemias in dogs. Journal of Veterinary Internal Medicine. 2022.
- Mair A, Martinez-Taboada F, Nitzan M. Effect of lingual gauze swab placement on pulse oximeter readings in anaesthetised dogs and cats. Veterinary Record. 2017.
- Staffieri F, Franchini D, Carella G, Montanaro M, Valentini V, Driessen B, Grasso S, Crovace A. Computed tomographic analysis of the effects of two inspired oxygen concentrations on pulmonary aeration in anesthetized and mechanically ventilated dogs. American Journal of Veterinary Research. 2007.
 by Multimédica
by Multimédica