Inhibidores de la ciclooxigenasa en la especie canina: un abordaje desde el punto de vista clínico (Parte I y II)
Resumen breve
Los antiinflamatorios no esteroideos son los fármacos más comúnmente recetados en la clínica diaria considerándose en la actualidad como la base del tratamiento de procesos nociceptivos e inflamatorios de diferente índole y magnitud. Sin embargo, su administración no está exenta del desarrollo de efectos adversos, por lo que el objetivo de este artículo es establecer aquellas nociones que permitan hacer un uso más seguro de este tipo de principios activos, haciendo especial énfasis en…Índice de contenidos
Resumen
Los antiinflamatorios no esteroideos son los fármacos más comúnmente recetados en la clínica diaria considerándose en la actualidad como la base del tratamiento de procesos nociceptivos e inflamatorios de diferente índole y magnitud. Sin embargo, su administración no está exenta del desarrollo de efectos adversos, por lo que el objetivo de este artículo es establecer aquellas nociones que permitan hacer un uso más seguro de este tipo de principios activos, haciendo especial énfasis en su mecanismo de acción, sus principales contraindicaciones y en el concepto de rotación terapéutica.
Introducción
Los procesos nociceptivos generan un impacto negativo sobre las funciones biológicas, repercutiendo directa e indirectamente sobre la calidad de vida de los pacientes. Desde la última década del siglo pasado y con la irrupción de una nueva generación de fármacos, los AINEs (antinflamatorios no esteroideos) se han erigido como la piedra angular en el tratamiento uni o multimodal del dolor agudo y crónico, visceral y/o musculoesquelético, resultando de utilidad tanto para su control durante el periodo perioperatorio1-3, como para el tratamiento de aquellos eventos nociceptivos inherentes a gran variedad de patologías ortopédicas en conjunción o no a terapias no farmacológicas4,5.
Dichos fármacos presentan una importancia notable en el diseño y elaboración de protocolos de analgesia multimodal y preventiva ante sus efectos antiinflamatorios, antipiréticos y analgésicos, lo que, junto a su rápido inicio de acción, la duración de su efecto clínico, su alta afinidad por las proteínas plasmáticas, la amplia variedad de formas de presentación y su potencial uso a largo plazo, los convierte en agentes de elección en multitud de procesos dada su gran versatilidad.
Este artículo determina la importancia de los mecanismos por los que estos principios activos ejercen sus acciones farmacológicas, destacando la necesidad de realizar una monitorización estricta durante su utilización dado su estrecho margen de seguridad y el potencial desarrollo de efectos secundarios relativos a su administración6 (p. ej., gastrointestinales, renales, hepáticos y desórdenes en la coagulación).
Mecanismo de acción e importancia de la selectividad COX-2
A finales del siglo XX, se determinó la existencia de dos isoformas de la enzima ciclooxigenasa7,8 (COX) denominadas COX-1 y COX-2 presentes en la mayoría de órganos y sistemas en concentraciones constantes, responsables de la producción de prostaglandinas.
Ya a principios de este siglo, se describió una tercera isoenzima que se denominó COX-3, actualmente subclasificada como una variante de la COX-1, que se encuentra presente en la corteza cerebral de los cánidos9,10 y que posee cierto grado de relación con el mecanismo de acción del paracetamol9,10.
El ácido araquidónico, un ácido graso que se libera ante daños en la membrana celular (principalmente en casos de fiebre, infección o agregación plaquetar) mediante la actuación de la enzima fosfolipasa A2, se dirige hacia el citoplasma donde da lugar, por acción de las enzimas lipoxigenasa (LOX) o la ciclooxigenasa, a eicosanoides como los leucotrienos y las prostaglandinas11,12 que presentan un papel importante no solo en la homeostasis en diferentes órganos y sistemas, si no en la respuesta inmune e inflamatoria y la estimulación de las vías del dolor.
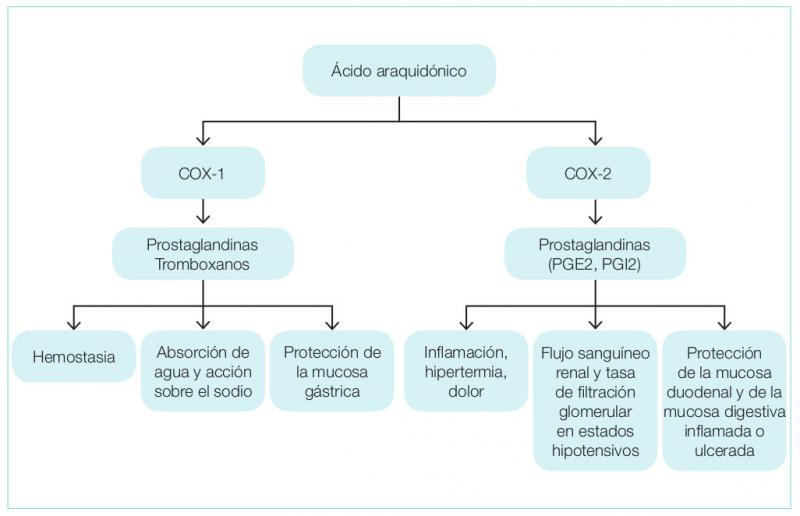
Aunque tradicionalmente la COX-1 se clasificaba como constitutiva13,14 (con expresión en gran cantidad de tejidos y encargada de funciones homeostáticas), mientras que la COX-2 se describía como una isoforma inducible por estímulos proinflamatorios y por lo tanto se consideraba como perjudicial, estudios recientes han determinado que ambas isoformas son tanto inducibles como constitutivas15-17 si bien la expresión constitutiva de la COX-2 es mucho más limitada que en el caso de la COX-117, aunque presenta alta relevancia en el equilibrio homeostático del aparato digestivo, reproductor, sistema nervioso, y urinario (especialmente en situaciones de hipovolemia e hipotensión18 ) y del endotelio vascular19 (Figura 1 y Tabla 1).
| Tabla 1. Selectividad COX. Conceptos clave. |
| Isoforma | Principales cometidos y consideraciones |
| COX-1 | Regulación de la homeostasis. Denominada inicialmente como la enzima constitutiva. Inducible en situaciones proinflamatorias. |
| COX-2 | Regulación de la homeostasis. Denominada inicialmente como enzima inducible. Presenta papel constitutivo en menor medida que la COX-1, contribuyendo al equilibrio homeostático del aparato digestivo, reproductor, sistema nervioso, urinario y del endotelio vascular. |
| COX-3 | Isoforma de la COX-1 localizada en el corazón y la corteza cerebral. Su inhibición presenta efectos analgésicos y antipiréticos. |
La COX-1 es la encargada del mantenimiento de ciertas funciones biológicas como la homeostasis vascular y la agregación plaquetar o la producción de moco gástrico, bicarbonato y la autorregulación del flujo sanguíneo renal, expresándose en la corteza cerebral donde su inhibición puede producir efectos antipiréticos y analgésicos20.
El daño tisular produce la liberación de bradiquininas, leucotrienos, histamina, serotonina, potasio, acetilcolina, sustancia P y factor activador de plaquetas, mientras que la prostaglandinas actúan como mediadores locales que incrementan la sensibilidad de las terminaciones nerviosas, pudiendo conducir al desarrollo de sensibilización periférica y sensibilización central21 y a la perpetuación de los denominados signos de Celso (calor, rubor, tumefacción, dolor, y pérdida de estructura), presentando además la COX-2 una estrecha relación con la angiogénesis en ciertos procesos neoplásicos (p. ej., carcinoma de células escamosas, carcinoma pancreático, carcinoma de células transicionales de vejiga), jugando a su vez un papel fundamental en la respuesta inflamatoria22-24.
Además, la COX-2 se expresa en el asta dorsal de la médula espinal, contribuyendo a la transmisión de estímulos nociceptivos, por lo que la supresión de la COX-2 mediante el uso de AINEs puede producir efectos analgésicos directos, mientras que también se encuentra aumentada en las células endoteliales del hipocampo en casos de hipertermia.
Tanto la COX-1 como la COX-2 son responsables de transformar el ácido araquidónico a PGG2 y PGH2 mediante reacciones enzimáticas complejas muy similares, actuando la PGH2 como sustrato para la biosíntesis de prostaglandinas, prostaciclinas y tromboxanos, mientras que mediante la vía LOX se producirán leucotrienos (Figura 1).
Los AINEs inhiben la expresión de la enzima ciclooxigenasa en las membranas celulares25 en diferente grado y de distinto modo dependiendo de la selectividad COX de cada AINE, presentando efectos relevantes tanto en el sistema nervioso central como en el periférico.
Así, los AINEs no selectivos inhiben ambas isoformas, suprimiendo la síntesis de prostaglandinas relacionadas con el desarrollo de inflamación, pero también aquellas que se encargan de los procesos homeostáticos, clasificándose como preferenciales aquellos que suprimen en una proporción mayor la COX-2, mientras que los principios activos con efectos despreciables sobre la COX-1, que ejercen su acción mayoritariamente sobre la COX-2 son denominados inhibidores COX-2 selectivos26.
Además, en lo que respecta al carprofeno y la tepoxalina se ha determinado un mecanismo de acción adicional al de la inhibición de la COX-1 y COX-2, como la supresión del factor nuclear Kappa-B (NFk-B), que regula la quimiotaxis inflamatoria, la liberación de enzimas proinflamatorias y citoquinas y la adhesión celular27,28, pudiendo por lo tanto presentar un mecanismo de acción más complejo.
Adicionalmente, ciertos AINEs actúan sobre la expresión de canales de sodio29, de calcio30 y canales de potasio dependientes de voltaje31, mientras que otros han mostrado inhibir el AP-127 que se expresa en gran variedad de procesos inflamatorios crónicos y oncológicos, si bien se considera necesaria la realización de estudios adicionales que permitan determinar aquellas vías complementarias sobre las que actúan estos fármacos.
Para finalizar y aunque no es objeto de estudio de este artículo, cabe reseñar la importancia de la vía LOX de la cascada del ácido araquidónico, que produce gran variedad de leucotrienos, asociados con el incremento de la permeabilidad vascular, la vasoconstricción, broncoconstricción y quimiotaxis inflamatoria32.
Selectividad COX
Como se había atisbado con anterioridad, la selectividad de los AINEs se expresa en función de la ratio de inhibición COX-1/COX-2, que ha sido considerada de manera tradicional como un indicador de la seguridad de esta clase de fármacos. Sin embargo, ésta no guarda relación con la eficacia analgésica o la potencia de los efectos antiinflamatorios (Tabla 2).
| Tabla 2. Selectividad COX. Conceptos clave. |
|
En todo caso el cociente de inhibición COX-1/COX-2 no permite una extrapolación objetiva, ya que existe tanto gran variabilidad interespecífica33,34 como una heterogeneidad manifiesta en los estudios in vitro para determinar estos valores33, al no tener en cuenta aquellas fluctuaciones en la concentración plasmática fruto de los procesos LADME por lo que su aplicación clínica resulta cuestionable.
Mientras que valores menores de 1, determinan la mayor selectividad COX-1, valores mayores de 1 establecen una mayor selectividad COX-2, considerándose la misma como dosis dependiente, ya que a altas concentraciones todos los principios activos incluidos en este grupo de fármacos actúan como inhibidores no selectivos35.
En el pasado, se consideraba que los inhibidores COX-2 selectivos presentaban efectos analgésicos y antiinflamatorios, manteniendo inalterada la COX-1 y sus funciones homeostáticas, hipótesis que hacía suponer que aquellos efectos secundarios relacionados con la administración de AINEs se reducirían drásticamente.
Ulteriormente y mediante su uso clínico a lo largo de las últimas décadas, se determinó que los efectos adversos inducidos por los AINEs se producían incluso en aquellos casos en los que se administraban inhibidores COX-2 selectivos como los coxibs, con los que si bien se ha documentado una disminución en la frecuencia de presentación de dichos eventos tanto en pequeños animales como en el ser humano, también se han descrito episodios de diversa magnitud asociados a su uso (p. ej., úlceras gástricas, fallo renal agudo y desórdenes en la coagulación), así como un potencial incremento de la actividad de la LOX ante la inhibición de la COX que puede generar efectos adversos de diferente índole por lo que no se ha de despreciar la selectividad COX/LOX de este tipo de antiinflamatorios a la hora de establecer su margen de seguridad36.
Los coxibs (cimicoxib, deracoxib, firocoxib, robenacoxib y mavacoxib) son los AINEs COX-2 selectivos con un mayor ratio de inhibición COX-1/COX-2, mientras que el meloxicam y el carprofeno son considerados COX-2 preferenciales, y otros como el ketoprofeno se clasifican como no selectivos.
Aspectos farmacocinéticos y farmacodinámicos
La mayoría de los AINEs (a excepción del mavacoxib) se consideran ácidos débiles altamente lipofílicos en condiciones fisiológicas que se absorben rápidamente tras la administración oral, siendo la absorción digestiva cercana al 100 %, a excepción del mavacoxib y el firocoxib en los que la biodisponibilidad se considera menor del 50 %, alcanzándose por lo general las concentraciones séricas máximas entre las 2 y 4 horas tras su ingesta.
No obstante, la administración de estos fármacos junto con la dieta puede alterar su absorción. Mientras el mavacoxib, la tepoxalina y el deracoxib aumentan su absorción en caso de suministrarse junto a la dieta, el robenacoxib disminuye su captación un 22 % en aquellos casos en los que se administra junto a la alimentación37.
Los inhibidores de la ciclooxigenasa presentan un grado de unión a proteínas plasmáticas de hasta el 99 %, incrementándose su fracción activa una vez se saturan los lugares de unión a la albúmina, produciéndose entonces sus efectos antinflamatorios, antipiréticos y analgésicos, ya que tal y como los principios farmacocinéticos establecen, la fracción libre es aquella considerada como activa.
Del mismo modo, el alto grado de unión a proteínas se encuentra relacionado con su bajo volumen de distribución, ya que la estrecha unión del fármaco a las proteínas impide la difusión al exterior del compartimento celular, considerándose el volumen de distribución más elevado el del firocoxib, mientras que el carprofeno es el que menor volumen de distribución presenta.
No obstante, es importante reseñar que dada la alta afinidad de los AINEs por las proteínas plasmáticas y por tanto su grado de unión a las mismas, pueden desplazar a otros fármacos, potenciando sus efectos, como en el caso de anticonvulsivantes (p. ej., fenobarbital, quimioterápicos, warfarina o digoxina)12.
La gran mayoría de los AINEs presentan metabolización hepática mediante glucuronidación en perros. Su uso se considera seguro incluso a largo plazo presentando otras vías accesorias de metabolización como la vía oxidativa y la hidroxilación38, siendo eliminados por vía biliar, urinaria y/o fecal.
La vida media difiere en función de la especie y el principio activo, siendo de hasta 24 horas en el caso del meloxicam, casi 8 horas en el caso del firocoxib, menor de 1 hora para el robenacoxib y de aproximadamente 3 horas para el deracoxib, mientras que el mavacoxib presenta una vida media de entre 15,5 y 44 días, llegando incluso a 2 meses y medio en algunos animales39,40.
Sin embargo, la inhibición COX que producen los AINEs presenta una duración relativamente larga en comparación a la vida media, lo que clásicamente se ha asociado a su componente lipofílico y a su grado de unión a proteínas.
Los AINEs se administran por vía parenteral (generalmente por vía subcutánea o intravenosa) en el periodo perioperatorio como parte de un protocolo de analgesia preventiva41, a fin de alcanzar concentraciones terapéuticas previamente al estímulo quirúrgico, lo que contribuye a la reducción del grado de dolor perioperatorio de una forma más eficiente cuando se realiza como parte de una pauta de analgesia multimodal42.
La seguridad de los AINEs en el periodo perioperatorio se ha de evaluar de manera individual para cada paciente, no solo en función de los procesos mórbidos que afecten al animal, si no de aquellos eventos relativos a la anestesia y al procedimiento quirúrgico como la hipovolemia, hipoperfusión renal, hipotermia, hipotensión y sangrado intraquirúrgico.
En lo que respecta al uso de AINEs durante el periodo postoperatorio, la vía parenteral se considera de elección, especialmente en el periodo de hospitalización, utilizándose la vía oral desde el momento en el que se precise o bien tras el alta, siendo su uso relativamente seguro en el control del dolor y la inflamación perioperatorios, permitiendo la administración incluso varios días o semanas después de la cirugía (Tabla 3).
| Tabla 3. Principales inhibidores COX-2 aprobados para su uso en España. |
| Principio activo | Dosis |
| Carprofeno | 2,2 mg/Kg cada 12 horas o 4,4 mg/Kg cada 24 horas |
| Cimicoxib | 2 mg/Kg cada 24 horas |
| Firocoxib | 5 mg/Kg cada 24 horas |
| Mavacoxib | 2 mg/Kg inicialmente, repetir a los 14 días. Posteriormente administración mensual |
| Meloxicam | 0,2 mg/Kg (dosis de carga), posteriormente 0,1 mg/Kg cada 24 horas |
| Robenacoxib | 1-2 mg/Kg cada 24 horas |
| Ácido tolfenámico | 4 mg/Kg cada 24 horas |
La recomendación en aquellos casos en los que se considere su uso a largo plazo consiste en una pauta farmacológica una vez al día, excepto en el caso del carprofeno (que puede administrarse en una o dos tomas al día) y del mavacoxib (con una administración inicial que se repetirá tras 14 días, para posteriormente administrarse de manera mensual)40,41 (Tabla 4).
| Tabla 4. Conceptos clave relativos la frecuencia de administración. |
|
Principales efectos adversos
Los efectos adversos más comunes ante la administración de AINEs se encuentran relacionados con la inhibición de prostaglandinas e incluyen fundamentalmente episodios gastrointestinales de diferente índole y magnitud, mientras que los hepáticos, renales y alteraciones en la coagulación se presentan con menor frecuencia43,44 (Tabla 5).
| Tabla 5. Predicción del número de efectos adversos en perros por cada millón de administraciones de AINEs. |
| Efecto adverso | Predicción del número de efectos adversos en perros por cada millón de administraciones |
| Emesis | 170 (18-1970) |
| Anorexia | 74 (24-752) |
| Letargia | 83 (36-469) |
| Insuficiencia renal | 44 (31-469) |
| Muerte | 113 (51-349) |
Tomado de: Hunt et al. An analysis of the relative frequencies of reported adverse events associated with NSAID administration in dogs and cats in the United Kingdom. Vet J. 2015;206(2):183-190.
Las nuevas generaciones de AINEs han limitado notablemente el desarrollo de efectos adversos en lo que respecta a otros principios activos utilizados en la antigüedad tales como el ácido acetilsalicílico, el etodolaco, la flunixin meglumina, el ácido tolfenámico y el ketoprofeno44,45.
Los efectos adversos son más frecuentes en animales con deshidratación, hipovolemia o entidades patológicas concomitantes6 por lo que se han de corregir dichas situaciones previamente a la administración de AINEs en aquellos casos en los que sea posible su utilización.
Además, se debe realizar un estudio individualizado a la hora de administrar estos fármacos, haciendo especial énfasis en aquellos pacientes con enfermedad gastrointestinal o renal en los que la pauta analgésica podría variar, resultando el examen clínico y los métodos de diagnóstico complementarios fundamentales a la hora de establecer tanto los riesgos potenciales asociados a su uso, como aquellas situaciones en las que la farmacoterapia con éstos se encuentre contraindicada (Tabla 6).
| Tabla 6. Principales contraindicaciones relativas a la administración de AINEs. |
|
Efectos gastrointestinales
En medicina humana, los AINEs generan efectos adversos a nivel digestivo en más 100.000 personas al año en Estados Unidos y Canadá produciendo complicaciones graves en aproximadamente el 16,5 % de los pacientes46-47, considerándose como la causa más común de úlcera gastrointestinal tanto en el ser humano como en la especie canina48,49.
En perros, los efectos adversos más significativos son el desarrollo de anorexia, vómitos y melena50, concomitantes o no a ulceración gastrointestinal, apreciándose una predisposición mayor en aquellos animales que han recibido tratamiento con corticosteroides o que presentan procesos gastrointestinales previos, si bien la susceptibilidad a los mismos puede tener un componente genético.
De este modo, no se puede considerar que el desarrollo de sintomatología digestiva se encuentre rigurosamente asociado a la presencia de erosión gastrointestinal, pudiendo acaecer situaciones de ulceración o perforación gastrointestinal sin sintomatología digestiva previa y viceversa15.
Aunque dichos efectos adversos pueden aparecer incluso a dosis bajas51, el desarrollo de úlceras y perforaciones digestivas habitualmente está relacionado con una administración errática, ya que los AINEs pueden perder la selectividad COX-2 especialmente ante sobredosificaciones46,52.
Así, estos principios activos pueden generar daños en la mucosa gástrica mediante un mecanismo múltiple que incluye tanto los efectos directos sobre el tubo digestivo, como aquellos efectos sistémicos ocasionados por la inhibición de la síntesis de prostaglandinas48.
Los inhibidores de la ciclooxigenasa pueden generar daños al concentrarse en la mucosa digestiva en un proceso denominado como atrapamiento iónico12, manteniéndose como formas no ionizadas a pH gástrico, lo que permite su difusión a través de las membranas plasmáticas de las células epiteliales, quedando retenidos a nivel intracelular.
A pH celular los AINEs se disocian a la forma ionizada liberándose hidrogeniones que producen lesiones directas sobre las células53, contribuyendo además la adherencia de neutrófilos al endotelio vascular a su progresión54, pudiendo ocasionar la obstrucción de capilares, lo que predispone a la mucosa digestiva a situaciones de isquemia.
Otros factores implicados en la patogenia de las lesiones inducidas por los AINEs son la peroxidación lipídica mediada por la liberación de radicales libres y proteasas de los neutrófilos, las alteraciones de la conducción en los canales iónicos y el incremento de la producción de leucotrienos, lo que junto al efecto tóxico sobre mecanismos mitocondriales celulares conduce al desarrollo de daños severos sobre la superficie de la mucosa51.
A nivel digestivo, tanto la COX-1 como la COX-2 se expresan de manera constitutiva, por lo que la inhibición de estas enzimas podría dar lugar a daño inducido y al desarrollo de efectos gastrointestinales, úlceras y perforación6,15,16, siendo los efectos adversos menos comunes cuando se produce una inhibición COX selectiva de una de las isoformas, tal y como ha demostrado un estudio que comparó la administración de inhibidores duales con el meloxicam y el carprofeno durante un periodo de 3 meses45 (Figuras 2 y 3).
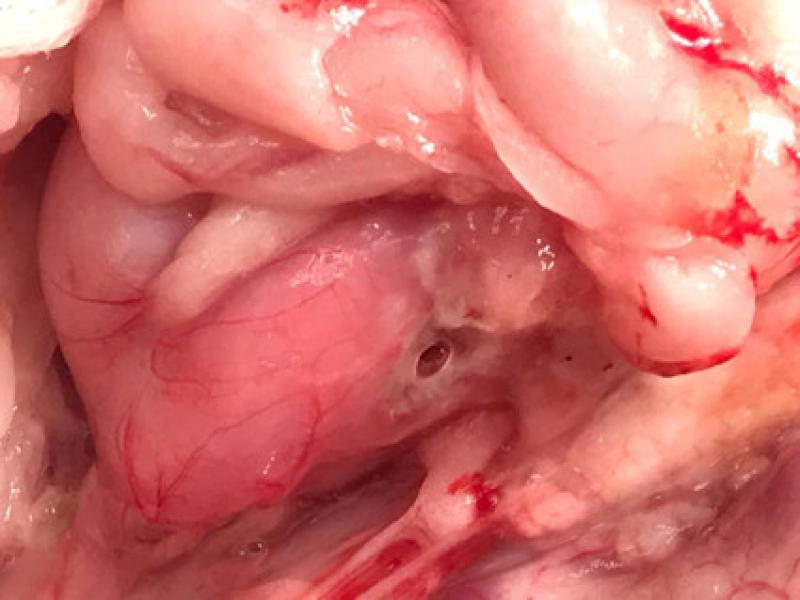
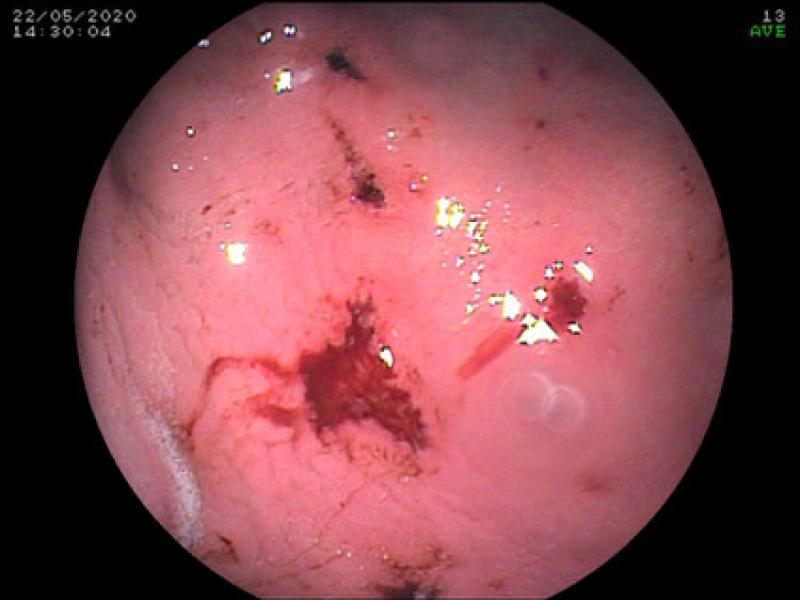
En estos casos, la COX-1 media la producción de prostaglandinas entre la que fundamentalmente se encuentra la PGE255, aumentando la expresión de la COX-2 tras la irritación o la exposición a una sustancia cáustica.
No obstante, la COX-2 presenta una relevancia capital en el proceso de curación de úlceras digestivas56, ante el incremento de la PGE2 y del factor vascular endotelial (VEGF), que estimula la angiogénesis en la interfase entre la úlcera y el tejido sano, por lo que la inhibición de la COX-2 en animales que sufren este tipo de procesos mórbidos puede resultar deletérea.
Mientras, los prostanoides sintetizados por la COX-1 salvaguardan a la mucosa gástrica de la secreción ácida, al fomentar la producción de la barrera mucosa de bicarbonato, incrementando la secreción de este en el duodeno y actuando tanto directa como indirectamente sobre la tasa de renovación celular57.
Por tanto, la inhibición de la génesis de prostaglandinas endógenas ante la administración de AINEs12,58 puede conducir a la disminución del flujo sanguíneo y de la cantidad de bicarbonato que se produce en el páncreas, la alteración de la tasa de replicación y la sustitución de las células epiteliales gastrointestinales59, así como a la variación de la cantidad y calidad de mucina en el moco gástrico. Todo ello predispone al daño de la mucosa gastrointestinal, principalmente a nivel gástrico y duodenal7, lo que junto a la inhibición plaquetaria puede causar pérdidas digestivas de sangre acuciantes.
En la actualidad se considera que gran cantidad de las perforaciones digestivas se producen en el duodeno. A este nivel, la COX-2 produce prostaglandinas protectoras por lo que su inhibición podría ir en detrimento de la salud del paciente60, viéndose además potenciados dichos efectos adversos en estos casos por la secreción biliar de metabolitos activos.
Mientras que ciertos estudios exponen que los AINEs COX-2 selectivos o COX-2 preferenciales presentan una menor incidencia en el desarrollo de efectos adversos gastrointestinales que los inhibidores duales45,61, otros han determinado que los inhibidores COX-2 selectivos podrían generar más efectos adversos en aquellos casos en los que existan lesiones gastrointestinales anteriores al inicio del tratamiento57, produciendo un retraso de la tasa de curación a pesar de mantener la actividad COX-1.
La adaptación gastrointestinal en tratamientos a largo plazo puede ser atribuible al incremento de la resistencia de la mucosa gástrica mediada por la producción de factor de crecimiento epitelial, la regeneración tisular62-66, el incremento del flujo sanguíneo y la disminución paulatina del infiltrado inflamatorio62-66.
La erosión gastrointestinal puede causar sangrado de diversa magnitud, por lo que ante la sospecha de este se realizarán pruebas de diagnóstico complementario como hemograma y extensión sanguínea para determinar la existencia de anemia, sobre todo en casos en los que existan indicios de pérdida crónica de sangre ante la presencia de úlceras sangrantes de pequeño tamaño67.
Por otra parte, la ecografía contribuirá tanto al diagnóstico de úlceras y perforaciones digestivas, como a la determinación de la presencia de líquido libre (p. ej., mediante la técnica AFAST)68, mientras que la endoscopia permitirá valorar de manera directa el daño de la mucosa gástrica69, 36, posibilitando la toma de biopsias gastrointestinales que por lo general aportan información relevante a la hora de valorar y determinar el origen y características de dichas lesiones (Figura 3).
Aquellas condiciones que producen un retraso de la absorción (p. ej., la terapia con antiácidos) pueden incrementar esta en el intestino delgado dando lugar a lesiones de diferente magnitud en las vellosidades intestinales70, agravándose este problema especialmente en aquellos casos en los que se alcanzan altas concentraciones del fármaco en bilis, donde la circulación enterohepática puede conducir al desarrollo de toxicidad intestinal.
En la actualidad, la recomendación clínica es evitar el uso de dichos fármacos en casos de enfermedad gastrointestinal, cirugía digestiva o en aquellos animales que se encuentran en tratamiento con corticoides, siendo además necesario tanto el control de la dosis como la monitorización exhaustiva en animales sanos con la finalidad de evitar el desarrollo de eventos digestivos (Tabla 7).
| Tabla 7. Principales factores de riesgo a la hora de administrar inhibidores de la ciclooxigenasa en pacientes con patología digestiva. |
|
Del mismo modo, en aquellas situaciones en las que se produzcan episodios gastrointestinales agudos de manera concurrente a la terapia con inhibidores de la ciclooxigenasa, se aconseja interrumpir el tratamiento hasta la resolución de los signos clínicos, para posteriormente sustituir el principio activo en cuestión por otro AINE tras un periodo de descanso en aquellos casos concretos en los que se considere factible o bien administrar otra clase de analgésico en aquellas circunstancias en las que la rotación terapéutica no sea posible.
Efectos a nivel renal
A pesar de su limitada relación con el peso corporal, los riñones reciben aproximadamente el 25 % del gasto cardíaco. Mientras la corteza renal percibe aproximadamente el 90 % del flujo sanguíneo renal, la médula tiene un aporte sanguíneo de entre el 1 y el 10 %71.
En estos órganos, tanto la COX-1 (que se expresa en los túbulos colectores, células intersticiales y vasos renales) como la COX-2 (que se expresa en la mácula densa, las células intersticiales y el asa de Henle) contribuyen a mantener la función tubular y la perfusión sanguínea, presentando una elevada relevancia en la autorregulación renal, que se produce a presiones arteriales medias de entre 60 y 150 mmHg.
Las prostaglandinas sintetizadas por ambas vías presentan un rol relevante en la correcta homeostasis renal, debido a su acción vasodilatadora que contrarresta la vasoconstricción renal y permite mantener tanto el flujo sanguíneo como la tasa de filtración glomerular72,73, incluso ante los efectos de la vasopresina, angiotensina II y catecolaminas como la norepinerfrina (Tabla 8).
| Tabla 8. Principales efectos renales de las prostaglandinas y efectos adversos asociados con la administración de AINEs. |
| Efectos renales de las prostaglandinas |
|
| Efectos adversos asociados a la administración de AINEs |
|
Además, tanto la PGE2 (prostanoide mayoritario a nivel renal) como la PGI2 actúan directamente sobre el transporte de cloro, así como sobre la excreción y reabsorción de sodio, estimulando la liberación de renina59, por lo que se considera que presentan acción directa e indirecta sobre el flujo sanguíneo74.
Mientras, el tromboxano A2 modula la producción de renina y la vasoconstricción, mostrando la PGE2 y la prostaciclina un carácter marcadamente hiperalgésico que contribuye al desarrollo de la sopa inflamatoria y al desarrollo de aquellos signos relacionados con la inflamación7.
Durante el periodo perioperatorio, pueden darse eventos tales como la hipotensión y/o isquemia renal que pueden producir una sobreexpresión de la COX-275, desencadenando la síntesis de PGE2, que en estas circunstancias ejerce una acción determinante al disminuir la resistencia vascular sistémica, contribuyendo al mantenimiento de la perfusión renal.
Por lo tanto, los mecanismos mediados por las prostaglandinas son fundamentales para el mantenimiento y protección de la función renal, especialmente en episodios de hipovolemia y deshidratación76, así como en situaciones especiales como la anestesia general, en la cual la perfusión renal puede verse alterada.
En estas circunstancias, la selectividad COX de los AINEs no está directamente relacionada con los efectos adversos renales, por lo que tanto los inhibidores no selectivos como los selectivos pueden producir nefrotoxicidad77, habiéndose descrito variaciones interespecíficas e individuales no solo en la expresión COX, si no en la acumulación de dichos principios activos.
Mientras que en animales sanos, el riñón presenta la capacidad para compensar los efectos relativos al tratamiento con AINEs1,3, los pacientes con enfermedad renal (en los que parece haber un incremento en la expresión COX-2 como mecanismo compensatorio) son más susceptibles al desarrollo de reacciones adversas relacionadas con su administración78, especialmente en aquellos casos en los que existan factores de riesgo (p. ej., deshidratación, hipotensión, enfermedad renal crónica, depleción de los electrolitos, shock o hemorragia)78,79 o en aquellos casos en los que se sobrepase la dosis estipulada.
Estas reacciones se producen generalmente ante la inhibición de la síntesis de prostanoides que se manifiesta como un descenso en el flujo sanguíneo renal y de la tasa de filtración glomerular y que pueden contribuir al empeoramiento de la funcionalidad renal, por lo que la administración de AINEs ha de plantearse únicamente tras la estabilización hemodinámica, siempre en función de la relación beneficio-riesgo para el paciente.
Durante los periodos de compromiso hemodinámico, se liberan vasopresores para mantener la resistencia vascular y la presión arterial, siendo esenciales los efectos vasodilatadores de las prostaglandinas para mantener el flujo sanguíneo renal y la tasa de filtración glomerular, habiendo de tener en cuenta que el empleo de AINEs en estos casos puede alterar la perfusión de este órgano y conducir a situaciones de isquemia renal.
Los efectos adversos renales son generalmente difíciles de valorar, considerándose que parámetros como la urea y la creatinina no son suficientemente sensibles para evaluar el daño renal temprano, habiendo de destacar que los efectos adversos inducidos por los AINEs son más comunes en aquellos casos en los que se administren de manera concomitante otros fármacos nefrotóxicos (Tabla 9).
| Tabla 9. Monitorización renal durante la administración de inhibidores de la ciclooxigenasa – principales parámetros. |
| Parámetro | Características |
| Perfusión renal |
|
| Daño tubular agudo |
|
| Otros |
|
En todo caso, unos niveles elevados de urea pueden ser el resultado de una excreción renal reducida, pero también de hemorragia digestiva y marcadores de metabolismo proteico, por lo que no se considera un parámetro laboratorial específico, resultando la determinación de la creatinina más precisa a la hora de evaluar la función renal, aunque también puede verse afectada por factores externos tales como la alimentación (especialmente en dietas altas en proteínas), la masa muscular y la deshidratación80.
Además, la tasa de filtración glomerular resulta de utilidad en aquellos casos en los que esté disponible, mientras que la determinación de la dimetilarginina simétrica (SDMA) es un indicador temprano de daño renal que no se ve afectado por la masa muscular81 y que aporta información relevante a la hora de evaluar la función renal, siendo especialmente útil en tratamientos a largo plazo.
Los AINEs pueden causar alteraciones en la hemodinámica renal, así como el desarrollo de procesos mórbidos como la nefritis intersticial, necrosis papilar y fallo renal agudo que generalmente tienen lugar entre los 14 y los 30 días tras el inicio de la administración, aunque estos efectos también pueden aparecer de manera tardía, documentándose hasta 6 meses después del inicio del tratamiento82.
Cabe destacar que hasta el 88 % de los estudios destinados a valorar la asociación entre la administración de inhibidores de la ciclooxigenasa y el deterioro de la función renal determinaron que no había relación alguna entre ambos83, estableciendo investigaciones adicionales una tasa de incidencia anual de toxicidad renal asociada a la administración de AINEs menor del 1 % en la especie humana84.
Del mismo modo, en la especie canina el riesgo de desarrollo de efectos adversos tempranos y tardíos parece ser bajo, no habiéndose registrado daño renal ante la administración de meloxicam en animales sanos incluso ante episodios de hipotensión85, mientras que adicionalmente se ha determinado la ausencia de daño renal tras la administración de carprofeno, ketoprofeno o meloxicam en la bioquímica y el urianálisis45, lo que determina que aquellos animales sin patología renal pueden compensar los efectos de los AINEs86.
No obstante, en aquellos casos en los que se administren estos fármacos durante el periodo perioperatorio se debe realizar una monitorización estricta de la presión arterial e instaurar una correcta pauta de fluidoterapia, especialmente en aquellos animales con problemas renales previos en los que existe una mayor posibilidad de fallo renal agudo, presentando también relevancia en animales sanos, en los que un mal manejo a nivel anestésico podría conllevar un deterioro de la función renal a largo plazo (Tabla 10).
| Tabla 10. Factores clave a nivel renal durante la administración de AINEs. |
|
En todo caso, resulta fundamental realizar controles periódicos que incluyan tanto hemograma como bioquímica sérica que permita determinar los valores hepáticos y renales, tanto inicialmente como 15 días después del comienzo del tratamiento, para posteriormente continuar con una monitorización exhaustiva que permita la detección precoz de anomalías a este nivel, lo que es especialmente relevante en aquellos animales en los que se valore una administración a largo plazo.
Efectos a nivel hepático
Los antiinflamatorios no esteroideos se consideran fármacos potencialmente hepatotóxicos87, que pueden generar reacciones adversas intrínsecas o idiosincráticas, de carácter impredecible, dosis-dependiente o no, generalmente debidas a la producción de metabolitos activos e independientes de la inhibición de la COX.
En animales con enfermedad hepática se puede producir una alteración de la metabolización y de la tasa de eliminación, con el consecuente aumento de la vida media, que puede dar lugar a numerosos efectos no solo a nivel hepático, si no sobre otros órganos y sistemas, siendo especialmente relevante el incremento de la posibilidad de ulceración gastroduodenal, por lo que ha de valorarse tanto su utilización como la reducción de la dosis en aquellos casos que se opte por este tipo de tratamiento.
A pesar de que ciertos estudios realizados en el ser humano determinan que la eliminación de ciertos AINEs no se encuentra alterada en pacientes con hepatopatías terminales88, investigaciones adicionales han determinado que el carprofeno y el meloxicam pueden producir un grado de hepatotoxicidad variable, aunque el riesgo no parece mayor al de otros inhibidores de la ciclooxigenasa89, 90.
La toxicidad hepática no parece estar relacionada con la dosis ni con la duración del tratamiento6 y podría deberse a factores genéticos, daño mitocondrial o inhibición COX, habiéndose determinado que ciertos inhibidores de la ciclooxigenasa disminuyen la concentración adenosin-trifosfato (ATP) disponible en el organismo, que resulta esencial para el metabolismo, produciéndose desde daño hepatocelular de diferente magnitud a necrosis hepática fulminante en caso de no interrumpir la terapia y establecer un tratamiento de soporte temprano90.
A finales del siglo pasado, se determinó que la mayoría de las hepatopatías relacionadas con la administración de AINEs se presentaban entre los 14 y los 21 días tras el inicio de la terapia89 por lo que la monitorización tanto de las enzimas hepáticas, como de la bilirrubina en las primeras fases del tratamiento, resulta fundamental para la detección temprana de efectos adversos a este nivel (Tabla 11).
| Tabla 11. AINEs en patología hepática. Conceptos relevantes. |
|
Por regla general, se recomienda la realización de una bioquímica previa que permita establecer valores hepáticos basales, siendo recomendable la monitorización de estos valores quincenalmente hasta los 3 meses, para posteriormente incrementar dichos intervalos, habiendo de realizarse una intervención inmediata en casos de incremento drástico y sin causa de los valores hepáticos, así como ante el desarrollo de ictericia.
Alteraciones en la coagulación
El equilibrio entre la actividad de las enzimas COX-1 y COX-2 presenta un papel determinante en el mantenimiento de la hemostasia, ya que la activación de la COX-1 determina la producción del tromboxano A2 en el riñón, pulmón, musculatura lisa y plaquetas91, encontrándose íntimamente relacionado con la formación del coágulo, la agregación plaquetaria y la consecuente vasoconstricción, mientras que la activación de la vía COX-2 media la producción de prostaciclinas, con efectos antiagregantes y vasodilatadores.
El tratamiento con AINEs puede causar disfunción plaquetar reversible, que cesa con la interrupción del régimen farmacológico, como determina un estudio en el que se estableció una correlación directa entre la administración de dichos fármacos y la alteración temporal de la agregación plaquetaria y del tiempo de tromboplastina parcial activada92.
En contraposición, otro estudio no determinó la supresión de la síntesis de tromboxano tras la administración de etodolaco, carprofeno y deracoxib durante 10 días93, mientras que investigaciones adicionales han mostrado que las alteraciones en la coagulación son mínimas e irrelevantes en perros sin procesos mórbidos concomitantes94.
No obstante, en la actualidad estos fármacos se encuentran contraindicados en pacientes con anemia y coagulopatías, habiendo de valorar su administración en caso de sangrado potencial, si bien se encuentra aceptado que los inhibidores COX-2 específicos de última generación resultan seguros en pacientes sanos, ante su menor efecto sobre las plaquetas.
Cicatrización ósea
El uso de inhibidores de la ciclooxigenasa en traumatología veterinaria resulta de especial interés debido a sus efectos analgésicos y su actividad antinflamatoria, aunque su administración es controvertida en casos de no unión o unión retardada o en aquellos pacientes en los que se sospeche de alteración en la consolidación ósea.
Las prostaglandinas presentan un papel importante en la osteogénesis, permitiendo el aumento de la masa cortical y trabecular95, habiéndose determinado que tratamientos prolongados con dosis elevadas de AINEs pueden producir una inhibición COX-2 que afecte a la cicatrización ósea temprana en perros, al igual que en el ser humano, siendo esta reversible tras la interrupción del tratamiento.
Varias investigaciones adicionales han determinado el retraso en la cicatrización ósea después de la estabilización experimental de una osteotomía de tibia durante el tratamiento con carprofeno a largo plazo, evidenciándose diferencias significativas a nivel radiográfico, biomecánico e histológico respecto a los grupos control.
Mientras, un estudio más reciente determinó que la administración de carprofeno durante ocho semanas, presentaba un impacto significativo respecto a la administración a corto plazo96, estableciendo la necesidad de realizar un uso responsable de AINEs en perros con riesgo de retraso en la cicatrización ósea, en los que se ha de valorar la interrupción del tratamiento tras el periodo perioperatorio temprano.
Efectos a nivel articular
Tanto la COX-1 como la COX-2 se encuentran aumentadas en la cápsula sinovial y líquido articular en animales con osteoartrosis, habiéndose asociado el uso crónico de AINEs al desarrollo de lesiones en el cartílago, tal y como determina un estudio que relacionó la administración de dosis elevadas de ácido acetilsalicílico con la inhibición de la síntesis de glicosaminoglicanos97.
Sin embargo, otro estudio no encontró diferencias significativas en perros con osteoartrosis a los que se administraba carprofeno con respecto a aquellos animales no tratados con AINEs98, mientras que investigaciones adicionales determinaron un efecto protector del cartílago en modelos de degeneración articular con cambios histopatológicos menos severos en aquellos casos en los que se administraba carprofeno99.
Efectos a nivel reproductivo
Ciertos estudios realizados sobre animales de experimentación han determinado que la deficiencia de COX-2, puede conducir a problemas de tracto reproductivo como ausencia de ovulación o implantación anormal del embrión, lo que junto a las posibilidades de hipoplasia renal y anomalías en el desarrollo del sistema hepatorrenal ante la administración de AINEs tanto a animales gestantes como lactantes puede dar lugar al incremento de la tasa de mortalidad de los cachorros100, por lo que estos fármacos están contraindicados tanto durante la gestación y la lactancia, como en cachorros de corta edad.
Periodo de lavado y transición farmacológica
La respuesta a un antiinflamatorio depende no solo de la especie sino del individuo, por lo que la seguridad y la eficacia de estos fármacos puede divergir entre pacientes, habiendo de realizar una selección del principio activo para cada caso concreto.
Además, resulta necesaria una evaluación periódica mediante el uso de escalas de dolor que permita determinar la disminución o la falta de respuesta al tratamiento, que puede tener una base farmacológica (p. ej., pauta de administración errática) o bien ser debida a la progresión del proceso causal al que se asocian los fenómenos nociceptivos e inflamatorios.
El manejo médico mediante la administración simultánea de corticoides y/o diferentes inhibidores de la ciclooxigenasa ha de evitarse86,101, por lo que tanto en aquellos casos en los que la respuesta sea parcial o inadecuada como en aquellas situaciones en las que se produzcan efectos adversos relacionados con la administración de estos, se ha de valorar el intercambio por otro antiinflamatorio no esteroideo, o bien por un principio activo de diferente naturaleza (p. ej., analgésicos opioides), considerándose un criterio a tener en cuenta en aquellas situaciones en las que la rotación haya resultado ineficaz.
Cabe destacar que en todos aquellos casos en los que se proceda a la rotación terapéutica o se haya realizado un tratamiento previo con corticoides, se ha de establecer un periodo de lavado antes del inicio de la terapia con el AINE seleccionado, pues el correcto cumplimiento de dicho periodo permite evitar en gran medida el desarrollo de efectos adversos potenciales, aunque este se considera variable y específico para cada antiinflamatorio, por lo que se precisa de estudios adicionales que permitan establecer dichos ciclos con una mayor precisión.
Ante estos hechos, se sugiere adaptar este periodo a la vida media del fármaco en cuestión, a pesar de que los efectos tisulares de los antiinflamatorios no están necesariamente asociados a esta, por lo que esta recomendación ha de tomarse con cautela.
De manera general, se asume que las interacciones farmacológicas resultarán mínimas después de un periodo de cuatro vidas medias, por lo que los periodos conservadores de lavado son de aproximadamente una semana para la mayoría de AINEs, mientras que para el mavacoxib se considera que puede llegar a los 200 días.
Tal y como se había determinado con anterioridad, aquellos pacientes que presentan efectos adversos durante el tratamiento con AINEs, pueden beneficiarse de la utilización de otro inhibidor de la ciclooxigenasa, siendo necesario realizar un periodo de transición hasta que los signos clínicos relacionados con la administración del primer fármaco hayan cesado, estableciendo una terapia de soporte con la finalidad de garantizar una correcta cobertura analgésica mediante la utilización de analgésicos adyuvantes (p. ej., tramadol, tapentadol, paracetamol, codeína, pregabalina, gabapentina, amantadina, opioides o antidepresivos tricíclicos) (Tabla 12).
| Tabla 12. Rotación terapéutica. Conceptos clave. |
|
Conclusión
Los AINEs se consideran efectivos en el tratamiento del dolor agudo y crónico, así como de los eventos nociceptivos en el periodo perioperatorio tanto en cirugía de tejidos blandos como en traumatología y enfermedades ortopédicas. La investigación en la materia y la aparición de nuevos principios activos ha permitido la reducción de efectos adversos, siendo el objetivo de este artículo realizar una revisión exhaustiva del mecanismo de acción y la descripción de los principales efectos asociados a su utilización, aportando nociones sobre los periodos de lavado y la rotación farmacológica que permita aplicar estos conceptos a la actividad clínica diaria.
Bibliografía
- Doig PA, Purbrick KA, Hare JE, McKeown DB. Clinical efficacy and tolerance of meloxicam in dogs with chronic osteoarthritis.Can Vet J. 2000;41(4):296-300.
- Ryan WG, Moldave K, Carithers D. Clinical effectiveness and safety of a new NSAID, firocoxib: a 1,000 dog study.Vet Ther. 2006;7(2):119-126.
- Mansa S, Palmer E, Grøndahl C. Long-term treatment with carprofen of 805 dogs with osteoarthritis. Vet Rec. 2007;160, 427–430.
- Beale B. Use of nutraceuticals and chondroprotectants in osteoarthritic dogs and cats. Vet Clin North Am Small Anim Pract 2004; 34: 271–89.
- Mathews K, Kronen PW, Lascelles D, Nolan A, Robertson S, Steagall, PV, Wright B . Guidelines for Recognition, Assessment and Treatment of Pain. J Small Anim Pract, 2014;55: E10-E68
- Monteiro-Steagall BP, Steagall PV, Lascelles BD. Systematic review of nonsteroidal anti-inflammatory drug-induced adverse effects in dogs.J Vet Intern Med. 2013;27(5):1011-1019.
- Johnston SA, Fox SM. Mechanisms of action of anti-inflammatory medications used for the treatment of osteoarthritis. J Am Vet Med Assoc 1997;210:1486–9
- Forrester SD, Troy GC. Renal effects of nonsteroidal antiinflammatory drugs. Compend Contin Educ Pract Vet 1999;21(10):910–9.
Davies NM, Good RL, Roupe KA, Yáňez JA. Cyclooxygenase‐3: axiom, dogma, anaomaly, enigma or splice error? – not as easy as 1, 2, 3. J Pharm Pharmaceut Sci 2004; 7(2): 217–226. - Chandrasekharan NV, Dai H, Roos KL. COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression.Proc Natl Acad Sci U S A. 2002;99(21):13926-13931
- Lees P, May SA, McKellar QA. Pharmacology and therapeutics of nonsteroidal antiinflammatory drugs in the dog and cat: 1 General pharmacology. Jour Small Animal Prac. 1991; 32: 183-193.
- Bryson PD. Nonsteroidal anti-inflammatory agents. En: Simmons HF. Comprehensive review in toxicology for emergency clinicians. 3ª edición. Washington Taylor and Francis; 1996. 565–567
- Laneuville O, Breuer DK, DeWitt DL. Differential inhibition of human prostaglandin endoperoxide synthases‐1 and ‐2 by nonsteroidal anti‐inflammatory drugs. J Pharm Exp Ther 1994; 271: 927–934
- Meade EA, Smith WL, DeWitt DL. Pharmacology of prostaglandin endoperoxide synthase isozymes‐1 and ‐2. Ann NY Acad Sci 1994; 714: 136–142.
- Wooten J, Blikslager A, Marks S. Effect of nonsteroidal antiinflammatory drugs with varied cyclooxygenase-2 selectivity on cyclooxygenase protein and prostanoid concentrations in pyloric and duodenal mucosa of dogs. Am J Vet Res 2009; 70: 1243–49
- Wallace J. Distribution and expression of cyclooxygenase (COX) isoenzymes, their physiological roles, and the categorization of nonsteroidal anti-inflammatory drugs (NSAIDs). Am J Med 1999; 107: 11S–16S.
- Lascelles B, Mcfarland J, Swann H. Guidelines for safe and effective use of NSAIDs in dogs. Vet Ther 2005; 6: 237–51.
- Brater DC. Effects of nonsteroidal anti‐inflammatory drugs on renal function: focus on cyclooxygenase‐20selective inhibition. Am J Med 1999; 107(6): 65–70.
- Gierse JK, Staten NR, Casperson GF. Cloning, expression, and selective inhibition of canine cyclooxygenase‐1 and cyclooxygenase‐2. Vet Ther 2002; 3: 270–280.
- Hamza M, Dionne RA. Mechanisms of non-opioid analgesics beyond cyclooxygenase enzyme inhibition. Curr Mol Pharmacol. 2009;2(1):1-14.
- Kulkarni SK, Jain NK, Singh A. Cyclooxygenase isoenzymes and newer thera-peutic potential for selective COX-2 inhibitors. Methods. Find Exp Clin Pharmacol 2000;22(5):291–8.
- Ito S, Okuda-Ashitaka E, Minami T. Central and peripheral roles of prostaglandins in pain and their interactions with novel neuropeptides nociceptin and nocistatin. Neurosci Res 2001; 41: 299–332.
- Crofford L. COX-1 and COX-2 tissue expression: implications and predictions. J Rheumatol 1997; 49 (suppl): 15–19.
- Hayashi T, Nishiyama K, Shirahama T. Inhibition of 5-lipoxygenase pathway suppresses the growth of bladder cancer cells. Int J Urol. 2006;13(8):1086-1091.
- Vane JR, Botting RM. New insights into the mode of action of anti‐inflammatory drugs. Inflamm Res 1995; 44: 1–10.
- Bergh M, Budsberg S. The coxib NSAIDs: potential clinical and pharmacologic importance in veterinary medicine. J Vet Intern Med 2005; 19: 633–43
- Tegeder I, Niederberger E, Israr E. Inhibition of NF-kappaB and AP-1 activation by R- and S-flurbiprofen.FASEB J. 2001;15(1):2-4.
- Bryant CE, Farnfield BA, Janicke HJ. Evaluation of the ability of carprofen and flunixin meglumine to inhibit activation of nuclear factor kappa B. Am J Vet Res 2003; 64: 211–215
- Park SY, Kim TH, Kim HI. Celecoxib inhibits Na+ currents in rat dorsal root ganglion neurons.Brain Res. 2007;1148:53-61.
- Brueggemann LI, Mackie AR, Mani BK. Differential effects of selective cyclooxygenase-2 inhibitors on vascular smooth muscle ion channels may account for differences in cardiovascular risk profiles. Mol Pharmacol.2009;76:1053-1061
- Freeman LC, Narvaez D, McCoy A. Depolarization and decreased surface expression of K+ channels contribute to NSAID-inhibition of intestinal restitution. Biochem Pharmacol.2007;74:74-85
- Bertolini A, Ottani A, Sandrini M. Dual acting anti-inflammatory drugs: a reappraisal.Pharmacol Res. 2001;44(6):437-450.
- Streppa HK, Jones CJ, Budsberg SC. Cyclooxygenase selectivity of nonsteroidal anti-inflammatory drugs in canine blood.Am J Vet Res. 2002;63(1):91-94.
- Warner TD, Giuliano F, Vojnovic I, Bukasa A, Mitchell JA, Vane JR. Nonsteroid drug selectivities for cyclo-oxygenase-1 rather than cyclo-oxygenase-2 are associated with human gastrointestinal toxicity: a full in vitro análisis. Proc Natl Acad Sci. 1999;96(13):7563-7568.
- Lees P, Landoni MF, Giraudel J, Toutain PL. Pharmacodynamics and pharmacokinetics of nonsteroidal anti-inflammatory drugs in species of veterinary interest.J Vet Pharmacol Ther.
- Moreau M. Superiority of the gastroduodenal safety profile of licofenole over rofecoxib, a COX‐2 selective inhibitor, in dogs.Jour Vet Pharm 2005;28, 81–86.
- Jung M, Lees P, Seewald W, King JN. Analytical determination and pharmacokinetics of robenacoxib in the dog. J Vet Pharmacol Ther 2009; 32(1): 41–48.
- Donovan JW. Nonsteroidal anti-inflammatory drugs and colchicine. En: Haddad LM, Shannon MW, Winchester JF, editors. Clinical management of poisoning and drug overdose. 3rd edition. Philadelphia: WB Saunders; 1998. p. 687–99.
- Cox SR, Liao S, Payne‐Johnson M,. Population pharmacokinetics of mavacoxib in osteoarthritic dogs. J Vet Pharmacol Ther 2011; 34(1): 1–11.
- Cox SR, Lesman SP, Boucher JF, et al. The pharmacokinetics of mavacoxib, long‐acting COX‐2 inhibitor, in young adult laboratory dogs. J Vet
- Pharmacol Ther 2010; 33(5): 461–470.
- Ingwersen W, Fox R, Cunningham G. Efficacy and safety of 3 versus 5 days of meloxicam as an analgesic for feline onychectomy and sterilization. Can Vet J 2012;53:257–64.
- Kaye AD, Urman RD, Vadivelu N. Preventive analgesia for postoperative pain control : a broader concept. Local Reg Anesth 2014;7(1):17–22.
- Pollmeier M, Toulemonde C. Clinical evaluation of firocoxib and carprofen for the treatment of dogs with osteoarthritis. Vet Rec.2006;159:547-551
- Nishihara K, Kikuchi H, Kanno T, Tanabe S, Sarashina T, Uzuka Y. Comparison of the upper gastrointestinal effects of etodolac and aspirin in healthy dogs.J Vet Med Sci. 2001;63(10):1131-1133.
- Luna SP, Basílio AC, Steagall PV. Evaluation of adverse effects of long-term oral administration of carprofen, etodolac, flunixin meglumine, ketoprofen, and meloxicam in dogs.Am J Vet Res. 2007;68(3):258-264.
- Wolfe MM, Lichenstein DR, Singh G: Medical progress: Gastrointestinal toxicity of nonsteroidal antiinflammatory drugs. N Engl J Med 340(24): 1888–1899,1999.
- Gajraj NM. Cyclooxygenase-2 inhibitors. Anesth Analg 96(6):1720–1738, 2003
- DeNovo RC. Diseases of the stomach. En: Handbook of Small Animal Gastroenterology,ed 2.Philadelphia,WB Saunders. 2003,pp 160.
- Halter F, Tarnawski AS, Schmassmann A, Peskar BM. Cyclooxygenase 2: Implications on maintenance of gastric mucosal integrity and ulcer healing: Controversial issues and perspectives. Gut49(3):443–453,2001.
- Fox SM. Nonsteroidal anti‐inflammatory drugs. En: Carroll GL, ed. Small Animal Anesthesia and Analgesia. Ames, IA: Blackwell Publishing, 2008; 143–157.
- Forsyth SF, Guilford WG, Haslett SJ, Godfrey J. Endoscopy of the gastroduodenal mucosa after carprofen, meloxicam and ketoprofen administration in dogs. J Small Anim Pract 1998; 39: 421–424.
- Enberg TB, Braun LD, Kuzma AB. Gastrointestinal perforation in five dogs associated with the administration of meloxicam. J Vet Emerg Crit Care 2006; 16: 34–43
- Tomlinson J, Blikslager A: Role of nonsteroidal anti-inflammatory drugs in gastrointestinal tract injury and repair. JAVMA 222:946–951,2003.
- Johnston SA, Fox SM. Mechanisms of action of anti-inflammatory medications used for the treatment of osteoarthritis. JAVMA1997;210:1486
- Wilson JE, Chandrasekharan NV, Westover KD. Determination of expresión of cyclooxygenase‐1 and ‐2 isozymes in canine tissues and their differential sensitivity to nonsteroidal anti‐inflammatory drugs. Am J Vet Res 2004; 65: 810–818.
- Hirose M, Miwa H, Kobayashi O, et al. Inhibition of proliferation of gastric epithelial cells by a cyclooxygenase 2 inhibitor, JTE522, is also mediated by a PGE2-independent pathway.Aliment Pharmacol Ther. 2002;16 Suppl 2:83-89.
- Goodman L, Torres B, Punke J, et al. Effects of firocoxib and tepoxalin on healing in a canine gastric mucosal injury model.J Vet Intern Med. 2009;23(1):56-62.
- Konturek SJ, Konturek PC, Brzozowski T. Prostaglandins and ulcer healing. J Physiol Pharmacol 2005; 56(Suppl 5): 5–31.
- Simmons DL, Botting RM, Hla T. Cyclooxygenase isozymes: the biology of prostaglandin synthesis and inhibition.Pharmacol Rev. 2004;56(3):387-437
- Lascelles BDX, Blikslager AT, Fox SM, Reece D. Gastrointestinal tract perforation in dogs treated with a selective cyclooxygenase‐2 inhibitor: 29 cases (2002–2003). JAVMA 2005; 227: 1112–1117
- Reimer ME, Johnston SA, Leib MS, et al. The gastroduodenal effects of buffered aspirin, carprofen, and etodolac in healthy dogs.J Vet Intern Med. 1999;13(5):472-477.
- Souza MH, de Lima OM Jr, Zamuner SR, et al. Gastritis increases resistance to aspirin‐induced mucosal injury via COX‐2‐mediated lipoxin synthesis. Am J Physiol Gastrointest Liver Physiol 2003; 285(1): G54–61.
- Hurley JW, Crandal LA. The effects of salicylates upon the stomach of dogs. Gasteroenterology 1964; 46: 36–43.
- Konturek JW, Dembinski A, Stoll R. Mucosal adaptation to aspirin induced gastric damage in humans. Studies on blood flow, gastric mucosal growth, and neutrophil activation. Gut 1994; 35: 1197–1204.
- Taylor LA, Crawford LM. Aspirin‐induced gastrointestinal lesions in dogs. JAVMA 1968; 152(6): 617–619.
- Phillips BM. Aspirin‐induced gastrointestinal microbleeding in dogs. Toxicol Appl Pharmacol 1973; 24: 182–189.
- Matsui H, Shimokawa O, Kaneko T, Nagano Y, Rai K, Hyodo I. The pathophysiology of non-steroidal anti-inflammatory drug (NSAID)-induced mucosal injuries in stomach and small intestine.J Clin Biochem Nutr. 2011;48(2):107-111
- McMurray J, Boysen S, Chalhoub S. Focused assessment with sonography in nontraumatized dogs and cats in the emergency and critical care setting.J Vet Emerg Crit Care . 2016;26(1):64-73.
- Gralnek IM, Dumonceau JM, Kuipers EJ.ñ Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideliness.Endoscopy. 2015;47(10):a1-a46.
- Treinen‐Moslen M, Kanz MF. Intestinal tract injury by drugs: importance of metabolite delivery by yellow bile road. Pharmacol Ther 2006; 112(3): 649–667.
- Brown, S. Physiology of the kidneys. En: Bartges, J and Polzin, DJ, eds. Nephrology and urology of small animals. 1st ed. West Sussex (UK): JohnWiley & Sons; 2011:10–7
- Rossat J, Maillard M, Nussberger JU. Renal effects of selective cyclooxygenase‐ 2 inhibition in normotensive salt‐depleted subjects. Clin Pharmacol Ther 1999; 66: 76–84.
- Gambaro G, Perazella MA. Adverse renal effects of anti‐inflammatory agents: evaluation of selective and nonselective cyclooxygenase inhibitors. J Intern Med 2003; 253: 643–652. 95
- Osborn JL, Kopp UC, Thames MD, DiBona GF. Interactions among renal nerves, prostaglandins, and renal arterial pressure in the regulation of renin release.Am J Physiol. 1984;247(5 Pt 2):F706-F713.
- Sellers RS, Senese PB, Khan KN. Interspecies differences in the nephrotoxic response to cyclooxygenase inhibition.Drug Chem Toxicol. 2004;27(2):111-122
- Cheng HF, Harris RC. Does cyclooxygenase-2 affect blood pressure?.Curr Hypertens Rep. 2003;5(1):87-92.
- Harirforoosh S, Jamali F. Effect of nonsteroidal anti-inflammatory drugs with varying extent of COX-2-COX-1 selectivity on urinary sodium and potassium excretion in the rat.Can J Physiol Pharmacol. 2005;83(1):85-90
- Lobetti RG, Joubert KE. Effect of administration of nonsteroidal anti‐inflammatory drugs before surgery on renal function in clinically normal dogs. Am J Vet Res 2000; 61: 1501–1506.
- Surdyk K,Sloan DL, Brown AA Evaluation of the renal effects of ibuprofen and carprofen in euvolemic and volume-depleted dogs. Intern J Appl Res Vet Med.2011;9:129-136
- Braun JP, Cabé E, Geffré A, Lefebvre HP, Trumel C. Comparison of plasma creatinine values measured by different veterinary practices.Vet Rec. 2008;162(7):215-216.
- Hall JA, Yerramilli M, Obare E, Yerramilli M, Almes K, Jewell DE. Serum concentrations of symmetric dimethylarginine and creatinine in dogs with naturally occurring chronic kidney disease.J Vet Intern Med. 2016;30(3):794-802.
- Lomas A, Lyon S, Sanderson M. Acute and chronic effects of tepoxalin on kidney function in dogs with chronic kidney disease andosteoarthritis.Am J Vet Res2013;74:939–44
- Yaxley J, Litfin T. Non-steroidal anti-inflammatories and the development of analgesic nephropathy: a systematic review.Ren Fail. 2016;38(9):1328-1334
- Curiel RV, Katz JD. Mitigating the cardiovascular and renal effects of NSAIDs.Pain Med. 2013;14 Suppl 1:S23-S2
- Boström IM, Nyman G, Hoppe A, Lord P. Effects of meloxicam on renal function in dogs with hypotension during anaesthesia. Vet Anaesth Analg 2006; 33(1): 62–69
- Narita T, Sato R, Motoishi K, Tani K, Naito Y, Hara S. The interaction between orally administered non-steroidal anti-inflammatory drugs and prednisolone in healthy dogs.J Vet Med Sci. 2007;69(4):353-363
- Lee WM. Drug induced hepatotoxicity. N Engl J Med 2003; 349: 474–485.
- Brater DC, Lasseter KC. Profile of etodolac: pharmacokinetic evaluation in special populations.Clin Rheumatol. 1989;8 Suppl 1:25-35.
- MacPhail CM, Lappin MR, Meyer DJ, Smith SG, Webster CR, Armstrong PJ. Hepatocellular toxicosis associated with administration of carprofen in 21 dogs.J Am Vet Med Assoc. 1998;212(12):1895-1901.
- Nakagawa K, Yamagami T, Takemura N. Hepatocellular toxicosis associated with the alternate administration of carprofen and meloxicam in a siberian husky.J Vet Med Sci. 2005;67(10):1051-1053
- Niemi TT, Taxell C, Rosenberg PH. Comparison of the effect of intravenous ketoprofen, ketorolac and diclofenac on platelet function in volunteers. Acta Anaesthesiol Scand 1997; 41(10): 1353–1358.
- Kazakos GM, Papazoglou LG, Rallis. Effects of meloxicam on the haemostatic profile of dogs undergoing orthopaedic surgery. Vet Rec 2005;157(15): 444–6.
- Sessions JK, Reynolds LR, Budsberg SC. In vivo effects of carprofen, deracoxib, and etodolac on prostanoid production in blood, gastric mucosa, and synovial fluid in dogs with chronic osteoarthritis.Am J Vet Res. 2005;66(5):812-817
- Blois SL, Allen DG, Wood RD, et al. Effects of aspirin, carprofen, deracoxib, and meloxicam on platelet function and systemic prostaglandin concentrations in healthy dogs. Am J Vet Res 2010;71(3):349–58
- Pountos I, Georgouli T, Calori GM, Giannoudis PV. Do nonsteroidal anti-inflammatory drugs affect bone healing? A critical analysis.Scientific World Journal. 2012;2012:606
- Gallaher HM, Butler JR, Wills RW. Effects of short- and long-term administration of nonsteroidal anti-inflammatory drugs on osteotomy healing in dogs.Vet Surg. 2019;48(7):1318-1329.
- Palmoski MJ, Colyer RA, Brandt KD. Marked suppression by salicylate of the augmented proteoglycan synthesis in osteoarthritic cartilage.Arthritis Rheum. 1980;23(1):83-91.
- Dassler CL, Griffey SM, Vasseur PB.Histological features of osteoarthritic canine cartilage after prolonged administration of carprofen.Veterinary and Comparative Orthopaedics and Traumatology. 2003;16(1):32-37.
- Pelletier JP, Lajeunesse D, Jovanovic DV. Carprofen simultaneously reduces progression of morphological changes in cartilage and subchondral bone in experimental dog osteoarthritis.J Rheumatol. 2000;27(12):2893-2902.
- Bergh MS, Budsberg SC. The coxib NSAIDs: potential clinical and pharmacologic importance in veterinary medicine.J Vet Intern Med. 2005;19(5):633-643.
- Boston SE, Moens NM, Kruth SA, Southorn EP. Endoscopic evaluation of the gastroduodenal mucosa to determine the safety of short-term concurrent administration of meloxicam and dexamethasone in healthy dogs.Am J Vet Res. 2003;64(11):1369-1375
 by Multimédica
by Multimédica