Manejo de anestesia general en una cabra con lesión intracraneal para estudio de imagen
Resumen breve
Cada vez es más frecuente la presentación de pequeños rumiantes en la clínica como animales “de compañía”. Este fenómeno contribuye a dos cambios en la presentación de patologías en estos animales. Por un lado, son animales que alcanzan unas edades más avanzadas, apareciendo patologías ligadas a la edad y, por otro lado, aumenta el rango de pruebas diagnósticas y procedimientos a los que los cuidadores están dispuestos a someter a estos animales.Índice de contenidos
Introducción
Cada vez es más frecuente la presentación de pequeños rumiantes en la clínica como animales “de compañía”. Este fenómeno contribuye a dos cambios en la presentación de patologías en estos animales. Por un lado, son animales que alcanzan unas edades más avanzadas, apareciendo patologías ligadas a la edad y, por otro lado, aumenta el rango de pruebas diagnósticas y procedimientos a los que los cuidadores están dispuestos a someter a estos animales.
La anestesia de pequeños rumiantes incluye varias consideraciones fisiológicas y otras de tipo legal. En cuanto a las consideraciones fisiológicas, a nivel digestivo, la secreción continua de saliva, el gran volumen del rumen y la posibilidad de que se timpanice predisponen a la regurgitación y neumonía por aspiración en esta especie. Este riesgo está aumentado en animales cuyo estado mental esté deteriorado por una patología intracraneal. Como consecuencia, el manejo anestésico estará centrado en la protección de la vía aérea. En cuanto a las consideraciones legales, existe legislación específica en la Unión Europea para animales de producción alimentaria que debe conocerse ya que afecta a los fármacos anestésicos y sedantes que pueden ser utilizados.
Las lesiones intracraneales pueden afectar al estado mental gravemente, aumentando el riesgo de alteraciones de hidratación y electrolíticas, neuropatías y miopatías, alteraciones en la ingesta de alimentos que conllevan alteraciones digestivas y de la fermentación en estos animales.
Caso clínico
Se presentó al servicio de neurología una cabra hembra no castrada, adulta de 8 años, de 40 kg, perteneciente a una raza enana. Presentaba historia de ataques epilépticos desde hacía un año, y debilidad desde hacía dos meses. El animal empeoró en las 48 horas previas, con tics faciales y babeo. Su estado había evolucionado a postración (24 horas de evolución en la presentación), anorexia, y status epilepticus. En el examen físico general se detectó un timpanismo ruminal moderado (Figura 1), taquicardia de 160 latidos por minuto, frecuencia respiratoria de 40 respiraciones por minuto, temperatura de 39.4 °C y leves crepitaciones pulmonares difusas. El pulso femoral era débil y el pulso tarsal no se detectaba. Las mucosas eran rosas y estaban húmedas, el tiempo de relleno capilar era menor a 2 segundos. El pliegue cutáneo era persistente. En el examen neurológico la cabra mostró un estado mental obnubilado, postración con tetraparesia no ambulatoria, ausencia de respuesta de amenaza en el ojo derecho, ausencia de reflejo palpebral derecho y sensibilidad facial derecha. La propiocepción estaba disminuida en las 4 extremidades, y existían fasciculaciones faciales con babeo. La localización neurológica de los signos se determinó en prosencéfalo izquierdo por lo que se programó una Tomografía Computarizada (TC) intracraneal con contraste bajo anestesia general, y análisis de líquido cefalorraquídeo.
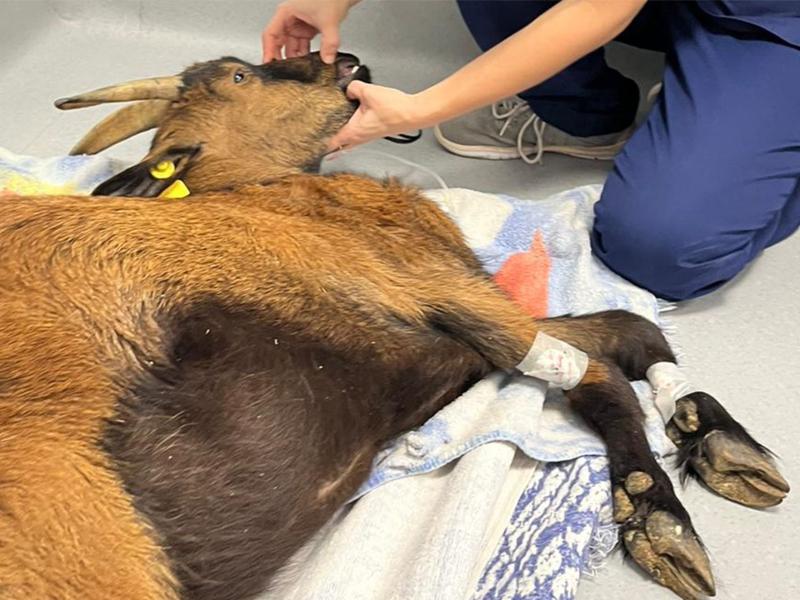
Las pruebas laboratoriales revelaron una leucocitosis neutrofílica, un aumento proteínas totales (9 mg/dl), glucosa (226 mg/dl) y urea (27 mg/dl) en sangre.
Previamente a la anestesia se procedió a la estabilización neurológica y hemodinámica del animal. Se colocó un catéter IV de 18 G en la vena yugular derecha. Para controlar las convulsiones se administraron fenobarbital (9 mg/kg) y diazepam (0,5 mg/kg) intravenosos (IV). Tras la administración de esta medicación, cesaron los mioclonos, pero el nistagmo lateral y la depresión mental continuaron. Se administraron bolos de Ringer Lactato (15 ml/kg en total) tras lo cual mejoró la calidad del pulso, y la FC descendió a 150 latidos por minuto. Tras comprobar que la FC no respondía más a bolos de fluidos, se decidió proceder a la anestesia general.
Se clasificó al animal como un ASA IV, considerando las anomalías del examen físico: presencia de depresión mental y signos intracraneales, deshidratación, taquicardia y timpanismo ruminal. Se detallan los valores normales en la exploración de una cabra más adelante (Tabla 1).
| Tabla 1. Constantes vitales normales en cabras adultas4. |
| Parámetro | Valor |
| Temperatura | 39-40.5 °C |
| Frecuencia Cardíaca | 70-100 latidos por minuto |
| Frecuencia Respiratoria | 15-30 respiraciones por minuto |
| Gestación | 145-155 días |
Tras preoxigenar al animal (flow-by, 2 l/min), se indujo la anestesia con propofol IV a efecto (3 mg/kg en total). Se instiló lidocaína al 2 % en la laringe y se intubó la tráquea con ayuda de un laringoscopio y un catéter urinario de perro (8 French), para ello se usó un tubo de PVC de 7 mm de diámetro interno. Para la intubación se colocó al animal en esternal, con la cabeza extendida verticalmente con ayuda de un ayudante. El balón de neumotaponamiento se hinchó antes de dejar caer la cabeza para sellar la vía aérea. Se conectó el tubo endotraqueal a un sistema de reinhalación (circuito F universal), y se mantuvo la anestesia con isoflurano (1,5-2 % en el vaporizador) en oxígeno (2 l/min). El animal mantuvo ventilación espontánea durante toda la anestesia con niveles de normocapnia en el capnograma. Para la adquisición de imágenes, se colocó a la cabra en esternal, con la cabeza elevada con respecto al cuerpo y las extremidades posteriores extendidas hacia atrás y se administró una dosis de Iohexol de 1.7 ml/kg IV.
Durante la anestesia general se administró Ringer lactato a 5 ml/kg/h. El plano anestésico se monitorizó clínicamente (posición del ojo y reflejo palpebral). Se usó un monitor multiparamétrico para monitorización de: ECG, capnografía, presión arterial no invasiva por oscilometría (en el metatarso) y saturación periférica de oxígeno. Durante la anestesia el animal desarrolló una hipotensión de 40 mmHg de presión arterial media, que respondió a la bajada de los niveles de isoflurano y la descompresión del rumen con un tubo esofágico. Tras comprobar que no se trataba de una lesión que aumentara la presión intracraneal en las imágenes del TAC, se extrae líquido cefalorraquídeo de la cisterna magna, en decúbito lateral derecho, sin complicaciones.
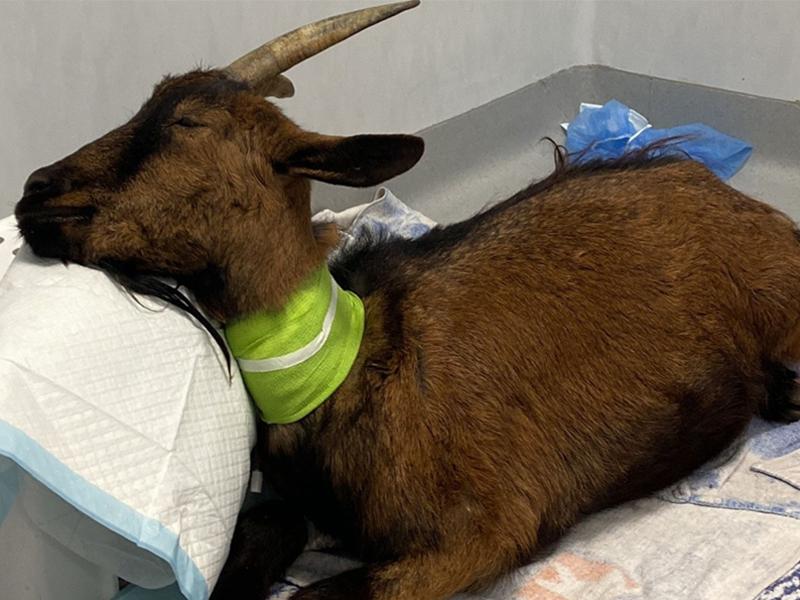
La cabra se recuperó en hospitalización, aislada del resto de animales, recibiendo fluidos IV (Ringer lactato a 2 ml/kg/h), en esternal, y con la cabeza elevada respecto al cuerpo (Figura 2). El tubo esofágico se retiró en la recuperación y la nariz se mantuvo más baja que la nuca para drenar el posible fluido que quedara en orofaringe. El tubo se colocó en el diastema oral hasta que el animal mantenía la cabeza erguida y movía el cuello.
En el TC no se observó ninguna alteración. En el análisis del líquido cefalorraquídeo se vio un aumento de las células nucleadas (20 células nucleadas/microl). En la citología se observó una pleocitosis mononuclear, por lo tanto, se estableció un diagnóstico de meningoencefalitis (sospecha de causa inmunomediada o infecciosa). Para determinar su causa se cursaron PCR de Cryptococcus spp y cultivo de líquido cefalorraquídeo.
Tras 12 horas de hospitalización, el animal fue transferido a su veterinario habitual para hospitalización y administración de dexametasona a dosis 0,05 mg/kg cada 12 horas IV, cefalosporina, suplementación de tiamina, fenobarbital (10 mg/kg cada 12) y diazepam en caso de crisis epiléptica (0,5-1 mg/kg). Evolucionó desfavorablemente sufriendo una parada cardiorrespiratoria a las 24 horas.
Discusión
En este animal se deben tener en cuenta diferentes consideraciones para el manejo anestésico (Tabla 2).
| Tabla 2. Consideraciones anestésicas de este caso. |
| Relacionadas con la especie | Relacionadas con las patologías | Relacionadas con el procedimiento: TC y extracción de líquido cefalorraquídeo de cisterna magna |
|
|
|
La CR 37/2010 de la Unión Europea clasifica a la especie caprina como animales de producción, y por lo tanto limita los fármacos que se pueden usar en esta especie, sean animales cuya función real sea la de animal de compañía o producción. En este caso, el uso de los fármacos que se administraron para el control de las crisis epilépticas y la anestesia harían que el animal tuviera que ser retirado de la cadena alimentaria ya que no está autorizado su uso. En este animal cuya vida de producción había acabado (estaba retirado en un santuario) este hecho no supone un problema legal, pero el veterinario anestesista debe conocer la legislación que afecta al uso de fármacos en estas especies.
El timpanismo ruminal, la regurgitación y neumonía por aspiración son problemas frecuentemente asociados con la anestesia general en rumiantes. La fermentación continúa en el rumen en el animal anestesiado, que no tiene la capacidad de eructar, por lo tanto el volumen y la presión del rumen irá aumentando con el tiempo si no se descomprime. El timpanismo ruminal causa aumento de la presión intra-abdominal, comprimiendo el diafragma y la vena cava, comprometiendo la función cardiopulmonar1.
En este caso ya existía cierto timpanismo, probablemente debido a la alteración del estado mental del animal, que había impedido una alimentación normal. Durante la anestesia, en el periodo de hipotensión, la decompresión del rumen ayudó a recuperar la presión arterial.
Una de las principales complicaciones en la anestesia de rumiantes es la neumonía por aspiración. Incluso en animales con anorexia el rumen se encontrará lleno de material líquido, facilitando la regurgitación en planos superficiales de anestesia por estimulación (regurgitación activa) o profundos por relajación muscular (pasiva). La regurgitación activa puede ser estimulada en la intubación si el plano anestésico no es el adecuado. Otra fuente de neumonía por aspiración es la saliva. La producción de saliva es continua y abundante durante la anestesia, por lo que se deberá garantizar que esta pueda drenarse sin riesgo de ser aspirada, por ejemplo, colocando la nariz más baja que la nuca durante la anestesia y recuperación. Por lo tanto, la protección de la vía aérea con un tubo con el balón de neumotaponamiento sellando la tráquea lo antes posible debe ser una de las prioridades del anestesista.
La intubación en pequeños rumiantes es dificultosa debido a la cavidad bucal estrecha y a lo profundo de la posición de la laringe. Se pueden utilizar estiletes o sondas urinarias a modo de guía para la colocación del tubo. En este caso se instiló lidocaína en la laringe de forma tópica para facilitar la intubación y para evitar la tos que podría aumentar la presión intracraneal. Este último uso de la lidocaína no ha sido descrito en pequeños rumiantes, pero sí en perros2.
En cuanto al estado neurológico, se decidió utilizar un abordaje de anestesia en animal con aumento de presión intracraneal debido al estado mental, hasta que las primeras imágenes del TC descartaran esta situación. Por lo tanto, el CO2 se mantuvo en valores normales, y la presión arterial por encima de 80 mmHg en un principio3. En el momento en el que la presión arterial bajó por debajo de 60 mmHg, la hipertensión craneal estaba descartada. Se administró un bolo de cristaloides y se procedió a descomprimir el rumen ya que se consideró la baja precarga como la principal causa de esta hipotensión.
En el examen físico general, el animal presentaba crepitaciones a la auscultación pulmonar, por lo que se consideró posible la neumonía por aspiración dado el estado postrado del animal. No se realizaron pruebas de imagen de tórax por restricciones en el presupuesto. La saturación de oxígeno fue medida por pulsioximetría durante la anestesia y recuperación, y se mantuvo en valores normales.
En este caso se ilustra cómo la confluencia de distintas patologías pueden ser manejadas en la estabilización anestesia de pequeños rumiantes, adaptando nuestra actuación a las peculiaridades de fisiológicas de los rumiantes.
Bibliografía
- Lin H. Chapter 1: Preanesthetic considerations. Farm animal anesthesia. 2nd edition. Lin H, Passler T, Clark-Price S. 2022. Wiley, USA.
- Thompson KR, Rioja E. Effects of intravenous and topical laryngeal lidocaine on heart rate, mean arterial pressure and cough response to endotracheal intubation in dogs. Vet Anaesth Analg 43, 371-378. 2016.
- Cornick JL. Anesthetic management of patients with neurological abnormalities. Compend Cont Ed Pract Vet 14:163–73. 1992.
- Jackson PGG, Cockcroft PD. Capítulo 17: goats. Clinical examination of farm animals. 2002. Blackwell Science.
 by Multimédica
by Multimédica